五味子多糖对原代大鼠肝细胞氧化应激损伤的保护机制研究
2018-01-03张玲莉
王 荣,刘 莉,张玲莉
·论著·
五味子多糖对原代大鼠肝细胞氧化应激损伤的保护机制研究
王 荣a,刘 莉b,张玲莉c
目的探讨五味子多糖对原代大鼠肝细胞氧化应激的保护效应,并对其作用机制进行研究。方法体外培养原代大鼠肝细胞,分为空白对照组、H2O2诱导组、H2O2+低剂量五味子多糖组、H2O2+中剂量五味子多糖组、H2O2+高剂量五味子多糖组;CCK-8试剂检测大鼠肝细胞相对存活率,相关试剂盒检测NO、MDA含量,Western blot检测大鼠肝细胞中P67-phox、P47-phox、SOD1、HO-1、Rac1、p-Rac1蛋白表达水平。结果与H2O2诱导组相比,不同浓度五味子多糖可明显提升大鼠肝细胞的存活率(P<0.05);与H2O2诱导组相比,不同剂量五味子多糖可明显抑制细胞中NO、MDA的生成(P<0.05);Western blot检测显示,不同剂量五味子多糖可明显促进抗氧化蛋白HO-1、SOD1表达,抑制促氧化蛋白P67-phox、P47-phox的表达,并且五味子多糖显著抑制Rac1的磷酸化(P<0.05)。结论五味子多糖可明显改善大鼠肝细胞氧化应激损伤,其作用机制可能与抑制Rac1的磷酸化有关。
五味子多糖;大鼠;肝细胞;氧化应激
0 引言
五味子为木兰科五味子属和南五味子属植物的泛称,全世界约有50多种,主要分布在东亚地区[1]。五味子发挥功效的成分主要有木质素、挥发油、多糖和全氮及氨基酸,目前对五味子的药理学作用研究主要集中在肝脏及心血管的保护作用,抗惊厥及改善心肌营养和功能等方面[2]。五味子多糖是从五味子中分离提纯得到的多糖类生物活性物质,具有明显的抗氧化、抗凋亡的作用,五味子多糖能通过增加细胞内抗氧化剂含量及各种抗氧化酶的活性,增强线粒体的功能和结构的完整性,对心脏、大脑、肝脏、肾脏等组织或细胞损伤均具有一定的保护作用[3-6]。但有关五味子多糖对肝细胞氧化应激损伤的保护作用机制尚未见相关报道。
本实验以体外培养的原代大鼠肝细胞为研究对象,利用H2O2制备氧化应激损伤模型,观察五味子多糖对氧化损伤大鼠肝细胞的保护作用,为临床肝脏药物的开发提供实验依据和理论参考。
1 材料与方法
1.1 材料 五味子多糖(上海信谊天平药业有限公司,批号:88415-35-4,≥99%);DMEM高糖培养基(上海吉诺公司)、胎牛血清(四季青生物有限公司)、胰蛋白酶(上海吉诺公司);CCK-8试剂盒(上海海联生物有限公司);BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号:P0023S-09);MDA、NO检测试剂盒购自南京建成生物有限公司;一抗稀释液(上海谷歌公司);ECL显色液(Sigma公司);β-actin、P67-phox、P47-phox、SOD1、HO-1、Rac1、p-Rac1一抗均购自美国Abcam公司;二抗羊抗兔IgG购自上海谷歌生物有限公司。
1.2 仪器 单人超净工作台(上海苏静实业有限公司);细胞培养箱(上海印溪仪器仪表有限公司);Victor3 1420 Multilable Counter酶标仪(美国BD,FACS AriaⅢ);HD-3000凝胶成像仪(上海上天精密仪器有限公司);7230G数显可见紫外分光光度计测定仪(上海菁华)。
1.3 原代细胞培养[7]采用改良原位两步非循环灌流法及多次过滤低速离心法分离原代大鼠肝细胞。采用DMEM完全培养基(包含10%胎牛血清、1%的105U/L青霉素和100 mg/L链霉素、160 U/L胰岛素)培养原代大鼠肝细胞。重悬调整肝细胞密度后,以1×106个细胞/孔接种于铺有鼠尾胶原的6孔板上培养,置于37 ℃、5% CO2培养箱中培养。4 d后换液,用DMEM完全培养基继续培养,之后每1 d换液1次,并在倒置显微镜下观察细胞形态变化。
1.4 大鼠肝细胞存活率检测 取对数生长期的大鼠肝细胞,清洗、消化、重悬细胞后,以5×103/孔接种至96孔板中,每组实验设置6个复孔,37 ℃、5% CO2的培养箱中培养过夜。低(20 μg/mL)、中(40 μg/mL)、高(80 μg/mL)剂量五味子多糖和H2O2共同作用肝细胞,加入含药物的终体积为100 μL/孔。五味子多糖作用24 h后,吸干旧培养基,每孔加入含CCK-8试剂10 μL的新鲜培养基100 μL。待CCK-8试剂与细胞作用1 h后,采用酶标仪测定450 nm处的吸光度OD值,并计算肝细胞相对存活率。
1.5 MDA、NO含量检测 取对数生长期的大鼠肝细胞,清洗、消化、重悬细胞后,以5×105/孔接种至6孔板中,每组实验设置6个复孔,37 ℃、5% CO2的培养箱中培养过夜。低、中、高剂量五味子多糖和H2O2共同作用肝细胞,加入含药物的终体积为1 mL/孔。药物作用24 h后,收集细胞上清培养液及细胞,将细胞裂解成匀浆液,按照试剂说明书测定MDA、NO含量。
1.6 蛋白表达水平检测 取对数生长期的大鼠肝细胞,清洗、消化、重悬细胞后,以5×105/孔接种至6孔板中,37 ℃、5% CO2的培养箱中培养过夜。低、中、高剂量五味子多糖和H2O2共同作用细胞,加入含药物的终体积为1 mL/孔。药物作用24 h后,收集细胞、裂解、测定蛋白浓度。细胞裂解液中加入上样缓冲液,100 ℃加热煮沸10 min。电泳时,每孔上样蛋白量为40 μg,在12%的SDS-PAGE凝胶中电泳分离,浓缩胶电泳分离时,电压设置为70 V,分离胶电泳时,电压设置为120 V;分离完成后在275 mA电流转膜60 min;再将NC膜用5%脱脂奶粉室温封闭1 h;一抗孵育过夜后,二抗常温下孵育1 h,洗膜3次,显色成像。

2 结果
2.1 各组原代大鼠肝细胞相对存活率的变化 五味子多糖孵育原代大鼠肝细胞24 h后,低、中、高浓度五味子多糖对细胞存活率的影响见图1。H2O2刺激细胞可明显降低细胞的相对存活率,与对照组相比差异有统计学意义(P<0.05);而经过低、中、高剂量五味子多糖作用后,细胞相对存活率较H2O2诱导组升高,差异均有统计学意义(P<0.05)。随着五味子多糖剂量上升,细胞相对存活率显著升高,说明五味子多糖呈浓度依赖性改善H2O2诱导大鼠肝细胞氧化应激损伤。
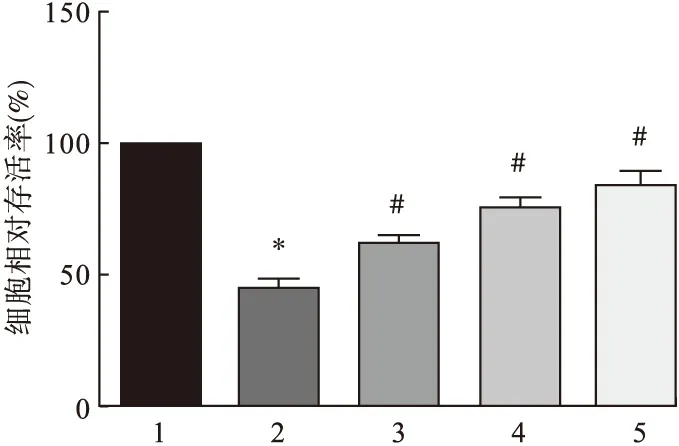
图1 五味子多糖对大鼠肝细胞增殖的影响
注:1.空白对照组,2.H2O2诱导组,3.H2O2+低剂量五味子多糖组,4.H2O2+中剂量五味子多糖组,5.H2O2+高剂量五味子多糖组。与空白对照组比较,*P<0.05;与H2O2诱导组比较,#P<0.05
2.2 大鼠肝细胞培养液中NO、MDA含量的变化 NO、MDA检测试剂盒对大鼠肝细胞氧化应激产物检测结果如图2所示,结果显示,H2O2处理组细胞中 NO、MDA含量均显著高于空白对照组(P<0.05)。经过高、中、低3种浓度五味子多糖作用大鼠肝细胞后,发现NO、MDA含量较H2O2处理组细胞明显降低,差异均有统计学意义(P<0.05),并且随着五味子多糖浓度增加显著性增强,呈现出浓度依赖性。说明五味子多糖可以抑制氧化应激产物NO、MDA的产生,起到保护大鼠肝细胞氧化应激损伤的作用。
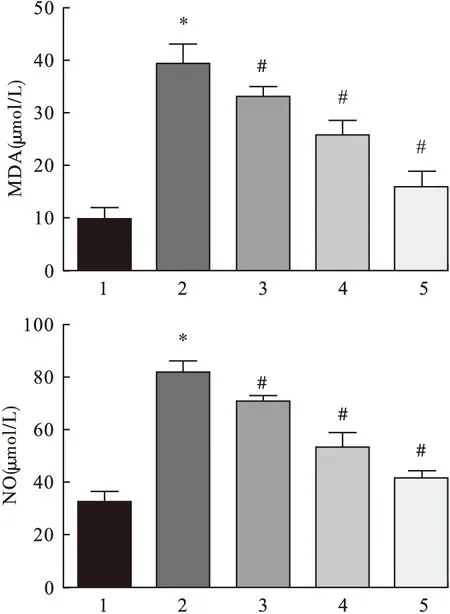
图2 不同组别间细胞氧化应激产物的比较
注:1.空白对照组,2.H2O2诱导组,3.H2O2+低剂量五味子多糖组,4.H2O2+中剂量五味子多糖组,5.H2O2+高剂量五味子多糖组。与空白对照组比较,*P<0.05;与H2O2诱导组比较,#P<0.05
2.3 大鼠肝细胞中P67-phox、P47-phox、SOD1、HO-1表达水平的变化 结果表明,H2O2处理组细胞中促氧化蛋白P67-phox和P47-phox表达水平均显著高于空白对照组,而抗氧化蛋白HO-1及SOD1表达水平均低于空白对照组(P<0.05)。经3种浓度五味子多糖作用大鼠肝细胞后,P67-phox、P47-phox表达水平降低,HO-1、SOD1表达水平升高,与H2O2诱导组比较差异均有统计学意义(P<0.05),并且随着五味子多糖剂量增加显著性增强,表现出浓度依赖性。见图3、图4。

图3 五味子多糖对细胞P67-phox、P47-phox、SOD1、HO-1表达水平的影响
2.4 大鼠肝细胞中Rac1磷酸化水平的变化 H2O2诱导组中Rac1磷酸化水平显著高于空白对照组(P<0.05),说明H2O2可诱导Rac1磷酸化导致氧化应激。不同剂量五味子多糖处理细胞后,p-Rac1水平显著低于H2O2诱导组,(P<0.05),并表现出浓度依赖性。见图5。
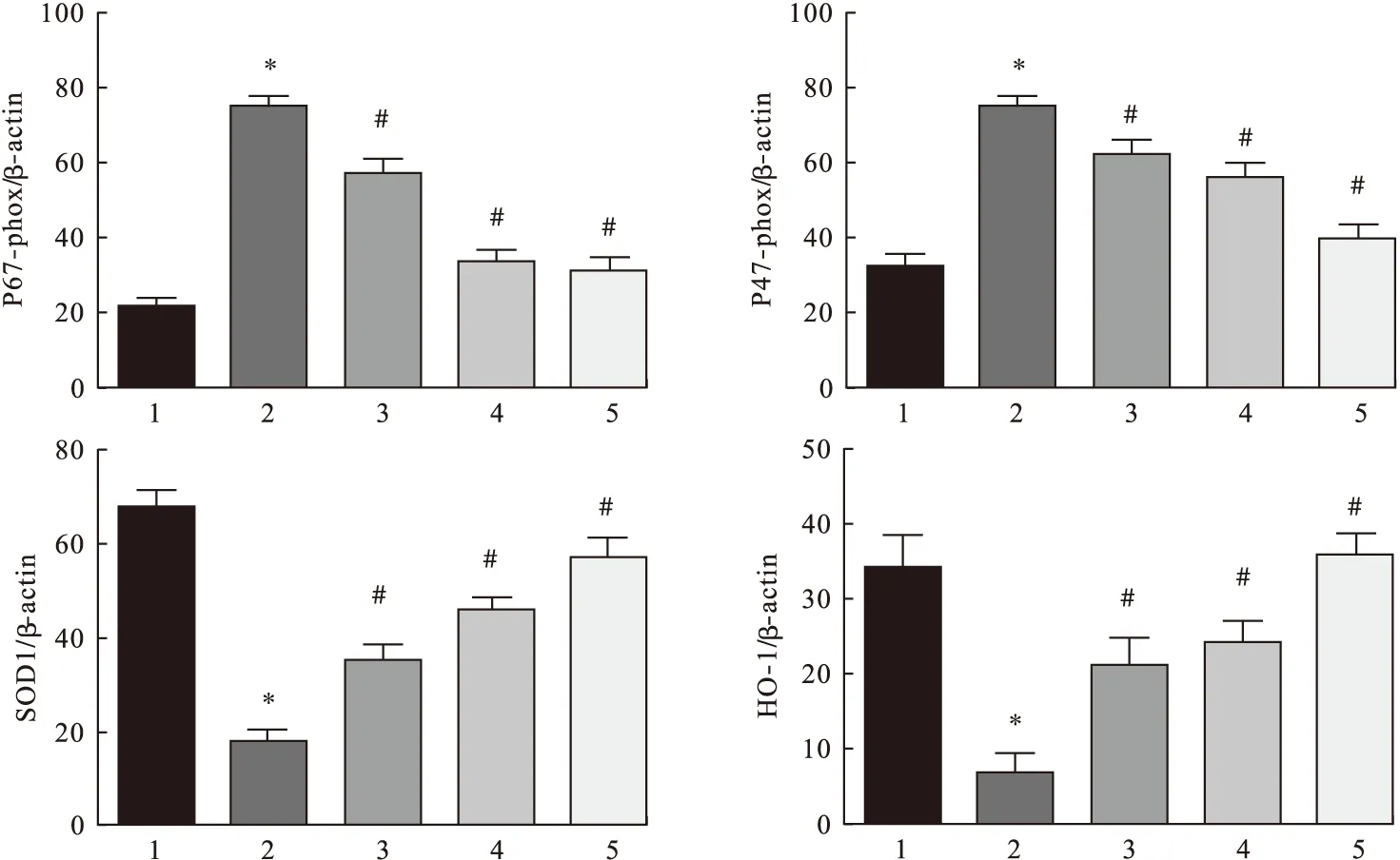
图4 各组P67-phox、P47-phox、SOD1、HO-1表达水平比较
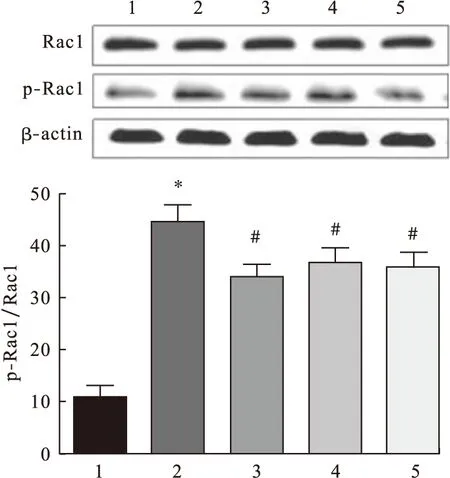
图5 五味子多糖对Rac磷酸化的影响
3 讨论
细胞内多种氧化还原反应的代谢产物会产生活性氧(ROS),体内ROS的产生和清除保持着动态平衡状态,以保证内环境的稳态。在多种体内外损伤因素的作用下,活性氧的生成大于自身的清除,进而产生氧化应激,活性氧在体内增多并参与氧化生物大分子的形成,诱发基因突变、蛋白质变性和脂质过氧化,进而损伤溶酶体、线粒体等细胞器,最终引起细胞的氧化应激损伤[6,8]。研究发现,氧化应激损伤常常导致肝纤维化的发生,而且抗氧化剂可以减慢或阻止肝纤维化的发展[9-10]。本实验结果发现,五味子多糖可以改善H2O2诱导的大鼠肝细胞氧化应激损伤,可通过促进肝细胞的增殖、抑制氧化应激产物MDA、NO的生成来达到作用效果。
P67-phox、P47-phox为促氧化的NADPH氧化酶的两个亚基,SOD1、HO-1是抗氧化发生的超氧化物歧化酶,其在氧化应激发生过程中有着重要的作用。本实验结果发现,五味子多糖可以显著降低P67-phox及P47-phox蛋白的表达水平,而显著升高SOD1及HO-1蛋白表达水平[11-12]。三磷酸酶(Rac1)在NADPH氧化酶的活化过程中起着重要的作用,Rac1的磷酸化可以激活氧化应激通路,导致组织氧化应激损伤的发生[13]。本实验也发现,五味子多糖可以抑制Rac1的磷酸化,起到抗氧化应激的作用。综上所述,五味子多糖可能通过抑制Rac1的磷酸化,降低P67-phox、P47-phox蛋白的表达,促进SOD1及HO-1蛋白表达,抑制氧化应激产物NO、MDA的产生,达到抗氧化应激的作用。
[1] 李梅,金晶,李佳,等.五味子乙素激活Nrf2/ARE通路对顺铂致HK-2细胞氧化应激损伤的保护作用[J].药学学报,2012,47(11):1434-1439.
[2] 金银萍,侯微,高薇,等.五味子对H2O2诱导的HaCaT细胞氧化应激损伤的保护作用[J].天然产物研究与开发,2015,27(11):1967-1971.
[3] 唐泽波,温娜,金宏.五味子多糖对氧化应激损伤血管内皮细胞的保护作用[J].中国西部科技,2014,(11):97-98.
[4] Gao XX,Meng XJ,Li JH,et al.Isolation,characterization and hypoglycemic activity of an acid polysaccharide isolated from Schisandra chinensis (Turcz.)[J].Baill Letters Organic Chem,2009,6(12):428-433.
[5] 高晓旭,李继海,姜贵全,等.北五味子多糖超声波提取及对油脂抗氧化性能研究[J].东北林业大学学报,2009,37(4):34-36.
[6] 高晓旭,孟宪军,李继海.北五味子活性多糖降脂减肥作用的研究[J].食品工业科技,2008,29(11):248-251.
[7] 叶娟,王群,付溪,等.原代大鼠肝细胞分离及培养鉴定[J].实用儿科临床杂志,2012,27(7):531-533.
[8] 范小华,王浩,谭康联,等.结直肠癌术后患者中医生存质量量表的研制及条目筛选[J].中国中西医结合杂志.
[9] 许文忠,黄月珠,于宏杰,等.嘉定区安亭镇“市民健康工程”实施效果评价[J].上海预防医学,2016,28(10):713-716.
[10] Tarry-Adkins JL,Fernandez-Twinn DS,Hargreaves IP,et al.Coenzyme Q10 prevents hepatic fibrosis,inflammation,and oxidative stress in a male rat model of poor maternal nutrition and accelerated postnatal growth[J].Am J Clin Nutr,2016,103(2):579-588.
[11] Matono R,Miyano K,Kiyohara T,et al.Arachidonic acid induces direct interaction of the p67(phox)-Rac complex with the phagocyte oxidase Nox2,leading to superoxide production[J].J Biol Chem,2014,289(36):24874-24884.
[12] Tafuri F,Ronchi D,Magri F,et al.SOD1 misplacing and mitochondrial dysfunction in amyotrophic lateral sclerosis pathogenesis[J].Front Cell Neurosci,2015,9:336.
[13] Gong J,Li ZZ,Guo S,et al.Neuron-specific tumor necrosis factor receptor-associated factor 3 Is a central regulator of neuronal death in acute Ischemic stroke[J].Hypertension,2015,66(3):604-616.
Protectivemechanismofschizandraepolysaccharideforoxidativestressinrathepatocytes
WANG Ronga,LIU Lib,ZHANG Ling-lic
(a.Nursing Department,b.Department of Thoracic Surgery,c.Department of Pharmacy,Renmin Hospital of Wuhan University,Wuhan 430060,China)
ObjectiveTo investigate the protective effect of schizandrae polysaccharide for oxidative stress in rat hepatocytes,and study the molecular mechanism of schizandrae polysaccharide in inhibiting oxidative stress.MethodsPrimary rat hepatocytes were culturedinvitro,and the rat hepatocytes were divided into five groups:control group,H2O2-induced group,and low,medium and high-dose schizandrae polysaccharide groups.The effect of schizandrae polysaccharide on the relative survival rate of hepatocytes was observed using CCK-8 assay.The levels NO and MDA were measured by related kits.The expression levels of P67-phox,P47-phox,SOD1,HO-1,Rac1 and p-Rac1 in cells were determined by Western blot.ResultsCompared with H2O2-induced group,schizandrae polysaccharide could significantly improve the survival rate of hepatocytes (P<0.05) and inhibit the levels of NO and MDA in hepatocytes (P<0.05);the expression levels of HO-1 and SOD-1 in all schizandrae polysaccharide groups were significantly increased (P<0.05),while the levels of P67-phox and P47-phox were significantly decreased (P<0.05).Moreover,the phosphorylation levels of Rac1 were significantly decreased in all schizandrae polysaccharide groups (P<0.05).ConclusionSchizandrae polysaccharide can significantly inhibit the oxidative stress injury of hepatocytes and its underlying mechanism may involve suppressing the phosphorylation of Rac1.
Schizandrae polysaccharide;Rat;Hepatocytes;Oxidative stress
2017-04-13
武汉大学人民医院a.护理部,b.胸外科,c.药学部,武汉 430060
10.14053/j.cnki.ppcr.201712001
