发芽对豇豆营养成分与微量元素的影响
2018-01-03刘金芳胡广林唐琦余赛西李凯
刘金芳,胡广林,唐琦,余赛西,李凯
(海南大学材料与化工学院,海南海口570228)
发芽对豇豆营养成分与微量元素的影响
刘金芳,胡广林*,唐琦,余赛西,李凯
(海南大学材料与化工学院,海南海口570228)
以海豇1号(H1)、海豇2号(H2)和海秀7号(H7)3种豇豆为原料,探讨发芽过程中营养成分和微量元素的变化。研究表明:发芽1 d时,除H2外,H1和H7的可溶性蛋白质的含量显著增加,随后3种品种均逐渐下降;随发芽时间的延伸,3种品种豇豆淀粉含量均呈下降趋势,可溶性总糖含量均是先降低后增加的趋势,H2和H7还原糖含量出现先增后减趋势而H1还原糖含量逐渐增加;在发芽3 d时3种品种维生素C含量达最高,H1、H2和H7分别为20.98、19.51、25.88mg/100 g;微量元素(Zn、Fe、Mn、Cu)含量存在基因型差异,3种豇豆随着发芽时间延长没有规律性变化但发芽5天后含量均略有增加;发芽4天后,3种品种豇豆的抗营养因子(植酸、单宁)含量分别降低了H1(48.68%,90.56%)、H2(27.27%,91.79%)和 H7(56.23%,90.03%),随后平缓。
豇豆;发芽;营养成分;微量元素
豇豆(Vigna unguiculata L.Walp)俗称角豆、姜豆、带豆,是一种极为常见的荚果细长的豆类作物,在我国广为种植,是夏秋两季的主要蔬菜之一。豇豆中,平均含有24%左右的蛋白质,1%~2%的脂肪和50%~67%碳水化合物[1],富含铁、磷、钙、维生素、纤维素等营养成分,并含多种氨基酸,特别是赖氨酸和色氨酸含量比较高,可以弥补禾谷类粮食的不足,是我国和东南亚等许多国家的重要豆类作物,豇豆比大多数其它豆类作物适应性强,耐热、耐旱及耐膺薄,种植经济效益较好,是近几十年来受到世界人民广泛重视而发展较快的豆类作物。
发芽是一种重要并简单的食品生物加工技术,豆类发芽后的整体营养价值得到提高[1-3]。在发芽过程中,种子中的酶(如植酸酶、淀粉酶和蛋白酶)被激活,从而释放出种子中的营养物质,降低抗营养成分的水平[2]。目前对豆类发芽过程中营养成分的研究较多,如王婷婷等[3]和吴海虹等[4]对蚕豆发芽过程中营养成分的变化进行探究;王洪涛等[5]对3种大豆发芽过程中营养成分变化规律研究以及王旭等[6]对绿豆萌发芽过程营养成分探究,但目前很少对豇豆发芽过程营养成分和微量营养成分(微量元素)的探究。本文以海豇1号(H1)、海豇 2号(H2)和海秀 7号(H7)为研究对象,探究发芽过程中豇豆营养成分及微量元素的变化。为豇豆食品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
海豇1号、海豇2号:海南省农业科学院蔬菜研究所;海秀7号:海口市潮汕种子店;牛血清蛋白(BR):上海伯奥生物科技有限公司;考马斯亮蓝G250(AR):上海晶纯生化科技有限公司;没食子酸(RG):上海麦克林生化科技有限公司;锌、铁、锰和铜标准溶液(1 000μg/mL):国家标准物质研究中心。
1.2 仪器与设备
火焰原子吸收分光光度计(TAS-99)、紫外可见分光光度计(TU-1901):北京普析通用仪器有限公司;恒温培养箱(CP-ST50A):长沙长锦科技有限公司;数显式电热恒温干燥箱(101B):余姚市远东数控仪器厂;离心机(DL-5-B):上海安亭科学仪器厂;超声波清洗仪(JL-180DTH):上海杰理科技有限公司。
1.3 方法
1.3.1 发芽豇豆样品的制备
选取颗粒完整、饱满且种皮色泽正常豇豆60粒用2%次氯酸钠消毒15min,用蒸馏水清洗3次后,加50mL水于恒温培养箱中浸泡12 h(浸泡温度为28℃),再避光培养(发芽温度为28℃,期间每隔6 h喷淋水1次)。每天采收发芽豇豆,用蒸馏水清洗3次,于(50±5)℃恒温干燥箱干燥12 h,磨成干粉,过60目筛,置于样品袋中备用。
1.3.2 豇豆生长指标和营养成分的测定
生长指标:芽长测定参考熊先清等[7]方法;发芽率和含水率测定参考徐娜等[8]方法。
可溶性蛋白质测定:考马斯亮蓝G-250比色法[9];还原糖、可溶性总糖、淀粉测定:DNS试剂显色法[10];VC测定:2,6-二氯靛酚滴定法(GB6195-86)[11];单宁测定:分光光度法(NY/T 1600-2008)[12];植酸:氯化铁沉淀法[13]。
1.3.3 微量元素含量的测定
微量元素测定参考ZOU Tao等[14]方法,稍加改善。准确称取0.3 g发芽豇豆干粉于高压密封消解罐内杯中,加入6mL浓HNO3预消解10 h后,加入1.5mL H2O2,组装好高压密封消解罐,于150°C电热恒温干燥箱中消解4 h,冷却至室温后,用二次水定容至50mL,制得样品消解液,采用火焰原子吸收分光光度法测定发芽豇豆中微量元素(Zn、Fe、Mn、Cu)含量。
1.4 数据处理
采用SPSS 22.0和Origin 7.5进行数据分析,并使用SPSS 22.0统计软件进行差异显著性分析(Duncan多重比较,p=0.05)。本试验中每个试样作3个平行样。
2 结果与分析
2.1 发芽过程中豇豆的生长指标的变化
不同基因型豇豆的发芽特性由表1数据所示。

表1 发芽时间对豇豆芽生长的影响Table 1 Effects of germination time on the growth of cowpea
3种豇豆的下胚轴长和含水率均随着发芽时间延长显著增加的趋势(P<0.05)。发芽5天后,H1,H2和H7的含水率分别是发芽1 d的1.38、1.28、1.31倍,其中H1的含水率最高达84.18%;H1,H2和H7的下胚轴长相比发芽1 d分别增加了6.64、5.98、7.80 cm,其中H7的下胚轴最长达8.10 cm。从表1中可以看出,发芽超过2 d,3种豇豆的发芽率均可达95%以上。故3种发芽豇豆的生长趋势良好。
2.2 发芽过程中豇豆营养成分和微量元素的变化
2.2.1 发芽过程中可溶性蛋白的变化
发芽过程中,豇豆可溶性蛋白质含量变化如图1所示。
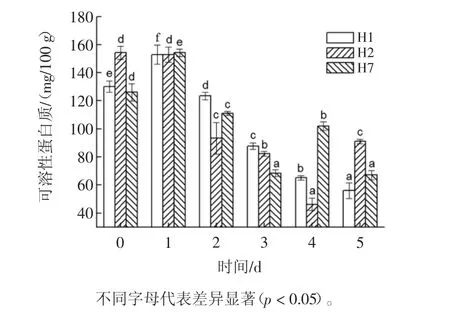
图1 发芽过程中豇豆可溶性蛋白质含量变化Fig.1 Change in soluble protein content of cowpea bean during germination
由图1可知,豇豆种子的初始可溶性蛋白质含量存在品种差异。发芽1 d后,除了海豇2号与初始值相近外,其他两个品种豇豆可溶性蛋白质显著增加(P<0.05),海豇1号和海秀7号增幅分别达17.44%和22.37%。发芽第2天~5天,除了H7在第4天和H2在第5天可溶性蛋白质呈现增加趋势外,3种豇豆的可溶性蛋白质呈逐渐下降趋势。豇豆发芽过程中,可溶性蛋白质的含量先增加后下降的原因可能是由于发芽初期贮藏蛋白中的某些不溶性蛋白质在水合状态下吸水膨胀,内部结构解体转换为可溶性蛋白质,导致可溶性蛋白质显著升高[4]。随着发芽的推进,蛋白酶活性的升高,使大分子的可溶性蛋白进行一定程度的水解[2,4]。
2.2.2 发芽过程中淀粉、还原性糖和可溶性总糖的变化
发芽过程中,豇豆淀粉含量变化如图2所示。
由图2可知,3种豇豆淀粉含量随着发芽时间的延长呈现显著降低趋势(P<0.05)。这与王婷婷等[3]报道的蚕豆发芽期间淀粉含量随时间延伸减少的现象一致。H1出现微增后再降低,可能是品种差异引起。发芽5天后,相比种子,H1、H2和H7的淀粉的含量分别降低了13.77%、19.46%和23.67%。发芽过程中,豇豆淀粉含量降低可能是由发芽时种子淀粉酶活力显著提高,淀粉被淀粉酶分解所致[4,15]。
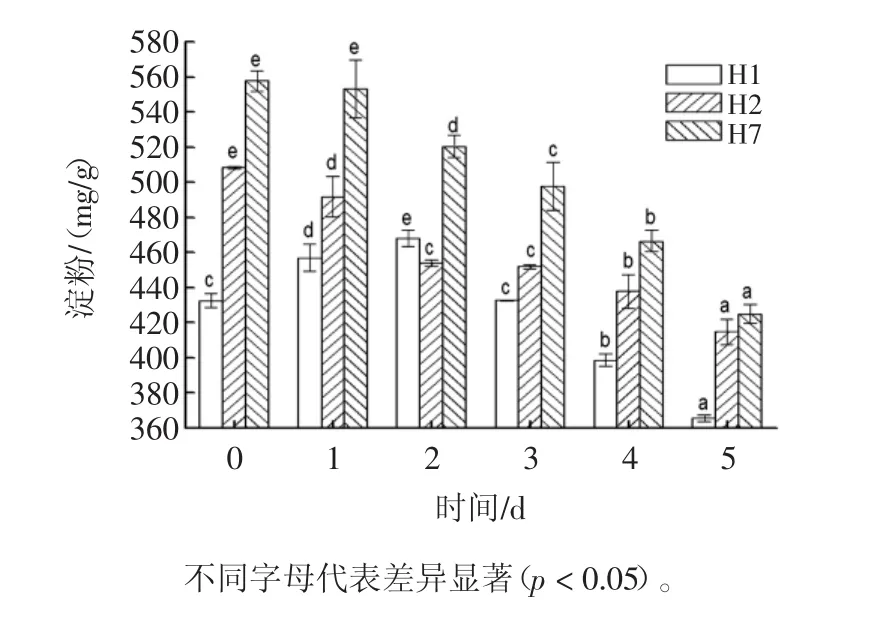
图2 发芽过程中豇豆淀粉含量变化Fig.2 Change in starch content of cowpea during germination
发芽过程中,豇豆还原糖含量变化如图3所示。

图3 发芽过程中豇豆还原糖含量变化Fig.3 Change in reducing sugar content of cowpea during germination
由图3可知,发芽1 d,3种豇豆还原糖均降低,这可能是还原糖提供发芽所需的能量所致。2 d~5 d时,除了H2在5 d和H7在4 d出现下降趋势外,还原糖含量迅速增加。发芽5天后,相比种子发芽后的H1、H2和H7还原糖含量分别增加了4.41、1.95、4.78倍。在淀粉酶的作用下,淀粉分解为葡萄糖等小分子还原性糖类[5]。
可溶性糖是植物内重要的渗透压调节物质,并可能在维持植物蛋白质稳定方面起到重要作用[7]。发芽过程中,豇豆可溶性总糖含量变化如图4所示。
由图4知,可溶性总糖随发芽时间延长变化趋势均是先降低后增加。H1和H7在第2天降到最低,分别达3.99mg/g和8.53mg/g。H2在4 d降到最低,达12.92mg/g。可溶性总糖呈现下降的趋势的原因可能是发芽幼苗组织中的可溶性糖逐渐被消耗。之后,出现上升趋势可能是由于淀粉酶活性逐渐增强,把淀粉分解成葡萄糖、蔗糖等小分子可溶性糖类。

图4 发芽过程中豇豆可溶性总糖含量变化Fig.4 Change in total soluble sugar content of cowpea during germination
2.2.3 发芽过程中VC的变化
发芽过程中,豇豆VC含量变化如图5所示。

图5 发芽过程中豇豆VC含量变化Fig.5 Change in vitamin C content of cowpea during germination
由图5可知,发芽后,3种豇豆VC含量均显著提高(P<0.05)。发芽 3 d时 VC含量达到最大,H1、H2和H7分别达 20.98、19.51、25.88mg/100 g。这种变化趋势与潘紫霄[15]论述发现大豆在发芽第3天时VC含量达到最大值(25mg/100 g)现象一致。发芽4 d~5 d时,3种豇豆VC含量略有下降,但仍高于1 d VC含量。发芽时VC含量显著增加表明豇豆萌芽过程中抗坏血酸开始合成代谢[1]。
2.2.4 发芽过程中微量元素的变化
Zn、Fe、Mn、Cu 是人体及植物生长必需的微量元素。Zn是许多酶的活动中心,是生物膜的成分,也是RNA和DNA与核糖体稳定所必需的物质;Fe最主要的生物血功能是参与氧的运输和造血过程;Mn不仅参与一些酶的构成、参与糖和脂类代谢,而且在蛋白质、DNA和RNA的合成中均起作用;Cu是生物体内许多氧化还原酶的组成部分[16]。由于供给不足和较低的生物利用率,Fe和Zn是人体饮食中经常缺少的矿物质[17]。铁和锌的缺乏被认为是世界上非常普遍的营养问题,在全球疾病主要风险因素中分别排名第9和第11[2]。发芽过程中,豇豆微量元素的变化如图6所示。

图6 发芽过程中豇豆微量元素含量变化Fig.6 Change in trace elements content of cowpea during germination
由图6所示,豇豆微量元素含量存在基因型差异。发芽5天后,3种品种Zn含量增加,H1,H2和H7分别增加了5.15%、18.04%、11.05%;Fe含量有所增加,H1,H2和H7分别增加了 22.07%、25.04%、4.17%;Cu含量变化不大,含量微增但没有显著增长;Mn含量增加,H1,H2和H7分别增加了14.97%、4.64%、19.13%。结果表明,发芽5 d可以提高豇豆中微量元素含量,但随发芽时间延长对3种豇豆微量元素含量影响没有规律性变化趋势。
2.2.5 发芽过程中抗营养因子植酸和单宁的变化及对植酸/锌摩尔比的影响
植酸(phytic acid,PA)是一种重要的抗营养因子。在人类的肠道中,植酸能降低矿物质的生物利用度,并通过抑制蛋白酶和淀粉酶来降低蛋白质和淀粉的消化率。具体地说,植酸与膳食必需矿物质钙、锌、铁和镁形成复合物,使它们在生物学上无法吸收[17-18]。发芽过程中植酸含量变化见图7。

图7 发芽过程中豇豆植酸含量变化Fig.7 Change in phytic acid content of cowpea during germination
由图7可知,发芽后豇豆中植酸的含量显著降低(P<0.05),这与前期报道一致[1,4,17]。不同品种之间的含量也存在显著性差异。发芽4 d时,H1,H2和H7这3种豇豆植酸含量达最低,分别降低了48.68%、27.27%、56.23%。植酸含量变化的原因可能是发芽过程中内源性植酸酶的活性增加,降低了植酸含量,而植酸酶的活性受到品种影响[1]。
单宁与蛋白质、淀粉和消化酶形成复合物,从而降低食物的营养价值[19]。富含单宁的食品通常认为营养价值不高。发芽过程中单宁含量变化见图8。
由图8可知,发芽可显著降低豇豆的单宁含量(P<0.05)。发芽 1 d,降低幅度最大,H1,H2和 H7分别达 69.67%、59.86%、62.53%。发芽 2 d~5 d,3种豇豆品种的单宁含量继续降低。发芽5 d时,H1,H2和H7,单宁含量分别降至1.49、1.00、0.93mg/g。
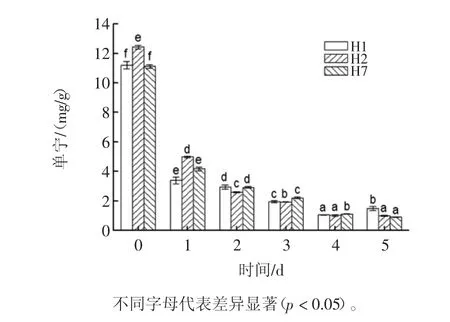
图8 发芽过程中豇豆单宁含量变化Fig.8 Change in tannin content of cowpea during germination
豆科植物中矿物质利用性不同,可能归因于矿物质含量、矿物与矿物质的相互作用以及植酸和单宁的存在[20]。在植物性食品中,锌的生物利用率主要受到植酸的影响,植酸/锌摩尔比是评价锌生物利用率的重要指标。植酸/锌摩尔比低于15,锌可获得较高的利用率[7,13,21]。发芽过程中植酸/锌含量变化见图9。

图9 发芽过程中豇豆植酸/锌含量变化Fig.9 Change in PA/Zn molar of cowpea during germination
由图9可知,发芽时间大于1 d时,3种品种的植酸/锌摩尔比均可以低于15。发芽4 d时,H1,H2和H7的植酸/锌摩尔比达最低,分别为7.88、11.17、9.86。熊先清等[7]研究中,绿豆发芽4 d植酸/锌的摩尔比从种子的25.50降到10.02。Wang等[17]研究中,发芽6 d后大豆中植酸含量降低了63%,体外模拟消化测得Zn的生物利用率显著增加。研究表明:发芽能降低植酸含量,提高Zn的生物利用度。
3 结论
种子萌发由吸水膨胀、酶系统的激活、呼吸作用增强及根芽生长等过程组成。萌芽期间,种子发生了一系列生理变化,由于不能从外界获取能量,须依靠自身的贮藏物质如淀粉、蛋白质的水解来提供芽苗生长和发育所需的能量。研究结果表明,发芽5 d,3种品种豇豆的生长趋势良好。发芽1 d时,除H2外,H1和H7的可溶性蛋白质的含量显著增加,随后3种品种均逐渐下降。萌发过程中,3种品种豇豆淀粉含量均呈下降趋势,可溶性总糖均是先降后增的趋势,H2和H7还原糖含量出现先增后减趋势而H1还原糖含量逐渐增加。3种品种维生素C含量的变化均是先增后减趋势,在发芽3 d时达最大含量。微量元素(Zn、Fe、Mn、Cu)含量存在基因型差异,随着发芽时间延长没有规律性变化,但含量有所增加。发芽使3种品种豇豆的抗营养因子(植酸、单宁)均显著降低,发芽4 d降低最显著。发芽1 d后3种品种豇豆植酸/锌的摩尔比均低于15,故发芽显著提高了Zn的生物利用率。从试验结果可以看出,发芽3 d~4 d的豇豆有相对较好生长趋势、营养物质含量和较高的微量元素的生物利用率。故可在今后的豇豆食品开发中作为参考依据。此外,也可根据不同需要选取不同萌发期的豇豆进行各种深加工。
[1]DEVI B C,KUSHWAHA A,KUMAR A.Sprouting characteristics and associated changes in nutritional composition of cowpea(Vigna unguiculata)[J].Journal of Food Science and Technology,2015,52(10):6821-6827
[2]RAES K,KNOCKAERT D,STRUIJS K,et al.Role of processing on bioaccessibility of minerals:Influence of localization of minerals and anti-nutritional factors in the plant[J].Trends in Food Science&Technology,2014,37:32-24
[3]王婷婷,刘嘉坤,李岩.发芽处理对蚕豆主要成分和γ-氨基丁酸的影响[J].食品研究与开发,2017,38(1):6-9
[4]吴海虹,宋江峰,李大婧,等.发芽处理对蚕豆主要营养成分与抗营养因子的影响[J].食品科学,2012,33(9):110-113
[5]汪洪涛,陈成,余芳,等.3种大豆发芽过程中营养成分变化规律研究[J].食品与机械,2015,31(1):30-32
[6]汪旭,陈野.绿豆萌芽过程营养成分变化规律[J].食品研究与开发,2015,36(9):1-4
[7]熊先清,胡广林.外源锌浸种处理对绿豆芽生长和营养品质的影响[J].食品工业科技,2017,38(4):170-175
[8]徐娜,邹涛,庞锦伟,等.外源锌浸种对大豆种子萌发、大豆芽生长及锌积累的影响[J].大豆科学,2012,31(6):932-936
[9]强伟,王洪伦,周昌范,等.考马斯亮蓝G-250染色法测定柠条锦鸡儿种子中可溶性蛋白含量[J].氨基酸和生物资源,2011,33(3):74-76
[10]尹建雄,卢红,谢强,等.3,5-二硝基水杨酸比色法快速测定烟草水溶性总糖、还原糖及淀粉的探讨[J].云南农业大学学报,2007,22(6):829-833
[11]中华人民共和国农牧渔业部.GB6195-86水果、蔬菜维生素C含量测定法[S].北京:中国标准出版社,1986:90-93
[12]中华人民共和国农业部.NY/T1600-2008水果、蔬菜及其制品中单宁含量的测定[S].北京:中国标准出版社,2008:1-2
[13]WANG Z M,LIU Q,PAN F,et al.Effects of increasing rates of zinc fertilization on phytic acid and phytic acid/zinc molar ratio in zinc bio-fortified wheat[J].Field Crops Research,2015,184:58-64
[14]ZOU T,XU N,HU GL,et al.Biofortification of soybean sprouts with zinc and bioaccessibility of zinc in the sprouts[J].Science Food A-griculture,2014,94:3053-3060
[15]潘紫霄.大豆发芽后营养成分的变化[J].农产品加工,2004(9):22-23
[16]陈建,吴国杰,赵谋明.食品化学原理[M].广州:华南理工大学出版社,2015:284-285
[17]WANG X K,YANG R Q,JIN X L,et al.Distribution of phytic acid and associated catabolic enzymes in soybean sprouts and indoleacetic acid promotion of Zn,Fe,and Ca bioavailability[J].Food Science and Biotechnology,2015,24(6):2161-2167
[18]CONCALVES A,GOUFO P,BARROS A,et al.Cowpea(Vigna unguiculata L.Walp),a renewed multipurpose crop for a more sustainable agri-food system:nutritional advantages and constraints[J].Science Food Agriculture,2016,96:2941-2951
[19]DWIVEDI M,YAJNANARAYANA K V,KAUR M,et al.Evaluation of anti nutritional factors in fungal fermented cereals[J].Food Science and Biotechnology,2015,24(6):2113-2116
[20]TRINIDAD T P,MALLILLIN A C,LOYOLA A S,et al.The potential health benefits of legumes as a good source of dietary fibre[J].British Journal of Nutrition,2010,103:569-574
[21]LEE H H,LOH SP,BONG C F,et al.Impact of phytic acid on nutrient bioaccessibility and antioxidant properties of dehusked rice[J].Journal of Food Science and Technology,2015,52(12):7806-7816
Effects of Germination on Nutritional Composition and Trace Elements in Cowpea
LIU Jin-fang,HU Guang-lin*,TANG Qi,YU Sai-xi,LI Kai
(College of Materials and Chemical Engineering,Hainan University,Haikou 570228,Hainan,China)
Cowpea(Vigna unguiculata)cultivars Haijiang No.1(H1),Haijiang No.2(H2)and Haixiu No.7(H7),as raw materials,were used to investigate the change of germination on nutritional composition and trace elements during the process of germination.The results showed that soluble proteins of H1 and H7(except for H2)significantly were increased after 1 d of germination,and then were gradually decreased in the three cultivars.With the extension of the germination time,three cultivars of cowpea starch all were decreased,and total soluble sugar were decreased first and then increased.The content of reducing sugar in H2 and H7 were increased first and then decreased and H1 reducing sugar content was gradually increased.The content of vitamin C (VC)in H1,H2 and H7 reached a maximum level of 20.98,19.51,25.88mg/100 g after 3 d of germination,respectively.Significant difference on trace elements(Zn,Fe,Mn,Cu)among 3 genotypes was observed,and there was no regular change during germination but contents were a slight increased after 5 d of germination.After 4 d of germination,the anti-nutritional factors(phytic acid,tannin)of the three varieties of H1,H2 and H7 were decreased by(48.68%,90.56%),(27.27%,91.79%)and(56.23%,90.03%),respectively,and then gently.
cowpea;germination;nutritional composition;trace elements
刘金芳,胡广林,唐琦,等.发芽对豇豆营养成分与微量元素的影响[J].食品研究与开发,2018,39(1):100-105
LIU Jinfang,HU Guanglin,TANG Qi,et al.Effects of Germination on Nutritional Composition and Trace Elements in Cowpea[J].Food Research and Development,2018,39(1):100-105
10.3969/j.issn.1005-6521.2018.01.020
国家自然科学基金资助项目(31460390)
刘金芳(1990—),女(汉),在读硕士研究生,研究方向:微量元素生物强化。
*通信作者:胡广林(1967—),男,教授,博士,主要从事食品营养成分方面的工作。
2017-07-22
