荧光法测定蒲公英中总黄酮的含量
2018-01-03高生平吴晓红张雅欣张玉婷
高生平,吴晓红,张雅欣,张玉婷
(1.南京工业大学浦江学院,江苏南京211134;2.江苏经贸职业技术学院,江苏南京211168)
荧光法测定蒲公英中总黄酮的含量
高生平1,吴晓红2,张雅欣1,张玉婷1
(1.南京工业大学浦江学院,江苏南京211134;2.江苏经贸职业技术学院,江苏南京211168)
根据黄酮类化合物能与铝离子形成稳定的荧光络合物,建立一种测定蒲公英中总黄酮的新方法。用60%乙醇加热回流提取蒲公英有效成分,以芦丁为标样,选择激发波长419 nm,发射波长506 nm,采用荧光法测定蒲公英中总黄酮含量,并进行加标回收试验。结果表明,该方法检出限低,回收率在90%~104%之间,线性回归方程为y=179.69x+145.13,相关系数 R2为 0.995 1。
荧光法;蒲公英;总黄酮
蒲公英是一种常见的药食同源植物[1]。蒲公英中 除含有蛋白质、微量元素、维生素、氨基酸、矿物质外,还含有多糖、多酚、绿原酸、咖啡酸和黄酮类物质等活性成分[2-6]。蒲公英全草具有清热解毒、利尿、缓泻等传统功效[5],是常用重要中药之一。最近研究表明,蒲公英还具有抗氧化[7]、抗炎抑菌[8]、抗病毒[9]、抗肿瘤[10]等作用,也有研究表明蒲公英的药用价值与其所含黄酮类物质有着极大的关系[11],这引起了人们的关注。我国资源十分丰富,但其黄酮含量因产地不同而差别较大[12],因此准确测定蒲公英中总黄酮含量对蒲公英的开发利用具有重要意义。
目前植物中总黄酮的测定方法主要是分光光度法[13-14]、薄层色谱法[15]和高效液相色谱法[16],薄层色谱法常用于定性,高效液相色谱法需要所有黄酮单体的标样才能定量测定总黄酮含量,成本高且难度大。分光光度法因其不需要复杂的仪器设备,且所需试剂便宜易得,故常被用于测定植物中的总黄酮含量。但现有研究[17-18]显示,用硝酸铝分光光度法测定总黄酮时,植物中绿原酸的存在可能对结果有干扰,因邻二酚类结构与Al3+形成稳定结构,并使测定的总黄酮含量偏高。本文根据黄酮类化合物能与铝离子形成稳定的荧光络合物的特性,采用荧光分析法测定了蒲公英中的总黄酮含量,并考察了绿原酸对测定结果的影响,旨在准确测定蒲公英中总黄酮含量,为鉴定其质量提供参考。
1 材料与方法
1.1 仪器
F-280型荧光分光光度计:天津港东科技发展股份有限公司;TGL-16型高速台式离心机:江苏省金坛市友联仪器研究所;KQ-50B型超声波清洗器:昆山市超声仪器有限公司;FA2004电子天平:上海精密仪器仪表有限公司。
1.2 材料
芦丁标准对照品(≥98%)、绿原酸标准对照品(≥98%)、硝酸铝、乙酸钠、无水乙酸、无水乙醇:分析纯试剂;蒲公英:自采低温烘干后粉碎备用。
1.3 试验方法
1.3.1 标准溶液的制备
精密称取芦丁标准品20mg于100mL容量瓶中,用60%的乙醇溶解定容,浓度为200μg/mL,准确吸取此溶液 0.1、0.2、0.4、0.6、0.8、1.0mL 分别置于 10mL 容量瓶中,加入5%的Al(NO3)3溶液1.0mL,pH=6.3的醋酸-醋酸钠缓冲液3.0mL。用60%乙醇定容,摇匀,即配成标准工作溶液。
1.3.2 样品处理
蒲公英洗净,自然风干后在烘箱中60℃烘12 h,粉碎机将其粉碎至粉状,置于密封袋中备用。分别按以下3种方式处理。
1)静置浸提:准确称取1 g蒲公英于锥形瓶中,加入100mL 60%乙醇,保鲜膜密封24 h,离心8min取上清液。
2)超声浸提:准确称取1 g蒲公英于锥形瓶中,加入100mL 60%乙醇,60℃保鲜膜密封超声2 h,离心取上清液。
3)索式提取:准确称取1 g蒲公英于滤纸中,用细线包扎好塞进抽提筒中,加入100mL 60%乙醇,使样品完全浸没在乙醇中,连接好抽提各部分,接通冷凝水,温度达到60℃时开始计时提取4 h,离心取上清液。
1.3.3 总黄酮含量测定
考虑到试验条件对测定结果产生一定的影响,进行了缓冲溶液pH值、乙醇浓度、5%Al(NO3)3溶液加入量、静置时间几个单因素试验,选择最佳试验条件测定总黄酮含量。
准确移取一定量的芦丁标准溶液置于10mL的容量瓶中,加入5%Al(NO3)3溶液1.0mL、pH 6.3 HAc-NaAc缓冲溶液3.0mL,以60%的乙醇定容摇匀,静置10min后,选择419 nm作为激发波长,测定系列标准溶液和样品溶液的荧光光谱,以506 nm处荧光强度对浓度作标准曲线,建立回归方程。
2 结果与讨论
2.1 试验条件的研究
2.1.1 测定波长的确定
按试验方法配制成标准溶液,用荧光分光光度计测定其荧光激发光谱和发射光谱,激发和发射狭缝均为20 nm,扫描速度为240 nm/min,所得激发光谱如图1,发射光谱如图2,可见最大激发波长与最大发射波长分别为419 nm和506 nm,故以此作为测定波长。

图1 芦丁标准溶液的激发光谱Fig.1 Excitation spectra of rutin standard solution
2.1.2 溶液pH值的影响
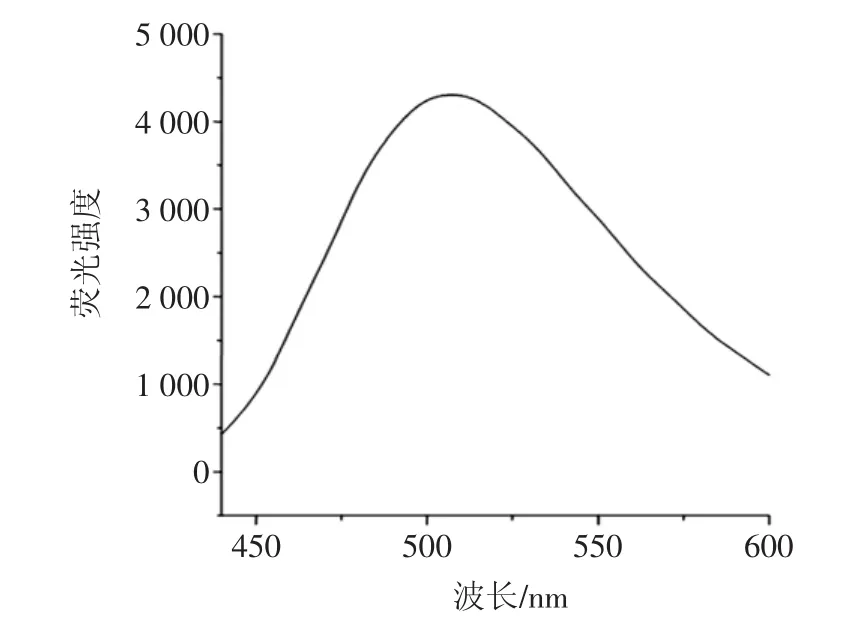
图2 芦丁标准溶液的发射光谱Fig.2 Emission spectra of rutin standard solution
不同酸度溶液对黄酮类化合物与铝离子生成配合物的稳定性以及荧光强度产生影响。在6个10mL容量瓶中,按照试验方法配制标准溶液,采用pH值分别为 3.6、3.9、4.7、4.9、5.5、6.3、6.6 的 HAc-NaAc 缓冲液,并进行荧光强度测定。如图3所示,pH值对荧光强度的影响很大且随着pH值的增加,荧光强度也一直在增大,pH=6.3时荧光强度达到顶点,pH=6.6时测定溶液中有沉淀出现,荧光强度降低,原因可能是黄酮类化合物在偏中性环境中与钠盐生成了螯合物,故试验中选择pH 6.3作为测定溶液的酸度。
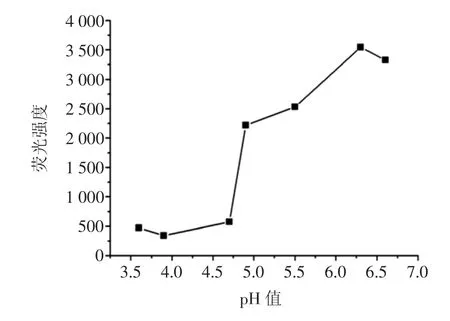
图3 溶液pH值对荧光强度的影响Fig.3 Effect on fluorescence intensity of pH
2.1.3 溶剂浓度的影响
选择了提取黄酮常用的乙醇作为溶剂,主要考察乙醇和水的混合比例对体系荧光强度的影响。在7个10mL容量瓶中,按照试验方法,分别用不同体积分数乙醇溶液定容,测定其荧光强度值,测定结果见图4。
从图4可以看出溶剂乙醇的体积分数对芦丁荧光强度影响非常大,荧光强度随乙醇体积分数的增大而变大。考虑到乙醇体积分数越大,挥发越严重,试验操作中对测定产生影响也会变大,本试验选择了60%的乙醇溶液作为溶剂,与文献[19]一致。
2.1.4 Al(NO3)3加入量的影响
黄酮类化合物与铝离子可生成稳定的荧光配合物,Al(NO3)3的用量可对荧光强度有一定的影响。在7个10mL容量瓶中,按照试验方法,分别加入5%Al(NO3)3溶液为 0、0.5、1.0、1.5、2.0、2.5、3.0mL,配制溶液后,测定各溶液的荧光强度值,结果如图5。
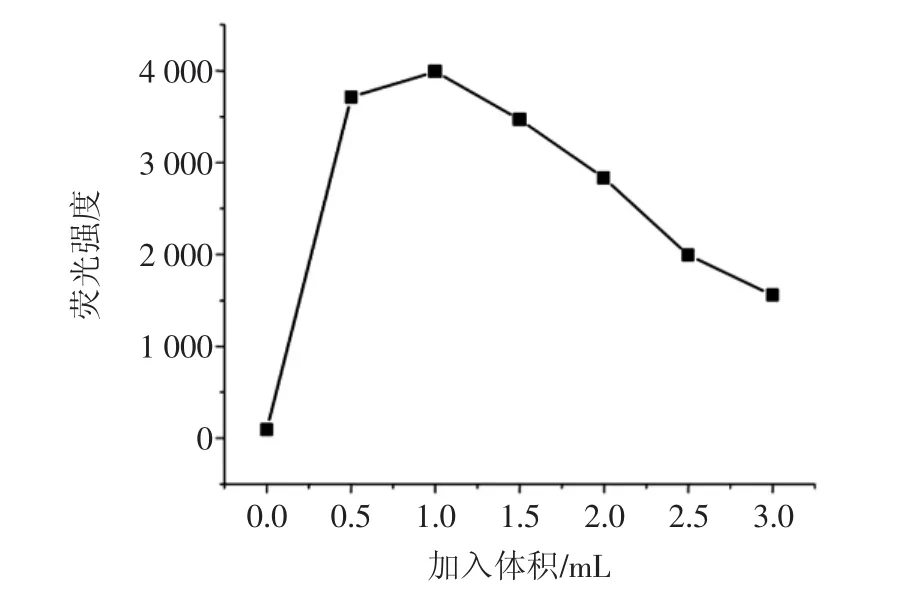
图5Al(NO3)3加入量对荧光强度的影响Fig.5 Effect on the fluorescence intensity of adding amount of Al(NO3)3
从图5可以看出,芦丁荧光值先随硝酸铝增加而增加,超过1.0mL后开始下降,当5%Al(NO3)3溶液用量为1.0mL时荧光强度较大。本试验选择采用加入5%Al(NO3)3为1.0mL。
2.1.5 静置时间的影响
将芦丁测定溶液静置于室内,并避免阳光直射,在不同时间测定溶液的荧光强度。由图6可以看出,在静置70min内荧光强度先变大后变小,但荧光强度变化不大,这说明本试验的溶液比较稳定。考虑到试验一致性,统一选择荧光强度最强的时候即溶液配好10min后进行测定。
2.1.6 绿原酸的影响

图6 静置时间对荧光强度的影响Fig.6 Effect on fluorescence intensity of static time
蒲公英提取物中含有绿原酸,绿原酸分子结构中含有邻二酚羟基,也可与Al3+形成配合物而发出荧光,从而使黄酮含量测定结果偏高。为了考察绿原酸对黄酮测定的影响,比较了419 nm作为激发光时芦丁标液和样品溶液的荧光光谱,根据图7可以看出样品与芦丁标准的发射波长只相差2 nm,说明样品中提取物发光物质与芦丁标液基本一致。为进一步验证绿原酸的干扰情况,在同等条件配制绿原酸溶液,用激发波长419 nm进行荧光扫描,如图8,可以看出此激发波长下绿原酸在500 nm之后几乎没有荧光,20倍浓度条件下可以忽略绿原酸的干扰。

图7 芦丁和样品的发射光谱Fig.7 Emission spectras of rutin and sample

图8 绿原酸标液的发射光谱Fig.8 Emission spectra of chlorogenic acid standard solution
2.2 线性方程与检出限
试验结果表明,芦丁标液的荧光强度与浓度在1.3×10-7mol/L~3.3×10-7mol/L 范围内具有良好的线性关系,线性回归方程为y=179.69x+145.13,相关系数R2为0.9951,式中:y为荧光强度;x为芦丁的浓度,μg/mL。对空白对照液进行11次平行测定,根据公式C=3S/K(式中:C 为检出限,mol/L;S为空白标准偏差,mol/L;K为校正曲线斜率)计算,方法的检出限为2.4×10-7mol/L。
2.3 样品测定与回收率
吸取0.5mL提取液在10mL容量瓶中,按照试验方法测定出样品中总黄酮含量,平行测定5次,测定结果见表1,说明该测定方法精密度较好,索氏提取法较静置浸提与超声提取法提取效果好。
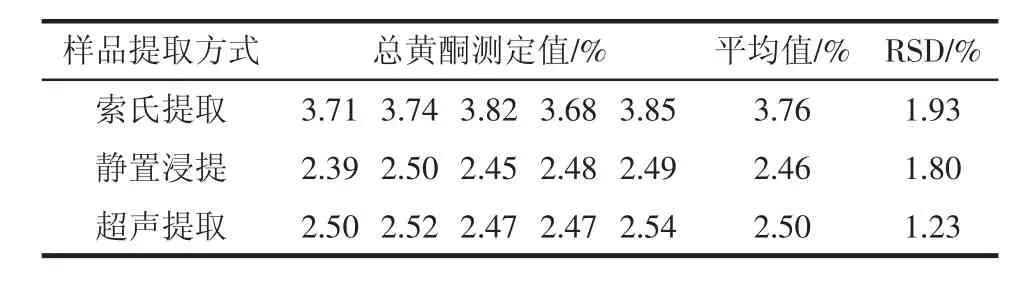
表1 样品测定结果(n=5)Table 1 Results of sample detection(n=5)
根据试验方法处理样品,加标做回收率试验,试验结果见表2,可见样品加标回收率在90%~104%之间,说明此方法的准确度较高。
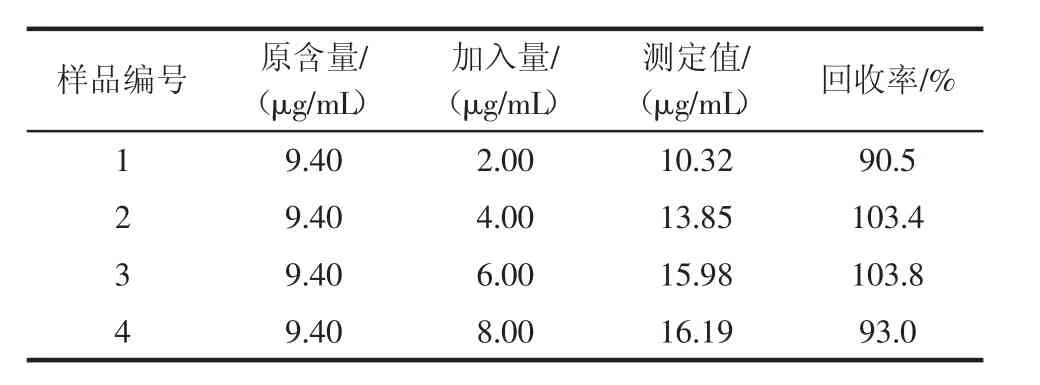
表2 样品回收率试验结果Table 2 Results of sample recovery test
3 结论与讨论
建立了荧光法测定蒲公英中总黄酮含量的方法,分别从测定波长、溶液pH值、乙醇体积分数、Al(NO3)3加入量、放置时间、提取方法等方面考察了测定条件对测定结果的影响。试验结果表明采用索式提取法提取黄酮效果较好;溶液酸度pH 6.3,5%Al(NO3)3加入量1.0mL,该测定方法灵敏度较高;20倍浓度绿原酸对测定结果无影响;芦丁标液的荧光强度与芦丁浓度(在 1.3×10-7mol/L~3.3×10-7mol/L范围内)呈现良好的线性关系,检出限低。本法灵敏度高,稳定性好,准确度高,可以作为测定蒲公英中总黄酮含量的参考方法。
黄酮类化合物的溶解度因它的结构和状态的不同而不同[20],大多数黄酮易溶于水、甲醇、乙醇等强极性溶剂,由于乙醇无毒、溶解性好,目前,针对黄酮类化合物的提取一般采用乙醇浸提的方法[21-23],本试验用60%乙醇作为溶剂,采用静置浸提、超声辅助浸提和索氏提取法3种提取方式对照,发现索氏提取法提取黄酮效果优于另外两种,操作时注意温度不能过高,防止黄酮类化合物被破坏。
[1]匡海学.中药化学[M].北京:中国中医药出版社,2003:148-152
[2]刘金娜,贾东升,马春英,等.蒲公英黄酮及蛋白含量的动态变化规律研究[J].食品研究与开发,2014,35(3):1-3
[3]Schütz K,Carle R,Schieber A.Taraxacum—A review on its phytochemical and pharmacological profile[J].Journal of Ethnopharmacology,2006,107(3):313-323
[4]Wolbis M,Krolikowska M.Polyphenolic compounds of dandelion[J].Acta Pol Pharm,1985,42:215-217
[5]赵守训,杭秉倩.蒲公英的化学成分和药理作用[J].中国野生植物资源,2001,20(3):1-3
[6]陈娜,王冬雪,王雪娟,等.蒲公英中绿原酸提取及抑菌活性研究[J].海峡药学,2016(12):16-19
[7]王剑,刘德丽,李峰.近5年蒲公英抑菌抗氧化活性研究进展[J].山东中医杂志,2015(3):233-235
[8]纪晓宇,彭苑霞,刘敏,等.蒲公英不同提取物对大肠杆菌体外抑菌活性的作用[J].广州中医药大学学报,2015(1):116-120
[9]王晓丹,夏晓玲,赵玉娇,等.蒲公英有机萃取物的抗甲型H1N1流感病毒作用[J].中国现代应用药学,2015(12):1423-1427
[10]熊富良,吴珊珊,李心愿,等.蒲公英抗肿瘤活性的研究进展[J].中国药师,2016(7):1363-1366
[11]孟志云,徐绥绪.蒲公英的化学与药理[J].沈阳药科大学学报,1997,14(2):137-143
[12]张咏梅,张淑慧,王朝卿,等.不同产地蒲公英中总黄酮的测定[J].中草药,2009,40(增刊):169-170
[13]刁海鹏,吕俊杰.蒲公英花中总黄酮含量测定[J].山西医科大学学报,2004,35(2):178-179
[14]赵二劳,史可,郭建红,等.双波长分光光度法测定蒲公英中总黄酮[J].分析科学学报,2015(5):728-730
[15]赵惠茹,蒋礼杰.微乳薄层色谱定性鉴别蒲公英中黄酮类成分的研究[J].现代中药研究与实践,2014(3):20-22
[16]赵惠茹,郭婷.反相高效液相色谱法同时测定蒲公英中槲皮素和木犀草素的含量[J].中国药师,2014(7):1106-1108
[17]陈从瑾,黄克瀛,李姣娟,等.植物中黄酮含量的光学测定方法研究进展[J].光谱实验室,2007,24(4):524-530
[18]尉芹,王冬梅,马希汉,等.杜仲叶总黄酮含量测定方法研究[J].西北农林科技大学学报:自然科学版,2001,29(5):121-125
[19]马登磊,邵建群,何深知,等.荧光分析法测定元宝枫叶中总黄酮含量的研究[J].首都医科大学学报,2014,35(1):113-117
[20]黄鑫,梁剑平,郝宝成.黄酮类化合物的分子修饰与构效关系的研究[J].安徽农业科学,2015(11):57-61
[21]陶亮亮,李鹏.超声辅助提取蒲公英中总黄酮的工艺研究[J].食品与发酵科技,2011,47(4):49-51
[22]柴建新,万茵,付桂明,等.杜仲叶总黄酮含量测定方法优化[J].中国食品学报,2013(4):225-230
[23]李利华.芹菜不同部位总黄酮含量测定及其抗氧化活性[J].食品研究与开发,2013,34(7):12-15
Determination of Total Flavonoids in Dandelion by Fluorescence Spectrometry
GAO Sheng-ping1,WU Xiao-hong2,ZHANG Ya-xin1,ZHANG Yu-ting1
(1.Nanjing Tech University Pujiang Institute,Nanjing 211134,Jiangsu,China;2.Jiangsu Vocational Institute of Commerce,Nanjing 211168,Jiangsu,China)
On the basis of flavonoids with aluminum ions to form stable fluorescent complexes,a new method for determination of total flavonoids in dandelion was established.Dandelion was heated with 60%ethanol to extract active ingredients.Rutin was selected as standard sample.The excitation wavelength was 419 nm,and the emission wavelength was 506 nm.The total flavonoids in dandelion was determined by fluorescent spectrometry and the recovery experiments were taken.The results showed that the detection limit of this method was low,the recovery was between 90%and 104%.The linear regression equation was y=179.69x+145.13.The correlation coefficient R2was 0.995 1.
fluorescence spectrometry;dandelion;total flavonoids
高生平,吴晓红,张雅欣,等.荧光法测定蒲公英中总黄酮的含量[J].食品研究与开发,2018,39(1):117-121
GAO Shengping,WU Xiaohong,ZHANG Yaxin,et al.Determination of Total Flavonoids in Dandelion by Fluorescence Spectrometry[J].Food Research and Development,2018,39(1):117-121
10.3969/j.issn.1005-6521.2018.01.023
江苏省高校自然科学研究面上项目资助(16KJB430019)
高生平(1979—),男(汉),讲师,博士,主要从事纳米材料合成与食品分析。
2017-05-19
