萝卜低盐腌制过程中脆度变化原因探究
2017-12-28梅明鑫
梅明鑫,刘 卫,晏 敏,周 宁,董 全*
(西南大学 食品科学学院,重庆 400715)
萝卜低盐腌制过程中脆度变化原因探究
梅明鑫,刘 卫,晏 敏,周 宁,董 全*
(西南大学 食品科学学院,重庆 400715)
蔬菜腌制过程中,随着腌制时间的延长,其质地逐渐变软。该研究通过检测萝卜腌制过程中水分、食盐、总酸、乙醇不溶物等含量的变化,研究多聚半乳糖醛酸酶、纤维素酶活性随腌制时间与脆度变化之间的关系,并观察不同腌制时期萝卜的组织微观结构变化。结果显示,腌制萝卜样品的脆度随着腌制时间的延长呈不断下降的趋势,总酸含量与脆度呈显著负相关(P<0.05),水分含量与脆度间相关性较低(P>0.05)。原果胶、乙醇不溶物、木质素与萝卜脆度呈显著正相关(P<0.05)。纤维素含量与脆度相关性较低(R2为0.832 3)。萝卜腌制过程中纤维素含量由2.96%降至2.34%,变化幅度较小。腌制萝卜扫描电镜结果表明,随着腌制的进行,其细胞壁逐渐皱缩、塌陷。
萝卜;腌制;脆度;软化机理
萝卜(Raphanus sativusL)不仅是人们喜食的蔬菜,也是作为腌制蔬菜的主要原料之一,其营养丰富,富含维生素B族和维生素C等成分。在腌制生产过程中,随着腌制时间的延长,萝卜容易变软,导致脆度下降。腌制蔬菜脆度下降的原因主要有以下几个方面:一是果胶物质的分解[1-2]。二是果蔬细胞膨压的变化。三是果蔬内部细胞结构的变化。果蔬组织由细胞构成,细胞的结构、形态、大小、空间排列及细胞间的作用力直接影响到果蔬产品的质构[3]。此外,果蔬原料的成熟度、腌制食盐浓度以及腌制环境中所含微生物杂菌情况也会对腌制品脆度产生一定影响[4-5]。
目前有关果蔬腌制过程中软化原因的研究主要集中在以下几个方面:细胞膨压降低、细胞壁组分降解及果蔬自身组织结构发生变化。细胞壁组分、多聚半乳糖醛酸酶、纤维素酶及组织微观结构等因素与果蔬质地关系密切[6],而对于萝卜腌制过程中与质地有关的各因素与脆度的关系尚未有报道,但目前,对于新鲜果蔬质地变化与纤维素、果胶、果胶酶等方面关系的研究报道较多。有研究认为,果实的软化主要是由于细胞壁酶作用引起中胶层和细胞壁物质水解。影响这些物质降解的水解酶很多,主要有多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectinesterase,PE)、纤维素酶和淀粉酶等。大量研究表明,PE和PG活性会通过影响不溶性果胶和可溶性果胶含量变化而使果实变软,因而是影响果实⒉度的间接内因。通过对萝卜腌制过程中水分、食盐、总酸、乙醇不溶物含量的变化,以及主要果胶物质和纤维素、木质素含量的变化,研究多聚半乳糖醛酸酶、纤维素酶活性随腌制时间的变化与脆度变化之间的关系[7-8],并观察不同腌制时期萝卜的组织微观结构变化,旨在探讨萝卜腌制过程中质地软化的机制,以期为萝卜的腌制加工提供理论依据。
1 材料与方法
1.1 材料与试剂
萝卜:新鲜、完整、无病虫害及机械损伤,长约40 cm,直径约9 cm,购于重庆市北碚区天生农贸市场。
食盐(食品级):重庆市盐业(集团)有限公司;白砂糖(食品级):广西贵糖股份有限公司;柠檬酸、柠檬酸钠、羧甲基纤维素钠、亚铁氰化钾、乙酸锌、HNO3、AgNO3、硫氰酸钾、硫酸铁铵、铬酸钾、酚酞、冰乙酸、NaOH、葡萄糖、酒石酸钾钠、结晶酚、3,5-二硝基水杨酸、Na2SO3、无水乙醇、咔唑、浓硫酸、乙酸钠、NaCl、丙酮、十六烷基三甲基溴化铵(均为分析纯):成都市科龙化工试剂厂;半乳糖醛酸、多聚半乳糖醛酸(均为分析纯):美国Sigma公司。
1.2 仪器与设备
FSH-Ⅱ高速组织匀浆机:江苏金坛市环宇科学仪器厂;T6新世纪紫外可见分光光度计:北京谱析通用仪器有限责任公司;PB-10精密pH计:德国Sartorius公司;5810台式高速离心机:德国Eppendorf公司;DF-101Z恒温加热式磁力搅拌器、SHZ-Ⅲ循环水式多用真空泵:郑州长城科工贸有限公司;Avanti J-301冷冻离心机:美国贝克曼有限公司;ALPAAI-4LSC真空冷冻干燥机、S-3000N扫描电子显微镜:日本日立精密仪器公司。
1.3 试验方法
1.3.1 低盐腌制萝卜基本工艺

挑选完整、无病虫害、无霉烂、无机械损伤,色泽较好的新鲜萝卜,清洗干净,切成长宽高为4 cm×4 cm×1 cm的块状,用10%的食盐水预腌处理24 h,然后将萝卜装入腌制坛内,装至离坛口约5 cm处,加入腌制液淹没萝卜,用竹片卡住坛口,避免萝卜露出腌制液面,盖好坛盖,用10%的食盐水封坛,存放于25℃条件下腌制。腌制坛选用玻璃腌制坛。腌制液的配比为2%白砂糖、4%食盐、0.2%氯化钙。萝卜与腌制液的质量比为1∶1。定期进行取样测定,先进行脆度的测定,然后进行其他指标的测定,各指标重复测定3次,取平均值。
1.3.2 萝卜腌制过程中主要成分及脆度变化的研究
萝卜入坛腌制后每2 d定期测定样品中水分含量、总酸及NaCl含量,同时每2 d测定样品脆度的变化,并对萝卜腌制过程中主要成分的变化与脆度的变化进行相关性研究。
1.3.3 萝卜腌制过程中脆度与细胞壁组分的含量变化的研究
萝卜入坛腌制后每2 d定期测定样品中原果胶(protopectin,PP)、水溶性果胶(water soluble pectin,WSP)、乙醇不溶物(alcohol-insoluble residue,AIR)、纤维素及木质素等组分的含量变化,同时每2 d测定样品的脆度值,对萝卜腌制过程中的主要细胞壁组分含量变化与脆度变化的相关性进行研究。
1.3.4 萝卜腌制过程中脆度与相关酶活性变化的研究
萝卜入坛腌制后每2 d定期测定样品中多聚半乳糖醛酸酶(polygalacturonase)、纤维素酶活性的变化,每2 d测定腌制萝卜的脆度值,并对萝卜腌制过程中相关酶活与脆度变化的相关性进行研究。
(1)脆度的测定
(2)理化指标的测定
水分含量的测定:参考GB 5009.3—2010《食品中水分的测定》中的方法,采用直接干燥法[9];
总酸含量的测定:参考GB/T 12456—2008《食品中总酸的测定》中的方法,采用酸碱滴定法[10];
氯化钠含量的测定:参考GB/T 12457—2008《食品中氯化钠的测定》中的方法,采用间接沉淀滴定法[11];
乙醇不溶物含量的测定:参考BILL Y L等[12]的方法,称取5g腌制白萝卜,加入25mL体积分数95%乙醇进行均质处理后,放入60℃电热恒温鼓风干燥箱中反应40 min,过滤后,再用10 mL体积分数85%乙醇清洗残留物2次,最后用10 mL乙醚清洗残留物1次,收集残留物于40℃电热恒温鼓风干燥箱中干燥至质量恒定,其残留物即为乙醇不溶物,重复3次,求平均值。
(3)果胶含量、纤维素、木质素含量的测定
翻转课堂独特地结合了一度被认为是矛盾的教学理论,即建构主义意识形态和行为主义原理的结合,其中积极学习,问题导向式学习是建立在建构主义理论基础上的,而指导性讲座则来自以行为主义理论为基础的直接教育方式。
果胶含量测定[13]:取6支25 mL具塞刻度试管,编号,梯度加入半乳糖醛酸标准液[13],然后小心地沿管壁加入6.0mL浓硫酸,在沸水浴中加热20 min取出冷却至室温后,各加入0.2 mL 1.5 g/L咔唑-乙醇溶液,摇匀。在暗处放置30 min后,测定反应液在波长530 nm处的吸光度值。以半乳糖醛酸质量(μg)为横坐标,绘制标准曲线,求得线性回归方程y=0.125 2x-0.001 3,R2=0.998 9。根据溶液吸光度值,在标准曲线上查出相应的半乳糖醛酸质量,计算果蔬组织中果胶含量,以生成半乳糖醛酸的含量表示。计算公式如下:
式中:m′为从标准曲线查得的半乳糖醛酸质量,μg;V为样品提取液的总体积,mL;Vs为测定时所取样品提取液的体积,mL;m为样品质量,g。
纤维素含量的测定:参考曹建康等[13]的称量法测定果蔬组织中粗纤维含量;
木质素含量的测定:参考LOU Z S等[14]的方法,称取150 mg AIR于50 mL离心管中,加入3 mL12 mol/L硫酸溶液,在20℃条件下振摇水解3h,然后向离心管中加入33 mL去离子水,沸水中振摇煮沸2.5 h取出冷却至室温后通过酸处理的0.45 μm Millipore HVLP过滤膜真空过滤,并用沸水清洗残留物,收集残留物并在60℃电热恒温鼓风干燥箱中干燥至残留物质量恒定,即为木质素。
(4)酶活的测定
多聚半乳糖醛酸酶活性的测定:参考ZHOU H W等[15]的分光光度计法;纤维素酶活性的测定:参考ZHANG J L等[16]的分光光度计法。
(5)白萝卜样品扫描电镜的预处理
参考陈光静等[17]的方法,取待测样品,用刀片将样品切分为1 mm3的正方体,将正方体切块放入装有适量4%戊二醛固定液的小瓶中固定24 h,经过pH7.2的磷酸缓冲溶液漂洗后,用梯度乙醇溶液(体积分数为50%、70%、80%、95%、100%)脱水,然后用临界点设备进行干燥,最后将干燥好的样品置于真空镀膜机中进行镀膜处理,在扫描电镜下观察样品微观结构。
1.3.5 数据分析
试验数据采用Origin和SPSS软件进行统计分析。
2 结果与分析
2.1 萝卜腌制过程脆度的变化
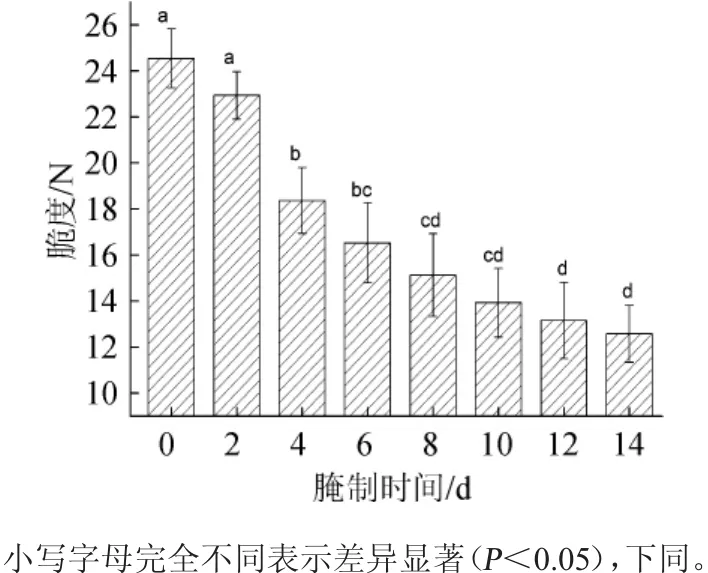
图1 萝卜腌制过程中脆度的变化Fig.1 Changes of brittleness of radishes during pickling process
由图1可知,腌制萝卜样品的脆度随着腌制时间的延长呈不断下降的趋势,腌制14 d后,脆度由24.54 N降低至12.57 N,降低约48.77%。萝卜在腌制2~10 d期间,其脆度降低幅度最大,由22.93 N降至13.92 N,10 d后下降速度减慢,最终降至12.57 N。
2.2 萝卜腌制过程中基本成分及pH变化
萝卜腌制过程中基本组分及pH变化见图2。由图2(A)可知,萝卜腌制过程中随着腌制时间的延长,水分含量呈现先下降后回升再下降的趋势,其中腌制0~4d时水分含量显著下降(P<0.05),4~14 d时水分含量总体变化不大,腌制时间对水分含量的影响差异不显著(P>0.05)。腌制0~6 d时,随着腌制时间的延长水分含量逐渐下降,主要是由于萝卜细胞中的水分与腌制液中的盐等进行物质交换,腌制液中的高渗透压使细胞内水分渗出,萝卜细胞水分含量降低,后期由于盐溶液缺氧等使细胞死亡,细胞膜由选择透过性变为全透性,食盐溶液进入细胞使其水分含量增多。
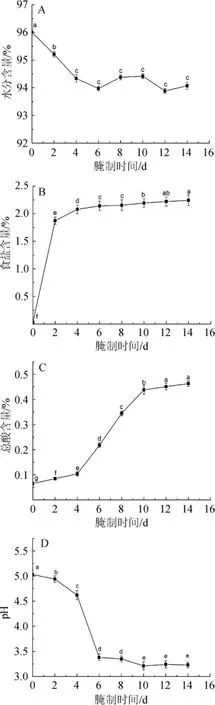
图2 萝卜腌制过程中基本组分及pH变化Fig.2 Changes of basic components and pH of radishes during pickling process
由图2(B)可知,新鲜萝卜中食盐含量很少,约0.0353%,经过预腌处理后食盐含量迅速增加,预腌处理对萝卜中的食盐含量具有极显著差异(P<0.01),后期腌制过程中食盐总体呈上升趋势但速度缓慢。萝卜经过预腌处理后食盐含量剧增,是由于新鲜萝卜内外食盐浓度差别较大,食盐渗透速度快,腌制后随着食盐浓度差逐渐缩小,食盐的渗透速度减慢,最终与腌制液浓度一致,达到渗透平衡。
由图2(C)可知,萝卜腌制过程中总酸含量呈上升趋势,其中第4~10天总酸含量上升速度较快,腌制萝卜酸度与新鲜萝卜具有显著差异(P<0.05),第10~14天总酸含量上升速度减缓,最终达到0.463 2%。其原因可能是腌制0~4 d时主要由肠膜明串珠菌启动乳酸发酵[18-19]很快被植物乳杆菌代替并产生大量乳酸,第4~10天总酸含量快速增加,腌制10 d后,由于体系中蛋白酶分解蛋白质产生多肽并进一步被分解为氨基酸,氨基酸的后期代谢(如脱氨、脱羧等)产生其他物质,总酸含量增长速度减缓。
由图2(D)可知,萝卜腌制过程中pH整体呈下降趋势,第0~4天pH下降速率缓慢,4~6 d下降速率最快,pH值由4.62降至3.38,6~10 d时pH下降速率减缓,10 d后pH有所回升,最终达到3.23。萝卜腌制过程中,乳酸菌代谢产生乳酸使pH值降低,同时抑制了其他腐败菌及杂菌的生长,改善了产品的风味和口感[20]。6 d后pH值下降缓慢,主要是由于游离乳酸的累积使乳酸脱氢酶的活性降低,影响了微生物的糖代谢,使乳酸菌生长受到抑制,产酸能力下降,pH速率降低[21]。
有研究表明,乳酸菌的最适pH值是6.0[22],pH值的降低引起细胞膜电荷发生改变,细胞膜通透性增加,细胞内酶活性降低,进而使乳酸菌的生长代谢受到抑制。总酸含量变化一定程度上可以反应pH的变化,pH可以影响微生物生长活动及蛋白酶系活性,进而影响糖类、蛋白质等酶解产物的变化,微生物的活动又反作用于pH,因此萝卜腌制过程中的总酸含量及pH变化是多种因素相互影响,相互制约的结果。
2.3 萝卜腌制过程中主要细胞壁组分含量的变化
细胞壁的成分、结构变化是影响果蔬质地的重要因素,对于支撑细胞形态具有重要作用。萝卜腌制过程中主要果胶组分含量的变化见图3。
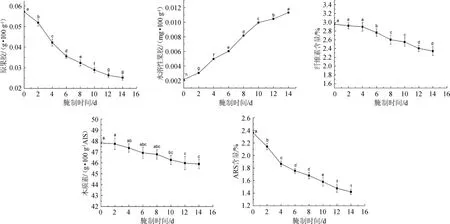
图3 萝卜腌制过程中主要果胶组分含量的变化Fig.3 Changes of main pectin components contents of radishes during pickling process
由图3可知,腌制期内,萝卜中原果胶含量随着腌制时间的延长而减少。腌制2~10d,原果胶含量显著下降(P<0.05),由0.052 g/100 g(湿质量)降低至0.029 g/100 g;腌制10 d后,样品中原果胶含量降低速度减慢,由0.029 g/100 g降低至0.025g/100g。萝卜在腌制过程中,由于Na+置换了原果胶中起交联作用的Mg2+与Ca2+,原果胶含量逐渐降低,萝卜质地逐渐变软,脆性降低。腌制期内,萝卜样品中水溶性果胶含量随腌制时间的延长呈上升趋势。腌制6~10d,萝卜的水溶性果胶增长速率最快,由6.05 mg/100 g增至9.96 mg/100 g;腌制14 d后其含量为11.32 mg/100 g。水溶性果胶含量逐渐增加,一方面是由于在多聚半乳糖醛酸酶的作用下,原果胶分解为可溶性果胶和果胶酸,另一方面Na+的置换作用促进了原果胶分解成水溶性果胶,并进一步水解生成果胶酸、甲醇等物质。腌制过程中,萝卜的乙醇不溶物含量随着腌制时间的延长而减少,且速率逐渐降低,腌制结束后,萝卜中AIR含量由最初的2.36%降低至1.42%。萝卜腌制过程中木质素含量呈下降趋势,降低幅度较小,腌制0~8 d,萝卜中木质素含量差异不显著(P>0.05)。萝卜腌制过程中纤维素含量由2.96%降至2.34%,变化幅度较小。
2.4 萝卜腌制过程中相关酶活的变化
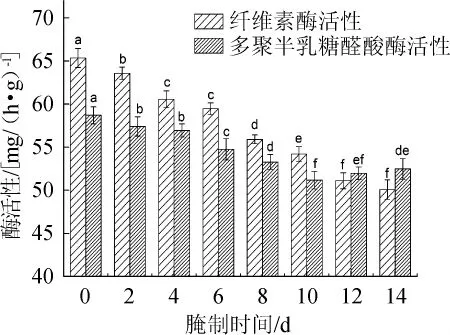
图4 萝卜腌制过程中多聚半乳糖醛酸酶和纤维素酶活性变化Fig.4 Changes of polygalacturonase and cellulase activities of radishes during pickling process
多聚半乳糖醛酸酶(PG)是一种细胞壁结构蛋白,可以通过水解作用及反式消去作用,催化果胶分子多聚α-(1,4)-半乳糖醛酸的裂解,使果胶分子分解为小分子物质,导致果实软化。KLEIN J D等[23]通过电子显微镜观察鳄梨和苹果细胞壁结构变化,证实了PG导致中胶层物质溶解以及细胞间聚合力的丧失。由图4可知,萝卜腌制过程中0~10 d,PG活性随着腌制时间的延长逐渐降低,这可能是由于随着腌制时间的延长,腌制液pH值逐渐降低,抑制了PG的活性,同时,腌制液中食盐溶液的渗透作用可能使使酶的活性中心遭到破坏,从而使酶活性降低。腌制10~14 d,PG活性出现回升,由51.18 mg/(h·g)上升至52.49 mg/(h·g),约上升2.56%,可能是由于后期腌制液中大量微生物生长繁殖,一些微生物分泌了PG,使其活性有所增加。
纤维素酶可以降解纤维素生成葡萄糖,主要由外切β-葡聚糖酶、内切β-葡萄糖苷酶等组成,作用于纤维素及纤维素衍生出来的产物。纤维素酶活性在整个腌制过程中不断降低。
2.5 萝卜腌制过程中脆度与基本组分含量变化的关系
对萝卜的脆度与基本组分含量进行相关性分析,结果见图5。由图5可知,总酸含量、食盐含量与脆度呈显著负相关(R2分别为0.900 1、0.949 9,P<0.05),水分含量与脆度间相关性较低(R2为0.7981,P>0.05)。 萝卜腌制过程中所产生的酸主要是由乳酸菌所产生的乳酸,乳酸含量对pH值有重要影响,有研究表明,当pH在4.3~4.9时,果胶水解程度最小,当pH<4.3或者>4.9时水解程度增加[24]。另有研究表明,果胶物质在pH<4.5时易发生β-消除反应,且pH越低,该反应速度越快[25]。腌制4~10 d,总酸含量快速增加,pH值降低至4.5以下,果胶水解度及β-消除反应速度增加,原果胶物质被分解,样品脆度下降;腌制10 d后总酸含量增加缓慢,pH值保持在3.2左右,果胶水解及β-消除反应速率稳定,原果胶降低速率减慢,因此10 d后脆度呈缓慢下降趋势。
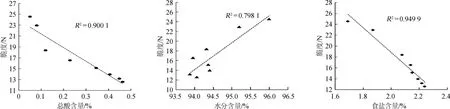
图5 萝卜腌制过程中脆度与基本组分含量的相关性分析Fig.5 Correlative analysis between brittleness and main chemical compositions contents of radishes during pickling process
由于分析腌制过程中脆度与食盐含量的相关性,因此此处食盐含量是指原料经过预腌处理后至腌制结束期间,腌制萝卜样品中的食盐含量。食盐对萝卜的脆度有重要影响,一方面是由于高浓度的食盐溶液产生高渗透压,萝卜果肉组织不会吸水膨胀反而会失去自由水,但是维持细胞结构的结合水依然保存,因此脆度得以保持,盐浓度越高,成品腌制萝卜脆度越好[26];另一方面,Na+通过置换萝卜细胞中果胶分子中的Ca2+,破坏多糖分子间的氢键,使多糖分子分散性增加,萝卜脆度降低,但是在萝卜加工过程中添加一定比例的CaCl2,使泡菜本身含有的果胶酸与Ca2+结合形成果胶酸盐,可以保持萝卜的脆度。腌制前4 d,食盐含量增长速度相对后期较快,说明腌制前4 d食盐渗入到萝卜中的速度较后期快,腌制前期具有更高的渗透压,细胞失水较快,细胞膨压降低更多,因此脆度在前4 d下降较快。2.6萝卜腌制过程中脆度与主要细胞壁组分含量的关系
对萝卜的脆度与主要细胞壁组分含量进行相关性分析,结果如图6所示。由图6可知,原果胶(PP)、乙醇不溶物(AIR)、木质素与萝卜脆度呈显著正相关(P<0.05,R2分别为0.9964、0.9868、0.9135),水溶性果胶与脆度呈显著负相关(P<0.05,R2为0.9372),纤维素含量与脆度相关性较低(R2为0.8323)。

图6 萝卜腌制过程中脆度与主要细胞壁组分含量的相关性分析Fig.6 Correlative analysis of brittleness and main cell wall components contents of radishes during pickling process
果胶主要存在于中胶层,是一类复杂的胶态物质[27],主要结构是D-半乳糖醛酸通过α-1,4-糖苷键链接成的长链。根据果胶与纤维素的交联程度及理化性质的不同,果胶可以分为原果胶、可溶性果胶及果胶酸。果蔬质地的软化通常伴随原果胶的降解及可溶性果胶、果胶酸的增加[28]。原果胶是一种具有粘结性的大分子物质,不溶于水,原果胶和纤维素在细胞层间与蛋白质结合成粘合剂,使细胞紧密粘合在一起,使蔬菜具有较高的脆度。原果胶在多聚半乳糖醛酸酶(PG)或酸的作用下可水解为水溶性果胶,此外,Na+置换原果胶中起交联作用的Ca2+与Mg2+,使原果胶降解,细胞间的结合能力降低,导致萝卜质地变软[29]。萝卜腌制过程中脆度的变化与原果胶、水溶性果胶含量变化的显著相关性说明原果胶的降解及水溶性果胶的增加使萝卜脆度降低。果蔬的质地与AIR含量关系密切,AIR能与Ca2+、Mg2+结合,提高果蔬组织结构脆度,AIR含量降低,果蔬表现出脆度下降。萝卜腌制过程中纤维素含量变化幅度较小,因此其含量变化与脆度变化相关性较低。
2.7 萝卜腌制过程中组织微观结构变化
细胞结构是影响果蔬质地的重要因素。有研究表明,果蔬经过腌制处理后,细胞结构发生变化,细胞膜出现破裂,细胞壁和中胶层出现收缩、塌陷[30]。萝卜腌制过程中组织结构扫描电镜图见图7。
由图7可知,预腌处理后的萝卜细胞结构完整,中胶层完整,组织结构略有褶皱;腌制3 d,细胞结构完整,细胞失水加重,次生木质部薄壁细胞出现形变、褶皱;腌制第6天,细胞进一步失水,次生木质部薄壁细胞出现明显褶皱、萎缩;腌制9 d,细胞失水严重,次生木质部薄壁细胞严重萎缩;腌制12 d,中胶层严重解体,细胞组织结构破坏严重;腌制15 d,次生木质部薄壁细胞完全皱缩、塌陷。
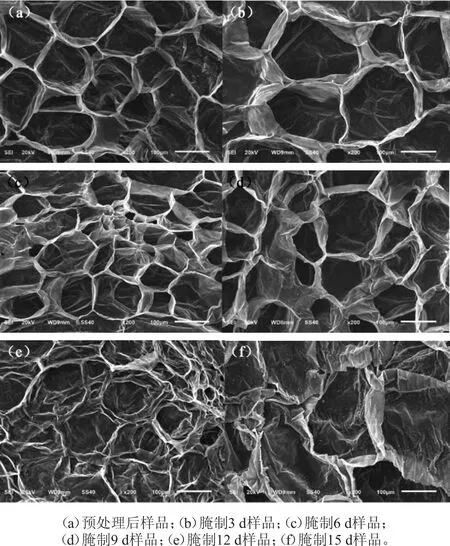
图7 萝卜腌制过程中组织结构扫描电镜图Fig.7 Scanning electron micrographs of radishes during pickling process
3 结论
萝卜腌制过程中,脆度随腌制时间的延长而逐渐降低,腌制萝卜中的总酸、食盐含量与脆度呈显著负相关(R2分别为0.900 1、0.949 9,P<0.05)水分含量与脆度相关性较低(R2=0.798 1,P>0.05)。总酸的增加可引起腌制萝卜脆度降低。
萝卜腌制过程中,其乙醇不溶物(AIR)、原果胶(PP)、木质素含量与脆度呈显著正相关(R2分别为0.9868、0.9964、0.913 5,P<0.05),水溶性果胶(WSP)与脆度呈显著负相关(R=0.937 2,P<0.05),纤维素含量与脆度的相关性不显著(R=0.832 3,P>0.05)。乙醇不溶物、原果胶、木质素的降低会导致腌制萝卜脆度降低,腌制萝卜脆度的降低与纤维素的变化相关性不大。
萝卜腌制过程中的多聚半乳糖醛酸酶(PG)与纤维素酶具有一定活性且整体呈下降趋势,说明萝卜腌制过程中原果胶的降解与PG有关,PG使原果胶降解,引起腌制萝卜脆度降低,此外,原果胶的降解也可能与酸的作用有关。腌制萝卜扫描电镜结果表明,萝卜腌制过程中组织微观结构发生明显的变化,随着腌制过程的进行,其细胞壁逐渐皱缩、塌陷。
传统的萝卜腌制是采用自然发酵的方法,较为粗放,产品的质量难以得到保障。今后应该通过实验室优化发酵工艺,采用人工接种的方法,加强腌制过程中的科学管理,以提高腌制萝卜的品质。
[1]JANTRAWUTP,ASSIFAOUA,CHAMBINO.Influenceoflowmethoxyl pectin gel textures andin vitrorelease of rutin from calcium pectinate beads[J].Carbohyd Polym,2013,97(2):335-342.
[2]陈光静,汪莉莎,胡 鹏,等.大叶麻竹笋腌制过程中质地的变化[J].食品与发酵工业,2013,39(4):101-105.
[3]姚 佳,胡小松.高静压对果蔬制品质构影响的研究进展[J].农业机械学报,2013,44(9):118-124.
[4]刘 卫,董 全.腌制蔬菜保脆及保藏研究现状[J].中国酿造,2015,34(1):5-9.
[5]尤逢惠,江 舰,万娅琼,等.腌制蔬菜保脆技术研究进展[J].安徽农业科学,2017,45(5):65-66,69.
[6]LAUXMANN M A,BORSANI J,OSORIO S,et al.Deciphering the metabolic pathways influencing heat and coldresponses during postharvest physiology of peach fruit[J].Plant Cell Environ,2013,37(3):601-606.
[7]张 娟,高滋艺,杨惠娟,等.‘秦冠’和‘富士’质地差异的解剖学观察及相关酶活性研究[J].西北农业学报,2015,24(10):88-94.
[8]高滋艺,范献光,杨惠娟,等.苹果发育过程中细胞壁代谢及果肉质地的变化[J].食品科学,2016,37(19):70-75.
[9]中华人民共和国卫生部.GB 5009.3—2010,食品中水分的测定[S].北京:中国标准出版社,2010.
[10]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12456—2008,食品中总酸的测定[S].北京:中国标准出版社,2008.
[11]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GBT 12457—2008,食品中氯化钠的测定[S].北京:中国标准出版社,2008.
[12]BILLY L,MEHINAGIC E,ROYER G.Relationship between texture and pectin composition of two apple cultivars during storage[J].Postharvest Biol Tec,2008,47(3):315-324.
[13]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:32-154.
[14]LOU Z S,XU X L,CAI Z Z,et al.Effect of ethylene and 1-methylcyclopropene(1-MCP)on lignification of postharvest bamboo shoot[J].Food Chem,2007,105(2):521-527.
[15]ZHOU H W,SONEGO L,KHALCHITSKI A,et al.Cell wall enzyme sand cell wall changes in flavor top'Nectarines':mRNA abundance enzyme activity,and changes in pectic and neutral polymers during ripening and in woollyfruit[J].J Am Soc Hortic Sci,2000,125(5):630-637.
[16]ZHANG J L,WANG S J,XU B G.Effect of alternating magnetic field treatments on enzymatic parameters of cellulose[J].J Sci Food Agr,2012,92(7):1384-1388.
[17]陈光静,郑 炯,汪丽莎,等.大叶麻竹笋腌制过程中质地变软原因探究[J].食品科学,2014,35(1):56-61.
[18]XIONG T,GUAN Q,SONG S,et al.Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentation[J].Food Control,2012,26(1):178-181.
[19]JI Y J,LEE S H,JIN H M,et al.Metatranscriptomic analysis of lactic acidbacterialgeneexpression duringkimchi fermentation[J].Int J Food Microbiol,2013,163(2):171-179.
[20]PARK J M,SHIN J H,GU J G,et al.Effect of antioxidant activity in kimchi during a short-term and over-ripening fermentation period[J].J Biosci Bioeng,2011,112(4):356-359.
[21]RODRÍGUEZ-GÓMEZF,BAUTISTA-GALLEGO J.ROMERO-GIL V,et al.Effects of salt mixtures on Spanish green table olive fermentation performance[J].LWT-Food Sci Technol,2012,46:56-63.
[22]熊素玉,姚新奎,谭小海,等.不同温度及pH条件对乳酸菌生长影响的研究[J].新疆农业科学,2006,43(6):533-538.
[23]KLEIN J D,HANZON J,IRWIN P L,et al.Pectinesterase activity and pectin methyl esterification in heated goldendelicious apples[J].Phytochemistry,1995,39(3):491-494.
[24]AOAC Official Method 937.09.Salt(chlorine as sodium chloride)in seafood volumetric[S].Association of Official Analytical Chemists,1937.
[25]LEE Y K,KIM S D.Preparation and characteristics of calcium lactate from black snail[J].Nutraceut Food,2003,8(2):166-172.
[26]汪立平,汪 欣,艾连中,等.纯种植物乳杆菌发酵低盐萝卜泡菜的研究[J].食品科学,2013,34(17):182-186.
[27]谢明永,李 精,聂少平.果胶研究与应用进展[J].中国食品学报,2013,13(8):1-14.
[28]宋晓雪,胡文忠,毕 阳,等.鲜切果蔬软化机理及其调控的研究进展[J].食品工业科技,2013,34(4):397-400.
[29]陈光静,汪莉莎,郑 炯,等.食盐质量浓度对大叶麻竹笋腌制过程中品质特性的影响[J].食品科学,2013,34(15):48-52.
[30]KIM J,CHOI H,KIM S,et al.Changes in physicochemical and sensory qualities of Korean picked cucumbers during fermentation[J].Korean J Food Sci Technol,1989,21(6):838-844.
Reasons for brittleness changes of radish during pickling process with low-salt content
MEI Mingxin,LIU Wei,YAN Min,ZHOU Yu,DONG Quan*
(College of Food Science,Southwest University,Chongqing 400715,China)
During the pickling process,the texture of vegetables gradually becomes soft as the pickling time prolonged.In this study,the relationship between polygalacturonase and cellulase activity and the changes of pickling time and brittleness was studied by detecting the changes of water,salt,total acid and alcohol-insoluble residue(AIR)contents in the radish pickling process.The microstructure changes of radish in different pickling periods were observed as well.The results showed that the brittleness of pickled radish samples showed a decreasing trend with the prolongation of the pickling time,and the total acid content was significantly negatively correlated with the brittleness (P<0.05),and the correlation between water content and brittleness was low (P>0.05).There was a significant positive correlation between the protopectin,AIR and lignin and the crispness of radish (P<0.05).The correlation between cellulose content and brittleness was low (R2=0.832 3).The content of cellulose decreased from 2.96%to 2.34%during the pickling process,and the variation range was small.The results of scanning electron microscopy of pickled radish showed that the cell wall gradually shrinked and collapsed with the pickling process.
radish;pickling;brittleness;softening mechanism
TS255
0254-5071(2017)12-0027-07
10.11882/j.issn.0254-5071.2017.12.007
2017-07-17
中央高校基本业务费专项资金(XDJK2017D127)
梅明鑫(1991-),女,硕士研究生,研究方向为食品安全与质量控制。
*通讯作者:董 全(1962-),男,教授,博士,研究方向为现代食品加工理论与技术。
