海南黑山羊瘤胃液中乳酸菌的分离和鉴定
2017-12-28张万昌谭海生杨劲松鞠雪莉李晓雷赵建国周汉林
张万昌,谭海生,杨劲松*,鞠雪莉,李晓雷,赵建国,李 茂,周汉林
(1.海南大学 食品学院,海南 海口 570228;2.中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737)
海南黑山羊瘤胃液中乳酸菌的分离和鉴定
张万昌1,谭海生1,杨劲松1*,鞠雪莉1,李晓雷1,赵建国1,李 茂2,周汉林2
(1.海南大学 食品学院,海南 海口 570228;2.中国热带农业科学院热带作物品种资源研究所,海南 儋州 571737)
以海南黑山羊瘤胃液为研究对象,对其进行乳酸菌的分离和鉴定,为黑山羊饲料的青贮提供优质的乳酸菌菌株。通过形态学观察及H2O2酶、糖发酵等生理生化试验对所分得菌株进行初步鉴定,并对分离得到的菌株进行16S rDNA基因扩增与测序。结果表明从黑山羊胃液中筛选出15株革兰氏阳性、H2O2酶阴性的乳酸菌疑似菌株,除菌株HBG20不能在pH 3.0条件下生长,其余菌株均能生长;三株代表菌株HBG11、HBG46和HBG86在低温5℃和高温55℃条件以及pH2.5时均能生长,同时在盐浓度为6.5%时也能生长。16S rDNA基因测序结果表明,菌株HBG11与耐久肠球菌(Enterococcus durans)同源性最高,菌株HBG46与植物乳杆菌(Lactobacillus plantarum)同源性最高,菌株HBG86与干酪乳杆菌(Lactobacillus casei)同源性最高。
黑山羊瘤胃液;乳酸菌;16S rDNA序列分析
海南黑山羊又称雷州山羊,是海南省重要的反刍家畜[1]。动物的健康状况是养殖者们最关心的问题,自19世纪40年代以来,抗生素在畜禽疾病的防治方面起到了重要作用,但随着人们健康意识的提高,抗生素替代品的研发逐渐被提上日程,以乳酸菌为主要添加剂的微生态制剂因其无污染、无毒副作用和良好的使用效果而慢慢的得到人们的重视[2]。这其中的原理在于动物胃肠道微生物与宿主之间有着密切的共生关系,在诸多方面影响机体内环境的稳定和动物的健康[3]。乳酸菌作为动物胃肠道中的固有优势菌群,已作为饲料添加剂应用[4]。目前,饲料生产上应用的大多数益生菌株并非来源于动物胃肠道,这些菌株的生态环境与动物肠道生理环境相差甚远,动物胃肠道内的酸性环境、胆盐和厌氧环境在很大程度上制约了许多微生物的生长。与此相比,源于反刍动物胃肠道内的微生物经过胃肠道自身的筛选,则能更好地适应胃肠道环境定殖和大量繁殖。
为此,以海南黑山羊瘤胃液为研究对象,对其进行乳酸菌的分离、鉴定,旨在筛选出繁殖快、产酸能力好等功能的乳酸菌,为开发更适合胃肠道内生长的乳酸菌,为微生态制剂的菌株提供支持。
1 材料与方法
1.1 材料与试剂
黑山羊胃液:采集于中国热带农业科学院热带作物品种资源研究所黑山羊种羊场。瘤胃瘘管安装手术后经12个月恢复健康的羊用于本研究瘤胃液供体。
MRS培养基:广东环凯微生物科技有限公司;营养肉汤(nutrient broth,NB)培养基:本课题实验室配制;氯化钠、二甲基亚砜(化学纯):广州化学试剂厂;吐温80、氯仿、丙酮、甲醇、冰醋酸、碳酸钙(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器和设备
GI54DW型全自动高压蒸汽灭菌锅:致微(厦门)仪器制造有限公司;SW-CJ-1FD型超净工作台:苏州佳宝净化工程设备有限公司;DHG-9203A型电热恒温培养箱:宁波江南仪器厂;SPX-250B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;PHS-3E型精密pH计:上海仪电科学仪器股份有限公司;UV-1100型紫外分光光度计:上海美谱达仪器有限公司;MDF-382E型超低温冰箱:日本三洋电机株式会社。
1.3 方法
1.3.1 样品采集
挑选瘘管安装术后(12月)健康的黑山羊,打开胃部预留孔洞,用经过高压灭菌的勺子掏取胃液于灭菌过的保温桶中,并立即带回实验室在超净工作台中用无菌纱布过滤,之后进行梯度稀释。
1.3.2 乳酸菌的分离纯化
选取10-1、10-3、10-5三个梯度倍数稀释,分别用移液枪吸取0.02 mL稀释液涂布于加有碳酸钙的MRS固体培养基上,37℃条件下厌氧培养48 h,然后挑选乳白色带有溶解圈的菌落经过两次以上划线分离得到单菌落[5]。
1.3.3 形态学鉴定
将分离得到的菌株接种到MRS固体培养基上,37℃厌氧培养16 h,进行革兰氏染色[6]。
1.3.4 生理生化实验
(1)过氧化氢触酶实验
用接种环取单菌落放在滴有3%过氧化氢的载玻片上,观察有无气泡产生[7]。
(2)生长曲线和产酸曲线
按照1%接种量接种到液体MRS培养基中,37℃恒温培养,每隔2 h测定pH和分光光度值,绘制生长曲线和产酸曲线[8-9]。
(3)不同温度、pH、盐浓度下生长状况
将筛选得到的菌株接种到MRS液体培养基中,分别在5℃、10℃条件下培养10 d,45℃、50℃条件下培养7 d,观察其生长状况。
将MRS液体培养基的pH值分别调整为2.5、3.0、3.5、4.0和7.0,接种后于37℃培养7 d,观察其生长状况。
向MRS液体培养基中添加3.0%和6.5%的氯化钠,接种后37℃培养7 d,观察其生长状况[10-14]。
1.3.5 发酵液中乳酸的定性分析
将筛选得到的菌株接种到MRS液体培养基中,培养24 h后4 000 r/min离心5 min,取上清液。采用纸层析法测定发酵液中是否含有乳酸。
展开剂为氯仿∶丙酮∶甲醇∶冰醋酸=7∶1∶1.5∶0.8。显色条件为3%溴甲酚绿酒精指示剂,喷雾后105℃烘箱烘10 min[15]。
1.3.6 16S rDNA测序分析
本试验分离得到的乳酸菌委托华大基因进行测序,将所得序列与数据库中己知的16S rDNA序列进行相似性分析。 16S rDNA 扩增序列为:(27f:AGAGTTTGATCMTGGCTCAG;1492R:TACGGYTACCTTGTTACGACTT)5′xxxxxxxxx 3′和 5′yyyyyyy 3′。
1.3.7 构建系统发育树
参照张莉力等[16-20]的方法,从GenBank中选择近缘菌株的16S r DNA基因序列,应用MEGA 5.3软件进行多重比对,采用Neighbour-Joining方法构建系统发育树,并进行bootstrap分析,重复次数为1 000次。
1.3.8 菌种保藏
对分离、鉴定得到的保藏菌株进行活化后,接种到装有MRS液体培养基的离心管中37℃培养16 h,然后用低速离心机离心,用移液枪吸取1.0 mL NB培养基与下层的细胞混匀,再转移到冷冻保藏管中,放入冰箱冷冻室预冻,最后放入超低温冰箱长久保存[21]。
2 结果与分析
2.1 菌落特征
从海南黑山羊胃液样品中筛选出15株能在MRS碳酸钙培养基上形成溶钙圈的疑似乳酸菌菌株,记录15株菌株的形态特征。由表1可以看出,只有菌株HBG11有球状的菌体形态出现,菌株HBG2、HBG18、HBG20、HBG21、HBG24、HBG26、HBG46、HBG49和HBG56(9株菌)在菌落形态、菌落大小、菌落颜色和菌体形态上相似,菌株HBG22、HBG38、HBG43、HBG44和HBG86(5株菌)在菌落形态、菌落大小、菌落颜色和菌体形态上相似。
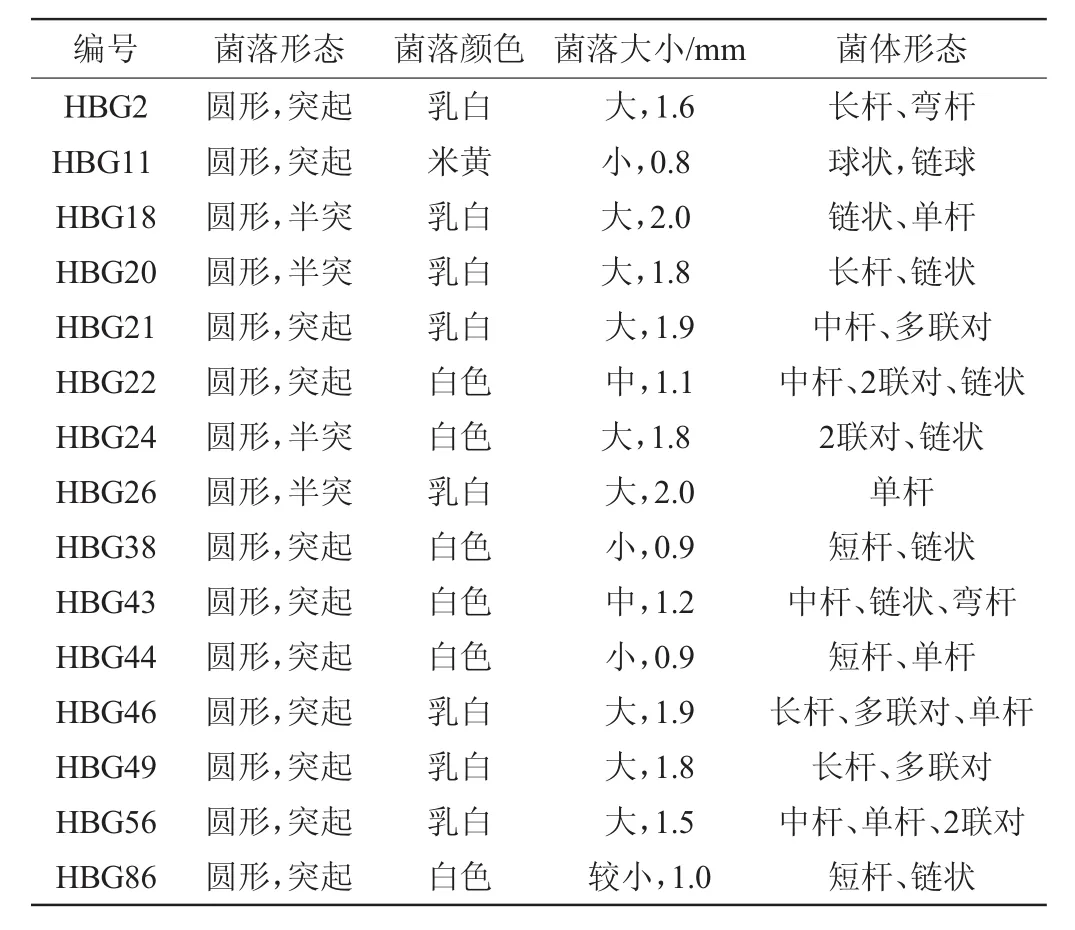
表1 15株黑山羊瘤胃液菌株的菌落及菌株特征Table 1 Morphological and characteristics of the 15 strains isolated from rumen fluid
2.2 生理生化试验结果
由表2可知,15株菌均为革兰氏阳性、过氧化氢酶触阴性菌,发酵葡萄糖均不产气,菌株HBG11发酵结束后pH为3.68,选作代表菌株;菌株HBG2、HBG18、HBG20、HBG21、HBG24、HBG26、HBG46、HBG49和HBG56发酵结束后pH在3.65左右,结合表1各株菌的形态特征选择菌株HBG46为代表菌株;菌株HBG22、HBG38、HBG43、HBG44和HBG86发酵结束后pH在3.79左右,结合表1各株菌的形态特征选择菌株HBG86为代表菌株。多数菌株在pH2.5或50℃时都不能生长。在耐酸性试验中随着pH值的增加菌种生长状况逐渐变好,pH7.0时生长状况最好;在温度耐受性实验中,5℃时的生长状况要普遍好于50℃时的生长状况。而在盐耐受性试验中,15株菌株在含盐量为3.0%时的生长状况要好于含盐量为6.5%NaCl时的生长状况。除菌株HBG20不能在pH 3.0的MRS培养基中生长,其余菌株均能生长。
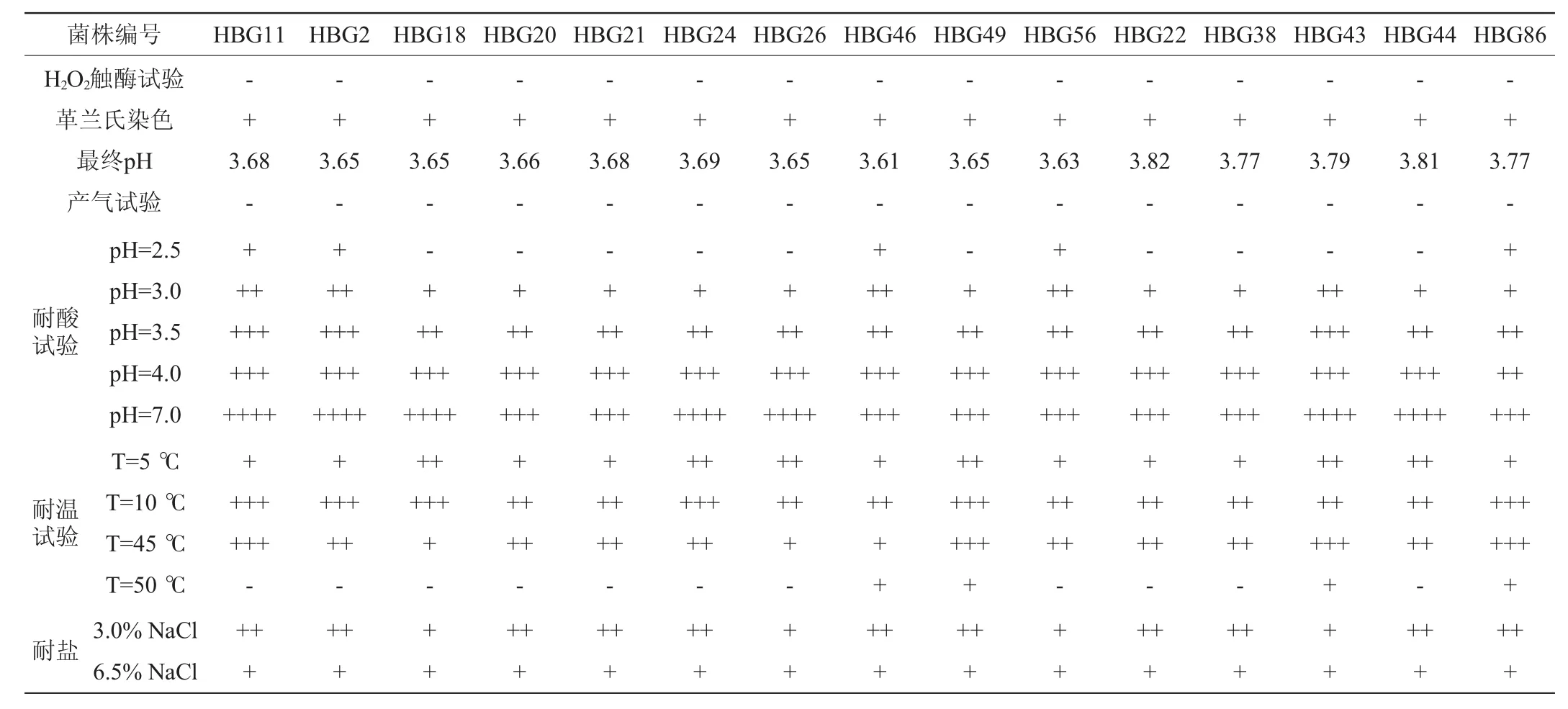
表2 15株黑山羊瘤胃液菌株的生理生化试验结果Table 2 Physiological and biochemical tests results of 15 strains isolated from rumen fluid
2.3 生长曲线和产酸曲线
乳酸菌的生长和产酸速度是乳酸菌活力良好的重要特征之一[22]。代表菌株的生长曲线和产酸曲线分别如图1、2所示。
由图1、图2可知,3株菌很快进入对数生长期,同时产酸量也相应增加,pH值迅速下降;14 h后逐渐进入稳定期,pH值降低缓慢。20 h后3株菌HBG11、HBG46、HBG86的最终pH值分别为3.68、3.61、3.77。
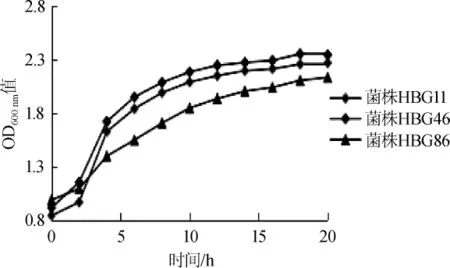
图1 代表菌株的生长曲线Fig.1 Growth curves of representative strains
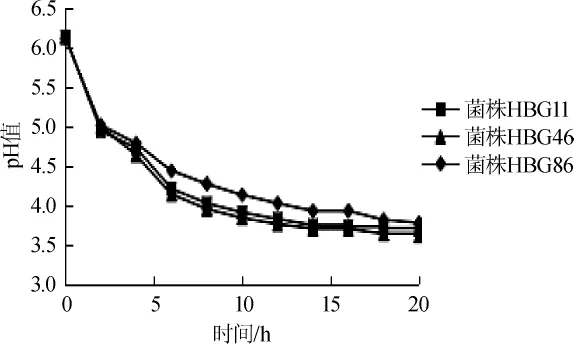
图2 代表菌株的产酸曲线Fig.2 Acid production curves of representative strains
2.4 发酵液中乳酸的定性分析
由图3可知,通过纸层析法对乳酸标准溶液和各菌株的发酵液进行对比实验,乳酸标准溶液的比称值(Rf值)为0.809;菌株HBG11、HHBG46和HBG86发酵液的的平均Rf值分别为0.801、0.813、0.806。 结果表明,三菌株发酵液中均含有乳酸,即菌株HBG11、HHBG46和HBG86均能产乳酸。
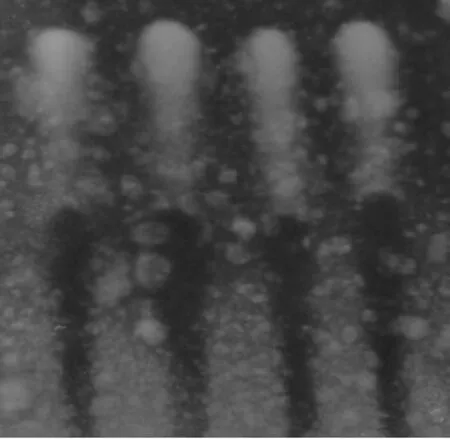
图3 乳酸纸层析实验结果Fig.3 Results of lactic acid paper chromatography tests
2.5 16S rDNA测序分析
将所选取的菌株经DNA提取、16S rDNA扩增和测序后,将序列结果登录NCBI数据库进行相似性比对,结果见表3。由表3可知,菌株HBG11和耐久肠球菌(Enterococcus durans)同源性最高,菌株HBG46和植物乳杆菌(Lactobacillus plantarum)同源性最高,菌株HBG86和干酪乳杆菌(Lactobacillus casei)同源性最高。所有菌种的同源性均达到99%以上,和标准菌株序列覆盖率均达到99%以上。

表3 黑山羊瘤胃典型菌株的16S rDNA序列同源性比对结果Table 3 Homologous alignment analysis of 16S rDNA sequences of the typical isolates from rumen fluid of Hainan black goat
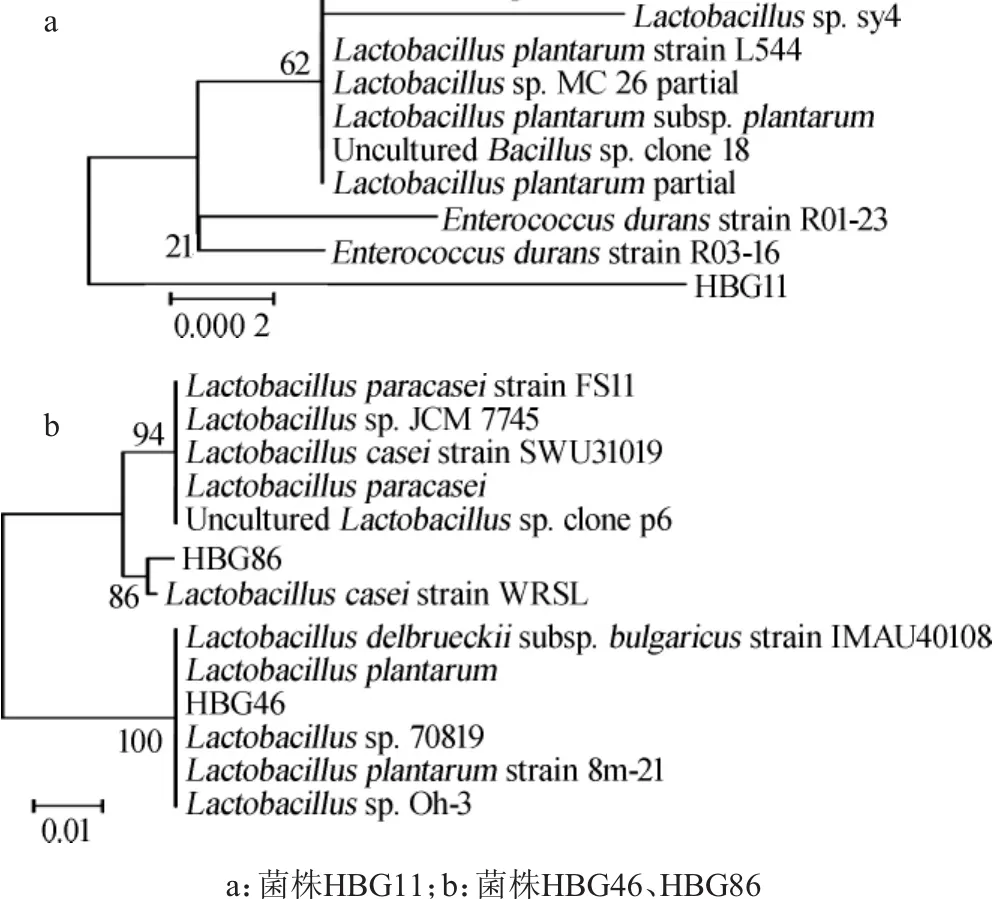
图4 利用16S rDNA序列对乳酸杆菌构建系统发育树Fig.4 Phylogenetic tree for lactic acid bacteria based on 16S rDNA sequences
菌株HBG11、HBG46及HBG86根据16S rDNA序列同源性对比和系统发育树的构建,结果见图4。由图4可知,菌株HBG11鉴定为耐久肠球菌(Enterococcus durans),菌株HBG46鉴定为植物乳杆菌(Lactobacillus plantarum),菌株HBG86鉴定为干酪乳杆菌(Lactobacillus casei)。
3 结论
从海南黑山羊胃液中筛选得到15株乳酸菌,生理生化实验和16SrDNA测试将其鉴定到种的水平。其中植物乳杆菌(L.plantarum)占60.0%,干酪乳杆菌(L.casei)占33.3%,耐久肠球菌(E.durans)占6.7%。
除菌株HBG20不能在pH 3.0 MRS条件生长,其余菌株均能生长;菌株HBG11、HBG46和HBG86在低温5℃和高温55℃以及pH2.5时均能生长,同时在盐浓度为3.0%和6.5%时也能生长。将菌株HBG11、HBG46和HBG86进行16S rDNA基因扩增与测序,鉴定菌株HBG11为耐久肠球菌(E.durans),菌株HBG46为植物乳杆菌(L.plantarum),菌株HBG86为干酪乳杆菌(L.casei)。
反刍动物在长期的自然进化过程中形成了独特的胃肠道微生物系统。经过长期的选择和适应,定植于胃肠道的微生物与宿主之间以及微生物之间形成了一种相互制约、相互依赖的动态平衡。这种平衡对于维持反刍动物的机体健康、提高反刍动物的生产性能具有重要的营养和生理作用。细菌在微生物发酵的各个方面都扮演着重要的角色。植物乳杆菌和乳酪杆菌是胃肠道的益生菌,在肠道内能形成正常菌群并产生短链脂肪酸,使肠道酸度增加,从而抑制肠道内不耐酸病原菌的繁殖,而且在动物肠道内还可产生细菌素、类细菌素、过氧化氢和某些有机酸等,并可黏附于肠道细胞上,产生占位性竞争和营养性竞争作用[23]。本研究结果表明,海南黑山羊瘤胃液中的植物杆菌和乳酪杆菌,在数量上占多数。
[1]李 茂,徐铁山,周汉林.海南黑山羊采食量研究营养与饲料[J].中国草食动物科学,2014(s1):278-281.
[2]张艳萍,李雪平,杜志琳,等.具有抑菌作用的乳酸菌菌株筛选[J].饲料研究,2015(7):16-19.
[3]焦金真,王芃芃,汤少勋,等.浏阳黑山羊胃肠道不同部位重要功能微生物的数量分布特征研究[J].畜牧兽医学报,2013,44(10):1590-1599.
[4]李维炯,倪永珍,黄宏坤,等.微生态制剂在生态畜牧业中的应用准效果[J].中国农业大学学报,2003,8(S1):85-92.
[5]李明珠,李 辉,王 丹.乳饮品中耐胃酸乳酸菌的分离鉴定与筛选[J].中国酿造,2014,33(9):42-44.
[6]杨海英,张振宇,佐玉梅,等.腌菜中乳酸菌的分离及产酸菌筛选研究[J].安徽农业科学,2012,40(13):7909-7910.
[7]高 盛,乔 宁,张宇微,等.人母乳源乳酸菌的筛选、鉴定及益生活性的初步研究[J].食品工业科技,2017,38(10):205-210.
[8]杨英歌,黄继翔,李 荣.耐酸乳酸菌的筛选及生长特性研究[J].食品工业科技,2014,35(10):248-257.
[9]潘晓倩,赵 燕,张顺亮,等.中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J].食品科学,2016,37(7):93-98.
[10]YANG J S,CAO Y,CAI Y,et al.Natural populations of lactic acid bacteria isolated from vegetable residues and silage fermentation[J].J Dairy Sci,2010,93:3136-3145.
[11]刘俊峰,尹 雪,郭雪峰.新疆阿勒泰地区酸奶疙瘩中乳酸菌的分离和鉴定[J].中国酿造,2017,36(9):116-119.
[12]GULFAM A L I,LIU Q H,YUAN X J,et al.Characteristics of lactic acid bacteria isolates and their effects on the fermentation quality of acacia (Sophora japonicaL.)leaf silage at low temperatures[J].Grassland Sci,2017,63(3):141-150.
[13]GULFAM A L I,GUO G,TAJEBE S,et al.Characteristics of lactic acid bacteria isolates and their effect on the fermentation quality of Napier grass silage at three high temperatures[J].J Sci Food Agr,2017,97(6):1931-1938.
[14]ZHANG Q,YU Z.Characterization,identification and application of lactic acid bacteria isolated fromLeymus chinensissilage[J].Grassland Sci,2017,63(2):111-118.
[15]梁 琼.德氏乳酸杆菌乳酸发酵条件研究及工艺优化[D].武汉:华中科技大学,2007.
[16]张莉力,柴虹宇.产苯乳酸乳酸菌的筛选及鉴定[J].安徽农业科学,2010,38(5):2590-2592.
[17]杨承剑,谢 芳,梁辛等.木薯渣中乳酸菌的分离鉴定及其产酸能力分析[J].中国酿造,2017,36(2):89-92.
[18]SAEEDI M,SHAHIDI F,MORTAZAVI S A,et al.Isolation and identification of lactic acid bacteria in Kurdish cheese during ripening using 16SrRNAgene sequence analysis[J].J Food Process Pres,2017,41(4):1-8.
[19]杨玉新,韦 鹏,李 丹,等.新疆特色食品中优良乳酸菌的筛选及分离鉴定[J].中国酿造,2017,36(4):50-53.
[20]刘宗敏,周红丽,谭兴和,等.一株植物乳杆菌的分离鉴定及应用[J].中国酿造,2017,36(7):95-99.
[21]云月英,王文龙,王雅娟.耐酸乳酸菌的筛选及初步鉴定[J].江苏农业科学,2013,41(1):256-259.
[22]徐绍成,周汉林,杨 瑞,等.香蕉茎叶中乳酸菌的分离和鉴定[J].广东农业科学,2010(2):122-124,127.
[23]黄沧海,谯仕彦,李德发.益生乳酸杆菌抑制大肠杆菌的研究[J].中国畜牧杂志,2003,39(6):27-28.
Isolation and identification of lactic acid bacteria from rumen fluid of Hainan black goat
ZHANG Wanchang1,TAN Haisheng1,YANG Jinsong1*,JU Xueli1,LI Xiaolei1,ZHAO Jianguo1,LI Mao2,ZHOU Hanlin2
(1.College of Food Science,Hainan University,Haikou 570228,China;2.Tropical Crops Genetic Resources Research Institute,Chinese Academy of Tropical Agriclutural Sciences,Danzhou 571737,China)
Using rumen fluid of Hainan black goat as research object,the lactic acid bacteria was isolated and identified,in order to provide high quality lactic acid bacteria for the black goat feed silage.The isolated strains were preliminarily identified and characterized by morphological observation,catalase,sugar fermentation and other physiological and biochemical tests,and then the isolated strains were identified by 16S rDNA gene amplification and sequence analysis.There were 15 Gram-positive,catalase-negative strains isolated from the rumen fluid of Hainan black goat in the experiment.Except for strain HBG20,other strains can grow at pH 3.0 condition.Three representative strains HBG11,HBG46 and HBG86 can grow at low temperature 5℃,high temperature 55℃and pH 2.5.Meanwhile,they can tolerate NaCl concentration of 6.5%.16S rDNA gene sequence results showed that three strains HBG11,HBG46 and HBG86 showed the highest homogeneity withEnterococcus durans,Lactobacillus plantarum,Lactobacillus casei,respectively.
Hainan black goat rumen fluid;lactic acid bacteria;16S rDNA senquence analysis
Q93-331
0254-5071(2017)12-0083-05
10.11882/j.issn.0254-5071.2017.12.017
2017-10-10
国家自然科学基金资助项目(31460621);海南省自然科学基金资助项目(314073)
张万昌(1989-),男,硕士研究生,研究方向为食品微生物学。
*通讯作者:杨劲松(1966-),教授,博士,研究方向为食品生物技术、食品微生物学、农产品贮藏与加工。
