一起禽肺病毒与H9亚型禽流感病毒混合感染的研究报道
2017-12-27马秀丽刘存霞亓丽红裴宗飞于可响李玉峰宋敏训
马秀丽,刘存霞,亓丽红,胡 峰,裴宗飞,于可响,黄 兵,李玉峰,宋敏训,艾 武
(1.山东省农业科学院家禽研究所 山东省禽病诊断与免疫重点实验室,济南 250023;2.山东省绿色食品发展中心,济南 250000)
一起禽肺病毒与H9亚型禽流感病毒混合感染的研究报道
马秀丽1,刘存霞1,亓丽红1,胡 峰1,裴宗飞2,于可响1,黄 兵1,李玉峰1,宋敏训1,艾 武1
(1.山东省农业科学院家禽研究所 山东省禽病诊断与免疫重点实验室,济南 250023;2.山东省绿色食品发展中心,济南 250000)
从山东省一起疑似禽肺病毒感染的病例中分离到1株H9亚型禽流感病毒(H9 subtype Avian influenza virus,AIV-H9),未分离到禽肺病毒(Avian metapneumovirus,APV),但血清学检测发现APV-ELISA抗体参差不齐。根据已公布的APV的G基因和AIV-H9的HA基因序列分别设计合成引物,进行RT-PCR扩增,结果得到大小为692 bp和1683 bp的目的条带;测序分析发现,该发病鸡场感染的APV(SD/RZ/15) G基因片段与Genbank中登录的B型APV核苷酸序列同源性最高(92.1%~-94.5%)且遗传距离最近,处于同一个分支。分离到的AIV-H9毒株(CK/SD/RZ/H9/15)的HA基因与参考毒株的核苷酸序列同源性为87.3%~98.9%,遗传进化关系分析表明该分离毒株与近几年分离的H9处于同一个分支上。综合上述试验结果,确定该病例为B型APV与AIV-H9的混合感染引起。
禽肺病毒;H9亚型禽流感病毒;混合感染
禽肺病毒(Avian metapneumovirus,APV)于1978年首次在南非报道[1],火鸡和鸡是APV的自然宿主,不同日龄的鸡均能感染。禽肺病毒感染后可引起3种疾病:火鸡鼻气管炎(turkey rhinotracheitis,TRT)、肉鸡肿头综合征(swolean-head syndrome,SHS)和禽鼻气管炎(rhinotracheitis,ART)。该病没有特征性的临床表现和病变,但可以通过感染禽与易感禽直接接触传播,或者接种感染禽类的呼吸道粘液或者其他样品传播。所引起的症状常与鸡传染性支气管炎、支原体、鼻气管鸟杆菌感染和禽流感等呼吸道疾病相混淆[2]。由于APV分离比较困难,目前所报道的APV感染,实验证据多限于血清学检测结果。已报道检测到APV的地区国家有南非,欧洲大陆、美国、法国、巴西、中国、韩国、日本、以色列、约旦、尼日利亚等国家,中国大陆于1998年首次分离到APV[3]。对APV感染种鸡的血清学研究,发现种鸡群中普遍存在APV感染,个别种鸡群阳性感染率达100%[4,5],而且开产前后或30周龄左右易感染,抗体水平明显升高。
H9亚型禽流感(H9 subtype avian influenza virus,AIV-H9)通常不发病或仅表现轻微的上呼吸道症状,因此,AIV-H9的感染或其引起的疾病常常被忽视。然而,一旦AIV-H9与其他病原微生物合并感染,就会给养殖场造成严重的经济损失。近年来,AIV-H9流行趋势不断增加且感染宿主十分广泛,因此,越来越被人们所重视[6,7]。
禽肺病毒单独发病较少,往往与大肠杆菌或禽流感混合感染,给养禽业造成巨大的经济损失。本研究对引起一起39日龄ROSS鸡最高日死淘率1.86%,发病鸡只有肿头、肿脸临床症状,剖检细菌感染较严重(心包炎、肝周炎)等进行了病原分离和抗体检测,研究结果如下。
1 材料与方法
1.1 病料来源 山东某鸡场发病鸡气管、肺脏组织。
1.2 实验动物及主要试剂
6日龄SPF鸡胚购于山东昊泰实验动物繁育公司;反转录酶(M-MLV)购自Promega公司;Trizol试剂为Invitrogen公司产品;APV试剂盒购自IDEXX公司。
1.3 病毒分离
取发病鸡气管、肺脏等组织匀浆捣碎,加双抗作用,离心取上清,经卵黄囊接种6日龄SPF鸡胚5枚,0.2 mL/枚,另设生理盐水对照。37℃温箱培养,观察7 d,记录结果,收取活胚尿囊液,进行血凝试验,按同样方法继代6次。收获尿囊液接种CEF细胞,盲传3代。
1.4 发病鸡群的抗体检测
采集发病鸡群1#和2#舍血清30份,按照IDEXX公司APV试剂盒说明书进行APV抗体的检测,常规HI试验进行H9抗体的检测。
1.5 RT-PCR鉴定
参考GenBank中收录的APV G基因序列,利用Primer premier 5.0软件设计合成1对引物,上游引物:5'-TGTCGTGGTAGTTAGTCG-3'和下游引物:5'-TTGGTCGGTTGTCGTTTA-3',扩增片段692 bp;参考AIV-H9 HA基因设计1对引物,上游引物:5'-AGCAAAAGCAGGGGAATTT-3'和下游引物:5'-AGTAGAAACAAGGGTGTTTTTG-3',扩增片段1683 bp。引物均由北京博尚生物有限公司合成。Trizol方法提取病料中的病毒RNA,进行RTPCR扩增。RT反应条件:72℃ 5 min,42℃ 30 min,95℃ 2 min。PCR反应条件:94℃预变性3 min,94℃变性 1 min,50℃ 退火1 min,72℃延伸 1 min,共进行30个循环,再72℃延伸10 min。回收PCR产物克隆至pMD18-T载体中,双酶切法鉴定阳性重组质粒,并送至北京博尚生物有限公司测序。
1.6 序列分析
将获得的基因序列分别与GenBank中公布的APV G基因和AIV-H9 HA基因进行核苷酸序列同源性分析,用Boot-strap法(Replication值为1000)计算基因遗传距离并绘制进化关系发生树,其中Bootstrap值小于50%的数值未显示,分析分离毒株与参考毒株之间的遗传距离。
2 结果
2.1 病毒分离
病料经卵黄囊途径接种6日龄SPF鸡胚,第一代鸡胚60 h出现死亡,经HA试验检测,分离病毒HA效价达4 log2,该分离毒株可被AIV-H9阳性血清中和,确定尿囊液中含有AIV-H9,命名为CK/SD/RZ/H9/15。将病料上清液与等体积AIV-H9阳性血清混合,室温作用0.5 h后,经卵黄囊接种SPF鸡胚,37℃温箱培养5 d,收集活胚尿囊液,继续盲传6代后,进行RT-PCR检测APV,均未扩增出目的条带,表明没有分离到APV。
2.2 发病鸡群的抗体检测
份血清分别进行H9亚型禽流感HI检测和APV-ELISA测定。结果显示,H9-HI抗体滴度参差不齐,最高者与最低者相差10 log2;14份血清为APV阳性,血清阳转率为46.7%,且ELISA抗体滴度参差不齐,最高者可达2136,最低者为1,见表1。
2.3 序列分析
扩增与等体积AIV-H9阳性血清混合作用后的病料中APV的G基因(标记为SD/RZ/15),进行测序分析发现,该基因与Genbank中登录的B型APV核苷酸序列同源性最高,高达92.1%~94.5%;而该序列与A型APV核苷酸序列同源性为54.1%~54.4%,与C型APV核苷酸序列同源性最低,仅为13.0%~25.4%。遗传进化关系分析表明该病料中APV的G基因与B型APV遗传距离最近,处于同一个分支(图1);分离到的AIV-H9毒株(CK/SD/RZ/H9/15)的HA基因与参考毒株的核苷酸序列同源性为87.3%~98.9%,遗传进化关系分析表明该分离毒株与近些年分离的H9处于同一个分支上。
选取2个发病鸡群共抽取30
3 讨论
禽肺病毒(APV)为副黏病毒科、肺病毒亚科、偏肺病毒属的病毒[8],F和G蛋白是副粘病毒的两个主要表面蛋白,并且是诱导保护性免疫应答的重要抗原[9],因此,F和G蛋白常被作为重点研究对象。根据禽肺病毒G蛋白的基因不同可以将其分为A、B、C、D 4个亚型,其中A亚型和B亚型呈世界范围内广泛流行,C亚型感染以美国为主,中国最近也发现C亚型禽肺病毒[10],D亚型仅见法国报道[11,12]。其中APV/C亚型,明显区别于APV/A和APV/B,而与人偏肺病毒的基因组相似[13]。
由于APV的分离比较困难,禽肺病毒感染最常用的诊断方法主要依赖ELISA的血清学检测法。商品化的ELISA试剂盒可用于禽肺病毒多个亚型抗体的检测,但不能分型,而PCR技术结合测序分析可进行APV的分型。因此,本试验中我们首先对采集的病料进行了RT-PCR检测,结果APV和AIV-H9均为阳性。同时我们又对该鸡场2个发病鸡群共抽取30份血清进行APV-ELISA测定,结果发现血清阳转率为46.7%,且ELISA抗体参差不齐,滴度最高者可达2136,表明抗体检测结果与PCR检测结果相吻合。

表1 发病鸡群抗体检测结果Table 1 Antibody detection of infectious chickens

图1 基于APV G基因核苷酸序列的进化关系分析Fig. 1 Phylogenetic analysis based on G gene of APV
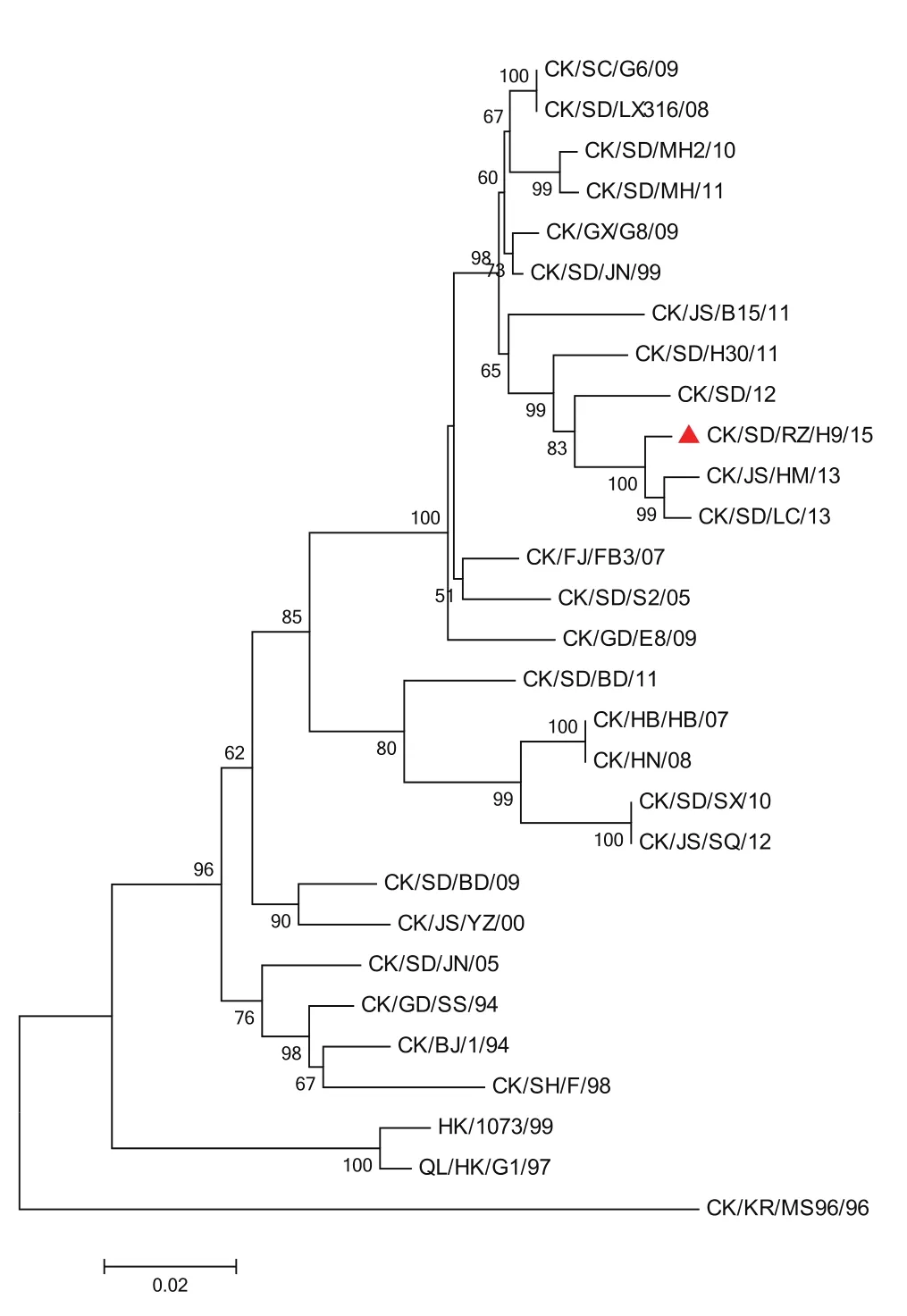
图2 基于AIV-H9 HA基因核苷酸序列的进化关系分析Fig. 2 Phylogenetic analysis based on HA gene of AIV-H9
为进一步分离APV,我们先用AIV-H9阳性血清中和病料,然后经卵黄囊途径接种6日龄SPF鸡胚,收获尿囊液,检测无血凝活性后继续盲传6代,仍未见鸡胚死亡。再将收取的尿囊液接种鸡胚成纤维细胞(chickenembryo fibroblast,CEF),盲传4代也未见细胞病变。收获的细胞毒经RT-PCR鉴定为APV阴性,表明未能分离到APV,这可能与送检样品的采集时机不准确有直接关系。APV的分离与样品的采集时间非常关键,鸡群一旦出现临床症状,排毒期已过,就很难分离到病毒,所以采集样品时,最好采集发病鸡群中没有临床症状鸡只的气管棉。尽管我们没能分离到APV,但通过对该发病鸡群感染的APV(SD/RZ/15)的G基因片段进行测序与进化关系分析,明确了该病例为B型APV感染所致。从该发病鸡群中也分离到1株AIV-H9,命名为CK/SD/RZ/H9/15,对鸡胚的致死率很高,且死亡时间较经典毒株缩短,多集中在48~72 h,表明该病毒对鸡胚的致死力有所增强。遗传进化分析表明该分离毒株与近几年分离的H9处于同一个分支上,未发生明显的遗传变异。
尽管APV感染在中国发现较晚,但已经在许多地区广泛流行[14]。目前,针对APV感染尚无有效的治疗方法。一旦确认感染,应用抗生素预防细菌性继发感染,减轻症状、减少死亡[15]。疫苗接种是预防APV感染的有效措施,建议引进国外商品化的A亚型或B亚型疫苗。抗病毒中药可用于AIV-H9的治疗。此外,加强饲养管理条件和生物安全措施,可明显减少APV和AIV-H9混合感染造成的损失。
[1] Buys S B, Du Preez J H. A preliminary report on the isolation of a virus causing sinusitis in turkeys in South Africa and attempts to attenuate the virus[J]. Turkeys,1980, 28: 36-56.
[2] Jones R. Avian pneumovirus infection: questions still unanswered[J]. Avian Pathol, 1996, 25(4): 649-648.
[3] 沈瑞忠, 曲立新, 于康震, 等. 禽肺病毒的分离鉴定[J]. 中国预防兽医学报, 1999, 21(1): 76-77。
[4] Owoade A A, Ducatez M F, Hubschen J M,et al. Avian metapneumovirus subtype A in China and subtypes A and B in Nigeria[J]. Avain Dis, 2008, 52: 502-506.
[5] 郭龙宗, 曲立新. 种鸡禽肺病毒感染的血清学调查[J].中国畜牧兽医, 2009, 36(4): 149-150.
[6] Li C, Yu K, Tian G,et al. Evolution of H9N2 influenza viruses from domestic poultry in Mainland China[J].Virology, 2005, 340(1): 70-83.
[7] 张毅, 王幼明, 王芳, 等.我国禽流感研究进展及成就[J].微生物学通报, 2014, 41(3): 497-503.
[8] Randhawa J S, Wilson S D, Tolley K P,et al. Nucleotide sequence of the gene encoding the viral polymerase of avian pneumovirus[J]. J Gen Virol, 1996, 77: 3047-3051.
[9] Sugiyama M, Koimaru H, Shiba M,et al. Drop of egg production in chickens by experimental infection with an avian metapneumovirus strain PLE8T1 derived from swollen head syndrome and the application to evaluate vaccine[J]. J Vet Med Sci, 2006, 68(8): 783-787.
[10] Wei L, Zhu S S, Yan X,et al. Isolation and charact-erization of avian metapneumovirus subgroup C in chickens[J]. The French branch of WVPA (GF-AMVA),2013: 379.
[11] Cook J K A, Cavanagh D. Detection and differentiation of avian pneumoviruses(metapneumoviruses)[J]. Avian Pathol, 2002, 31:117-132.
[12] Shobha B, Preeti B. Avian and human metapneumo virus[J]. Ny Acad Sci, 2007, 1102: 66-85.
[13] Seal B S. Avian pneumoviruses and emergence of a new type in the United States of America[J]. Anim Health Res Rev, 2000, 1: 67-72.
[14] 徐仕忠, 秦云, 于鹏, 等. 中国鸡群禽偏肺病毒感染的流行病学调查报告[J]. 中国家禽, 2013, 35(6): 59-60.
[15] 孙石开, 刘闯, 鲁俊鹏, 等. 覃健萍禽肺病毒研究进展[J].中国预防兽医学报, 2012, 34(9): 756-760.
A BRIEF REPORT OF MIXED INFECTION OF AVIAN METAPNEUMOVIRUS AND H9 SUBTYPE AVIAN INFLUENZA VIRUS
MA Xiu-li1, LIU Cun-xia1, QI Li-hong1, HU Feng1, PEI Zong-fei2, YU Ke-xiang1, HUANG Bing1,LI Yu-Feng1, SONG Min-xun1, AI Wu1
(1. The Key Lab of Poultry Disease Diagnosis and Immunology of Shandong Institute of Poultry Science, Shandong Academy of Agricultural Science, Jinan 250023, China; 2. Shandong Green Food Development Center, Jinan 250000, China)
The H9 subtype Avian influenza virus (AIV-H9) (CK/SD/RZ/H9/15)was isolated from a case infected by Avian metapneumovirus (APV) in Shandong. No APV was isolated and antibody was detected irregularly by ELISA. However, the cDNA fragments of 692 bp and 1683 bp were amplified using specific primers corresponding to G gene of APV and HA gene of AIV-H9 in GenBank. The nucleotide sequences analysis showed that the APV shared more than 92.1%-94.5% homology with B type APV in G gene,which suggested that APV might belong to B type APV. Furthermore, the AIV strain CK/SD/RZ/H9/15 shared 87.3%-98.9% homology with AIV-H9 in view of HA gene, which suggested closer relationship between isolated viruses in recent years. In conclusion, the case was caused by mixed infection of APV and AIV-H9.
Avian metapneumovirus; H9 subtype Avian influence virus; mixed infection
2017-04-20
国家自然科学基金应急管理项目(31440086);山东省现代农业产业技术体系项目(SDAIT-13-011-01);山东省农业科学院农业科技创新工程(CXGC2016A10)
马秀丽,女,博士,副研究员,主要从事禽病诊断与防制技术研究
宋敏训,E-mail:mxsong@aliyun.com;艾武,E-mail:aw5970@163.com
S852.659.5
A
1674-6422(2017)06-0023-05
