口蹄疫、猪瘟、高致病性猪繁殖与呼吸综合征三种疫苗同步两点免疫在规模猪场的应用试验
2017-12-27黄文炳黄金山唐云姣班雪花施开创
覃 勇,黄文炳,黄金山,赵 聪,唐云姣,班雪花,施开创
(1.百色市动物疫病预防控制中心,百色 533000;2.平果县动物疫病预防控制中心,平果 531400;3.右江区动物疫病预防控制中心,百色 533000;4.田东县动物疫病预防控制中心,田东 531500;5.广西动物疫病预防控制中心,南宁 530001)
口蹄疫、猪瘟、高致病性猪繁殖与呼吸综合征三种疫苗同步两点免疫在规模猪场的应用试验
覃 勇1,黄文炳2,黄金山3,赵 聪1,唐云姣1,班雪花4,施开创5
(1.百色市动物疫病预防控制中心,百色 533000;2.平果县动物疫病预防控制中心,平果 531400;3.右江区动物疫病预防控制中心,百色 533000;4.田东县动物疫病预防控制中心,田东 531500;5.广西动物疫病预防控制中心,南宁 530001)
为探索和评估口蹄疫(foot-and-mouth disease,FMD)、猪瘟(classical swine fever,CSF)、高致病性猪繁殖与呼吸综合征(highly pathogenic porcine reproductive and respiratory syndrome,HP-PRRS)的合理免疫程序,选择6个规模猪场,其中3个猪场采用“332法”免疫程序(即先用FMD和CSF疫苗同时在颈部两侧注射,间隔14 d后再用HP-PRRS疫苗注射),另3个猪场采用“321法”免疫程序(即将CSF和HP-PRRS疫苗混合后作1针在颈部一侧注射,FMD疫苗作1针在颈部另一侧注射),每季度采集血清和病死猪组织样品。应用ELISA方法检测血清中的FMD、CSF和HP-PRRS抗体,应用RT-PCR方法检测组织样品中的FMD、CSF和HP-PRRS病原体;统计分析抗体阳性率、发病率、死亡率、死亡猪病原阳性率等评价指标。结果显示,应用“321法”的3个猪场与应用“332法”的3个猪场相比,其生猪死亡率(下降1.3%)、HP-PRRS病原体阳性率(下降6.6%)显著下降(P<0.05),而其他考核指标则差异不具备显著统计学意义(P>0.05)。本研究表明,规模猪场应用“321法”免疫程序的免疫效果优于“332法”免疫程序的免疫效果,值得在临床推广应用。
口蹄疫;猪瘟;高致病性猪繁殖与呼吸综合征;免疫程序;田间试验
口蹄疫(foot-and-mouth disease,FMD)、猪瘟(classical swine fever,CSF)、高致病性猪繁殖与呼吸综合征(highly pathogenic porcine reproductive and respiratory syndrome,HP-PRRS)是当前国内严重危害养猪业的重要疫病。猪繁殖与呼吸综合征病毒(Highly pathogenic Porcine reproductive and respiratory syndrome virus,PRRSV)感染可以导致免疫抑制和抗体依赖性增强作用[1,2],可以影响CSF疫苗的免疫效果[3,4];猪瘟病毒(Classical swine fever virus,CSFV)感染也会抑制机体的免疫功能[5,6],影响FMD疫苗的免疫效果[7,8]。为做好FMD、CSF和HP-PRRS的防控,各级政府和广大养殖户投入了大量的人力、物力和财力。其中,疫苗免疫是最为重要的防控措施,而合理的免疫程序对免疫效果至关重要。为此,许多学者开展了FMD、CSF和HPPRRS 3种疫苗不同免疫程序的研究,但不同学者的研究结果有所差异。张长龙等[9]报道,FMD、CSF和HP-PRRS 3种疫苗同时分点免疫相互之间干扰较大;而接种CSF疫苗7 d后,再接种FMD和HP-PRRS疫苗,两者具有协同促进作用。卢景等[10]报道,FMD、CSF和HP-PRRS 3种疫苗同时分点免疫,其抗体水平都低于单独免疫;FMD和HP-PRRS疫苗或CSF和HP-PRRS疫苗同时分点免疫,均会产生相互干扰作用。窦鹏勋等[11]报道,FMD与HP-PRRS疫苗同时免疫具有协同作用,CSF和HP-PRRS疫苗同时免疫会相互影响。马睿麟等[12]报道,FMD、CSF和HP-PRRS 3种疫苗同时分点免疫或单独免疫,免疫效果一致。陶得和等[13]报道,FMD、CSF、HPPRRS疫苗同时免疫的效果优于两两联合免疫的效果。本课题组开展的3种疫苗不同免疫程序的前期研究表明,先用FMD和CSF疫苗同时在颈部分点注射、间隔14 d后再用HP-PRRS疫苗注射(简称“332法”),与HP-PRRS和CSF疫苗释稀后混合在一起作为一针、FMD疫苗作为一针同时分点注射(简称“321”法),均取得了良好的免疫效果[14]。由于“321法”只需开展一次注射即可完成三种疫苗的免疫,深受广大养殖户和兽医人员的欢迎。本研究将“332法”和“321法”免疫程序在6个规模猪场扩大田间应用试验,比较两种方法的免疫效果,为临床大面积推广应用提供基础数据。
1 材料与方法
1.1 疫苗
2015年试验期间,口蹄疫O型灭活疫苗(O/MYA98/BY/2010株)在第一、二季度使用内蒙古必威安泰生物科技有限公司生产的疫苗(批号2014009),在第三、四季度使用中牧实业股份有限公司生产的疫苗(批号1411006);猪瘟弱毒疫苗(细胞源)使用成都天邦生物制品有限公司生产的疫苗(批号2014076);高致病性猪繁殖与呼吸综合征弱毒疫苗(TJM-F92株)使用吉林特研生物技术有限责任公司生产的疫苗(批号2014121002)。
1.2 主要试剂
口蹄疫O型抗体液相阻断ELISA试剂盒为中国农业科学院兰州兽医研究所产品(批号2014092301、20150415101-2、20150729101-2),猪瘟(CSFV-Ab)抗体检测试剂盒为韩国金诺公司产品(批号107HS544),猪繁殖与呼吸综合征病毒抗体ELISA检测试剂盒为法国LSI公司产品(批号5-TTVETPRA-047)。口蹄疫通用型RT-PCR检测试剂盒(批号FMD20141216P)、猪瘟病毒通用型RT-PCR检测试剂盒(批号CSF20141218P)、猪繁殖与呼吸综合征病毒(Nsp2 1594~1680变异株)RT-PCR检测试剂盒(批号HPRRS20150203P)均为北京世纪元亨动物防疫技术有限公司产品。
1.3 试验设计
选择6个自繁自养的中小规模猪场,这些猪场饲养生猪品种、饲养规模、饲养模式、管理水平、免疫疫苗种类及免疫程序(主要免疫口蹄疫、猪瘟、猪繁殖与呼吸综合征、伪狂犬病、猪细小病毒病、猪圆环病毒病等)基本一致。近年生产平稳,没有发生传染病流行及异常大量死亡现象,仅有个别猪只零星发病死亡或因消瘦、病弱而被淘汰。2014~2016年,应用本实验室建立的鉴别检测PRRSV经典株、变异株和疫苗株的多重RT-PCR方法[15],对猪场内PRRS流行情况进行定期监测,未发现PRRSV经典株在猪群内流行。
6个试验猪场包括广西壮族自治区右江区A、B猪场、田东县C、D猪场、平果县E、F猪场,25~28日龄断奶,30~35日龄首次免疫。其中A、C、E场采用“332法”免疫程序,即先用FMD O型灭活疫苗和CSF弱毒疫苗在颈部两侧同时分点注射,间隔14 d后,再用HP-PRRS弱毒疫苗(TJM-F92株)免疫,免疫剂量为1 mL(头份)/头;B、D、F场采用“321法”免疫程序,即将CSF弱毒疫苗和HP-PRRS弱毒疫苗(TJM-F92株)释稀后混合在一起作为一针在颈部一侧注射,同时将FMD O型灭活疫苗作为一针在颈部另一侧注射,免疫剂量为1 mL(头份)/头。于每个季度最后一个月的20~25日,分别在6个猪场随机采集首次免疫后30~45 d的血清样品各20份,全年共480份;在6个猪场的日常管理和疫病防控中,根据猪群的健康状况和生产指标,结合发病情况和临床症状,解剖病死或淘汰猪,发现疑似FMD、CSF、HP-PRRS等传染病明显病变的,则采集组织样品(心、肝、肺、扁桃体、淋巴结等),每个猪场每个季度各10份,全年共240份。置-20℃保存备用。同时,在6个猪场各随机选择1窝(8头/窝)30~35日龄健康小猪,作为免疫抗体消长规律的监测猪。于免疫后0、15、30、60、90 d分别采集血清,共240份,置-20℃保存备用。其中,“332法”免疫程序的猪场分别按照FMD O型灭活疫苗和CSF弱毒疫苗免疫时间、HP-PRRS弱毒疫苗免疫时间采样。
1.4 血清抗体检测
HP-PRRS抗体采用ELISA检测,具体操作按试剂盒说明书进行,判定标准:IRPC≤20时判为HP-PRRS抗体阴性,IRPC>20时判为HP-PRRS抗体阳性;CSF抗体采用ELISA检测,具体操作按试剂盒说明书进行,判定标准:PC<40 %时判为CSF抗体阴性,PC≥40%时判为CSF抗体阳性;FMD抗体采用液相阻断ELISA检测,具体操作按试剂盒说明书进行,判断标准:对照临界值,抗体效价<1:64时判为FMD O型抗体阴性,1:64时判为FMD O型抗体可疑,≥1:128时判为FMD O型抗体阳性。
1.5 组织样品病原检测
FMDV采用RT-PCR检测,具体操作按试剂盒说明书进行,被检样品出现131 bp扩增带时判为FMDV阳性,否则为阴性;CSFV采用RT-PCR检测,具体操作按试剂盒说明书进行,被检样品出现235 bp扩增带时判为CSFV阳性,否则为阴性;PRRSV采用RT-PCR检测,具体操作按试剂盒说明书进行,被检样品出现278 bp扩增带时判为HP-PRRSV阳性,否则为阴性。
1.6 数据采集与统计分析
根据6个试验猪场日常防疫档案记录,统计分析生猪免疫数、发病数、死亡数;根据实验室检测结果,统计分析抗体阳性率、病原阳性率。利用excel 2007 单因素方差分析法对各数据进行差异性分析,当P<0.05时为差异具有显著统计学意义。
2 结果
2.1 抗体消长规律检测结果
从6个猪场各选取一窝猪(8头/窝),于疫苗免疫后0、15、30、60、90 d采集血清,共240份。分别应用ELISA方法检测FMD、CSF、HP-PRRS抗体。结果显示,FMD、CSF、HP-PRRS抗体于免疫后15 d抗体水平迅速提高,到30 d达到最高峰,此后逐步下降,到90 d时抗体阳性率均高于70%(见图1),仍达到农业部对免疫抗体群体合格率的要求。数据分析表明,应用“321法”与“332法”免疫程序的抗体阳性率在试验期间差异均不具备显著统计学意义(P>0.05),见表1。
2.2 免疫抗体检测结果
采集的480份血清进行FMD、CSF、HP-PRRS抗体检测。结果显示,应用“321法”与“332法”免疫程序相比,FMD抗体阳性率低2.9%,差异不具备显著统计学意义(P=0.1274>0.05);CSF抗体阳性率低0.8%,差异不具备显著统计学意义(P=0.7216>0.05);HP-PRRS抗体阳性率高3.7%,差异不具备应用ELISA方法,对6个猪场显著统计学意义(P=0.4507>0.05),见表2。
2.3 生猪发病率与死亡率
对6个猪场的饲养量、发病率、死亡率进行统计分析。结果显示:应用“321法”与“332法”免疫程序相比,生猪平均发病率低1.5%,差异不具备显著统计学意义(P=0.1547>0.05),生猪平均死亡率低1.3%,差异具备显著统计学意义(P=0.0019<0.05),见表3。
2.4 病死猪病原检测结果
应用RT-PCR方法,对从6个猪场采集的240份病死猪组织样品进行FMDV、CSFV、HP-PRRSV病原检测。结果显示:应用“321法”与“332法”免疫程序相比,FMDV均为阴性;CSFV阳性率低0.8%,差异不具备显著统计学意义(P=0.7502>0.05);HP-PRRSV阳性率低6.6%,差异具备显著统计学意义(P=0.04983<0.05),见表4,部分病原检测结果见图2。

图1 疫苗免疫后FMD(A)、CSF(B)和HP-PRRS(C)抗体动态变化情况Fig. 1 Changes of FMD (A), CSF (B) and HP-PRRS (C) antibodies after vaccination

表1 疫苗免疫后抗体消长情况Table 1 Changes of antibody positive rate after immunization with vaccines

表2 FMD、CSF和HP-PRRS抗体检测结果Table 2 The detected results of FMD, CSF and HP-PRRS antibodies

表3 生猪发病率和死亡率情况Table 3 The data of morbidity rate and mortality rate
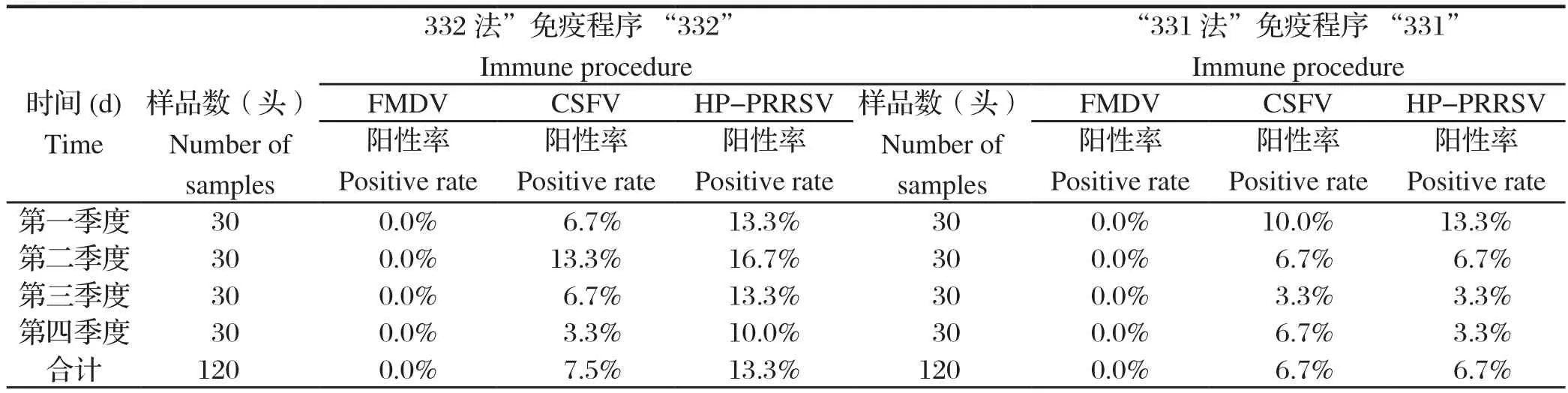
表4 病死猪FMDV、CSFV和HP-PRRSV检测结果Table 4 The detected results of FMDV, CSFV and HP-PRRSV from dead pigs
2.5 综合评价
“321法”与采用“332法”免疫程序相比,其生猪死亡率、病死猪HP-PRRSV病原检出率显著降低(P
综合分析各项考核指标发现,采用<0.05),表明“321法”免疫程序取得更佳的防控效果,见表5。
3 讨论
规模猪场需要免疫的疫苗种类多、劳动强度大,为简化免疫程序、减少免疫次数、提高免疫效果,许多学者针对FMD、CSF、HP-PRRS三种疫苗开展了大量免疫试验。张长龙等[9]采用三种疫苗同时分点免疫,发现三种疫苗之间相互干扰较大,CSF抗体产生时间推迟;而先接种CSF疫苗,7 d后接种FMD和HP-PRRS疫苗,后两者具有协同促进作用。卢景等[10]报道,FMD、CSF和HP-PRRS三种疫苗同时分点免疫,其抗体水平都低于单独免疫;FMD和HP-PRRS疫苗或CSF和HP-PRRS疫苗同时分点免疫,均会产生相互干扰作用,但对7 d后免疫的CSF疫苗或FMD疫苗没有影响;FMD和CSF疫苗同时分点免疫,7 d后再免疫HP-PRRS疫苗,其抗体效价与三种疫苗单独免疫基本一致。窦鹏勋等[11]报道,CSF、FMD、HP-PRRS疫苗同时免疫可取得理想的免疫效果,FMD与HP-PRRS疫苗同时免疫具有协同作用,CSF和HP-PRRS疫苗同时免疫会相互干扰。马睿麟等[12]报道,CSF和HP-PRRS疫苗组合免疫,7 d后免疫FMD疫苗,FMD抗体值较低;先免疫CSF疫苗,7 d后免疫FMD和HP-PRRS疫苗,猪瘟抗体受到干扰;FMD、CSF和PRRS三种疫苗同时分点免疫或单独免疫,免疫效果一致。陈文武等[16]报道,先免疫HP-PRRS疫苗,7 d后同时分点注射FMD和CSF疫苗,或者CSF、FMD、HP-PRRS三种疫苗同时分点免疫注射,均获得较好的免疫效果;CSF和FMD同时免疫具有协同作用,CSF和HP-PRRS或FMD和HP-PRRS疫苗同时免疫会相互干扰。任宇斓等[17]用FMD、CSF、HP-PRRS疫苗同时分点注射以及3种疫苗间隔7 d免疫注射,均取得理想的免疫效果。陶得和等[13]报道,FMD、CSF、HP-PRRS疫苗同时免疫的效果优于两两联合免疫的效果。可见,不同学者的试验结果并不完全一致,这可能与不同地域的气候条件、养殖习惯、饲养管理、猪的品种品系、年龄、健康状况、疫苗种类和生产厂家、免疫程序、猪群基础免疫、母源抗体水平等多种因素的影响有关。值得注意的是,以上报道均是小规模试验所获得的研究数据,迄今未见临床较大规模应用的数据。临床实际应用的效果如何,有待于进一步扩大田间应用试验。
本课题组从节约人力、物力、财力、时间成本以及获得最佳防控效果等多方面考虑,结合广西当前政府采购3种疫苗的种类以及常用的几种免疫方式,开展试验研究。结果发现,CSF弱毒疫苗和HPPRRS弱毒疫苗释稀后混合为一针,FMD灭活疫苗另作一针同时分点免疫(简称“321法”);或者先用FMD灭活疫苗和CSF弱毒疫苗同时分点免疫,间隔14 d后,再用HP-PRRS弱毒疫苗免疫(简称“332法”),均取得较好的免疫效果[14]。周建国等[18]在云南省的试验,也得到类似的结果。为将该项研究成果大面积推广应用于临床,本研究进一步在3个县6个规模猪场扩大田间应用试验,其中3个猪场应用“332法”、另3个猪场应用“321法”免疫程序。结果发现,采用“321法”免疫程序与采用“332法”免疫程序相比,猪群死亡率(下降1.3%)、病死猪HP-PRRSV病原阳性率(下降6.6%)显著下降(P<0.05),其他指标如发病率、抗体阳性率等虽然有所差异,但差异不具备显著统计学意义(P>0.05)。表明,“321法”的免疫效果优于“332法”的免疫效果,并且可以节省大量人力、物力、财力,值得在临床推广应用。值得注意的是,即使经过疫苗免疫,仍能从病死猪组织样品中检测到CSFV和HP-PRRSV,说明免疫猪群中仍有CSFV和HP-PRRSV存在和循环,对猪群构成严重的威胁,必须高度重视,加以重点防控。
近年来,我国通过实行强制免疫等措施,有效控制了PRRS的发生和蔓延,大大降低了该病对养猪业的危害。但是,国内猪群仍普遍感染PRRSV野毒株[19],PRRS时有发生,对该病的防控丝毫不可松懈,其中疫苗免疫仍是最为有效的措施。疫苗免疫可降低感染猪组织中的病毒含量,缩短猪群向外排毒时间,可减轻病猪的临床症状、病理损伤,降低感染猪群的发病率和死亡率[20,21]。本研究中,采用“321法”与采用“332法”免疫程序相比,猪群的HP-PRRS抗体阳性率高3.7%,死亡率低1.3%,病死猪HP-PRRSV阳性率低6.6%,疫苗免疫取得明显成效。但是,由于弱毒疫苗的免疫效果与猪群中的流行毒株密切相关,其对同一基因型同源毒株(homologous isolate)提供几乎完全保护,对异源毒株(heterologous isolate)提供部分保护,而对不同基因型毒株几乎不提供保护[22,23]。因此,必须加强猪群中流行毒株的监测,明确猪群中流行的是基因I型(欧洲型)还是基因Ⅱ型(美洲型)、是美洲型经典株还是变异株,以便使用有针对性的疫苗株,如选择使用欧洲型或美洲型毒株,抑或选择使用美洲型经典株致弱活疫苗(如CH-1R株)或变异株致弱活疫苗(如JXA1-R、HuN4-F112、TJM-F92株),以提高疫苗免疫效果,确保防控成效。但是,近年来我国PRRSV流行毒株不断出现新的特点,以Ch-1a株为代表的PRRSV经典株在猪群中仍有流行,以JXA1株为代表的HP-PRRSV继续作为流行优势毒株并处于持续变异之中[18],不同毒株间(野毒株与野毒株、野毒株与疫苗株、疫苗株与疫苗株之间)发生重组不断产生新的强毒株[24],最近又报道了在nsp2基因存在393个核苷酸缺失的美洲型NADC30类病毒的存在[25],加上已在部分省份的临床发病猪群中分离到欧洲型毒株[26],使得PRRSV流行毒株日益多样化和复杂化。特别是美洲型NADC30类病毒在我国有迅速蔓延之势[27],而现有的基因Ⅱ型(美洲型)疫苗均不能提供完全的免疫保护[28]。如何针对临床流行毒株,选择确实有效的疫苗株,以提高疫苗的免疫效果,是当前有效防控HP-PRRS所面临的严峻挑战,必须给予高度重视。
综上所述,采用“321”法免疫程序(即将CSF和HP-PRRS疫苗混合后作一针在颈部一侧注射,FMD疫苗作一针在颈部另一侧注射),在规模猪场开展田间应用试验取得良好的免疫和防控效果,值得在临床大量推广应用。
[1] Loving C L, Osorio F A, Murtaugh M P,et al. Innate and adaptive immunity against porcine reproductive and respiratory syndrome virus[J]. Vet Immunol Immunopathol, 2015, 167 (1-2): 1-14.
[2] Gu W, Guo L, Yu H,et al. Involment of CD16 in antibody-dependent enhancement of porcine reproductive and respiratory syndrome virus infection[J]. J Gen Virol,2015, 96 (Pt 7): 1712-1722.
[3] Wang X, Mu G, Dang R,et al. Up-regulation of IL-10 upon PRRSV vaccination impacts on the immune response against CSFV[J]. Vet Microbiol, 2016, 197: 68-71.
[4] Suradhat S, Kesdangsakonwut S, Sada W,et al. Negative impact of porcine reproductive and respiratory syndrome virus infection on the efficacy of classical swine fever vaccine[J]. Vaccine, 2006, 24 (14): 2634-2642.
[5] von Rosen T, Lohse L, Nielsen J,et al.Classical swine fever virus infection modulates serum levels of INF-α,IL-8 and TNF-α in 6-month-old pigs[J]. Res Vet Sci,2013, 95 (3): 1262-1267.
[6] Muñoz-González, Ruggli N, Rosell R,et al. Postnatal persistent infection with classical swine fever virus and its immunological implications[J]. PLoS One, 2015, 10 (5):e0125692.
[7] Tarradas J, de la Torre M E, Rosell R,et al. The impact of CSFV on the immune response to control infection[J].Virus Res, 2014, 185: 82-91.
[8] De Clercq K, Koenen F, Strobbe R,et al. Simultaneous vaccination of piglets against foot-and-mouth disease and classical swine fever[J]. Vet Microbiol, 1989, 20(3):215-221.
[9] 张长龙, 严宝英, 贾文孝, 等. 猪瘟、猪口蹄疫、高致病性猪蓝耳病疫苗有效免疫试验初探[J]. 动物医学进展,2009, 30 (7): 101-103.
[10] 卢景, 陆承平, 段振华. 口蹄疫、猪瘟和高致病性猪蓝耳病3种疫苗不同组合对猪的免疫效果评价[J]. 畜牧与兽医, 2012, 44 (1): 76-79.
[11] 窦鹏勋, 葛建强, 张勇, 等. 3种疫苗单独和联合免疫对猪抗体水平的影响[J]. 安徽农业科学, 2009, 37(31):15259-15261.
[12] 马睿麟, 蔡金山, 沈艳丽, 等. 猪瘟、口蹄疫、猪繁殖与呼吸综合征等多种疫苗免疫试验[J]. 畜牧与兽医, 2010,42(10): 79-82.
[13] 陶得和, 漆晶晶, 白文丽, 等. 高致病性蓝耳病疫苗、猪瘟、口蹄疫疫苗同时免疫试验报告[J]. 河南畜牧兽医,2010, 31(6): 6-8.
[14] 胡杰, 张步娴, 屈素洁, 等. 不同免疫方式对仔猪免疫高致病性猪繁殖与呼吸综合征、猪瘟、猪口蹄疫三种疫苗抗体水平的影响[J]. 中国动物传染病学报, 2014, 22(5): 61-67.
[15] 施开创, 许心婷, 胡杰, 等. PRRSV美洲型经典株、变异株和疫苗株多重RT-PCR鉴别检测方法的建立及应用[J]. 中国畜牧兽医, 2017, 44(3): 879-887.
[16] 陈文武, 马长宾, 崔蕾, 等. FMD、HP-PRRS及CSF三种疫苗不同免疫组合同时分点免疫的抗体水平检测[J]. 黑龙江畜牧兽医, 2016(3): 95-98.
[17] 任宇斓, 于厚军, 蒋文生, 等. 猪口蹄疫、猪瘟、高致病性猪蓝耳病三种疫苗不同组合同时分点免疫效果观察与分析[J]. 中国动物检疫, 2011, 28 (5): 67-71.
[18] 周建国, 张应国, 段博芳, 等. 口蹄疫、猪瘟和高致病性猪蓝耳病三种疫苗同步两点免疫新技术研究与应用[J].中国畜牧兽医文摘, 2016, 32 (7): 100-101.
[19] 杨汉春, 周磊. 2016年猪病流行情况与2017年流行趋势及防控对策[J]. 猪业科学, 2017, 34 (2): 36-37.
[20] Leng X, Li Z, Xia M,et al. Evaluation of the efficacy of an attenuated live vaccine against highly pathogenic porcine reproductive and respiratory syndrome virus in young pigs[J]. Clin Vaccine Immunol, 2012, 19(8): 1199-1206.
[21] Jeong J, Choi K, Kang I,et al. Evaluation of a 20 year old porcine reproductive and respiratory syndrome (PRRS)modified live vaccine (Ingelvac(®) PRRS MLV) against two recent type 2 PRRS virus isolates in South Korea[J].Vet Microbiol, 2016, 192: 102-109.
[22] Vu H L, Pattnaik A K, Osorio F A. Strategies to broaden the cross-protective efficacy of vaccines against porcine reproductive and respiratory syndrome virus[J]. Vet Microbiol, 2017, 206: 29-34.
[23] Choi K, Park C, Jeong J,et al. Comparison of protection provided by type 1 and type 2 porcine reproductive and respiratory syndrome field viruses against homologous and heterologous challenge[J]. Vet Microbiol, 2016, 191:72-81.
[24] Zhao K, Ye C, Chang X,et al. Importation and recombination are responsible for the latest emergence of highly pathogenic porcine reproductive and respiratory syndrome virus in China[J]. J Virol, 2015, 89(20): 10712-10716.
[25] Zhou L, Wang Z, Ding Y,et al. NADC30-like strain of porcine reproductive and respiratory syndrome virus,China[J]. Emerg Infect Dis, 2015, 21(12): 2256-2257.
[26] Zhou Z, Liu Q, Hu D,et al. Complete genomic characterization and genetic diversity of four European genotype porcine reproductive and respiratory syndrome virus isolates from China in 2011[J]. Virus Genes, 2015,51(3): 375-384.
[27] Li X, Bao H, Wang Y,et al. Widespread of NADC30-like PRRSV in China: another Pandora's box for Chinese pig industry as the outbreak of highly pathogenic PRRSV in 2006?[J]. Infect Genet Evol, 2017, 49: 12-13.
[28] Bai X, Wang Y, Xu X,et al. Commercial vaccines provide limited protection to NADC30-like PRRSV infection[J].Vaccine, 2016, 34(46): 5540-5545.
FIELD EFFICACY OF FMD, CSF AND HP-PRRS VACCINES SIMULTANEOUSLY ADMINISTERED ON INTENSIVE PIG FARMS AT TWO DIFFERENT SITES
QIN Yong1, WANG Wen-bing2, HUANG Jin-shan3, ZHAO Cong1, TANG Yun-jiao1, BAN Xue-hua4,SHI Kai-chuang5
(1. Baise Center for Animal Disease Control and Prevention, Baise 533000, China; 2. Pingguo Center for Animal Disease Control and Prevention, Pingguo 531400, China; 3. Youjiang Center for Animal Disease Control and Prevention, Baise 533000, China; 4. Tiandong Center for Animal Disease Control and Prevention, Tiandong 531500, China; 5. Guangxi Center for Animal Disease Control and Prevention, Nanning 530001, China)
To explore the optimal vaccination procedure of foot-and-mouth disease (FMD), classical swine fever (CSF) and highly pathogenic porcine reproductive and respiratory syndrome (HP-PRRS) vaccines on intensive pig farms, field vaccination experiment was carried out on 6 pig farms. Two vaccination procedures were implemented. The "332" procedure used on three farms included FMD and CSF vaccines were injected at the same time and HP-PRRS vaccine was injected 14 days later. The "321" procedure used on other three farms was that HP-PRRS and CSF vaccines were mixed together and injected in one side of the necks and FMD vaccine was injected in other side of the necks. Serum samples from vaccinated pigs and tissues from dead pigs were collected quarterly for examination of antibody responses and lesions. Antibodies to FMD, CSF and HP-PRRS vaccines were detected by ELISA and viraemia of FMDV, CSFV and HP-PRRSV were detected in RT-PCR. The data of 3 farms implemented "321" procedure were compared with those of 3 farms implemented "332 " procedure. On the 3 farms implemented "321" procedure, the mortality rate of pigs decreased 1.3 % and the positive rate of HP-PRRSV decreased 6.6 %, which were of significance (P<0.05) as compared with 3 farms implemented "332 " procedure. The results indicated that the field eきcacy of "321" procedure was better than that of "332" procedure, worthy to be applied in clinical practice on intensive pig farms.
Foot-and-mouth disease; classical swine fever; highly pathogenic porcine reproductive and respiratory syndrome; immune procedure; field eきcacy
S852.659.6
A
1674-6422(2017)06-0015-08
2017-03-06
广西科学研究与技术开发计划项目(桂科转14125004-22);广西水产畜牧科技项目(桂渔牧科201528017);广西科技重大专项(2017)
覃勇,男,高级兽医师,主要从事动物疫病预防控制工作
施开创,E-mail: shikaichuang@126.com
