基于微量量热法的不同来源黄芩抑菌活性对比研究△
2017-12-26曾燕郭兰萍王继永黄璐琦
曾燕,郭兰萍,王继永*,黄璐琦*
(1.中国中药公司,北京 102600;2.中国中医科学院 中药资源中心,北京 100700)
·基础研究·
基于微量量热法的不同来源黄芩抑菌活性对比研究△
曾燕1,郭兰萍2,王继永1*,黄璐琦2*
(1.中国中药公司,北京 102600;2.中国中医科学院 中药资源中心,北京 100700)
目的构建基于生物热技术的不同来源黄芩抑菌活性区分方法,基于生物热技术考察不同来源黄芩的抑菌活性差异。方法采用微量量热技术,研究不同来源黄芩对大肠杆菌生长代谢的热动力学参数的影响,考察栽培区域、采收期、生长年限和种质等的差异对黄芩抑菌活性的影响。结果不同产地黄芩热动力学参数特征差异较大,其抑制率在24.3%~129.5%,其中河北承德和内蒙古武川黄芩抑菌活性显著高于山东莒县和山西运城;随着药材采收月份的变化(7—11月),黄芩的抑菌活性出现了先下降后急剧增加的现象,且在11月份抑菌活性达到最强;对比不同生长年限的黄芩(2~5年),总体上黄芩药材的抑菌活性随着药材生长年限的增加而增强;多点试验考察不同种质黄芩药材抑菌活性发现,不同种质黄芩抑菌活性差异较大,其表现出来的抑菌活性与纬度跨越有关。结论不同产地黄芩抑菌活性存在一定的差异,药材的采收时间、生长年限以及种质等的差异均能对黄芩抑菌率产生影响。基于生物热技术的微量量热技术用于不同来源药材的区分,较传统的药理、化学和形态学方法具有一定的便捷性和快速性,可作为进一步区分不同来源药材药效差异的依据之一。
黄芩;微量量热法;生物活性;品质区分
在生命体生长、繁殖、衰亡过程中,伴随代谢有热量释放,释放的热量随生长期的变化关系就是热活性谱线图(简称“热谱图”)。生物热动学参数可对生物体在生长代谢过程中的相关信息进行定性、定量分析,有较强的专属性、灵敏性和重现性[1]。
随着生物热理论和技术的日趋完善和成熟,微量量热法在药物研究领域中的应用也日益广泛,如药物稳定性研究、药物抗肿瘤、药物制剂研究、药物活性的定量构效关系、抗菌药物活性筛选研究以及联合用药等方面[2]。目前,基于生物热的微量量热技术在中药药性的科学阐释、中药活性成分的活性评价、中药注射剂的安全性评价等方面多有探讨,这是对中医药传统研究思路和研究方法的拓展。具有高灵敏度的微量量热仪可以直接、连续地测量生物体生长过程中的热量变化,进一步反映生物体的整个生长代谢过程能量的转移。该技术为解决中药质量控制和药效评价等复杂性难题提供了一些思路,并具有一些优越性[3]。
在中药材质量评价中,单一的化学评价方法越来越受到质疑,而传统的药理学评价方法又较为繁琐。基于微量量热技术的中药材质量评价方法或可作为中药材质量区分的依据之一,如不同产地药材品质对比[4-6]、不同种质活性评价[7-8]、不同生长年限药材的活性评价[9]、中药材不同药效部位的活性评价等方面有过一些研究[10-11]。
黄芩ScutellariabaicalensisGeorgi为唇形科多年生药用植物,具有清热燥湿、泻火解毒、止血、安胎的功能。现代药理学表明,黄芩具有抗氧化、抗肿瘤、清除自由基、抗炎、抗菌等作用,并对免疫系统、心脑血管系统、消化系统、神经系统等具有一定的有保护和治疗作用[12-14]。不同来源黄芩,包括产地、生长年限等方面的差异将导致黄芩质量差异[15-17]。这些差异不仅体现在药材外观性状上的差异和化学成分上的差异,也应体现在生物活性和临床功效上的差异,而相关研究非常之少[18]。基于此,我们收集不同产区、不同生长年限、不同采收期的黄芩进行生物热对比研究;同时进行田间小区试验,考察黄芩种质差异对黄芩药材生物热动力学参数和抑菌活性的影响。采用微量量热法评价不同黄芩的“活性”,为黄芩道地药材研究提供更丰富的信息,同时也拓展新技术、新方法在中药材质量评价方面的应用。
1 材料与仪器
黄芩药材:于2013年采集河北、内蒙古、山西和山东不同产地栽培黄芩。药材来源包括不同产区商品田药材,田间受控试验药材,不同采收期、不同生长年限药材样品共计50份,另外收集1份黄芩栓皮样本1份,样品信息见表1,样品采集后55 ℃烘干,粉碎,过四号筛备用。
黄芩浸膏制备:取黄芩粉末10 g,加80 mL 70% 乙醇,超声提取1 h,抽滤,80 ℃水浴挥发24 h,80 ℃烘箱烘40 h,研磨粉碎,80 ℃烘箱烘干8 h,即得黄芩浸膏粉末样品。
菌株:根据生物热力学研究特点和本研究所选中药的主要生物活性,拟选取在分子生物学和基因工程中体外培养技术成熟、代谢功率较大的大肠杆菌作为本研究主要的生物模型。大肠杆菌(Escherichia coli ATCC 25922)由解放军302医院临床医学检验中心提供,自行传代于第四代,4 ℃冰箱保存备用。
培养基:LB液体培养基,准确称取10.0 g胰蛋白胨、5.0 g酵母浸膏、10.0 g氯化钠混合均匀,加入1000 mL超纯水溶解,调pH 7.2~7.4,121 ℃高压蒸气灭菌30 min,放置空气中冷却,4 ℃冰箱保存备用。
Thermometric 3114/3236 TAM Air Isothermal Calorimeter8通道微量量热仪(美国TA公司)。
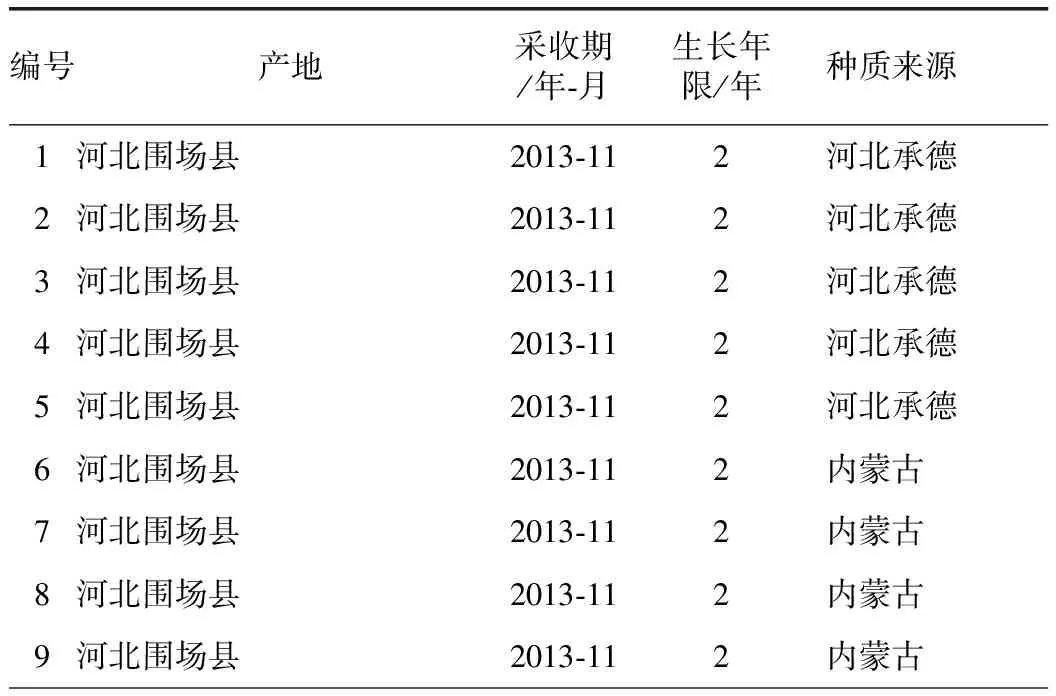
表1 51份黄芩样品信息
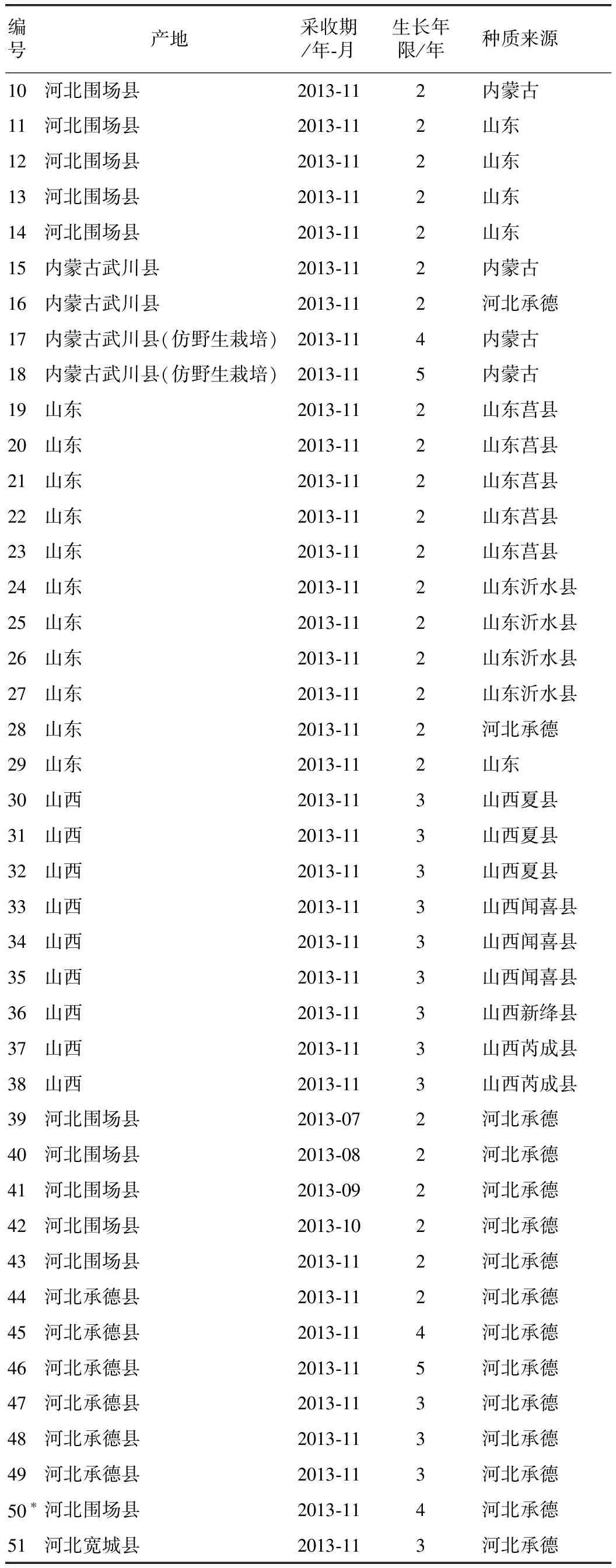
表1(续)
注:*表示黄芩栓皮。
2 方法
2.1 微量量热法实验条件
根据前期技术经验,本研究确定不同黄芩样品生物热动力学测定条件:37 ℃等温条件下,培养至3~5代的大肠杆菌(菌号为44103),接种量为1×106个·mL-1,LB培养基,安瓿法(2.5 mL)。同时本研究在以上的实验条件下,对微量量热法进行了方法学考察。
2.2 不同检测通道等同性考察
本部分实验测定在上述相同条件下,以大肠杆菌为生物模型,LB为培养基对置于TAM Air微量量热仪8个通道中的大肠杆菌代谢同时进行监测,记录热谱曲线,并进行各热谱曲线相似度(S)评价。结果表明,不同通道所测得的热谱曲线相似度均大于0.8,说明在本实验条件下TAM Air微量量热仪的各个通道所测定结果具有高度的等同性。
2.3 生物热动力学参数的抽提
功率-时间(P-t)曲线和对数lnP-t曲线的获取:将安瓿瓶放入恒温于37 ℃的八通道微量量热仪中,仪器自动跟踪记录大肠杆菌生长代谢过程中的热功率变化,记录结束提取实验时间和热功率数据,使用Origin 8.0软件(OriginLab公司,美国),以时间为横坐标,功率为纵坐标作图,得到P-t曲线(Ⅰ)和对数lnP-t曲线(Ⅱ)。
大肠杆菌代谢分期和生长速率常数k:正常大肠杆菌的生长代谢过程由P-t曲线形状可以看出分为4个时期:第一指数生长期(a-b)、停滞期(b-c)、第二指数生长期(c-d)和衰亡期(d-e)。同时,从P-t曲线中得到反映细菌生长代谢的热力学参数:细菌在指数生长期的最大产热功率P1、P2,达峰时间t1、t2及不同时期的细菌代谢热Q。
通过lnP-t曲线,得到关于指数生长期的lnP与t的线性方程:
lnP=lnP0+kt
(1)
式中:P为t时所对应的产热功率,P0为t=0时所对应的产热功率。
从方程(1)中得到细菌在指数生长期生长速率常数k1、k2。
抑菌率I计算公式为:
I=[(t2-t0)/t0]×100%
(2)
式中:t0为空白组第二指数生长期达峰时间,t2为给药组第二指数生长期的达峰时间。
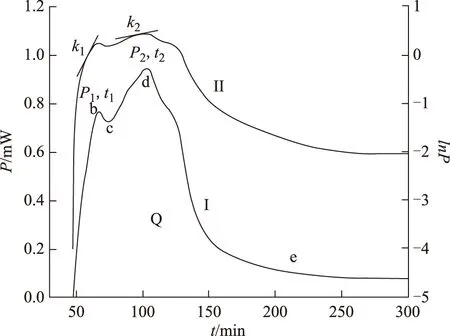
图1 大肠杆菌生长代谢的热谱曲线:P-t曲线(Ⅰ)和对数lnP-t曲线(Ⅱ)(T=37 ℃,n=3)
2.4 数据统计
使用SPSS 19.0对样品热动力学参数进行单因素方差分析,用Excel 2013进行描述统计和统计图形的制作。
3 结果
3.1 黄芩样品剂量的确定
以1号样品为研究对象进行剂量考察。精密称取1号样品270 mg,在无菌条件下,加入18 mL的LB培养基混合均匀,使供试品母液终浓度为15 mg·mL-1。配制接种用大肠杆菌培养液25 mL。将药液、大肠杆菌培养液、培养基按表2体积数加入安瓿瓶中,使终体积10 mL。加盖瓶塞,密封,混合均匀,将安瓿瓶转移至微量量热仪通道中,跟踪记录大肠杆菌生长热谱曲线,见图 2。
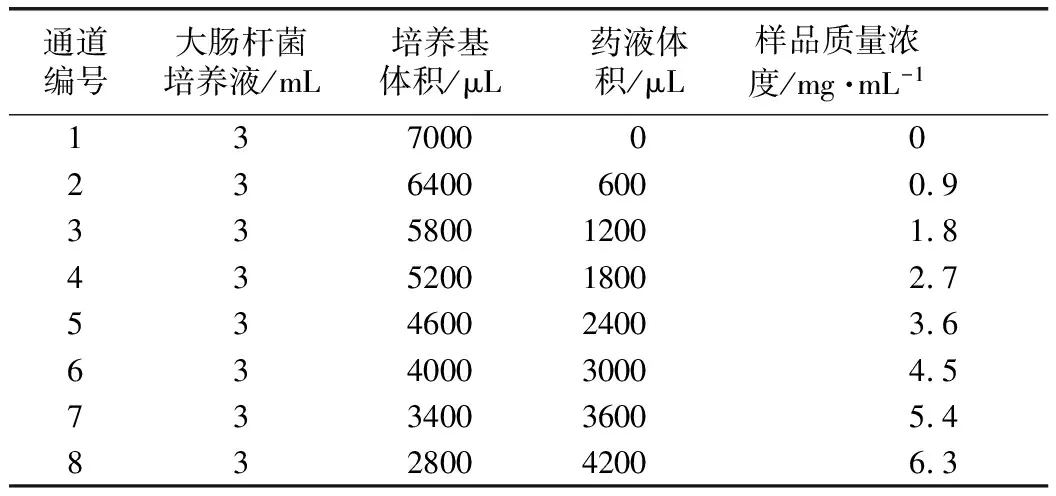
表2 八通道加入体积数和样品浓度

图2 不同浓度黄芩1号样品作用下大肠杆菌生长代谢热谱曲线
从图2可以看出,在0.9~6.3 mg·mL-1内,黄芩1号样品可明显抑制大肠杆菌生长代谢。以空白组为参照,0.9、1.8、2.7、3.6、4.5、5.4、6.3 mg·mL-17个不同质量浓度样品对大肠杆菌的抑制率依次为11.5%、17.7%、22.3%、26.1%、30.8%、36.1%、41.5%。从抑制率可以看出,随着药物剂量增加,对大肠杆菌生长代谢的抑制作用不断增强。为避免药物浓度过大而出现假阳性现象,控制抑制率在合理范围内(相当于1号样品质量浓度5 mg·mL-1),结合药材浸膏得率,拟选取相当于原药材110 mg进行不同产地黄芩样品抑制大肠杆菌活性对比研究。
3.2 不同黄芩样品抑菌活性比较
3.2.1 不同黄芩样品抑菌活性总体比较 将处理好的黄芩样品移到微量量热仪通道中,仪器自动记录热谱曲线,如图 3。不同样品的抑菌率见表 3。

表3 不同产地黄芩样品作用下的大肠杆菌生物热动力学参数(T=37 ℃,n=3)
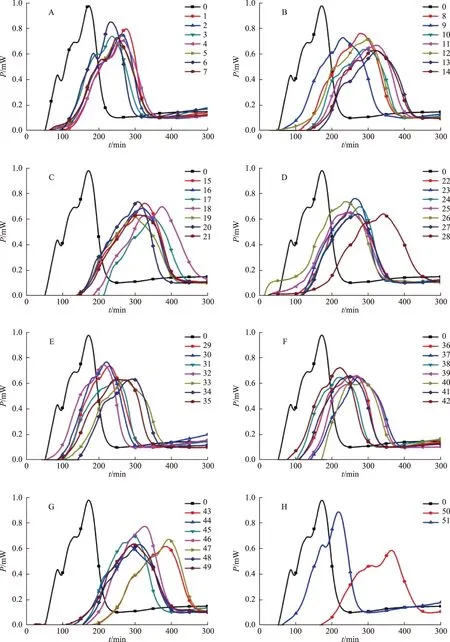
注:A.1~7号样品;B.8~14号样品;C.15~21号样品;D.22~28号样品;E.29~35号样品;F.36~42号样品;G.43~49号样品;H.50~51号样品。图3 相同剂量不同黄芩样品作用下大肠杆菌的生长代谢热谱曲线(T=37 ℃,n=3)
结果发现,不同产地黄芩大肠杆菌抑菌率在24.3%~129.5%,各样品抑菌活性存在较大差异。
3.2.2 不同栽培区黄芩药材的抑菌活性对比 对来自河北承德、内蒙古武川、山东莒县和山西运城的黄芩药材进行抑菌活性对比发现(见图 4):承德样品和武川样品的抑菌活性均显著高于莒县和运城样品,承德样品分别比莒县和运城样品高出69.14%和113.69%。
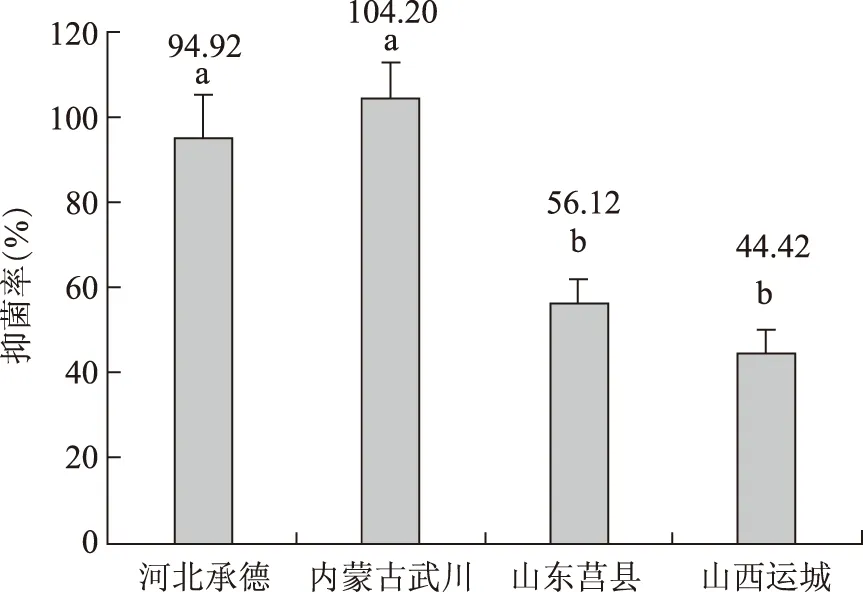
注:a、b表示不同样品彼此之间的差异,P <0.05;下同。图4 不同来源黄芩药材抑菌活性比较(n=3~10)
3.2.3 不同采收期黄芩药材抑菌活性对比 本实验中的黄芩材料来源于河北承德黄芩基地。于2012年4月份种子直播,2013年7月中旬—11月中旬,分5次分别取样,制备提取物用于生物活性测定。结果发现,总体上7—11月份黄芩提取物抑菌活性出现了先下降后增加的趋势,8—10月份抑菌活性逐渐降到最低,在11月份最高(见图5)。
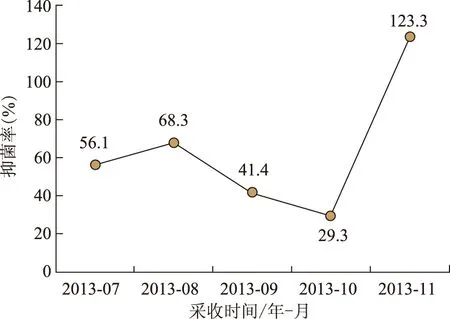
注:分别取1份混合样品,每份样品30~40株。图5 不同采收时间黄芩药材抑菌活性比较
3.2.4 不同生长年限黄芩药材抑菌活性对比 本实验的黄芩材料分别取自河北承德县和内蒙古武川县的黄芩药材商品田,药材提取物用于生物活性测定。结果发现,总体上两个区域黄芩药材的抑菌活性均呈现随药材生长年限增加而增强的趋势;2年生药材的抑菌活性分别增加了32.55%和36.20%(见图 6)。
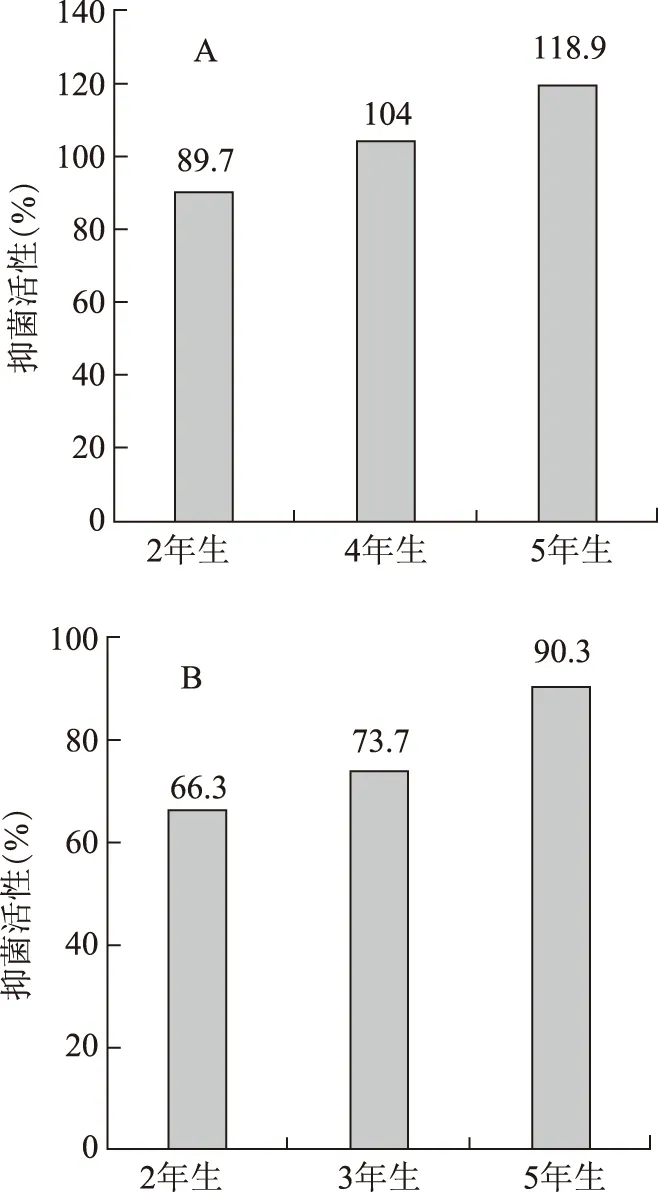
注:A.内蒙古样品;B.河北承德样品;每份样品为30~40株的混合样品。图6 不同生长年限黄芩药材抑菌活性比较
3.2.5 黄芩栓皮和黄芩药材的抑菌活性对比 对比黄芩栓皮和黄芩根部的抑菌活性发现(见图 7),所有测试样品抑菌活性在24.3%~129.5%,黄芩药材平均抑菌率为62.96%,黄芩外栓皮为111.90%,高出药材平均值的77.73%。
3.2.6 不同种质对黄芩抑菌活性的影响 对不同种质黄芩2年生药材进行抑菌活性对比分析,结果发现:在承德实验区中(见图8A),河北种质和内蒙古种质抑菌活性无差异,山东种质抑菌活性显著高于河北和内蒙古种质;在内蒙古实验区中(见图8C),承德种质和内蒙古种质黄芩抑菌活性接近。在山东实验区中(见图8B),承德种质抑菌活性高出山东近2倍。
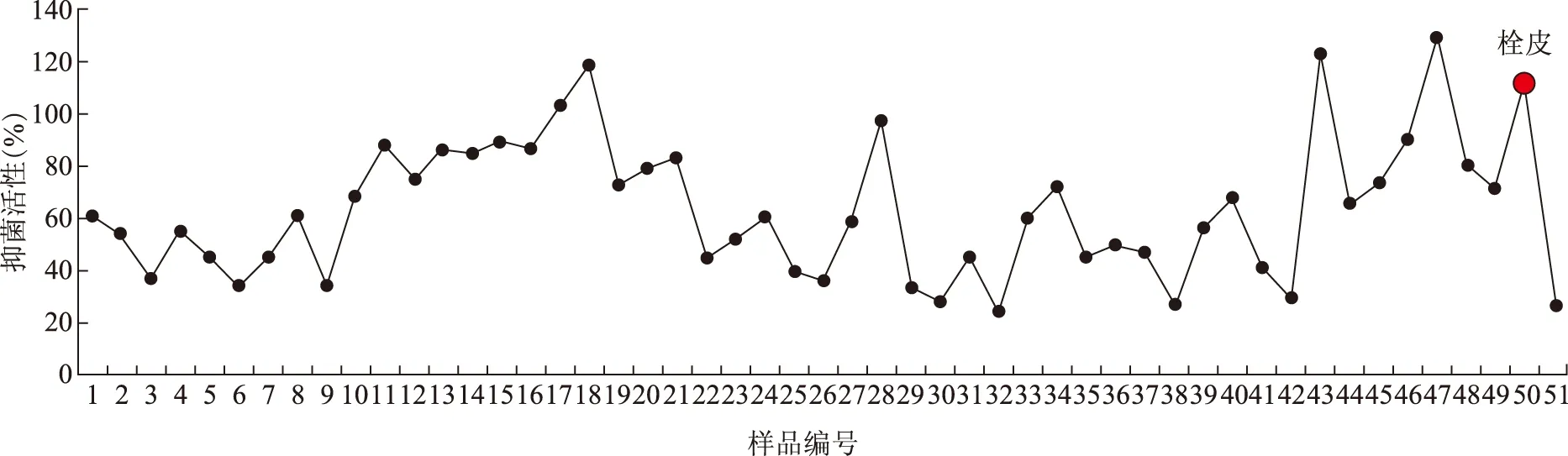
注:每份样品为30~50株的混合样品。图7 不同生长年限黄芩药材抑菌活性比较

注:A.承德试验区(n=4);B.山东试验区;C.内蒙古试验区;每个试验区均取1份样品,每份样品为30~40株的混合样品。图8 不同种质黄芩抑菌活性比较
4 结论与讨论
本研究采用微量量热法考察了不同来源黄芩抑菌活性的差异,对不同黄芩的抑菌活性进行对比,得出如下结论:1)不同来源黄芩药材的抑菌活性存在较大差异;2)河北和内蒙古样品的抑菌活性显著高于山东和山西样品;3)不同采收期黄芩抑菌活性出现了先下降后增加的趋势,11月份抑菌活性最强;4)黄芩药材的抑菌活性随着药材生长年限的增加而出现增强;5)不同试验区中不同种质黄芩抑菌活性差异较大,黄芩移栽到不同栽培区后,其抑菌活性出现了显著的增加,其抑菌活性可能与纬度跨越有关。
基于微量量热法的中药生物热活性检测技术具有实时在线、灵敏、准确、高效、经济、普适性好的特点,符合中药药效评价的客观现实和发展方向,在理论上比现行的中药指标性成分定性定量分析具一定优势[2,19-26]。如采用微量量热法研究粉防己中防己碱金属配合物的生物活性[27],对甘草中的多糖组分进行了抑菌活性研究[28],另外在茵陈、麻黄、草乌、麦冬、板蓝根、人工牛黄等中药材研究上也有应用,研究人员认为微量量热法是一种有效的体外筛选药物的方法,可以指导药物设计、揭示药物与微生物间的相互作用机制,并且在指导临床上合理使用抗菌药等方面具有重要的应用和理论价值[29-34]。
本研究试图探索一种基于化学成分与临床药效评价之间的技术方法,解决一些中药材研究过程的共性问题。包括如何更科学地指导中药材的适时采收,对不同产地和种质的药材进行身份鉴定,对不同生长年限的药材进行区分,也包括用于建立道地药材评价体系等。
总之,从某种意义上来讲,生物活性测定与化学成分测定相比,在某种程度上体现了中药的整体效应,符合中医药的整体观[9],可作为中药药效评价的“预评价”方法,对于构建中药材道地性研究评价体系具有一定的借鉴作用。
[1] Xie C L,Tang H K,Song Z H,et al.Microcalorimetric study of bacterial growth[J].Thermochimica Acta,1988,123(88):33-41.
[2] 胡艳军,蒋风雷,欧阳宇,等.微量热法在药物活性评价中的应用[J].中国科学:化学,2010,40(9):1276-1285.
[3] Kong W J,Wang J B,Jin C,et al.Effect of emodin on Candida albicans growth investigated by microcalorimetry combined with chemometric analysis[J].Appl Microbiol Biotechnol,2009,83(6):1183-1190.
[4] 赵艳玲,山丽梅,金城,等.基于生物热活性表达的中药板蓝根品质评价研究[J].中药材,2008,31(5):743-747.
[5] 马莉,曹俊岭,廖庆文,等.微量量热法对不同产地板蓝根药材品质的评价[J].中国药房,2009,20(30):2324-2326.
[6] 张学儒,王伽伯,肖小河,等.大黄药材两种化学型对金葡菌生长代谢热动力学变化的影响[J].药学学报,2010,45(9):1144-1148.
[7] 周丹蕾,鄢丹,李宝才,等.微量量热法研究天然虫草和人工虫草对大肠杆菌生长代谢的影响[J].药学学报,2009,44(6):640-644.
[8] 王磊,李建宇,袁海龙,等.基于微量量热法的不同种质忍冬质量评价的初步研究[J].解放军药学学报,2010,1(2):133-136.
[9] 代春美,肖小河,王迪,等.微量热法对不同生长年份黄连品质的评价[J].中草药,2006,37(2):205-209.
[10] 赵艳玲,王伽伯,肖小河.微量热法研究板蓝根的生物热力学特征[J].中草药,2007,38(2):193-196.
[11] 张甜甜,张媛媛,陈红鸽,等.基于微量量热法的金银花抗菌活性部位初筛[J].解放军药学学报,2011,7(3):205-207.
[12] 宋旦哥,孟庆刚.黄芩药理作用研究述评[J].中华中医药学刊,2009,53(8):1619-1622.
[13] 李晨睿,牛银波,潘亚磊,等.黄芩药动学研究进展[J].中国药理学通报,2013,29(8):1048-1053.
[14] 刘云波,郭丽华,邱世翠,等.黄芩体外抑菌作用研究[J].时珍国医国药,2002,13(10):596.
[15] 肖丽和,王红燕,李发美,等.不同来源黄芩药材HPLC指纹图谱比较[J].沈阳药科大学学报,2004,21(1):28-31.
[16] 薛黎明,秦雪梅,张丽增.不同产地黄芩药材的黄芩苷含量测定及指纹图谱研究[J].中成药,2008,30(1):10-13.
[17] 常小平,王影.不同产地黄芩中主要有效成分含量比较[J].河南中医,2010,30(12):1176-1177.
[18] 宋旦哥.基于不同来源的黄芩物质基础与其药效学相关性研究[D].北京:北京中医药大学,2010.
[19] 肖小河,王永炎,刘义.从热力学角度审视和研究中医药[C]//中华中医药学会糖尿病分会.中医药学术发展大会论文集,2005:168-169.
[20] 代春美,肖小河,金城,等.微量热分析在中医药研究中的应用[J].中草药,2005,36(10):139-141.
[21] 李月生,夏祥翔,李新怀,等.微量热技术在生命科学研究中的应用[J].化工时刊,2007,21(7):64-67.
[22] 高誉珊.基于微量量热技术的典型寒热中药生物热动力学研究[D].北京:北京中医药大学,2014.
[23] 张萍.肖小河研究员中医药学术思想研究[D].北京:中国人民解放军医学院,2012.
[24] 王建涛.中药中有效成分生物活性的微量量热法研究[D].曲阜:曲阜师范大学,2007.
[25] 肖小河,金城,鄢丹,等.中药大质量观及实践[J].中草药,2010,41(4):505-508.
[26] 赵艳玲,肖小河,刘义.热力学理论在中医药研究中的应用与发展[J].解放军药学学报,2005,21(4):291-293.
[27] 李晶,毕红艳,杜保同,等.微量热法测定粉防己碱金属配合物的抑菌性[J].应用化学,2011,28(8):897-900.
[28] 刘莲,林贵梅,邵伟,等.微量量热法研究甘草多糖对细菌代谢作用的影响[J].药物生物技术,2011,18(1):48-51.
[29] 李晓霞,潘晓茹,吴莉莉,等.麦冬对大肠杆菌代谢作用的微量量热法研究[J].山东中医药大学学报,2001,35(4):307-309.
[30] 聂毅,刘晓静,张洪林,等.微量量热法研究草乌生物碱对细菌的代谢作用[J].曲阜师范大学学报(自然科学版),2003,29(1):82-84.
[31] 于游,孙玉希,卢海峰,等.微量量热法研究中药麻黄及其有效成分对大肠杆菌的抑制作用[C]//中国药学会药物分析杂志.2003年药物分析论坛“热分析在药物分析中的应用”专题学术研讨会论文集,2003:36.
[32] 于游,聂毅,孙玉希,等.微量量热法研究中药茵陈及其有效成分对大肠杆菌的代谢作用[J].曲阜师范大学学报(自然科学版),2004,30(1):72-74.
[33] Zang Q C,Wang J B,Kong W J,et al.Searching for the main anti-bacterial components in artificial Calculus bovis using UPLC and microcalorimetry coupled with multi-linear regression analysis[J].J Sep Sci,2011,34(23):3330-3338.
[34] Kong W,Zhao Y,Shan L,et al.Microcalorimetric studies of the action on four organic acids in Radix isatidis on the growth of microorganisms[J].Sheng Wu Gong Cheng Xue Bao,2008,24(4):646-650.
ComparativeStudyonBacteriostaticActivityofdifferentScutellariabaicalensisBasedonMicrocalorimetricTechnique
ZENG Yan1,GUO Lanping2,WANG Jiyong1*,HUANG Luqi2*
(1.ChinaNationalTraditionalChineseMedicineCorporation,Beijing100195,China; 2.NationalResourceCenterforChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China)
Objective: To study the bacteriostatic activity of differentScutellariabaicalensisbased on the microcalorimetric technique.MethodsThe effects of differentS.baicalensison the thermokinetics parameters ofEscherichiacolimetabolism were studied by using the technology of microcalorimetric, and the differences of bacteriostatic activity ofS.baicalensison different cultivation area, harvesting time, growing year and germplasm were compered.ResultsThe results showed the differences about thermokinetics parameters among the differences cultivation area. The bacteriostatic activity changed between 24.3% and 129.5%, and the samples root from Hebei and Neimeng showed stronger bacteriostatic activity than those from Shangdong and Shangxi. It exhibited the first declining later increasing of bacteriostatic activity with the harvesting time changing (from the July to the November), and the strongest bacteriostatic activity occurred in November. There were also the trends of gradually increase on the bacteriostatic activity with the increasing years of planting (from two years to five years). The experimental result of multi-site testes showed a big difference among the different plant germplasm, it should be a relevance between bacteriostatic activity and the spanning of latitude across.ConclusionThere exist some differences among these samples from difference cultivated area and the harvesting time, growing years and germplasm should also affect the bacteriostatic activity. It is concluded that the method based on the microcalorimetric technique could be used to distinguish the differentS.baicalensis, and is more convenient and faster, also provide more information for distinguish pharmacological activity of different drug sources.
ScutellariabaicalensisGeorgi; microcalorimetric; biological activity; quality distinguish
10.13313/j.issn.1673-4890.2017.9.010
中医药行业科研专项(201407005-5,201507002);中国中药公司博士后专项(2012);江苏省中药资源产业化过程协同创新中心项目(2013);
*
王继永,研究员,研究方向:中药资源,E-mail:wangjiyong75@163.com;黄璐琦,中国工程院院士,研究员,研究方向:中药资源,E-mail:huangluqi01@126.com
2015-03-02)
