乙酸致内脏痛模型小鼠杏仁中央核c-fos表达和动物焦虑样行为的影响
2017-12-25,,,,,,,*
,,,, ,, ,*
(1.南华大学人体解剖学教研室,湖南 衡阳421001;2.南华大学生理学教研室)
·基础医学·
乙酸致内脏痛模型小鼠杏仁中央核c-fos表达和动物焦虑样行为的影响
李林1,曹文宇1,刘政海1,曾佳玉1,徐杨2,张仁丽1,万炜1,向宇燕1*
(1.南华大学人体解剖学教研室,湖南 衡阳421001;2.南华大学生理学教研室)
目的探讨乙酸所致内脏痛小鼠杏仁中央核(CeA)c-fos的表达时程变化及其与小鼠焦虑样行为的关系。方法将雄性昆明小鼠随机分为生理盐水组、乙酸致内脏痛1 h组、乙酸致内脏痛2 h组以及乙酸致内脏痛24 h组,观察各组动物1 h内腹壁收缩次数,采用旷场实验对生理盐水组、乙酸致内脏痛2 h组及乙酸致内脏痛24 h组动物焦虑样行为进行检测,行为学检测结束后,采用免疫组织化学法分别检测此3组动物杏仁中央核c-fos的表达变化。结果内脏痛评分表明,与生理盐水组比较,乙酸致内脏痛1 h组动物腹壁收缩次数明显增加(P<0.001),而乙酸致内脏痛2 h组及乙酸致内脏痛24 h组动物腹壁收缩次数无明显变化(P>0.05);旷场实验结果表明,与生理盐水组比较,乙酸致内脏痛2 h组和乙酸致内脏痛24 h组中央格停留时间及穿越中央格子数均明显减少(P<0.001),而三组动物活动度间差异无统计学意义(P>0.05)。免疫组化结果表明,与生理盐水组比较,乙酸致内脏痛2 h组及乙酸致内脏痛24 h组动物杏仁中央核c-fos表达增加(P<0.05)。结论乙酸致内脏痛小鼠焦虑情绪持续的时间远远长于疼痛本身,其机制可能与杏仁中央核神经元过度活化有关。
内脏痛; 杏仁中央核; c-fos; 焦虑
疼痛是一种与组织损伤或潜在损伤相关的不愉快的主观感觉和情感体验,它包括感觉和情感两个层面:感觉层面主要指对疼痛程度的感受,情感层面则主要包括疼痛引起的焦虑样或抑郁样行为等,其中疼痛相关的负面情绪的影响比疼痛本身的危害更大[1-2]。内脏痛是病理性疼痛最常见的一种形式,常由机械性牵拉、痉挛、缺血和炎症等刺激所致,但其定位不明确,患者常伴有不安、恐惧、焦虑样行为[3-4],然而,内脏痛引起个体焦虑行为改变的神经生物学机制仍不清楚。杏仁中央核(central nucleus of amygdala,CeA)是情感和疼痛感觉信号组成部分的一个集成中心,参与了疼痛等伤害性刺激诱导负性情绪的调节[5-6]。c-fos是一种存在于正常神经细胞核内的即刻早期基因,c-fos的表达与中枢对各种伤害性刺激的应答有密切关系,c-fos表达的数量与所受到的刺激强度正相关,是研究脑区激活的经典标记物[7]。本文旨在探讨乙酸所致内脏痛小鼠杏仁中央核c-fos表达的时程变化及其与动物焦虑行为之间的关系。
1 材料与方法
1.1动物雄性昆明小鼠48只,体重22~25 g(湖南斯莱克景达提供)随机分成生理盐水组,乙酸致内脏痛1 h组、2 h组、24 h组,每组12只。所有小鼠均在本实验室动物房适应性饲养7天,室温控制在(24±2) ℃,12 h昼夜节律(光照时间08∶00-20∶00),自由饮水与进食。
1.2动物分组
1.2.1 内脏痛模型的建立 乙酸致内脏痛1 h组(one hour after acetic acid-elicited visceral pain,AA-1h )、乙酸致内脏痛2 h组(two hour after acetic acid-elicited visceral pain,AA-2 h )以及乙酸致内脏痛24 h组(twenty-four hour after acetic acid-elicited visceral pain,AA-24 h )通过腹腔注射1.0%乙酸10 mL/kg建立内脏痛模型组[8],生理盐水组腹腔注射等量生理盐水,AA-1h、AA-2 h及AA-24 h分别指乙酸腹腔注射后第1 h、第2 h以及第24 h。将小鼠单独置于白色清洁饲养箱内,记录所有动物1 h内的腹壁收缩次数。小鼠出现腹部收内凹、臀部歪扭和后肢伸张记为腹壁收缩1次。
1.2.2 焦虑行为检测 将小鼠预适应实验环境1 h后逐一置于旷场中央格区让其自由活动5 min,并用摄像机记录小鼠整个活动过程。采用单盲法观察记录小鼠中央格运动时间、中央格穿越格子数、总穿越格子数。每只小鼠检测完毕后,均清洁旷场并予75%酒精清除实验箱内气味。实验中小鼠穿越格子总数代表小鼠活动度,中央格穿越格子数越多、中央格停留时间越长说明其焦虑程度越轻[3]。
1.2.3 免疫组织化学染色 行为学检测结束后,动物立即给予10% 水合氯醛深度麻醉,先用生理盐水灌注,再用 4 ℃ 的4% 多聚甲醛固定液固定,取脑于 4 ℃冰箱后固定过夜,依次予15%、30%蔗糖充分沉糖后,冰冻切片机行连续冠状切片,片厚30 μm。取一套切片依次经3%过氧化氢溶液处理及0.01%mmol/L PBS漂洗三遍后,5%羊血清室温封闭2 h,加入羊抗兔多克隆抗体c-fos(santa cruz,1∶1 000)室温下孵育2 h,然后转至4 ℃冰箱过夜。0.01 mmol/L PBS冲洗,10 min×3次;加入山羊抗兔Ig G(1∶200),室温下孵育2 h;0.01 mmol/L PBS冲洗,10 min×3次;加入过氧化酶标记的ABC复合物(A液和B液比例为1∶200,提前30 min配制)室温下孵育2 h;0.01 mmol/L PBS冲洗,10 min×3次;DAB显色。切片常规脱水、透明和封片,400倍光学显微镜下进行观察。光学显微镜采集图像(MC55广东明美科技公司)。
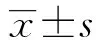
2 结 果
2.1注射乙酸后不同时间点动物内脏痛评分AA-1h组动物腹部剧烈疼痛,腹壁收缩次数显著增加,而生理盐水组、AA-2 h组及AA-24 h组均仅有极少数扭体行为发生(图1)。统计结果表明,AA-1h组腹壁收缩次数明显多于生理盐水组(P<0.001),而AA-2 h组及AA-24 h组与生理盐水组比较腹壁收缩次数间差异无显著性(P>0.05)。
2.2注射乙酸后不同时间点动物焦虑行为评分
旷场实验检测了生理盐水组、AA-2 h组和AA-24 h组动物焦虑情绪(图2)。与生理盐水组相比,AA-2 h组和AA-24 h组小鼠在旷场中央格穿越格子数明显减少(P<0.001),AA-2 h组和AA-24 h组小鼠在旷场中央格停留的时间也明显减少(P<0.001),但各组动物在旷场中穿越的总格子数无差异(P>0.05)。
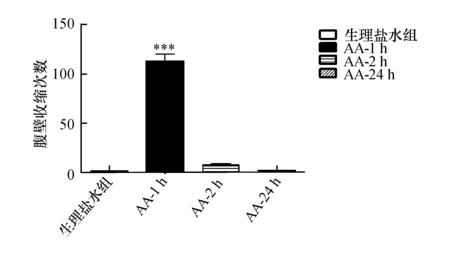
图1 乙酸或生理盐水对腹痛的时程影响与生理盐水组比较,***P<0.001

图2 生理盐水或乙酸对小鼠焦虑行为的影响A:生理盐水组、AA-2 h组及AA-24 h组中央格停留时间;B:生理盐水组、AA-2 h组及AA-24 h组中央格穿越格子数;C:生理盐水组、AA-2 h组及AA-24 h组穿越总格子数. 与生理盐水组比较,***P<0.001;与生理盐水组比较,**P<0.01
2.3注射乙酸后不同时间点小鼠杏仁中央核c-fos表达变化免疫组化结果显示(图3),与生理盐水组比较,AA2 h组和AA24 h组小鼠杏仁中央核c-fos阳性细胞数明显增加(P<0.05)。而AA24 h组与AA2 h组比较c-fos阳性细胞数明显减少(P<0.01),杏仁中央核在内脏痛消失后仍然处于激活状态。

图3 生理盐水或乙酸对杏仁中央核c-fos 表达的影响A、B、C为别为生理盐水组、AA-2 h组及AA-24 h组杏仁中央核c-fos免疫组化结果,D为免疫组化结果直方图,与生理盐水组比较,***:P<0.001;与生理盐水组比较, *:P<0.05;与AA-2 h组及生理盐水组比较,##:P<0.01,bar=100 μm
3 讨 论
内脏痛是临床常见症状,随着研究的深入,人们对内脏痛的认识也逐步加深。乙酸致内脏痛是指通过腹腔注射乙酸引起腹腔内脏器官出现化学性炎症,使动物产生内脏疼痛。尽管存在由于乙酸可能造成腹壁紧张,导致躯体痛混杂的缺点,但这类模型操作方便,避免了麻醉药对模型的影响,疼痛行为反应即时出现,变化明显。通过Schmauss C[9]提出的评分方法能方便的量化疼痛行为指标,是目前应用较广泛的内脏痛模型之一。本课题组前期实验用大鼠复制了这一疼痛模型[10];本实验中,在小鼠腹腔注射乙酸后1 h内腹壁收缩次数明显增加,同样建立了炎性内脏痛模型。
炎症痛的同时存在焦虑情绪,但疼痛的存在会影响焦虑行为的检测。因此,本实验在注射AA后2 h、24 h检测了小鼠的疼痛行为,发现这两个时间点动物的腹壁收缩次数显著减少,提示动物的内脏痛消失,这一结果与文献报道及本课题组之前的研究相一致[3,10]。进一步在旷场实验中,注射乙酸后2 h动物无论是在中央格停留的时间及中央格穿越的次数明显减少,但动物的活动度无明显改变,提示动物在内脏痛消失后仍然出现焦虑样行为,与早期报道的文献相一致[3];为了观察动物焦虑情绪持续的时间,采用旷场实验检测动物在注射乙酸后24 h的焦虑样行为,结果表明模型小鼠在中央格停留的时间及中央格穿越的格子数仍然显著少于生理盐水对照组,提示内脏痛伴随的焦虑情绪远远长于疼痛本身,出现疼痛与情绪相互分离的现象。疼痛与情绪相分离这一现象在躯体疼痛,如福尔马林疼痛、切割痛中已有报道[11-12]。
c-fos是一种存在于正常神经细胞核内的即刻早期基因,c-fos的表达与中枢对各种伤害性刺激的应答有密切关系,它的表达可反应神经元功能处于激活状态,被认为是神经元活化的标志物[13],也就是说表达c-fos蛋白的神经元可能参与了这种刺激信息的处理过程。早期的研究指出,乙酸诱导的内脏痛大鼠蓝斑核、孤束核、下丘脑室旁核c-fos的表达增加,可以持续至乙酸注射后6 h[14]。与生理盐水组相比,AA-2 h组、AA-24 h组动物杏仁中央核c-fos阳性细胞数目均显著增加,提示杏仁中央核神经元处于激活状态。与生理盐水组相比,AA-2 h组、AA-24 h组动物在旷场实验中表现出焦虑样行为,这可能是与杏仁中央核神经元过度激活有关。在伤害性刺激结束后,杏仁中央核的激活被认为是诱导动物出现负性情绪的重要原因[5-6]。所谓表观遗传是指:基因表达发生了可遗传的改变,但序列却没有发生变化。甲基化、组蛋白修饰、染色质重塑及非编码调控机制共同构成了表观遗传涉及的机制。表观遗传修饰在即早基因表达调控中具有重要的作用,研究表明c-fos基因甲基岛甲基化水平的降低可能与其表达上调密切相关,并且参与动物行为的调节[15]。因此,推测在乙酸诱导内脏痛小鼠的焦虑样行为产生的过程中,杏仁中央核的活化可能起到了关键的调控作用,其具体的机制仍然有待于进一步探讨。
[1] Cao H,Gao YJ,Ren WH,et al.Activation of extracellular signal-regulated kinase in the anterior cingulate cortex contributes to the induction and expression of affective pain[J].J Neurosci,2009,29(10):3307-3321.
[2] de CWA,Craig KD.Updating the definition of pain[J].Pain,2016.
[3] Zhong XL,Wei R,Zhou P,et al.Activation of anterior cingulate cortex extracellular signal-regulated kinase-1 and -2 (ERK1/2) regulates acetic acid-induced,pain-related anxiety in adult female mice[J].Acta Histochem Cytochem,2012,45(4):219-225.
[4] de la Puente B,Romero-Alejo E,Vela J M,et al.Changes in saccharin preference behavior as a primary outcome to evaluate pain and analgesia in acetic acid-induced visceral pain in mice[J].J Pain Res,2015,8:663-673.
[5] Jiang H,Fang D,Kong LY,et al.Sensitization of neurons in the central nucleus of the amygdala via the decreased GABAergic inhibition contributes to the development of neuropathic pain-related anxiety-like behaviors in rats[J].Mol Brain,2014,7:72.
[6] Ji G,Li Z,Neugebauer V.Reactive oxygen species mediate visceral pain-related amygdala plasticity and behaviors[J].Pain,2015,156(5):825-836.
[7] Dimova V,Horn C,Parthum A,et al.Does severe acute pain provoke lasting changes in attentional and emotional mechanisms of pain-related processing A longitudinal study[J].Pain,2013,154(12):2737-2744.
[8] Satyanarayana P S,Jain N K,Singh A,et al.Isobolographic analysis of interaction between cyclooxygenase inhibitors and tramadol in acetic acid-induced writhing in mice[J].Prog Neuropsychopharmacol Biol Psychiatry,2004,28(4):641-649.
[9] Yaksh C S A T.In Vivo studies on spinal opiate receptor systems mediating antinociception.Il.pharmacological profiles suggesting a differential association of mu,delta and kappa receptors with visceral chemical and cutaneous thermal stimuli in the rat1[J].J Pharmacol Exp Ther,1984,228(1).
[10] 张仁丽,万炜,刘红,等.三七总皂苷预处理对炎性内脏痛大鼠脊髓背角谷氨酰胺合成酶表达的影响[J].解剖学报,2015,46(1):20-24.
[11] Luo C,Zhang YL,Luo W,et al.Differential effects of general anesthetics on anxiety-like behavior in formalin-induced pain: involvement of ERK activation in the anterior cingulate cortex[J].Psychopharmacology (Berl),2015,232(24):4433-4444.
[12] Dai R P,Li C Q,Zhang J W,et al.Biphasic activation of extracellular signal-regulated kinase in anterior cingulate cortex distinctly regulates the development of pain-related anxiety and mechanical hypersensitivity in rats after incision[J].Anesthesiology,2011,115(3):604-613.
[13] Wang Z,Bradesi S,Maarek J M,et al.Regional brain activation in conscious,nonrestrained rats in response to noxious visceral stimulation[J].Pain,2008,138(1):233-243.
[14] Sinniger V,Porcher C,Mouchet P,et al.c-fos and CRF receptor gene transcription in the brain of acetic acid-induced somato-visceral pain in rats[J].Pain,2004,110(3):738-750.
[15] Saunderson EA,Spiers H,Mifsud KR,et al.Stress-induced gene expression and behavior are controlled by DNA methylation and methyl donor availability in the dentate gyrus[J].Proc Nat Acad Sci USA,2016,113(17):4830-4835.
Theexpressionofc-fosinthecentralnucleusofamygdalaanditsrelationshipwithvisceralpainrelatedanxiety-likebehaviourinmice
LI Lin,CAO Wenyu,LIU Zhenghai,et al
(DepartmentofClinicalAnatomy,SchoolofMedicine,UniversityofSouthChina,Hengyang,421001Hunan,China)
ObjectiveTo explore the expression of c-fos in the central nucleus of amygdala (CeA) and its relationship with acetic acid-elicited visceral pain (AAVP)related anxiety behavior in mice.MethodsMale Kunming mice were randomly divided into normal saline (NS)group and one hour after acetic acid-elicited visceral pain (AA-1h)group,two hours after acetic acid-elicited visceral pain (AA-2 h)group and twenty-four hours after acetic acid-elicited visceral pain (AA-24 h)group,visceral pain behaviours of all animals were measured by Writhing test while the anxiety-like behavior of NS group and AA-2 h group and AA-24 h group animals were determined by open field test (OFT).After the behavior test,the three group animals were scarified for the determination of c-fos in the CeA by immunohistochemistry.ResultsCompared to NS group, AA-1h group animals showed significantly increased number of writhes(P<0.001),while no statistics difference between NS group and AA-2 h or AA-24 h group(P>0.05,respectively) .In the OFT,AA-2 h or AA-24 h group showed significantly decreased time and number of crossing in the center compared with the NS group(P<0.001,respectively),while no difference in the locomotive activity was found among the three groups(P>0.05,respectively).The results of immunohistochemistry showed that compared to NS group,AA-2 h or AA-24 h group showed significantly increased number of c-fos positive cell in the CeA(NS vs AA-2 h,P<0.001,NS vs AA-24 h,P<0.05).ConclusionAA treatment leads to anxiety-like behavior in the mice even after the visceral pain disappeared,which might be due to the over-activated neuron in the CeA.
visceral pain; central nucleus of amygdala; c-fos;anxiety
10.15972/j.cnki.43-1509/r.2017.02.007
2016-10-08;
2017-01-10
湖南省教育厅重点项目(编号:12A119) ,南华大学博士科研启动基金(编号:2015XQD28),湖南省(南华大学)研究生科研创新项目(编号:CX2016B479 ),衡阳市科技发展计划项目(编号:2015KJ19).
*通讯作者,E-mal:xyy6887@163.com.
R322.81
A
蒋湘莲)
