PTEN蛋白在胃癌中的表达及临床病理意义
2017-12-25,,,,3,,,*
, , , ,3, , , *
(1.南华大学肿瘤研究所,湖南省胃癌研究中心,湖南省高校肿瘤细胞与分子病理学重点实验室,湖南 衡阳 421001;2.湖南环境生物职业技术学院内科学教研室;3.南华大学附属第二医院病理科)
·基础医学·
PTEN蛋白在胃癌中的表达及临床病理意义
罗文1,2,周娟1#,夏红1,苏坚1,3,刘芳1,汤欢1,苏琦1*
(1.南华大学肿瘤研究所,湖南省胃癌研究中心,湖南省高校肿瘤细胞与分子病理学重点实验室,湖南 衡阳 421001;2.湖南环境生物职业技术学院内科学教研室;3.南华大学附属第二医院病理科)
目的研究10号染色体缺失的张力蛋白同源磷酸酶基因(PTEN)蛋白在胃癌中的表达与临床病理的关系,为寻找胃癌肿瘤标记物提供一定的实验依据。方法应用组织芯片及免疫组化方法检测140例胃癌组织、54例癌旁胃黏膜组织与64例正常胃黏膜组织中PTEN的表达情况,研究PTEN与胃癌发生发展的关系。结果PTEN蛋白在正常组织表达85.94%(55/64)明显高于癌前病变51.85%(28/54)与胃癌20.71%(29/140)(P<0.05),而癌前病变表达显著高于胃癌(P<0.05)。PTEN在高分化、中分化、低分化腺癌、黏液癌与印戒细胞癌分别表达44.83%(13/29)、26.08%(6/23)、14.58%(7/48)、7.40%(2/27)与7.69%(1/13),各组间差异具有显著性(P<0.05)。PTEN在淋巴结转移组表达11.53%(12/104)明显低于无淋巴结转移组47.22%(17/36)(P<0.05)。在Ⅰ+Ⅱ期表达38.30%(18/47)明显高于Ⅲ+Ⅳ期11.83%(11/93)(P<0.05)。结论PTEN蛋白下调与胃癌的发生、分化程度、淋巴结转移和临床分期有关。
胃癌; PTEN; 组织芯片; 免疫组织化学
胃癌是最常见的恶性肿瘤之一,每年全世界新发病例约95.16万,死亡约72.31万,发生率与死亡率分别为全球第四位与第二位[1]。据2015年流行病学最新统计,胃癌在我国每年约新发67.9万和死亡49.8万人,发生率与死亡率位于第二。由于患者就诊时大多已发生侵袭转移,5年生存率低于10%[2-3]。因此,研究胃癌侵袭转移机制,寻找诊断标志与治疗靶点具有重要的意义。
众所周知,10号染色体缺失的张力蛋白同源磷酸酶基因(phosphatase and tensin homologue deleted on chromosome ten,PTEN)是抑癌基因,在胃癌、肺癌、乳腺癌、前列腺癌、胰腺癌、头颈部癌与口腔癌等多种肿瘤中表达缺失或低表达,与肿瘤的发生发展密切相关[4-11]。本文采用组织芯片与免疫组化研究PTEN蛋白在胃癌中表达与临床病理的关系。
1 材料与方法
1.1病例资料从南华大学附属湘潭医院存档石蜡块获取胃癌140例及癌旁组织54例,另取距离肿瘤边缘>5 cm处的正常胃黏膜上皮64例作为对照。每例均有明确临床背景资料和病理组织学切片诊断支持,对每一组织标本,均先观察HE切片以确定并标记出癌组织、癌旁组织及正常组织部位,制作组织芯片。140例胃癌标本中,男性97例,女性43例,年龄40~74岁,平均年龄56.7岁。按WHO病理组织学分类[12],高分化腺癌29例,中分化腺癌23例,低分化腺癌48例,黏液癌27例,印戒细胞癌13例。
1.2免疫组化染色PTEN(#9188)抗体购自Cell Signaling公司,二步法SP通用试剂盒购自福州迈新生物技术公司。按照试剂盒的说明进行SP染色,步骤具体如下:切片放入68 ℃烤箱内烘烤20 min;切片常规二甲苯脱蜡、酒精梯度脱水;冲水20 min;PBS清洗3次,每次5 min;抗原修复;PBS清洗3次,每次5 min;加入3%H2O2室温37 ℃静置10 min,用于灭活内源性过氧化物酶;PBS清洗3次,每次5 min;甩干PBS,滴加一抗,湿盒内孵育1 h;PBS清洗3次,每次5 min;去除PBS,滴加50 μL试剂A(聚合物增强剂),室温静置10 min;PBS清洗3次,每次5 min;滴加50 μL试剂B(酶标抗鼠/兔聚合物),室温静置10 min;PBS清洗3次,每次5 min;滴加50 μL试剂C(链霉亲和素—过氧化物酶),静置10 min;PBS清洗3次,每次5 min;清除PBS,滴加50 μL DAB显色液,镜下掌握显色程度;自来水充分冲洗;苏木素复染1 min,PBS液返蓝5 min,最后脱水、透明、封片。
1.3结果判定根据文献[12],阳性细胞染色程度及着色细胞百分率进行记分:0分不着色,1分浅棕色,2分深棕色;着色细胞<5%为0分,5%~25%为1分,26%~50%为2分;>50%为3分。两种分值相加,1分为(-);2分为弱阳性(+);其中2~3分为阳性(++);4~6分为强阳性(+++)。(++)~(+++)判为阳性,(-)~(+)判为阴性。PTEN蛋白阳性表达为棕黄或棕褐色颗粒,定位于胞浆或胞核。
1.4统计学分析实验结果应用SPSS软件实施统计学分析,采用χ2检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 PTEN蛋白在胃癌组织中的表达PTEN在正常组织上皮明显呈阳性表达,在胃癌组织及癌前病变中呈阴性或部分阳性表达。PTEN在正常组织表达85.94%(55/64)明显高于癌前病变51.85%(28/54)与胃癌20.71%(29/140)(P<0.05),而在癌前病变表达显著高于胃癌(P<0.05)(表1,图1)。
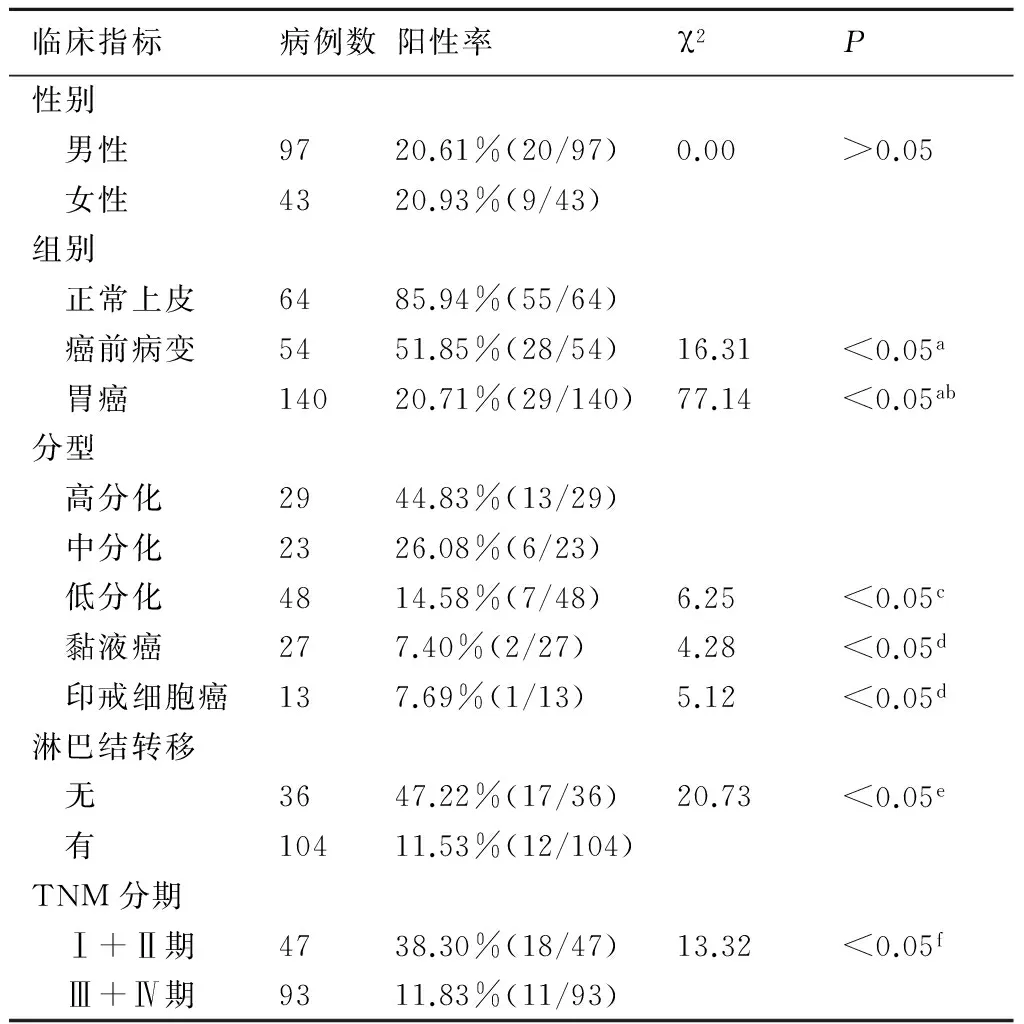
表1 PTEN表达与胃癌临床病理的关系
a:与正常组织比较;b:与癌前病变比较;c:与高中分化比较;d:与腺癌比较;e:与无转移比较;f:与Ⅰ+Ⅱ期比较
2.2 PTEN表达与临床胃癌病理指标的关系表1所示,PTEN蛋白在高分化、中分化、低分化腺癌的表达率分别为44.83%(13/29)、26.08%(6/23)、14.58%(7/48),经χ2检验各组间差异具有显著性(P<0.05),并且明显高于黏液癌7.40%(2/27)与印戒细胞癌7.69%(1/13)。PTEN蛋白在淋巴结转移组11.53%(12/104)明显低于无淋巴结转移组47.22%(17/36) (P<0.01)。PTEN在Ⅰ+Ⅱ期表达38.30%(18/47)明显高于Ⅲ+Ⅳ期11.83%(11/93) (P<0.01)。男性表达20.61%(20/97)与女性表达间20.93%(9/43)差异无显著性(P>0.05)。
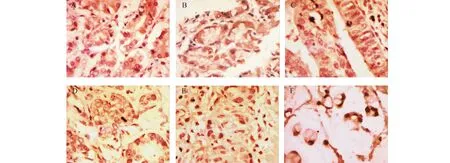
图1 PTEN在胃癌组织中表达(SP400×)A:正常组织;B:肠化;C:高分化;D:中分化;E:低分化;F:黏液癌
3 讨 论
PTEN抑癌基因又称为MMAC1(mutated in multiple advanced cancer 1)和TEP1(TGF-regulated and epithelial cell -enriched phosphatase)。PTEN基因位于染色体10q23.3,由9个外显子组成,编码由403个氨基酸组成的蛋白质,具有磷酸酯酶的活性,PTEN蛋白可通过拮抗酪氨酸激酶等磷酸化酶的活性而抑制肿瘤的发生发展[5]。
研究显示,PTEN在肺鳞状细胞癌低表达与恶性程度和淋巴结转移有关,因此,PTEN表达缺失可作为评估恶性与独立的预后因子[6]。PTEN高表达的NSCLC患者平均生存12.9月较低表达患者生存17.1月具有明显差异。PTEN高表达在肺腺癌平均生存23.50月较低表达患者生存15.54月具有明显差异,并且减少43%的危险。PTEN表达在T1/T2明显高于T3/T4,而肺腺癌明显高于肺鳞状细胞癌,表明PTEN表达可能是NSCLC患者预后良好的标志[7]。PTEN在360例乳腺癌中低表达,PTEN启动子存在39.44%甲基化,而45.56%PTEN表达下调,两者具有显著相关性,并与恶性程度有关,表明PTEN启动子甲基化是PTEN表达缺失的机制,PTEN甲基化和表达缺失可能成为乳腺癌的危险判断的标志[8]。PTEN在前列腺癌中低表达,采用免疫组化与FISH 检测PTEN 基因缺失显示,731例前列腺癌中,免疫组化与FISH 的特异性为91%(FISH检测602例PTEN 基因缺失,免疫组化549例表达缺失),敏感性为97%(67例纯合子缺失中免疫组化65例表达缺失)。因此,免疫组化筛选对鉴定PTEN 基因纯合子缺失是显著有益的[9]。研究表明,PTEN 在胰腺癌中表达低于正常组织,与组织学分级、临床分期和淋巴结转移明显相关[10]。25.0%的壶腹癌PTEN表达缺失与淋巴结转移、临床分期、高频率复发和更短生存率相关,是外科手术治疗后重要的预后因子[11]。PTEN在头颈部癌表达下调,与增殖标记Ki-67、临床分期和分级呈负相关[12]。
在胃癌中,Zhu等采用组织芯片与免疫组化检测159例胃癌与151例非胃癌组织显示,PTEN在62%胃癌组织表达较非胃癌组织明显下调,PTEN表达缺失与组织学类型和临床分期密切相关,表明PTEN可作为胃癌诊断的标志[4]。Kim等显示,PTEN在438例胃癌中20.3%表达降低,可能成为临床治疗靶点[13]。Zhang等采用FISH与免疫组化检测胃癌患者肿瘤细胞移植SCID小鼠的移植瘤中,发现66%的移植瘤中PTEN表达缺失[14]。研究表明,PTEN在胃癌低表达,与肿瘤大小和淋巴结转移密切相关,相反,PI3K、AKT、p-AKT、p-mTOR等在胃癌中高表达,表明PI3K/AKT/mTOR通路在胃癌中活化,可能是特异性靶向治疗胃癌的靶点[15]。免疫组化检测亚洲胃癌患者显示,PTEN 异常表达与肿瘤大小、分化程度、临床分期、侵袭、淋巴结转移、远距离转移和血管侵袭有关,提示免疫组化检测PTEN可预告侵袭与转移[16]。Zhang 等研究表明,HER2抑制剂trastuzuma与lapatinib是治疗胃癌的最佳靶向药物,但是,PTEN表达缺失是对trastuzuma或lapatinib治疗胃癌患者早期抗药性的重要预兆标志。因此,治疗前检测胃癌患者PTEN是否存在缺失,必须对缺失患者调整治疗方案,显然,进一步研发治疗胃癌的药物是今后研究的重点[17]。
本文结果显示,PTEN蛋白在85.94%正常胃黏膜组织上皮呈阳性表达,明显高于癌前病变51.85%与胃癌20.71%,且在癌前病变表达显著高于胃癌,表明PTEN低表达与胃癌发生有关。并且,PTEN蛋白在高分化、中分化、低分化腺癌、黏液癌与印戒细胞癌的表达率分别为44.83%、26.08%、14.58%,7.40% 与7.69%,各组间差异具有显著性,表明PTEN低表达与胃癌分化程度相关。PTEN表达在淋巴结转移组11.53%明显低于无淋巴结转移组47.22%。PTEN在Ⅰ+Ⅱ期表达38.30%明显高于Ⅲ+Ⅳ期11.83%,表明PTEN低表达与淋巴结转移和临床分期显著相关。综上所述,PTEN低表达与胃癌发生、分化程度、淋巴结转移和临床分期明显有关,可能是胃癌诊断与预后判断的重要标志,本研究结果与国内外报告一致。
DJ-1(Parkinson’s disease-associated protein 7,PARK7)是癌基因,也是PTEN的重要负调控蛋白,在胃癌发生发展起着重要作用。LI等发现,DJ-1蛋白在66.7%胃癌高表达与肿瘤侵袭深度、淋巴结转移、远距离转移和临床分期有关。而PTEN在58.7%的胃癌表达下调与临床分期和DJ-1高表达相关。并且, DJ-1高表达和PTEN低表达与胃癌患者不良预后显著相关,可能成为胃癌患者预后的重要因子[18]。因此,研发抑制DJ-1表达和促进PTEN表达的治疗胃癌药物将是今后的新策略[17]。近来,采用蛋白质组学技术鉴定二烯丙基二硫(diallyl disulfide,DADS)诱导白血病分化的差异蛋白质中,发现DJ-1蛋白表达明显下调[19]。然而,DADS是否可通过下调DJ-1上调PTEN抑制胃癌细胞增殖与迁移侵袭,尚待进一步研究。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012 [J].CA Cancer J Clin,2015,65(2):87-108.
[2] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] Orditura M,Galizia G,Sforza V,et al.Treatment of gastric cancer [J].World J Gastroenterol,2014,20(7):1635-1649.
[4] Zhu X,Qin X,Fei M,et al.Loss and reduced expression of PTEN correlate with advanced-stage gastric carcinoma[J].Exp Ther Med,2013,5(1):57-64.
[5] Li YN,Zhou YZ,Zhang N,et al.Expression of phosphatase and tensin homology deleted on chromosometen (PTEN) in squamous-cell lung cancer and its clinical significance[J].Zhonghua Jie He He Hu Xi Za Zhi,2016,39(6):450-453.
[6] Li X,Yang Y,Zhang H,et al.High levels of phosphatase and tensin homolog expression predict favorable prognosis in patients with non-small cell lung cancer [J].Cell Biochem Biophys,2015,73(3):631-637.
[7] Siddiqui S,Akhter N,Deo SV,et al.A study on promoter methylation of PTEN in sporadic breast cancer patients from North India[J].Breast Cancer,2016,23(6):922-931.
[8] Lotan TL,Wei W,Ludkovski O,et al.Analytic validation of a clinical-grade PTEN immunohistochemistry assay in prostate cancer by comparison with PTEN FISH[J].Mod Pathol,2016,29(8):904-914.
[9] Huang W,Yang J,Ren J,et al.Expression of PTEN and KAI1 tumor suppressor genes in pancreatic carcinoma and its association with different pathological factors[J].Oncol Lett,2016,11(1):559-562.
[10] Shroff S,Overman MJ,Rashid A,et al.The expression of PTEN is associated with improved prognosis in patients with ampullary adenocarcinoma after pancreaticoduodenectomy[J].Arch Pathol Lab Med,2013,137(11):1619-1626.
[11] Ahmed MW,Kayani MA,Shabbir G,et al.Expression of PTEN and its correlation with proliferation marker Ki-67 in head and neck cancer[J].Int J Biol Markers,2016,31(2):e193-203.
[12] Wu YJ,Tang Y,Li ZF,et al.Expression and significance of Rac1,Pak1 and Rock1 in gastric carcinoma[J].Asia Pac J Clin Oncol,2014,10(2):e33-39.
[13] Kim HS,Shin SJ,Beom SH,et al.Comprehensive expression profiles of gastric cancer molecular subtypes by immunohistochemistry:implications for individualized therapy[J].Oncotarget,2016,7(28):44608-44620.
[14] Zhang T,Zhang L,Fan S,et al.Patient-derived gastric carcinoma xenograft mouse models faithfully represent human tumor molecular diversity[J].PLoS One,2015,10(7):e0134493.
[15] Tapia O,Riquelme I,Leal P,et al.The PI3K/AKT/mTOR pathway is activated in gastric cancer with potential prognostic and predictive significance[J].Virchows Arch,2014,465(1):25-33.
[16] Chen J,Li T,Liu Q,et al.Clinical and prognostic significance of HIF-1α,PTEN,CD44v6,and survivin for gastric cancer:a meta-analysis[J].PLoS One,2014,9(3):e91842.
[17] Zhang X,Park JS,Park KH,et al.PTEN deficiency as a predictive biomarker of resistance to HER2-targeted therapy in advanced gastric cancer[J].Oncology,2015,88(2):76-85.
[18] Li Y,Cui J,Zhang CH,et al.High-expression of DJ-1 and loss of PTEN associated with tumor metastasis and correlated with poor prognosis of gastric carcinoma[J].Int J Med Sci,2013,10(12):1689-1697.
[19] Ling H,He J,Tan H,et al.Identification of potential targets for differentiation in human leukemia HL-60 cells induced by diallyl disulfide[J].Int J Oncol,2017,50(2):697-707.
ExpressionofPTENingastriccancerandclinicalpathologicalsignificance
LUO Wen,ZHOU Juan,XIA Hong,et al
(CancerResearchInstitute,CenterforGastricCancerResearchofHunanProvince,KeyLaboratoryofCancerCellulalandMoleculayPathologyofHunan,UniversityofSouthChina,Hengyang421001,Hunan,China)
ObjectiveTo investigate the expression of PTEN protein in gastric cancer and clinical pathological significance.MethodsTissue microarray technique and SP Immunohistochemistry method were applied to detect PTEN protein expression in the 140 cases of gastric cancer,the 54 cases of tissue nearby and 64 cases matched non-cancer mucosa and evaluate the influence of abnormal expression of PTEN protein for carcinogenesis and progression of gastric cancer.ResultsImmunohistochemistry results revealed that the positive rates of PTEN protein expression in matched non-cancer mucosa,tissue nearby and gastric cancer were 83.36% (19/22),56.25% (27/48) and 24.44% (22/90),respectively.The PTEN protein positive expression in gastric cancer were significantly lower than those matched non-cancer mucosa and the tissue nearby (P<0.05).The positive rates of PTEN expression were 44.83% (13/29) in well differentiated,26.08% (6/23) in moderate differentiated,14.58% (7/48) in poorly differentiated,7.40% (2/27) in mucinous cancer and 7.69% (1/13) in signet ring cell cancer,respectively,and the positive expression rates of PTEN between distinct degree of differentiation were significantly different in gastric cancer (P<0.05).ConclusionThe down-regulation of PTEN protein was concerned with carcinogenesis,degree of differentiation,lymphatic metabasis and clinical stage in gastric cancer.
gastric cancer; PTEN; tissue microarray; immunohistochemistry
10.15972/j.cnki.43-1509/r.2017.02.001
2016-12-06;
2017-02-19
国家自然科学基金(81102854,81374013).
*通讯作者,E-mail:suqi1945@163.com.
#并列第一作者,E-mail:suqi1945@163.com.
R735.2
A
蒋湘莲)
