橘皮素对PC-12细胞Aβ水平的影响及机制研究
2017-12-25,,,,,,,*
, ,,, , ,,*
(1.南华大学医学院神经科学研究所、生理学教研室,湖南 衡阳 421001;2.北京航天总医院ICU;3.桂林医学院附属医院广西桂林;4.湖南中医药高等专科学校湖南株洲;5.南华大学医学院心血管疾病研究所;6.南华大学护理学院)
·基础医学·
橘皮素对PC-12细胞Aβ水平的影响及机制研究
欧阳新平1,郑莉2,周寿红1,陆素青3,陈歆4,张敏5,何平平6*,唐朝克5*
(1.南华大学医学院神经科学研究所、生理学教研室,湖南 衡阳 421001;2.北京航天总医院ICU;3.桂林医学院附属医院广西桂林;4.湖南中医药高等专科学校湖南株洲;5.南华大学医学院心血管疾病研究所;6.南华大学护理学院)
目的观察橘皮素对PC-12细胞β淀粉样蛋白(Aβ)水平的影响并探讨其可能的机制。方法不同浓度(0.1、1、10、100 μmol/L)的橘皮素,作用不同时间(0 h、6 h、12 h、24 h、48 h)处理PC-12细胞后,采用ELISA检测细胞培养液Aβ40和Aβ42水平,Western blot检测PC-12细胞三磷酸腺苷结合盒转运体A1(ABCA1)蛋白水平,RT-PCR检测PC-12细胞ABCA1 mRNA水平。ABCA1 SiRNA抑制ABCA1蛋白表达。结果10 μmol/L及100 μmol/L橘皮素组Aβ40和Aβ42水平显著下降,ABCA1蛋白水平明显增加,而所有组ABCA1 mRNA水平没有改变。使用100μmol/L橘皮素处理PC-12细胞,处理后ABCA1 mRNA表达与对照组比较差异无显著性,24 h及48 h组ABCA1水平显著增加,Aβ40和Aβ42水平显著下降。使用ABCA1 SiRNA抑制PC-12细胞ABCA1蛋白表达后,ABCA1 siRNA处理组与对照组比较,Aβ40和Aβ42水平显著增加。结论橘皮素可通过增加ABCA1蛋白来降低PC-12细胞Aβ40和Aβ42水平。
橘皮素; PC12细胞; ABCA1; β淀粉样蛋白; 阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)是一种在老年人群中发病率较高且危害性较大的一种神经退行性疾病。目前研究表明,脑内过量的β淀粉样蛋白(β-Amyloid protein,Aβ)聚集形成老年斑,从而对神经元产生毒性并导致其变性死亡[1]。三磷酸腺苷结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)是一种跨膜蛋白,其主要作用之一是维持细胞内外胆固醇的动态平衡[2]。研究显示,在ABCA1敲除小鼠其脑内Aβ水平增加[3],而ABCA1过表达小鼠则其脑Aβ水平减少[4-5]。因此,现在认为ABCA1可作为治疗AD的一个重要潜在靶点,因此寻找一种能有效上调ABCA1表达的物质变得至关重要。橘皮素(Tangeretin)是中国传统中药材橘皮中所含的有效成分之一,属于黄酮类化合物。大量研究表明黄酮类具有抑制细菌、抗肿瘤、抗病毒及抗氧化等广泛的药理作用,近年来研究表明同为黄酮类的花青素具有上调ABCA1蛋白的作用[6-7],那是否橘皮素能通过增加ABCA1表达,进而降低Aβ水平,目前尚未见文献报道。
1 材料和方法
1.1材料与试剂橘皮素购自Sigma公司;RPMI-1640培养基、胎牛血清、胰酶购自杭州四季清公司;兔抗鼠ABCA1、β-actin一抗、辣根过氧化物酶标记羊抗兔二抗、小鼠特异性ABCA1小干扰RNA(SiRNA)购自Santa Cruz公司;Aβ40和Aβ42ELISA检测试剂盒采购自美国Invitrogen公司;RT-PCR试剂盒购于芬兰Finnzymes公司;其他所有试剂均为国产分析纯。
1.2细胞培养PC-12细胞由中山大学生理教研室提供,使用1640培养液(含有10%胎牛血清)在恒温细胞培养箱(37 ℃、5% CO2)内培养细胞。当细胞生长至80%融合时,进行胰酶消化后传代。当细胞进入对数生长期时,更换培养液,24 h加入1 640培养液(对照)或不同浓度(100 nmol/L 、1 μmol/L、10 μmol/L、100 μmol/L)的橘皮素,作用不同时间(0 h、6 h、12 h、24 h、48 h)后分别收取上清液冻存备用。使用RIPA细胞裂解液裂解细胞,4 ℃ 12 000 rpm离心30 min,转移上清液至新EP管后冻存备用。
1.3酶联免疫吸附实验(ELISA) 将收集到的细胞培养液离心(4 ℃,12 000 rpm,10 min),取上清液。使用Aβ40或Aβ42试剂盒进行测定,根据试剂盒说明书采用双抗体夹心酶标免疫法检测样本中Aβ40或Aβ42的水平。先把纯化后的抗体包被在96孔板中,制成为固相抗体后,再将Aβ40或Aβ42抗原、生物素化的抗体以及HRP标记的亲和素依次加入含有包被抗体的孔中,然后采用底物TMB显色,颜色的深浅和样本中的Aβ40或Aβ42呈正向相关。随后使用酶标仪(设定450nm波长)测定每个样本吸光度值(OD值),最后计算出样本的浓度。
1.4小干扰RNA转染小鼠特异性ABCA1小干扰RNA(siRNA)由圣克鲁斯生物技术公司提供。ABCA1 siRNA:sense 5′-GGAUUUUUUGCUCAGAUUGTT-3′,antisense 5′-CAAUCUGAGCAAAAAAUCCTT-3′。将PC-12细胞放入六孔板(2×106细胞/孔)24 h。使用脂质体2000分别进行转染48 h。使用Western blot检测ABCA1siRNA对相应蛋白抑制效果。
1.5蛋白质免疫印迹实验(Western Blot) 收集细胞,使用预冷的PBS洗涤2次,蛋白裂解液500 μL裂解细胞,冰上孵育30 min后,将样本于4 ℃、15 000 rpm离心30 min,收集上清,即为细胞的总蛋白。采用BAC法测定蛋白含量。煮沸变性,上样后进行电泳,电压为80 mV,在6%SDS-聚丙烯酰胺凝胶电泳1 h分离蛋白质。将分离的蛋白质用湿转法转膜至硝酸纤维素膜上,10%脱脂牛奶室温下封闭2~3 h或4 ℃封闭过夜,加入兔抗鼠β-actin(1∶200)、ABCA1(1∶200)一抗孵育4~6 h。使用TBST缓冲液洗膜10 min×3次,随后加入二抗,孵育2~3 h,TBST缓冲液洗膜10 min×3次。显影剂显影后,使用凝胶图像分析系统扫描,并进行半定量分析。
1.6 RNA提取和实时定量PCR(Real-time Quantitative PCR,Real-time PCR) 先提取PC-12细胞总RNA,然后使用SYBR绿色荧光测定试剂盒,采用Roche light Cycler Run 5.32 Real-Time PCR系统进行Real-time PCR分析。合成小鼠ABCA1引物序列:5′-GGGTGAACGAGTTTCGGTATG-3′和5′-CTGAAGATGCTTGGCTTTGCT-3′。最后采用ΔΔCt方法进行定量测定。
1.7统计学分析使用均数±标准差表示所得的实验数据。两组间的比较采用Student’st检验,三组或多组之间的比较采用one-way ANOVA分析。所有数据均使用SPSS 13.0软件进行统计分析,以P<0.05为差异具有显著性标准。
2 结 果
2.1橘皮素减少PC-12细胞Aβ40和Aβ42水平ELISA方法检测PC-12细胞培养液Aβ40和Aβ42水平(Aβ由膜上剪切生成后进入细胞培养液)。结果显示10 μmol/L、100 μmol/L组Aβ40和Aβ42水平显著下降,且100 μmol/L组下降更明显(图1A,图1B);24 h及48 h组Aβ40和Aβ42水平显著下降(图1C,图1D),说明橘皮素能减少PC-12细胞Aβ40和Aβ42水平。
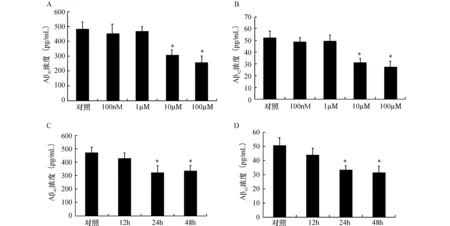
图1 橘皮素对PC-12细胞Aβ40及Aβ42水平的影响(n=3) 与对照组比较,*P<0.05
2.2橘皮素增加PC-12细胞ABCA1蛋白水平Western blot和RT-PCR结果显示10μmol/L、100μmol/L橘皮素组与对照组相比,ABCA1蛋白水平明显增加(图2A),而ABCA1 mRNA水平则没有改变(图2C);24 h及48 h组PC-12细胞ABCA1水平显著增加(图2B),ABCA1 mRNA表达与对照组比较差异无显著性(图2D),说明橘皮素增加PC-12细胞ABCA1蛋白水平,但不影响ABCA1 mRNA水平。
2.3橘皮素通过PC-12细胞ABCA1蛋白减少Aβ水平
2.3.1 ABCA1 siRNA抑制效果检测 Western blot检测ABCA1 siRNA 后PC-12细胞ABCA1蛋白水平,结果显示ABCA1 siRNA能有效抑制PC-12细胞ABCA1表达(图3)。
2.3.2 橘皮素通过PC-12细胞ABCA1蛋白减少Aβ水平 ELISA结果显示橘皮素处理组与对照组比较,Aβ40和Aβ42水平显著下降。ABCA1 siRNA处理组与对照组比较,Aβ40和Aβ42水平显著增加。橘皮素+ABCA1 siRNA处理组与橘皮素处理组比较,Aβ40和Aβ42水平显著增加(图4)。说明橘皮素通过PC-12细胞ABCA1蛋白减少Aβ40和Aβ42水平。
3 讨 论
橘皮素属于多甲氧基黄酮类(polymethoxylated flavones,PMFs),研究证明其具有很强的抗氧化、抗炎、抗癌、抗肿瘤、抗菌及降低胆固醇水平的功能[8-11]。近年来研究表明同为黄酮类的花青素具有上调ABCA1蛋白的作用[9],那是否橘皮素能通过作用于ABCA1,进而降低Aβ水平,目前尚未见文献报道。因此,本研究中观察橘皮素对PC-12细胞ABCA1及Aβ水平的影响。
沉积的Aβ是AD病变中老年斑的核心组成成分,它在AD这种神经退行性疾病的病变过程中起关键作用[12-13]。在AD中,Aβ可以导致线粒体功能的破坏、氧化和应激、破坏细胞膜的完整性以及损伤神经轴突运输和突触传递,最终引起神经元的变性丢失[13]。在这些病理生理过程中,Aβ的产生是其中的关键步骤,因此,针对脑内Aβ代谢的调节是治疗AD的一种有效且至关重要的策略[14]。
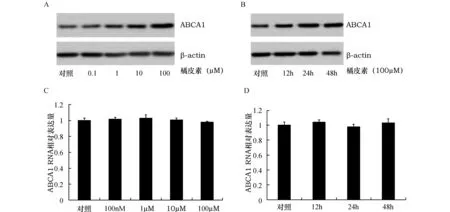
图2.橘皮素对PC-12细胞ABCA1蛋白及mRNA的影响(n=3)
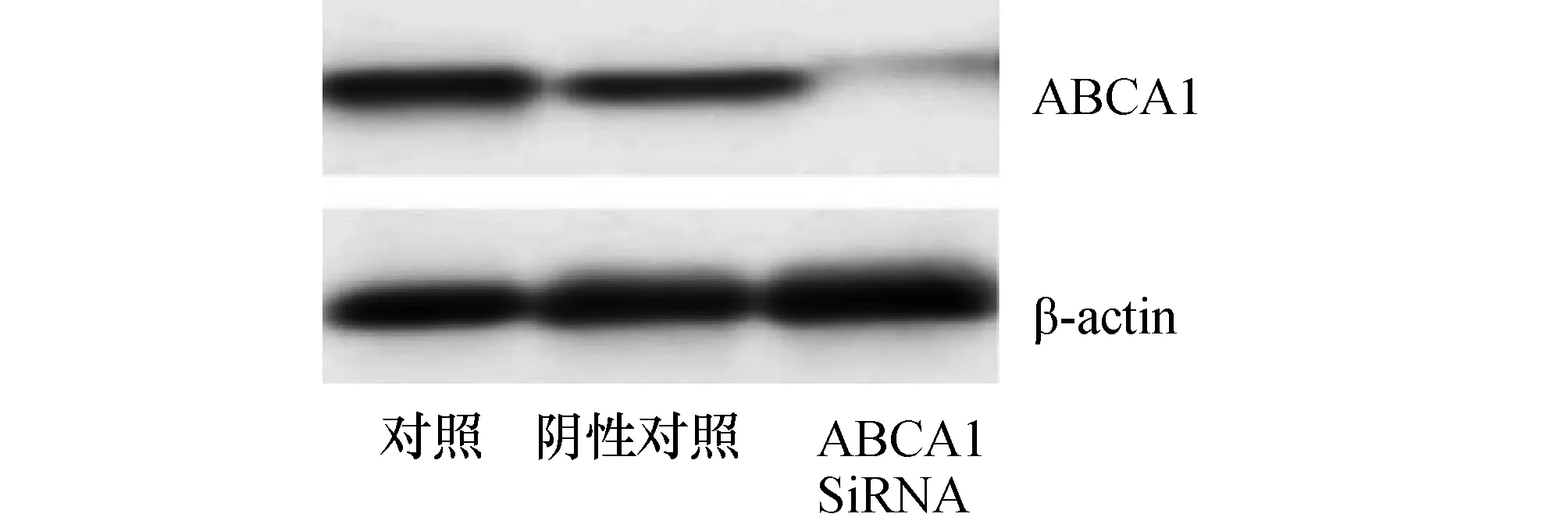
图3 ABCA1 SiRNA对PC-12细胞ABCA1表达的影响
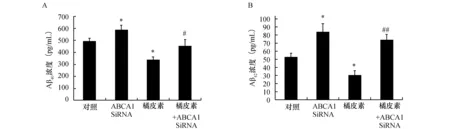
图4 橘皮素通过PC-12细胞ABCA1蛋白影响Aβ40及Aβ42水平(n=3)与对照组比较,*P<0.05;与橘皮素比较,#P<0.05,##P<0.01
我们研究结果表明橘皮素处理PC-12细胞24 h后,PC-12细胞培养液Aβ40和Aβ42水平显著降低。说明橘皮素能降低Aβ40和Aβ42水平。
研究表明,一些参与AD病理过程的关键因子,例如胆固醇代谢异常会影响淀粉样前体蛋白(β-Amyloid protein,APP)及β位淀粉样前体蛋白分解酶1(beta-site APP cleaving enzyme 1,BACE1)的募集[14]。胆固醇代谢的异常和Aβ沉积都与AD的发生发展有非常密切的联系,而且两者经常伴随存在,另外胆固醇代谢的异常会增加Aβ沉积[15]。
ABCA1是调节细胞膜内外胆固醇平衡的一个非常重要的因子。在脑内,ABCA1可转运细胞内的胆固醇和磷脂流出细胞外到载脂蛋白E(apolipoprotein E,apoE),并且可以影响apoE的荷脂以及脑内apoE水平。许多研究表明,ABCA1缺乏会增加Aβ水平。Koldamova等研究发现在过表达APP的APP23和PDAPP模型小鼠中,敲除脑内ABCA1水平可降低apoE荷脂和apoE水平,并增加脑内Aβ40及Aβ42的水平[15]。脑内ABCA1高表达则降低Aβ水平。研究发现使用促进ABCA1高表达的人工合成药物T0901317处理APP23转基因小鼠,可以增加脑内ABCA1蛋白表达并且显著降低Aβ40和Aβ42的脑水平[15]。本实验的研究结果也证实了这一点,使用ABCA1 siRNA削弱ABCA1蛋白表达后,PC-12细胞的Aβ40和Aβ42水平显著增加。因此,ABCA1可以作为降低Aβ水平以及治疗AD的一个潜在靶点。
我们使用橘皮素处理PC-12细胞24 h后,ABCA1蛋白水平明显增加,而ABCA1 mRNA水平则没有改变,说明橘皮素能增加ABCA1蛋白表达的同时降低Aβ40和Aβ42水平。随后,使用ABCA1 siRNA抑制ABCA1蛋白表达,结果显示橘皮素降低Aβ40和Aβ42水平的能力显著减弱,说明橘皮素能通过增加ABCA1蛋白表达来降低Aβ40和Aβ42水平。因此,橘皮素有望对阿尔茨海默病的治疗提供一个方向,其机制有待进一步探讨。
[1] Morgan C,Colombres M,Nunez MT,et al.Structure and function of amyloid in Alzheimer’s disease[J].Prog Neurobiol,2004,74 (6):323-349.
[2] Hirsch-Reinshagen V,Burgess BL,Wellington CL.Why lipids are important for Alzheimer disease[J]. Mol Cell Biochem,2009,326 (1-2):121-129.
[3] Kim J,Yoon H,Ramirez CM,et al.MiR-106b impairs cholesterol efflux and increases Abeta levels by repressing ABCA1 expression[J].Exp Neurol,2012,235(2):476-483.
[4] 欧阳新平,张敏,何平平,等.三磷酸腺苷结合盒转运体A1在脑疾病发生发展中的作用[J].生物化学与生物物理进展,2014,41 (4):317-323.
[5] Donkin JJ,Stukas S,Hirsch-Reinshagen V,et al.ATP-binding cassette transporter A1 mediates the beneficial effects of the liver X receptor agonist GW3965 on object recognition memory and amyloid burden in amyloid precursor protein/presenilin 1 mice[J].J Biol Chem,2010,285 (44):34144-34154.
[6] Xia M,Hou M,Zhu H.Anthocyanins induce cholesterol efflux from mouse peritoneal macrophages:the role of the peroxisome proliferator-activated receptor {gamma}-liver X receptor {alpha}-ABCA1 pathway[J].J Biol Chem,2005,280(44):36792-36801.
[7] Wang D,Xia M,Yan X,et al.Gut microbiota metabolism of anthocyanin promotes reverse cholesterol transport in mice via repressing miRNA-10b[J].Circ Res,2013,111(8):967-981.
[8] Funaro A,Wu X,Song M,et al.Enhanced anti-inflammatory activities by the combination of luteolin and tangeretin[J].J Food Sci,2016,81(5):H1320-1327.
[9] 源瀚祺,黄庆华,张小英,等.茶枝柑皮提取物中川陈皮素和橘皮素的大鼠肠吸收特性[J].食品科学,2014,35(15):263-265.
[10] Lee YY,Lee EJ,Park JS,et al.Antiinflammatory and antioxidant mechanism of tangeretin in activated microglia[J].J Neuroimmune Pharmacol,2016,11(2):294-305.
[11] Xu JJ,Liu Z,Tang W,et al.Tangeretin from citrus reticulate inhibits respiratory syncytial virus replication and associated inflammation in vivo[J].J Agric Food Chem,2015,63(43):9520-9527.
[12] Frautschy SA,Baird A,Cole GM.Effects of injected Alzheimer beta-amyloid cores in rat brain[J].Proc Natl Acad Sci USA,1991,88 (19),8362-8366.
[13] Yankner BA,Dawes LR,Fisher S,et al.Neurotoxicity of a fragment of the amyloid precursor associated with Alzheimer’s disease[J].Science,1989,245 (4916):417-240.
[14] Citron M.Strategies for disease modification in Alzheimer’s disease[J].Nat Rev Neurosci,2004,5 (9):677-685.
[15] Wang XF,Cao YW,Feng ZZ,et al.Quantitative assessment of the effect of ABCA1 gene polymorphism on the risk of Alzheimer’s disease[J].Mol Biol Rep,2013,40 (2):779-85.
TheinfluenceandmechanismresearchoftangeretinonthePC-12cellbetaamyloidproteinlevels
OUYANG Xinping,ZHENG Li,ZHOU Shouhong,et al
(DepartmentofPhysiology,TheNeuroscienceInstitute,MedicalCollege,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo observe the effect that the Tangeretin on the PC-12 cell beta Amyloid (Aβ) protein levels and discuss the possible mechanism.MethodsUsing different concentrations (0.1,1,10,100μmol/L) of the Tangeretin to treat PC-12 cells at different time (0h,6h,12h,24 h,48 h),the level of Aβ40and Aβ42inthe cell culture were detected by the method of ELISA,the levels of ATP binding cassette transporter A1 (ABCA1) protein in the PC-12 cells were detected by western blot,the levels of ABCA1 mRNA in the PC-12 cells were detected by RT-PCR.After using ABCA1 SiRNA to inhibit the expression of ABCA1 protein.ResultsAβ40and Aβ42levels decreased significantly in 10μmol/L and 100μmol/L Tangeretin group,ABCA1 protein level increased significantly,and ABCA1 mRNA level of all groups didn’t change.With the treatment of 100μmol/L Tangeretin on PC-12 cells,ABCA1 mRNA expression hadn’t significant difference compared with the control group,ABCA1 protein level of 24 h and 48 h group increased significantly,Aβ40and Aβ42levels decreased significantly.ConclusionThe Taneretin can reduce Aβ40and Aβ42levels through increasing ABCA1 protein level.
tangeretin;PC-12 cells;ABCA1;amyloid beta;alzheimer’s disease
10.15972/j.cnki.43-1509/r.2017.02.003
2016-12-25;
2017-03-01
湖南省研究生科研创新项目(CX2014B393);湖南省中医药管理局重点项目(201524);南华大学校内博士启动基金(2014XQD36、2015XQD37)。
*通讯作者,E-Mail:tangchaoke@qq.com;E-Mail:hpp-612@163.com。
R741.05
A
秦旭平)
