RIPK1/RIPK3依赖的细胞程序性坏死在清除兼性胞内菌感染中的作用
2017-12-25,,
,,
(南华大学病原生物学研究所/特殊病原体防控湖南省重点实验室,湖南 衡阳 421001)
·小专论·
RIPK1/RIPK3依赖的细胞程序性坏死在清除兼性胞内菌感染中的作用
罗茜,张晓红,赵飞骏*
(南华大学病原生物学研究所/特殊病原体防控湖南省重点实验室,湖南 衡阳 421001)
程序性坏死是一种与炎症相关的细胞死亡模式,与依赖半胱氨酸天冬氨酸蛋白酶调控的凋亡不同,这种细胞死亡模式受受体互作蛋白激酶(RIPK)1和3调控。在兼性胞内菌感染过程中,宿主会运用多种策略使隐藏在细胞内的兼性胞内菌重新暴露于抗菌机制面前。许多研究报道表明宿主细胞的程序性坏死是其中一种重要的策略,有助于兼性胞内菌感染的清除。在本文中,我们将探讨在宿主细胞内发生的由RIPK1/RIPK3途径介导的程序性坏死机制,以及其在清除兼性胞内菌感染中的意义。
RIPK1/RIPK3; 细菌感染; 程序性坏死
细胞死亡被分为程序性死亡和非程序性死亡。常见的细胞程序性死亡比如凋亡[1],主要由半胱氨酸天冬氨酸蛋白酶(caspase)介导;非程序性死亡主要指坏死(Necrosis)[2]。坏死一直以来被认为是机体应对外来刺激时发生的一种有积极意义的非程序性细胞死亡形式。最近一些研究表明,坏死不仅仅局限于非程序性死亡,它在细胞水平上也表现出一种受信号通路调节的程序性死亡的特点。这种可调节的坏死可以出现在病原体与宿主之间相互作用的过程中,它能帮助宿主抵抗病原体的损害。目前,大致把这种可调节的坏死分为铁死亡(Ferroptosis)[3]、 线粒体通透性转换(Mitochondria permeability transition,MPT)[4]介导的坏死、焦亡(Pyroptosis)[5]和程序性坏死(Necroptosis)[6]。
1 RIPK1/RIPK3依赖的细胞程序性坏死
受体互作蛋白激酶1(Receptor-interacting protein kinase 1,RIPK1)由3个功能明确的结构域组成:N端激酶结构域,中间结构域,C端死亡结构域。RIPK1激酶功能结构域对程序性坏死很重要。中间结构域包含一个RHIM(RIP-homotypic interaction motif)结构,能帮助RIPK1与其它包含RHIM的蛋白相互作用,比如DNA依赖的干扰素调节活化因子(DNA-dependent activator of IFN-regulatory factors,DAI),β干扰素TIR结构域衔接蛋白(TIR-domain-containing adapter-inducing interferon-β,TRIF),受体互作蛋白激酶3(Receptor-interacting protein kinase 3,RIPK3)。RIPK3与RIPK1具有高度同源性,具有一样的激酶功能结构域和RHIM结构。RHIM结构之间的相互作用在细胞程序性坏死过程中具有重要意义。而RIPK1 C端的死亡结构域能调节其与死亡受体(TNFR1,Fas)之间的反应[7]。RIPK1包含的这些功能明确的结构域在调节细胞死亡信号通路发挥强有力的作用。而目前研究认为程序性坏死指的就是由RIPK1/RIPK3依赖的细胞死亡。
目前关于程序性坏死的研究大多数都是建立在肿瘤坏死因子(Tumor necrosis factor,TNF)诱导基础上。TNF是一种能诱导肿瘤细胞坏死的细胞因子。现有研究表明,TNF相关信号通路既能介导细胞凋亡也能介导细胞程序性坏死(图1)。细胞凋亡是一种依赖于caspase的程序性死亡;而程序性坏死则是主要通过RIPK1/RIPK3诱导的细胞坏死。当TNF与宿主细胞表面的TNFR1结合时,能在其受体通路下游募集形成一种低聚物—复合体Ⅰ。复合体Ⅰ主要由RIPK1和一些辅助因子(比如TRADD、LUBAC、cIAPs和TRAF2/5)组成,辅助因子中的cIAPs和TRAF2/5能使RIPK1多聚泛素化,进而活化NF-κB相关信号通路,而NF-κB信号相关通路又能提高细胞的存活率。当复合体Ⅰ被破坏的时,RIPK1能重新与RIPK3和caspase-8结合,形成复合体Ⅱa,诱导细胞凋亡。当caspase-8活化程度不高或者RIPK3和MLKL (Mixed lineage kinase domain-like protein)的表达水平比较高时,复合体Ⅱ中的RIPK1和RIPK3就能互相磷酸化,使其本身被激活。活化的RIPK3又能使MLKL磷酸化,这三者组成复合体Ⅱb促进程序性坏死的发生。活化的MLKL能作用于细胞膜上的离子通道,通过对离子通道的调控进而调节细胞的渗透压,导致细胞肿胀,细胞膜破碎,最终使细胞死亡[8]。最新的研究表明,除TNFR1能介导细胞程序性坏死外,Ⅰ型干扰素(Type I interferon,IFN-Ⅰ)受体也能介导细胞程序性坏死(图1),机制与TNFR1类似[9]。
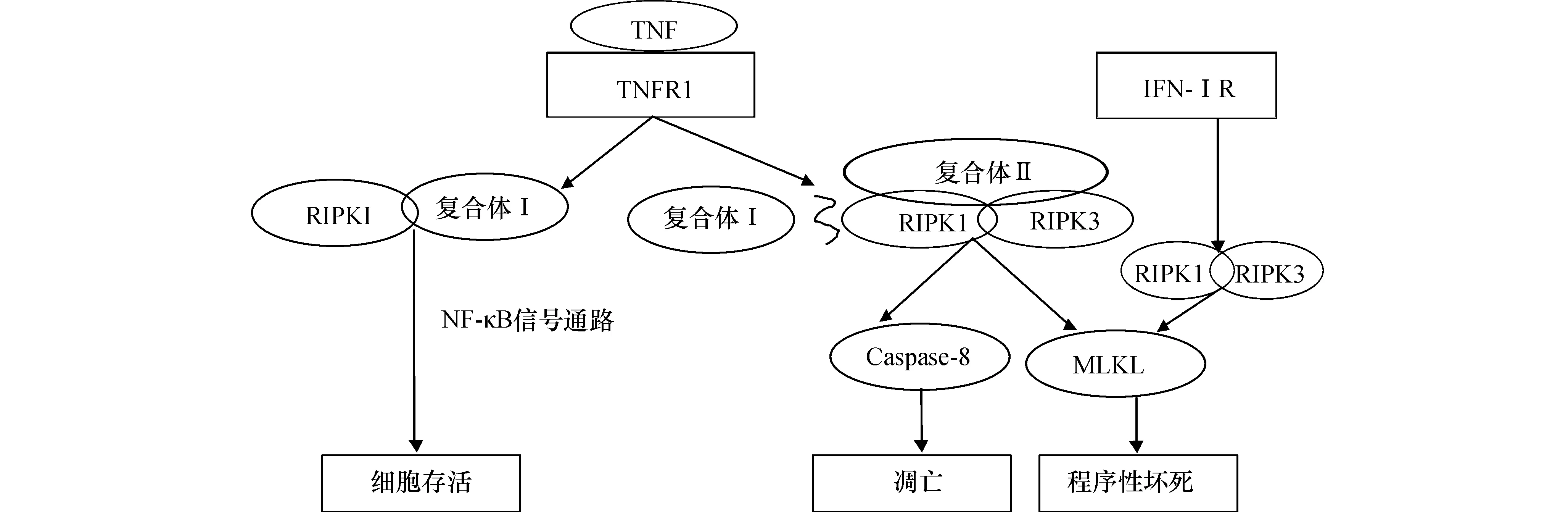
图1 TNFR1和IFN-ⅠR介导的细胞程序性坏死
2 宿主细胞发生RIPK1/RIPK3依赖的细胞程序性坏死在清除兼性胞内菌感染中的作用
宿主细胞死亡,将影响细胞内寄生细菌的感染和增殖。宿主细胞调控的由RIPK1/RIPK3信号通路介导的程序性坏死在细菌感染过程中占据了重要位置。目前发现结核分枝杆菌(Mycobacterium Tuberculosis)、沙门菌(Salmonella)、单核细胞增生李斯特菌(Liseria monocytogenes)和鼠疫耶尔森菌(Yersinia)等多种兼性胞内菌感染与RIPK1/RIPK3信号通路介导的细胞程序性坏死相关。
2.1结核分枝杆菌结核分枝杆菌是一种兼性胞内菌,是人类常见的呼吸道传染性的疾病肺结核的病原菌。根据世界卫生组织(WHO)的数据统计,平均每年有150万人死于这种细菌杀手。肺结核的发生是一种非常复杂的过程,具体的机制还不明确,但有一点可以肯定的是巨噬细胞在控制肺结核感染过程中发挥重要作用[10]。研究人员最近利用海鱼分枝杆菌感染斑马鱼幼仔建立了与结核分枝杆菌侵入人体相似的动物模型,在实验过程中发现在被分枝杆菌感染的巨噬细胞中当TNF信号通路被激活后,能诱导细胞内活性氧(Reactive oxygen species,ROS)的产生,ROS能增强斑马鱼幼仔对海鱼分枝杆菌的抵抗力[11]。这条通路激活能够减少分枝杆菌在细胞内的数量同时也能防止被感染的巨噬细胞死于由细菌诱导的细胞死亡。但是在大多数结核分枝杆菌感染中,如果巨噬细胞被感染程度比较严重时,细胞内的TNF信号通路就能激活RIPK1/RIPK3信号通路从而导致细胞发生程序性坏死[12],细胞膜破损,在巨噬细胞内大量存在的结核分枝杆菌就会被释放出来。结核分枝杆菌失去生存所必须的营养供给环境,同时又被暴露在宿主免疫系统面前,最终被清除。
2.2伤寒沙门菌沙门菌病是一种常见的食源性细菌感染性疾病,主要的临床表现为发热、腹泻与腹痛。在美国,每年伤寒沙门菌能感染100万人,在这100万人中大约有400人因此丧命[13]。伤寒沙门菌是一种兼性胞内菌,有研究表明它在体内和体外实验中均能引起巨噬细胞和上皮细胞的死亡[14]。在20年前,研究人员就认为沙门菌引起巨噬细胞的死亡可能是通过凋亡通路实现[15]。但在近年的研究发现这种沙门菌引起巨噬细胞的死亡并非通过caspase-3或者caspase-8介导的凋亡完成,而是通过caspase-1和caspase-11介导的焦亡通路完成[16]。还有研究证实沙门菌可以激活细胞内的IFN-I信号通路,随后将诱导巨噬细胞发生程序性坏死[16]。研究人员用抗IFN-I受体的中和抗体与巨噬细胞共培养,之后再用沙门菌感染,发现巨噬细胞没有出现大量死亡。研究者又分别用3种方式预处理的巨噬细胞,依次是用necrostatin-1抑制RIPK1的巨噬细胞、敲除IFN-I受体的巨噬细胞和敲除RIPK3的巨噬细胞,之后都用沙门菌感染,最后发现巨噬细胞死亡数都有明显的降低[9]。在更深入的研究中,研究人员用沙门菌感染IFN-I受体和RIPK3缺陷型的小鼠,发现这两种小鼠的巨噬细胞数明显比同样感染的野生型小鼠的巨噬细胞多,前两者的细菌滴度明显比野生型小鼠的细菌滴度低[9]。在这个例子中,巨噬细胞的程序性坏死有利于限制沙门菌在巨噬细胞内的增殖。
2.3单核细胞增生李斯特菌单核细胞增生李斯特菌(Listeria monocytogenes,LM)是一种兼性胞内病原菌,它在感染宿主巨噬细胞内或者非巨噬细胞内都能复制生存。一旦LM被宿主细胞以吞噬小体的形式吞进胞内后,在被运送至溶酶体之前,其产生的毒力因子李斯特菌溶血素O(Listeriolysion O,LLO)就会发挥作用,帮助其从吞噬小体中逃离,从而避免被溶酶体中各类酶降解破坏。之前有研究认为LM可引起的巨噬细胞死亡,可能与焦亡有关而不是凋亡[17]。但最近有研究发现一种非焦亡并与炎症相关的细胞死亡可能也参与到LM导致巨噬细胞死亡过程中来,当LM感染小鼠后,小鼠肝脏中的Kuffer细胞会发生大量死亡并伴随有大量炎症因子的分泌。这种死亡方式不依赖caspase-1就可以发生,所以排除细胞发生焦亡。此外,当小鼠感染Dhly基因突变株(不产生LLO的LM)后,Kupffer细胞死亡就没有发生,一般含有LLO的LM能激发宿主细胞产生TNF[18],最近有研究证实LLO家族的前体也能通过直接活化RIPK1/RIPK3信号通路来诱导细胞程序性死亡[8]。因此有理由相信这种细胞死亡是穿孔素(LLO)与RIPK1/RIPK3信号通路导致的程序性坏死。同时,当LM感染Ifnar-/-小鼠,发现Kupffer细胞同样没有出现死亡,提示I型干扰素介导的信号通路极有可能也在LM导致的Kupffer细胞死亡机制中发挥了重要作用。而用LM去感染RIPK1的抑制剂necrostatin-1预先处理的小鼠后,Kupffer细胞死亡数量明显减少。以上数据均提示RIPK1/RIPK3信号通路介导的细胞程序性死亡在清除LM感染的过程中发挥重要作用。
2.4鼠疫耶尔森菌鼠疫耶尔森菌是一种革兰阴性细菌,是鼠疫的主要病原菌。鼠疫主要的临床表现为发烧、腹痛、腹泻同时在脾脏、肝脏和淋巴结伴有组织坏死和肉芽肿的形成[19]。鼠疫耶尔森菌一系列的外膜蛋白(Yops)是其主要的毒力因子,Yops通过细菌的三型分泌系统进入宿主细胞中发挥作用[20]。最近的一些研究发现当使用necrostatin-1抑制RIPK1后,由鼠疫耶尔森菌诱导的巨噬细胞死亡数降低。用鼠疫耶尔森菌感染RIPK1缺陷巨噬细胞后,细胞死亡数也大量减少,这表明RIPK1在鼠疫耶尔森菌诱导宿主巨噬细胞死亡过程中发挥着关键作用[7]。再进一步探索研究研究者发现鼠疫耶尔森菌诱导巨噬细胞大量死亡不仅需要RIPK1参与,同时也需要Caspase-8和RIPK3的加入[20]。有趣的是,当单独抑制或敲除Caspase-8和RIPK3两种分子的一种,巨噬细胞死亡并不能被完全阻止,只有当同时抑制或敲除Caspase-8和RIPK3时,巨噬细胞死亡才会被完全抑制[7]。以上研究发现表明在鼠疫耶尔森菌诱导巨噬细胞死亡过程中,其激活RIPK1后,RIPK1既能活化Caspase-8依赖的凋亡途径也能活化RIPK3依赖的程序性坏死途径最终导致巨噬细胞死亡。人们认为在鼠疫耶尔森菌感染宿主细胞时发生RIPK1和RIPK3依赖的程序性坏死主要是YopJ在其中发挥了重要作用,YopJ是鼠疫耶尔森菌一种外膜蛋白毒力因子。用缺少YopJ的鼠疫耶尔森菌突变体感染巨噬细胞,RIPK1和RIPK3依赖的程序性坏死在很大程度上被抑制[7]。巨噬细胞发生程序性坏死,有利于宿主清除入侵机体的鼠疫耶尔森菌。
3 小结与展望
文中介绍的几种兼性胞内菌在感染宿主时,宿主细胞尤其是最先与细菌接触并能把菌体吞噬的巨噬细胞发生由RIPK1/RIPK3信号通路介导的程序性坏死。这种细胞死亡方式最大特点就是细胞膜发生破损,细胞内容物溢出引起宿主强烈的免疫反应,包括更多炎症因子的分泌以及更多免疫细胞聚集到感染部位发挥抗菌作用,同时兼性胞内菌也无法从破碎的细胞中获得生存所需的营养,最终导致入侵宿主的细菌被清除。这种死亡方式会导致部分的宿主细胞死亡,但这些已经被感染的细胞已经无法发挥正常功能,还可能会成为细菌增殖的温床,所以宿主选择让这些细胞死亡,对整个宿主抗感染过程具有重要意义。
细菌感染可以调节宿主细胞的多种应答反应。其中一种应答反应就是细胞程序性坏死。程序性坏死在病原体感染宿主过程中发挥积极作用。这种由 RIPK1和RIPK3介导的细胞程序性坏死,一方面能够帮助清除已经被细菌感染的宿主细胞,另一方面可以使某些已经被宿主细胞胞吞的兼性胞内菌重新暴露在宿主的抗菌机制面前,帮助宿主清除这些细菌,消除感染。在研究病原体感染和宿主细胞死亡过程中,我们需要全面的看待宿主细胞死亡的作用,不能只看到细胞死亡对宿主不利的一面,还需要看到细胞死亡对宿主有利的方面,综合分析才能了解清楚机体与病原体之间相互影响的真正意义。
[1] Lin JC,Tsao MF,Lin YJ.Differential impacts of alternative splicing networks on apoptosis[J].Int J Mol Sci,2016,17(12):2097.
[2] Bonafede MM,Curtis JR,McMorrow D,et al.Treatment effectiveness and treatment patterns among rheumatoid arthritis patients after switching from a tumor necrosis factor inhibitor to another medication[J].Clinicoecon Outcomes Res,2016,8:707-715.
[3] D’Herde K,Krysko DV.Ferroptosis:Oxidized PEs trigger death[J].Nat Chem Biol,2016,13(1):4-5.
[4] Shulga N,Pastorino JG.Ethanol sensitizes mitochondria to the permeability transition by inhibiting deacetylation of cyclophilin-D mediated by sirtuin-3[J].J Cell Sci,2016,129(13):2685.
[5] Kofahi HM,Taylor NG,Hirasawa K,et al.Hepatitis C virus infection of cultured human hepatoma cells causes apoptosis and pyroptosis in both infected and bystander cells[J].Sci Rep,2016,6:37433.
[6] Ma W,Tummers B,van Esch EM,et al.Human papillomavirus downregulates the expression of ifitm1 and ripk3 to escape from ifnγ- and tnfα-mediated antiproliferative effects and necroptosis[J].Front Immunol,2016,7:496.
[7] Saleh D,Degterev A.Emerging roles for RIPK1 and RIPK3 in pathogen-Induced cell death and host immunity[J].Curr Top Microbiol Immunol,2015,10:23-24.
[8] Blériot C,Lecuit M.The interplay between regulated necrosis and bacterial infection[J].Cell Mol Life Sci,2016,73(11-12):2369-78.
[9] Robinson N,McComb S,Mulligan R,et al.Type I interferon induces necroptosis in macrophages during infection with Salmonella enterica serovar Typhimurium[J].Nat Immunol,2012,13(10):954-962.
[10] Pawar K,Hanisch C,Palma Vera SE,et al.Down regulated lncRNA MEG3 eliminates mycobacteria in macrophages via autophagy[J].Sci Rep,2016,6:19416.
[11] Clay H,Volkman HE,Ramakrishnan L.Tumor necrosis factor signaling mediates resistance to mycobacteria by inhibiting bacterial growth and macrophage death[J].Immunity,2008,29(2):283-94.
[12] Roca FJ,Ramakrishnan L.TNF dually mediates resistance and susceptibility to mycobacteria via mitochondrial reactive oxygen species[J].Cell,2013,153(3):521-534.
[13] Scallan E,Hoekstra RM,Angulo FJ,et al.Foodborne illness acquired in the United States-major pathogens[J].Emerg Infect Dis,2011,17(1):7-15.
[14] Gokulan K,Khare S,Rooney AW,et al.Impact of plasmids,including those encodingVirB4/D4 type IV secretion systems,on Salmonella enterica serovar heidelberg virulence in macrophages and epithelial cells[J].PloS one,2013,8(10):77866.
[15] Agnihothram SS,Basco MD,Mullis L,et al.Infection of murine macrophages by salmonella enterica serovar heidelberg blocks murine norovirus infectivity and virus-induced apoptosis[J].PloS one,2015,10(12):0144911.
[16] Broz P,Ruby T,Belhocine K,et al.Caspase-11 increases susceptibility to Salmonella infection in the absence of caspase-1[J].Nature,2012,490(7419):288-291.
[17] Wu J,Fernandes-Alnemri T,Alnemri ES.et al.Involvement of the AIM2,NLRC4,and NLRP3 inflammasomes in caspase-1 activation by listeria monocytogenes[J].J Clin Immunol,2010,30(5):693-702.
[18] dos Santos SA,de Andrade Júnior DR,de Andrade DR.TNF-α production and apoptosis in hepatocytes after listeria monocytogenes and Salmonella typhimurium invasion[J].Rev Inst Med Trop Sao Paulo,2011,53(2):107-12.
[19] Bi Y.Immunology of yersinia pestis infection[J].Adv Exp Med Biol,2016,918:273-292.
[20] Deuschle E,Keller B,Siegfried A,et al.Role of β1 integrins and bacterial adhesins for yop injection into leukocytes in yersinia enterocolitica systemic mouse infection[J].Int J Med Microbiol,2016,306(2):77-88.
10.15972/j.cnki.43-1509/r.2017.02.018
2016-12-23;
2017-02-21
国家自然科学基金(81373230,81301470).
*通讯作者,E-mail:hengyangzhfj@126.com.
R363
A
秦旭平)
