急性胰腺炎后胰腺内分泌变化临床研究
2017-12-22曲鹏飞韩俊泉杜瑞斌崔乃强
曲鹏飞,王 红,韩俊泉,杜瑞斌,肖 继,崔乃强
论 著
急性胰腺炎后胰腺内分泌变化临床研究
曲鹏飞1,王 红1,韩俊泉1,杜瑞斌1,肖 继1,崔乃强2
目的:观察研究急性胰腺炎后胰腺内分泌变化。方法:选取既往无糖尿病病史的急性胰腺炎住院患者60例为急性胰腺炎组,既往无糖尿病病史正常体检者30人为对照组。测定入院时、入院次日晨空腹、入院后第3 d晨空腹、入院后第7 d晨空腹血糖、胰岛素和C肽,比较两组结果。结果:急性胰腺炎组血糖在入院时[(7.2±1.4)mmol/L]、24 h[(7.3±2.3)mmol/L]、3 d[(9.4±1.6)mmol/L]较对照组[(4.3±1.8)mmol/L]升高,具有统计学意义,入院后7 d血糖[(4.5±1.2)mmol/L]较对照组无明显升高。急性胰腺炎组血清胰岛素在入院后24 h [(10.0±3.0)μIU/mL]、3 d [(9.5±2.6)μIU/mL]较对照组[(11.4±0.6)μIU/mL]降低,具有统计学意义(P<0.05),入院时[(11.8±2.7)μIU/mL]及入院后7 d [(11.9±2.7)μIU/mL]血清胰岛素较对照组无明显变化。急性胰腺炎组血清C肽在入院后24 h [(1.3±0.6)ng/mL]、3 d [(1.3±0.3)ng/mL]较对照组 [(1.5±0.5)ng/mL]降低,入院时 [(1.4±0.3)ng/mL]及入院后 7 d [(1.5±0.3)ng/mL]血清C肽较对照组无明显变化。急性胰腺炎组血糖值随着发病时间延长呈现先升后降趋势,发病后7 d血糖基本恢复。血清胰岛素及C肽值则呈现先降后升趋势。结论:急性胰腺炎患者随着病情发展血糖先升后降,胰岛素及C肽先降后升,提示急性胰腺炎患者胰腺内分泌功能失调。
急性胰腺炎;胰腺内分泌;内分泌功能
急性胰腺炎(acute pancreatitis,AP)时内分泌系统的变化引起国内外学者重视。胰腺炎急性期通常伴有表现为尿糖和血糖水平升高的胰腺内分泌功能障碍。AP时糖代谢异常,归因于胰岛内分泌细胞被破坏,功能丧失,内分泌激素水平紊乱,由此为AP的研究提供新的思路。关于胰腺内分泌系统的功能,人们了解最多的是涉及血糖的稳态调节。血糖值波动主要归因于胰岛内分泌激素紊乱,胰岛素是降低血糖的重要激素。胰岛素原在酶的作用下逐渐分解出等量的胰岛素和C肽。胰岛素与锌结合,以结晶形式贮存于β颗粒中,其半衰期短,易被肝脏降解。C肽水平较稳定,其测定不受胰岛素抗体及外源性胰岛素的影响,C肽可比胰岛素更稳定和更准确地反映β细胞功能。AP尤其重症急性胰腺炎胰岛内分泌细胞受到破坏。胰腺炎患者胰腺内、外分泌功能均有损伤,但是损伤的病理生理学机制尚未被阐明。本研究主要通过观察AP患者在不同时间点血糖、胰岛素以及C肽水平的变化,分析其变化情况,探讨AP后胰腺内分泌功能变化。
1 资料与方法
1.1 一般资料 纳入标准:选取2012年9月—2015年2月我院诊断为AP,18周岁<年龄<60周岁的,就诊距发病时间<6 h患者。既往无糖尿病病史。入院后给予禁食水,肠外营养支持等基础治疗,未予中药治疗的患者。共收集符合标准的病人60例作为AP组,男性32例,女性28例,年龄范围23~60岁,平均年龄(51.2±11.2)岁。另外选取2012年9月—2015年2月我院治未病中心体检,既往无糖尿病病史者共30人作为对照组,其中男性17例,女性13例,年龄范围23~60岁,平均年龄(49.0±15.4)岁。结果见表1。

表1 一般资料比较
1.2 诊断标准 依据新修订的Atlanta标准诊断为AP,符合以下3个特点:(1)急性起病的持续、严重腹痛,疼痛常放射到背部,伴有恶心、呕吐。(2)血清淀粉酶至少大于正常上限3倍。(3)影像学检查发现急性胰腺炎。如果腹痛剧烈,血清淀粉酶和/或脂肪酶的活性,小于3倍正常上限的,确认诊断应依靠影像检查。具有(1)、(2),或者(3)即可诊断。
1.3 观察指标 血糖值由天津中医药大学第二附属医院生化室测定。AP组的患者在入院时、入院次日晨空腹、入院后第3日晨空腹、入院后第7日晨空腹分别采集外周静脉血5 mL。由我院生化室测定血糖、胰岛素和C肽。
1.4 统计学方法 采用 SPSS 14.0统计学软件进行分析,计量资料以()表示,组间比较采用t检验。
2 结果
各组患者血糖、胰岛素、C肽结果显示:AP组血糖在入院时、24 h、3 d时较对照组升高(P<0.05),具有统计学意义,入院后7天血糖较对照组无明显升高(P>0.05)。AP组血清胰岛素在入院后24 h、3 d较对照组降低(P<0.05),具有统计学意义,入院时及入院后7天血清胰岛素较对照组无明显变化(P>0.05)。AP组血清C肽在入院后24 h、3 d较对照组降低(P<0.05),具有统计学意义,入院时及入院后7天血清C肽较对照组无明显变化(P>0.05)。数据显示AP组患者血糖值随着发病时间延长呈现先升后降趋势,发病后7 d血糖基本恢复,血清胰岛素及C肽值呈先降后升趋势(结果见表2、图1)。

图1 各组血糖、胰岛素、C肽值
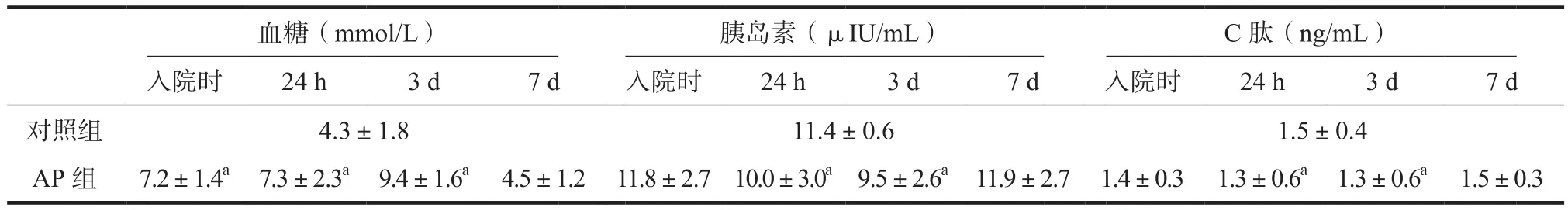
表2 各组血糖、胰岛素、C肽值
3 讨论
AP是外科常见的急腹症,轻症者病情较平稳、病死率低,而重症患者多病情凶险、并发症多、病死率高。AP病人经常伴有高血糖及尿糖,表明AP对胰腺的内分泌功能有一定的影响。目前对胰腺外分泌系统在AP时的变化有较深入的了解。胰腺内、外分泌系统在结构与功能上是统一的整体,通过胰岛-腺泡轴,内外分泌系统紧密联系,且在病理情况下相互影响[1]。AP急性发作后恢复期因胰岛功能受损,极易引起并发症。AP时胰腺内分泌系统的变化引起国内外学者重视。
胰腺是具有外分泌和内分泌功能的腺体,AP主要是胰腺外分泌功能异常导致的疾病,但胰腺内分泌系统与AP关系密切。胰腺外分泌部由腺泡细胞和导管细胞组成,腺泡细胞是主要细胞,分泌各种消化酶。内分泌部即胰岛B细胞是胰岛最主要的细胞,分泌胰岛素,其主要功能是帮助外周组织摄取葡萄糖,在局部影响胰腺的增殖和调节胰腺的外分泌功能。胰腺外、内分泌系统依靠相互之间的毛细血管网连接,二者在细胞起源、显微结构等方面为统一的整体,形成所谓的“胰岛-腺泡轴”,二者紧密联系且在功能上相互影响[1]。胰腺炎患者胰腺内、外分泌功能均有损伤,但是损伤的病理生理学机制尚未被阐明[2]。近年来研究显示胰腺内、外分泌系统之间有很强的功能联系[3],它们在生理及病理状态下相互影响,关系十分密切。既往传统的研究及治疗主要集中于AP胰腺外分泌系统的功能受损,对内分泌系统功能受损的研究较少。AP源于外分泌系统,胰蛋白酶原异常激活可导致胰腺腺泡细胞破坏,通过胰岛-腺泡轴影响胰岛内分泌细胞,使胰岛细胞分泌的C肽、胰岛素、胰高血糖素(GG)等发生波动,临床以血糖波动为表现,它的变化仅在一定程度反映了胰岛内分泌细胞功能的变化,C肽、胰岛素和GG可以明确反映内分泌细胞改变[4]。有研究认为AP时胰腺内分泌主要病理改变在于腺泡和胰岛的破坏,可能继发于外分泌系统的变化[5]。
AP时胰腺内、外分泌功能均有变化,AP是发生于胰腺外分泌部的疾病,在发病过程中常伴有胰腺内分泌功能的异常。有研究发现AP伴有胰岛素抵抗,给予外源性葡萄糖刺激时则表现为胰岛素分泌能力减弱,重症AP时上述现象尤为明显。研究发现AP时胰腺组织结构被破坏,胰腺内分泌细胞功能受到影响,早期血清胰岛素和GG升高4~5倍。由此证实,AP尤其重症AP胰岛内分泌细胞受到破坏。另有研究发现AP引起的应激反应可使组织对胰岛素的敏感性降低及反应性低下导致胰岛素抵抗。
AP时糖代谢异常,归因于胰岛内分泌细胞被破坏[6],功能丧失,内分泌激素水平紊乱,可以为AP的研究提供新思路。但各种因素如何影响内分泌细胞,内分泌细胞的亚细胞结构如何被破坏[7],各种内分泌细胞对致病因素的耐受程度等都有待于进一步研究。胰腺炎时机体处于应激状态,体内糖皮质激素与GG分泌升高[8],胰岛素的分泌与释放减少,特别是炎症促使GG释放增加,甚至可达正常血液水平的10倍。AP患者的内分泌功能受到了一定的影响,并与胰腺病变的轻重程度有关。AP出现应激性高血糖主要是在发病早期,患者处于应激状态时可使交感神经兴奋性增高,使GG代偿性分泌增多,出现一过性血糖升高,一般为轻度升高;另一方面,当胰腺发生急性炎症时,由于胰腺组织出现微循环障碍,导致水肿、缺血、坏死,影响了胰岛素的分泌和排泄,促使血糖升高[9]。
研究发现[10],AP后超过40%患者伴有胰腺外分泌和内分泌功能障碍,胰腺炎后32%患者都被新确诊为糖尿病。伴有慢性疾患的胰腺炎患者更有可能发展成糖尿病[11]。诸多研究发现AP时患者血糖异常。约50%的AP患者可出现暂时性高血糖,30%的患者有尿糖增高[12]。张毅等[13]研究发现急性胰腺炎后约18.25%的病人发现糖尿病情况,重型胰腺炎病人62.5%血糖 > 11.1 mmol/L,46.66%后期出现糖尿病情况。对AP并发高血糖患者,通过严密的血糖监控和正确使用胰岛素,以及严格的营养支持和饮食护理,能使患者血糖水平维持在正常范围内,从而减少并发症的发生,提高生存率[14]。葛春林等[15]研究发现有34.2%的AP患者出现了应激性高血糖,其中重症AP的发生率明显高于轻型AP,说明这部分AP患者的内分泌功能受到了一定的影响,影响程度与胰腺炎症的轻重程度密切相关。研究发现[16]AP患者恢复期血糖、胰岛素、C肽、GG的动态变化,发现发病时一各指标与对照组比较,均值升高,各指标在恢复期逐渐恢复,但仍未恢复到正常水平。这都证实了AP患者血糖升高的普遍性。
此观察研究结果显示AP组血糖在入院时、24 h、3 d较对照组升高(P<0.05),具有统计学意义,入院后7天血糖较对照组无明显升高(P>0.05)。AP组血清胰岛素在入院后24 h、3 d时较对照组降低(P<0.05),具有统计学意义,入院时及入院后7天血清胰岛素较对照组无明显变化(P>0.05)。AP组血清C肽在入院后24 h、3 d时较对照组降低(P<0.05),具有统计学意义,入院时及入院后7天血清C肽较对照组无明显变化(P>0.05)。数据显示AP组与对照组相比血糖值随着发病时间延长呈现先升后降趋势,发病后7天血糖基本恢复。血清胰岛素及C肽值呈先降后升趋势。证实了AP患者胰腺内分泌功能受损的确存在。
高血糖和胰岛素抵抗在危重病患者病程中亦普遍存在[17]。重症AP时内分泌激素水平的异常提示患者存在内分泌部损伤[18]。重症AP患者初期出现较高水平血糖可引起机体严重的病理生理改变,可增加患者并发症发生率及病死率,从而影响重症AP全过程病情的发展,而血糖控制的程度直接影响患者的预后。临床治疗应重视监测与控制血糖[19]。血糖升高易导致AP患者合并糖尿病,从而引起相应的并发症。因此临床上对AP患者要注意血糖监测,及时发现因胰岛功能紊乱而出现的糖尿病,及时处理,避免并发症[20]。研究发现C反应蛋自、血糖测定简单、快速,在AP严重程度及预后评估方面有重要意义,对重症胰腺炎的病情监测有价值[21]。因此血糖监测在胰腺炎的治疗中意义重大,临床上应充分重视胰腺炎后导致的胰腺内分泌变化。
胰腺内、外分泌系统在结构与功能上是统一的整体,通过胰岛-腺泡轴,内、外分泌系统紧密联系,且在病理情况下相互影响。AP急性发作后恢复期因胰岛功能受损,极易引起并发症的发生。AP时胰腺内分泌系统的变化引起国内外学者重视。胰腺炎患者胰腺内、外分泌功能均有损伤,但是损伤的病理生理学机制尚未被阐明。AP时糖代谢异常,归因于胰岛内分泌细胞被破坏,功能丧失,内分泌激素水平紊乱。由此为AP的研究提供新的思路,但各种因素如何影响内分泌细胞,内分泌细胞的亚细胞结构如何被破坏,各种内分泌细胞对致病因素的耐受程度等都有待深入研究。
[1] Barreto SG, Carati CJ, Toouli J, et al. The islet-acinar axis of the pancreas: more than just insulin [J]. Am J Physiol Gastrointest Liver Physiol, 2010, 299(1): G10-22.
[2] Andersson B, Pendse ML, Andersson R. Pancreatic function,quality of life and costs at long-term follow-up after acute pancreatitis [J].World J Gastroenterol, 2010, 16(39): 4944-4951.
[3] 张新明, 孙诚谊. 胰腺内外分泌系统结构与功能关系 [J]. 国外医学外科学分册, 2004, 31: 36-39.
[4] 袁永. 重症胰腺炎血糖测定临床意义 [J]. 中国误诊学杂志,2005, 5(7): 1269-1270.
[5] Virji MA, Rao KN. Acute hemorrhagic pancreatitis in mice: A study of glucoregulatory hormones and glucose, metaloolism [J].Am J Pathol, 1985, 118(1): 162-167.
[6] Wu D, Xu Y, Zeng Y, et al. Endocrine pancreatic function changes after acute pancreatitis [J]. Pancreas, 2011, 40(7): 1006-1011.
[7] Sheverdin luP. Pancreatic endocrine function in patients with acute pancreatitis [J]. Khirurgiia(Mosk), 1992, 1(1): 62-64.
[8] 张斌. 感染与胰岛素抵抗 [J]. 国外医学外科分册, 1997, 24:147.
[9] 石刚,陶淘,冯晓芬,急性胰腺炎患者血糖、血钙变化及临床意义[J]. 川北医学院学报,2009,24(3):244-245.
[10] Hochman D, Louie B, Bailey R. Determination of patient quality of life following severe acute pancreatitis [J].Can J Surg, 2006,49(2): 101-106.
[11] Banks PA, Conwell DL, Toskes PP. The management of acute and chronic pancreatitis [J]. Gastroenterol Hematol, 2010, 6(2): 1-16.
[12] 曾加贤. 胰岛素持续泵入治疗急性重症胰腺炎继发高血糖的疗效观察 [J]. 中国医药指南, 2011, 9(2): 72-73.
[13] 张毅, 李路涛, 孙惠文, 等. 急性胰腺炎病人血糖和后期糖尿病的关系 [J]. 糖尿病新世界, 2014, 7: 30-31.
[14] 刘湘林, 朱丽萍, 刘彦莉, 等. 急性胰腺炎并发高血糖的护理干预 [J]. 西南国防医药, 2013, 1(23): 90-91.
[15] 葛春林, 何三光, 郭仁宣. 急性胰腺炎患者血糖和血脂的变化及临床意义 [J]. 中华普通外科杂志, 2001, 16(2): 127-128.
[16] 吉丽, 段稚, 郑宪玲, 等. 急性胰腺炎恢复期患者血糖、胰岛素、肽、胰高血糖素动态研究 [J]. 四川医学, 2011, 32 (9): 1434-1435.
[17] 罗艳红, 钟广伟, 赵双平, 等. 应用电针干预重症早期急性胰腺炎并发肠麻痹 [J].中国针灸, 2011, 31(2): 105-109.
[18] 陈颖, 陈辰, 余佳, 等. 重症急性胰腺炎大鼠胰腺内分泌功能研究 [J]. 微循环学杂态, 2012, 22(1): 20-22.
[19] 张潇颖, 林子琦, 薛平, 等. 重症急性胰腺炎患者初期合并不同水平高血糖的临床研究 [J]. 四川大学学报(医学版), 2013,44(6): 974-978.
[20] 刘胜雄. 急性胰腺炎的糖尿病发病率与风险因素的研究 [J]. 中国实用医药, 2012, 7(16): 138-139.
[21] 张东艳. 急性胰腺炎患者C反应蛋白、血糖变化及螺旋CT检查的临床意义 [J]. 现代预防医学, 2012, 39(17): 4588-4589.
Clinical Study on Endocrine Changes in Pancreas after Acute Pancreatitis
QU Peng-fei,WANG Hong,HAN Jun-quan,et al. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin(300150), China
ObjectiveTo observe the changes of pancreatic endocrine after acute pancreatitis (AP).MethodsSixty cases of hospitalized patients with AP were selected as observation group, meanwhile, 30 healthy people were selected as control group. All of them were without the history of diabetes mellitus. The fasting blood glucose, insulin and C peptide were measured on the morning of the day, next day, day 3 and day 7 after admission. The results were compared between the observation group and control group.ResultsThe values of fasting blood glucose in the observation group at admission, 24 h later and 3 d after admission were (7.2±1.4),(7.3±2.3) and (9.4±1.6) mmol/L, respectively, which were higher than that in the control group [(4.3±1.8)mmol/L] (P < 0.05). However, there was no statistical significance on day 7 between two groups. The levels of serum insulin in observation group were (10.0±3.0) μIU/mL at 24 h, (9.5±2.6) μIU/mL 3 d after admission.Compared with the control group [(11.4±0.6) μIU/mL], there was statistical significance (P< 0.05), but it was not statisticly significant compared with the control group at admission and on day 7 after admission. The levels of serum C peptide in observation group were (1.3±0.6) and (1.3±0.3) ng/mL on day 1 and 3 after admission,which were decreased compared with the control group [(1.5±0.5) ng/mL]. The levels of serum C peptide in observation group at admission [(1.4±0.3) ng/mL] and on day 7 after admission [(1.5±0.3) ng/mL] had no significant difference compared with control group. In the AP group, the blood sugar increased first and then decreased after the onset time, and the blood sugar basically recovered 7d after the onset. The serum insulin and C peptide showed the trend of decreasingfirst and then rising.ConclusionWith the development of AP, the level of blood sugar rises first and then drops,however, the levels of insulin and C peptide fall first and then rise. It is suggested that there is dysfunction of pancreatic endocrine in patients with AP.
Acute pancreatitis; pancreatic endocrine; endocrine function
R657.5+1
A
1007-6948(2017)06-0583-05
10.3969/j.issn.1007-6948.2017.06.001
国家自然科学基金项目(81202780)
1.天津中医药大学第二附属医院普外科(天津 300150)
2.天津市南开医院(天津 300193)
王 红,Email:ctwanghong@sina.com
(收稿:2017-02-20 修回:2017-10-26)
屈振亮)
