代谢组学技术在营养学研究中的应用
2017-12-21张海丽辛凤姣王凤忠
许 腾,张 玥,张海丽,辛凤姣,王 艳,王凤忠
(中国农业科学院农产品加工研究所,北京 100081)
代谢组学技术在营养学研究中的应用
许 腾,张 玥,张海丽,辛凤姣,王 艳,王凤忠
(中国农业科学院农产品加工研究所,北京 100081)
代谢组学可以系统性地研究生物体受到扰动或干预后整体代谢水平的变化。文章概述了代谢组学技术的生物样品采集与制备、分析技术、数据处理与统计分析、差异代谢物结构鉴定与代谢通路分析等方法与步骤及其在营养学研究领域中的应用,展望了代谢组学技术在营养学研究领域的应用前景,以期为下一步的研究提供参考。
营养学;代谢组学;核磁共振;气相色谱-质谱;液相色谱-质谱
生物个体的各项生命活动以交织复杂的代谢网交互作用和影响,基于代谢组学的研究能够反映出机体受到内外环境改变或扰动后相互协调的最终结果,而这个结果在代谢水平上得以放大,从而可以将宏观的个体表征与机体内在的微观因素联系起来[1-2]。代谢组学起步相对较晚,近年来,高分辨率、高灵敏度的现代分析仪器和技术的进步推动了代谢组学的迅猛发展,目前,代谢组学已被广泛应用到微生物学、动植物学、医药学、食品科学和环境科学等多个研究领域[3]。运用代谢组学技术建立起细胞与生物体小分子代谢产物复杂体系的研究模式,可以系统地研究食物的营养成分与机体的相互作用[4],从而预防和干预一些慢性疾病和癌症的发生与发展。
代谢组学是对基因组学、转录组学与蛋白质组学研究内容的扩展和延伸,因为小分子代谢物质才是生物体生命活动的表征和最终结果[5-8],或者可以说代谢组学可作为探索机体内部信息机制的窗口。生物体内存在复杂、庞大的代谢网络,承担着机体内部物质、能量的产生与调节等生命活动[9-10],这之中起调节作用的物质大部分是广泛存在于体内的小分子代谢物质[2]。代谢组学技术通过非靶向的研究可以全景式地观测到机体代谢轮廓的变化,而对小分子化合物进行定量靶向研究[11],能尽可能多地掌握机体内部代谢化合物的上调与下调,及其变化对疾病、基因及外界环境因子的影响。
1 代谢组学研究的步骤与方法
代谢组学的研究步骤包括生物样品采集与制备、分析技术、数据处理与统计分析、差异代谢物结构鉴定与代谢通路分析等几个部分[12-13]。
1.1 生物样品采集与制备
生物样品的采集与制备是进行代谢组学分析和研究的初始步骤,也在一定程度上决定了能否获得可靠的实验结果。采集的样本需要有一定的代表性,且应尽量避免因样品本身存在的个体差异对后续的检测分析结果产生的影响,同时在研究人类或动物组织样品时,还需要考虑地域、年龄、性别、饮食及先天基因等多种因素的影响[14]。代谢组学的生物样品一般为尿液、血液和组织等,组织样品采集后,为避免代谢物改变,应迅速进行淬灭、预处理等操作,血液和尿液等体液样品不需要猝灭,采集后应立即进行低温离心,以除去细胞。处理后的样品于-80℃或者液氮中保存,将样品分装成若干份,避免重复的冻结-解冻循环[15-16]。生物样品不同,采集方法不同,其预处理方法也各异,应根据不同的化合物、不同的分析手段,选择不同的提取条件和方法,进行方法优化。代谢产物通常是利用“相似相溶原则”,把不同极性的物质分开,进行下一步分析[17]。在大规模非靶向代谢组学研究中,为保证分析数据的精密度和准确度,通常需要制备质控(QC)样品,以监测分析方法的稳定性和可靠性。在采集与制备生物样品过程中,原则上应尽量保证代谢产物信息的完整性。
1.2 分析技术
代谢组学的分析手段主要包括以核磁共振(NMR)和色谱-质谱(GC/LC-MS)为核心的两大技术平台[18]。目前,没有任何一种技术能检测分析一个细胞或者一个样品中的全部代谢物,代谢组学的常用研究方法通常需要结合多种分析手段,将非靶向和靶向研究结合,实现优势互补。
1.2.1核磁共振技术—NMR NMR具有非选择性和高通量的优势,可对待测化合物进行无偏向、无创性的分析检测,结构解析准确,不需要繁琐的前处理过程[19]。特别是1H NMR,因对含氢代谢物具有广泛普适性而成为代谢组学分析的重要工具。NMR的缺点是灵敏度相对较低[20],检测线性范围窄,所需样品量相对质谱而言较多,且仪器的价格和维护费用比较昂贵,解决的办法是提高磁场强度、使用超低温探头来提高灵敏度等[21]。此外,还可以与色谱、质谱联用,如采用在线HPLC-NMR提高信号分辨率和对色谱峰的识别等[22]。
1.2.2气质联用技术—GC-MS 与代谢组学的其他分析方法相比,气相色谱技术发展较为成熟,气相色谱-质谱联用分析技术广泛用于多组分混合物中对未知组分的定性分析,具有高灵敏度、精密度及耐用性的特点[23],且仪器购置价格较为低廉,其对应的代谢物数据库较为完善和稳定,是应用较为广泛的一种代谢组学分析方法[24]。全二维气相色谱/飞行时间质谱方法(GC×GC-TOF-MS)可以检测到更多一维方法无法分离的色谱峰,具有更高的灵敏度和分辨效果,显著提高了分析的效率[25]。不足之处是,GC-MS分析样本准备工作比较繁琐,生物样品普遍需要衍生化处理才能检测到足够的代谢组分信息[26],且难以充分有效地利用GC-MS得到的全部信息。
1.2.3液质联用技术—LC-MS 相比于NMR灵敏度低、GC-MS样品处理较复杂等问题,LC-MS可以实现对代谢产物的快速分析与鉴定,获得精确分子量,其应用非常广泛。与GC-MS相比较而言,LC-MS对样本中代谢物信息的保留更加全面[27-28]。LC-MS常用的为电喷雾液质联用技术(LC-ESI-MS),特点是产生高电荷离子,使质荷比(m/z)降低到多数质量分析器可以检测的范围,扩展了分子量的分析范围[29-30]。同样,LC-MS也有缺陷,如在样品制备过程中,来自生物样本的低分子量代谢产物在有机溶剂萃取过程中将不可避免地丢失,目前其对应的代谢物库仍然不健全,这给后期对代谢物的分析造成了一定的困难与挑战。
1.3 数据处理与统计分析
利用代谢组学得到大量复杂、多维的信息后,如何正确分析和解释代谢组学的数据,如何利用可视化分析工具揭示其潜在规律是代谢组学研究的关键。数据处理主要包括对原始大数据的处理和管理、多元变量标准化与统计、代谢网络的模型构建和回归拟合、标志物和通路鉴定与分析[9]。代谢组学的数据处理通常是对采集得到的数据进行分组、分类辨别,主要手段为模式识别技术,包括非监督学习方法和有监督学习方法[17],进而研究机体受扰动后的代谢物变化规律及机制。其中,非监督方法将非人为干扰得到的分组与样品原始信息进行比较从而找出差异性物质,反映数据的原始状态,获得的结果与有监督学习方法相比更为客观,包括聚类分析、主成分分析和自组织图等;有监督学习方法是利用数学模型对样品进行辨别和分组,包括辨别式功能分析、人工神经网络、偏最小二乘法、偏最小二乘法-显著性分析联合法等[31]。近年来,支持向量机(SVM)方法表现出优于传统统计分析方法的预测精度,因此被广泛应用到代谢组学数据的统计分析与处理中[8]。通过对获得的多维复杂数据进行综合定量、比较与考察,实现对信息的降维和挖掘,识别出差异性代谢物[32-33]。
1.4 差异代谢物结构鉴定与代谢通路分析
基于GC-MS和LC-MS等技术得到的代谢物信息可通过二级质谱确定差异代谢物的分子量和分子式,对比化合物结构数据库、代谢物数据库,得到可能的生物标记物及其相关生物信息[34-35]。基于NMR的代谢组学,通过解析代谢物的化学位移(一般是1H NMR),结合数据库和文献对照对差异代谢物进行鉴定。识别机体中显著性差异代谢物,确定代谢网络中发生变化的关键信点及其影响的通路,最终阐明生物系统应对外界或机体内部相应刺激的调控机制。
2 代谢组学在营养学研究中的应用
代谢组学在营养学领域的应用称为营养代谢组学,指在生物体不同的健康状态与疾病状态下,利用代谢组学的方法系统性地研究膳食与生物体代谢之间的交互作用及其对人体健康的影响[36]。目前,我国正面临着营养缺乏与营养过剩的双重问题,营养相关的慢性病的患病率逐年上升,如糖尿病、高血压、肥胖等营养代谢病,严重威胁着国民健康[37]。研究表明,个性化膳食可使生物体内部代谢发生变化,进而影响生物体的健康状态。随着越来越多的人开始关注个性化营养的作用[38],相关的研究报道也逐渐增多,附图统计了Pubmed文献数据库中2002—2016年有关营养代谢组学研究的论文,从2010年开始,论文数目呈现指数趋势增长,这也说明营养代谢组学研究将会是未来营养学研究的一大热点。
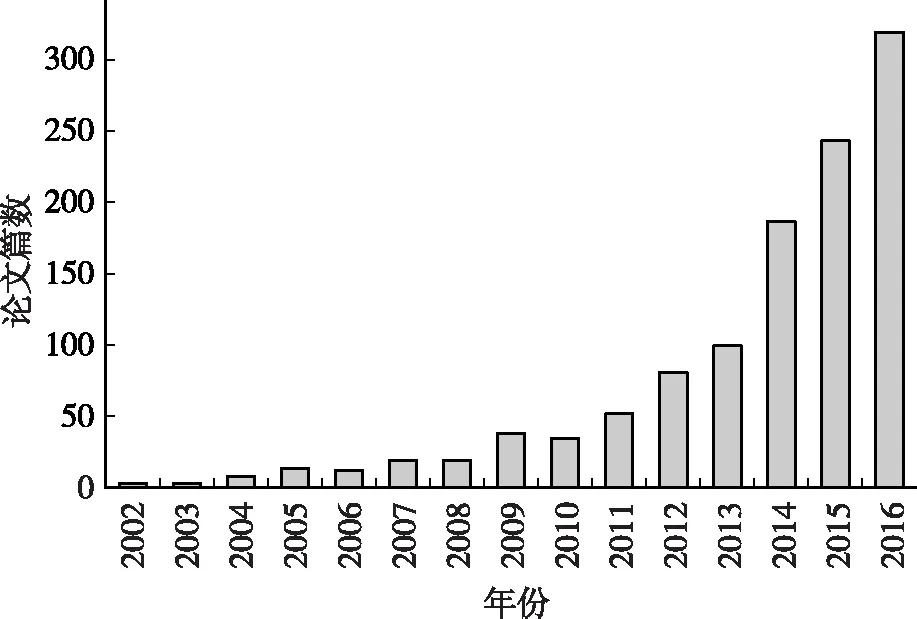
附图 pubmed数据库营养代谢组学相关论文统计
代谢组学为营养学的研究提供了新的方向和平台,现已广泛应用到多个营养学研究领域中,如食物中生物活性成分作用机制研究、不同饮食和生理状态下机体代谢差异研究、营养素量对机体代谢影响的研究、肠道微生物代谢的研究以及营养代谢病的研究。
2.1 食物中的生物活性成分对机体代谢的影响
食物能够提供给人体所必需的大多数营养物质,也能提供一些调节人体机能的活性成分,这些活性物质在机体中的代谢调控机制也是营养学研究的一项重要任务[1]。Solanky等[39]利用动物模型对表儿茶酸的作用进行了研究,基于NMR的代谢组学研究发现,表儿茶酸使SD大鼠内源代谢物水平发生了显著改变,尤其二甲胺、肌酐、牛磺酸、柠檬酸盐和α-酮戊二酸等,对差异性代谢物进行靶向分析,发现影响代谢通路的机制主要是通过表儿茶酸对肾脏功能的调节,使能量代谢从碳水化合物分解代谢转变为脂肪酸和氨基酸分解。Zheng等[40]运用NMR代谢组学与多元统计相结合的方法研究补充低聚乳果糖对结肠炎大鼠氨基酸代谢的影响,通过血清代谢物的分析发现,补充低聚乳糖可使模型大鼠体内异亮氨酸、缬氨酸、丙氨酸、柠檬酸、氧化三甲胺、牛磺酸浓度降低,琥珀酸的浓度增加,影响了其全身的氨基酸代谢,将有助于机体免受氨毒性和氧化损伤。Fu等[41]运用代谢组学方法研究了绿茶多酚对D-半乳糖诱导衰老大鼠的保护作用机制,基于超高效液相色谱-质谱分析技术对其血浆样品进行分析,结果表明,绿茶多酚可以通过干预卵磷脂、氨基酸和磷脂代谢途径发挥抗衰老作用。这些研究通过对特定的生物活性成分进行代谢组学研究,分析其对机体代谢通路造成的影响,阐明了特定活性成分的作用机制,有利于进一步研究与实施相应的干预策略。
2.2 不同饮食、生理状态下机体代谢差异的研究
代谢组学全组分的分析方法可以用来判断不同营养物质组成、不同饮食习惯及生理状态所对应的代谢表征。基于NMR的尿液代谢组学,Zheng等[42]研究了酪蛋白、乳清蛋白分别对肥胖青少年饮食干预的影响,为期12w的干预研究结果发现,酪蛋白脱脂牛奶干预后肥胖青少年尿中尿素排泄量显著增加,而乳清蛋白脱脂牛奶干预后尿素排泄没有显著影响[42]。Lindsay等[43]通过代谢组学方法研究了健康孕妇在妊娠阶段代谢的变化,结果表明,随着妊娠过程的进展,母体血浆中的几种必需和非必需氨基酸、长链多不饱和脂肪酸、左旋肉碱、乙酰肉碱、磷脂酰胆碱、神经鞘磷脂浓度均有明显下降。Accardi等[44]通过基于高分辨质谱的代谢组学对军事特定人员的营养状况和健康指标进行分析,获取军事特定人群的血清样本并研究其代谢差异,结果得到了61种代谢物可以作为生物标志物,用来评估特定军队机体的营养和健康状况[44]。
2.3 营养素对机体代谢影响的研究
食物能够为机体提供营养与能量,营养素缺乏或过量都会对机体代谢产生一定的影响。Toue等[45]基于代谢组学技术利用动物模型研究摄入过量的蛋氨酸对代谢的影响,发现蛋氨酸摄入过多会导致大鼠肾上腺和睾丸的白细胞计数减少、胸腺萎缩、溶血性贫血等症状。早期的研究结果揭示高半胱氨酸是监控蛋氨酸是否过量的良好标记物[46]。Kowalski等[47]运用代谢组学研究高脂肪日粮对小鼠骨骼肌葡萄糖代谢通路的影响,结果表明,过量的脂肪饮食可通过改变三羧酸循环导致肌肉葡萄糖代谢的缺陷。Matsuzaki等[48]通过血浆代谢组学研究发现,尿素和α-酮异已酸可能是氨基酸过量摄入时的标志物。以上研究表明,代谢组学在监控机体的营养素代谢方面有着独到的优势,可以为营养素的适量、安全摄入提供科学依据与数据支撑。
2.4 肠道微生物代谢的研究
食物被人体摄入后,进入肠道首先会经过肠道微生物的作用。食物影响肠道微生物环境,而肠道微生物的状态也会影响机体对食物成分的吸收与代谢[49-50]。Zheng等[51]研究了补充色氨酸对大鼠代谢的影响,基于代谢组学方法通过对大鼠肝组织、血清和粪便样品的分析,发现色氨酸补充促进了大鼠体内的蛋白质合成,降低粪便中的三甲胺等含胺类物质,能够调节肠道微生物代谢,降低大鼠体重。Takis等[35]基于NMR代谢组学研究白茶对人体尿液代谢谱的影响,发现高剂量摄入白茶对人体可能存在一定的危害,但是适量饮用白茶会提高机体肠道微生物菌群代谢物的浓度,如茶多酚、黄酮等具有高抗氧化能力的肠道菌群代谢物,引起代谢途径中马尿酸和柠檬酸上调、肌酐下降,增强机体肾功能。这些研究表明,肠道微生物代谢与人体代谢有着交互的作用和影响,代谢组学在肠道微生物相关研究的应用越来越广泛。通过代谢组学的研究,可以深入了解机体代谢与微生物相互作用后的代谢变化。
2.5 营养代谢病的研究
营养代谢病是由于营养素如蛋白质、脂肪、碳水化合物在体内的代谢失衡,使得体内一个或多个代谢过程异常改变导致内环境紊乱而引起的疾病,如糖尿病、高血压、肥胖、脂质代谢病等,严重危害人类健康,其发病机制及防治措施研究成为近几年医学研究的热点和难点[52-53]。Onuh等[54]研究了鸡皮蛋白水解肽饮食喂养原发性高血压大鼠的尿液和血浆代谢组学,分析鉴定出多种可能参与血压调节的生物标记物,且验证了代谢物变化为通过精氨酸代谢途径产生NO,从而达到血管舒张作用。Llorach等[55]通过HPLC-TOF-MS的代谢组学研究了20名有心血管疾病的志愿者在食用可可之后的代谢轮廓,揭示了可可与高血压、心血管疾病之间的关系,表明适量范围内食用可可,对心脑血管疾病有着积极的作用和影响。Men等[56]通过UHPLC-QTOF-MS代谢组学,从大鼠尿样中成功鉴定了20个与肥胖相关的标志代谢物。此外,Files等[57]采用代谢组学方法,揭示了老年急性肺损伤小鼠代谢谱与长链脂肪酸代谢相关。Gang等[58]发现脂质代谢和前列腺癌变有着密切的关系,研究表明,P300是调节脂肪酸合酶表达、脂质积累和前列腺癌细胞生长的关键因素[58]。以上研究表明,借助代谢组学能有效地阐明营养代谢病的发生、发展机制,为营养代谢病的预防和治疗奠定理论基础。
3 代谢组学在营养学研究中的挑战和展望
综上所述,代谢组学的研究方法从整体的角度评估不同的饮食、营养素、食物活性成分等对机体代谢的影响,探索生物体内代谢通路的改变,为营养学相关研究带来新的突破。近年来,随着分析仪器的发展与升级,NMR、MS等仪器分析能力的日益增强,代谢组学分析技术结合多维统计分析的方法在营养学研究中的作用日益凸显。当然,代谢组学分析技术也存在一些难题,如质谱和核磁数据解析必须依靠专业知识和技能,归纳出有用的信息,而且得到分析结果尚需得到进一步确认等。在未来的研究中,代谢组学方法将会更加完善和便捷,能更有效地应用于机制研究、营养干预及诊断中。同样,基于代谢组学的特点,对具有不同代谢表型的个体进行个性化的营养指导,可能成为今后营养代谢组学的重要研究方向。◇
[1]Nicholson J K,Lindon J C.Systems biology:metabonomics [J].Nature,2008,455(7216):1054-1056.
[2]许国旺,路鑫,杨胜利.代谢组学研究进展 [J].中国医学科学院学报,2007,29(6):701-711.
[3]Patti G J,Yanes O,Siuzdak G.Innovation:metabolomics:the apogee of the omics trilogy [J].Nature Reviews Molecular Cell Biology,2012,13(4):263-269.
[4]中国科学技术协会.2014—2015营养学学科发展报告 [M].中国科学技术出版社,2016.
[5]刘莉扬,崔鸿飞,田埂.高通量测序技术在宏基因组学中的应用 [J].中国医药生物技术,2013,8(3):196-200.
[6]王尧龙,黄璐琦,袁媛,等.药用植物转录组研究进展 [J].中国中药杂志,2015,40(11):2055-2061.
[7]赵静,王宏伟,田二杰,等.蛋白质组学实验技术及其应用 [J].动物医学进展,2015(1):116-120.
[8]周秋香,余晓斌,涂国全,等.代谢组学研究进展及其应用 [J].生物技术通报,2013(1):49-55.
[9]张双庆,黄振武.营养代谢组学技术在营养学研究中的应用 [J].卫生研究,2013,42(6):1041-1046.
[10]Bagchi D,Lau F,Bagchi M.Genomics,proteomics,and metabolomics in nutraceuticals and functional foods [J].International Plant & Animal Genome Conference XX,2010:185-217.
[11]Özdemir V,Kolker E.Precision Nutrition 4.0:A big data and ethics foresight analysis-convergence of agrigenomics,nutrigenomics,nutriproteomics,and nutrimetabolomics [J].Omics A Journal of Integrative Biology,2016,20(2):69-75.
[12]Brennan L.Metabolomics in nutrition research:current status and perspectives [J].Biochemical Society Transactions,2013,41(2):670-673.
[13]Brennan L.Metabolomics in nutrition research-a powerful window into nutritional metabolism [J].Essays in Biochemistry,2016,60(5):451-458.
[14]Daley M,Dekaban G,Bartha R,et al.Metabolomics profiling of concussion in adolescent male hockey players:a novel diagnostic method [J].Metabolomics,2016,12(12):185-193.
[15]Yin P,Zhou L,Zhao X,et al.Sample collection and preparation of biofluids and extracts for liquid chromatography-mass spectrometry [J].Methods in Molecular Biology,2015,1277:51-59.
[16]Yin P,Lehmann R,Xu G.Effects of pre-analytical processes on blood samples used in metabolomics studies [J].Analytical & Bioanalytical Chemistry,2015,407(17):4879-4892.
[17]李宁,范雪梅,王义明,等.代谢组学及其分析技术的研究进展 [J].中南药学,2014(7):668-673.
[18]刘思洁,吴永宁,方赤光.代谢组学技术在食品安全中的应用 [J].食品安全质量检测学报,2014(4):1081-1086..
[19]Clendinen C S,Pasquel C,Ajredini R,et al.13C NMR metabolomics:INADEQUATE network analysis [J].Analytical Chemistry,2015,87(11):5698-5706.
[20]Savorani F,Rasmussen M A,Mikkelsen M S,et al.A primer to nutritional metabolomics by NMR spectroscopy and chemometrics [J].Food Research International,2013,54(1):1131-1145.
[21]Gil A M,de Pinho P G,Monteiro M S,et al.NMR metabolomics of renal cancer:an overview [J].Bioanalysis,2015,7(18):2361-2374.
[22]Urban S.Applications in natural product chemical profiling and identification using HPLC-NMR and HPLC-MS methodologies [J].Planta Medica,2016,81:S1-S381.
[23]赵珊,王鹏程,冯健,等.代谢组学技术及其在中医药研究中的应用 [J].中草药,2015,46(5):756-765.
[24]Guo L,Tan S F,Li X,et al.Fast automated dual-syringe based dispersive liquid-liquid microextraction coupled with gas chromatography-mass spectrometry for the determination of polycyclic aromatic hydrocarbons in environmental water samples [J].Journal of Chromatography A,2016,1438:1-9.
[25]Santos A L D,Polidoro A D S,Schneider J K,et al.Comprehensive two-dimensional gas chromatography time-of-flight mass spectrometry (GC × GC/TOFMS)for the analysis of volatile compounds inPiperregnellii(Miq.)C.DC.essential oils [J].Microchemical Journal,2015,118:242-251.
[26]Fiehn O.Metabolomics by gas chromatography-mass spectrometry:combined targeted and untargeted profiling [J].Curr Protoc Mol Biol,2015,114:30.4.1-30.4.32.
[27]De V A,Venter P,Pasch H.Recent advances and trends in the liquid-chromatography-mass spectrometry analysis of flavonoids [J].Journal of Chromatography A,2016,1430:16-78.
[28]Metz T O,Zhang Q,Page J S,et al.The future of liquid chromatography-mass spectrometry (LC-MS)in metabolic profiling and metabolomic studies for biomarker discovery [J].Biomarkers in Medicine,2007,1(1):159-185.
[29]Guida R D,Engel J,Allwood J W,et al.Non-targeted UHPLC-MS metabolomic data processing methods:a comparative investigation of normalisation,missing value imputation,transformation and scaling [J].Metabolomics,2016,12(5):93-104.
[30]Johnson C H,Patterson A D,Krausz K W,et al.Radiation metabolomics.4.UPLC-ESI-QTOFMS-Based metabolomics for urinary biomarker discovery in gamma-irradiated rats [J].Radiation Research,2011,175(4):473-484.
[31]Sheng R,Hinzman A A,Kang E L,et al.Computational and statistical analysis of metabolomics data [J].Metabolomics,2015,11(6):1-22.
[32]Uarrota V G,Moresco R,Coelho B,et al.Metabolomics combined with chemometric tools (PCA,HCA,PLS-DA and SVM)for screening cassava (Manihot esculenta Crantz)roots during postharvest physiological deterioration [J].Food Chemistry,2014,161(6):67-78.
[33]柯朝甫,张涛,武晓岩,等.代谢组学数据分析的统计学方法 [J].中国卫生统计,2014,31(2):357-359.
[34]Feng L,Wu H W,Song G Q,et al.Chronical sleep interruption-induced cognitive decline assessed by a metabolomics method [J].Behavioural Brain Research,2016,302:60-68.
[35]Takis P G,Oraiopoulou M E,Konidaris C,et al.(1)H-NMR based metabolomics study for the detection of the human urine metabolic profile effects ofOriganumdictamnustea ingestion [J].Food & Function,2016,7(9):4104-4115.
[36]孙长颢,李颖,刘丽燕,等.营养代谢组学研究进展 [C].中国营养学研究发展报告研讨会,2014.
[37]杨月欣,王竹,糜漫天.食物营养和保健食品研究进展 [J].营养学报,2015,37(2):128-130.
[38]Brennan L.Use of metabotyping for optimal nutrition [J].Current Opinion in Biotechnology,2017,44:35-38.
[39]Solanky K S,Bailey N J C,Holmes E,et al.NMR-based metabonomic studies on the biochemical effects of epicatechin in the rat [J].Journal of Agricultural & Food Chemistry,2003,51(14):4139-4145.
[40]Zheng R,Z,Lv Y,Fu X,et al.Metabolomic analysis of amino acid metabolism in colitic rats supplemented with lactosucrose [J].Amino Acids,2013,45(4):877-887.
[41]Fu C W,Wang T J,Wang Y,et al.Metabonomics study of the protective effects of green tea polyphenols on aging rats induced by D-galactose [J].Journal of Pharmaceutical & Biomedical Analysis,2011,55(5):1067-1074.
[42]Zheng H,Yde C C,Dalsgaard T K,et al.Nuclear magnetic resonance-based metabolomics reveals that dairy protein fractions affect urinary urea excretion differently in overweight adolescents [J].European Food Research & Technology,2015,240(3):489-497.
[43]Lindsay K L,Christian H,Olaf U,et al.Longitudinal metabolomic profiling of amino acids and lipids across healthy pregnancy [J].Plos One,2015,10(12):1-19.
[44]Accardi C J,Walker D I,Uppal K,et al.High-resolution metabolomics for nutrition and health assessment of armed forces personnel [J].Journal of Occupational & Environmental Medicine,2016,58(S8):S80-S88.
[45]Toue S,Kodama R,Amao M,et al.Screening of toxicity biomarkers for methionine excess in rats [J].Journal of Nutrition,2006,136(6):1716S-1721S.
[46]Chin K,Toue S,Kawamata Y,et al.A 4-week toxicity study of methionine in male rats [J].International Journal of Toxicology,2015,34(3):233-241.
[47]Kowalski G M,Souza D P D,Burch M L,et al.Application of dynamic metabolomics to examine invivo,skeletal muscle glucose metabolism in the chronically high-fat fed mouse [J].Biochemical & Biophysical Research Communications,2015,462(1):27-32.
[48]Matsuzaki K,Kato H,Sakai R,et al.Transcriptomics and metabolomics of dietary leucine excess [J].Journal of Nutrition,2005,135(6 Suppl):1571S-1575S.
[49]Ursell L K,Haiser H J,Treuren W V,et al.The Intestinal metabolome-an intersection between microbiota and host [J].Gastroenterology,2014,146(6):1470-1476.
[50]David L A,Maurice C F,Carmody R N.Diet rapidly and reproducibly alters the human gut microbiome [J].Nature,2014,505(7484):559-563.
[51]Zheng R,Yang YH,Wen Y M,et al.Metabolomic analysis of amino acid and fat metabolism in rats with L-tryptophan supplementation [J].Amino Acids,2014,46(12):2681-2691.
[52]何庆华,任萍萍,王玉兰.代谢组学在营养学研究中的应用 [J].食品科学,2011,32(5):317-320.
[53]Ojeda P,Bobe A,Dolan K,et al.Nutritional modulation of gut microbiota-the impact on metabolic disease pathophysiology [J].Journal of Nutritional Biochemistry,2016,28:191-200.
[54]Onuh J O,Girgih A T,Nwachukwu I,et al.A metabolomics approach for investigating urinary and plasma changes in spontaneously hypertensive rats (SHR)fed with chicken skin protein hydrolysates diets [J].Journal of Functional Foods,2016,22:20-33.
[55]Llorach R,Urpi-Sarda M,Tulipani S,et al.Metabolomic fingerprint in patients at high risk of cardiovascular disease by cocoa intervention [J].Molecular Nutrition & Food Research,2013,57(6):962-973.
[56]Men L H,Pi Z F,Zhou Y,et al.Urine metabolomics of high-fat diet induced obesity using UHPLC-Q-TOF-MS [J].Journal of Pharmaceutical & Biomedical Analysis,2017,132:258-266.
[57]Files D C,Ilaiwy A,Parry T L,et al.Lung injury-induced skeletal muscle wasting in aged mice is linked to alterations in long chain fatty acid metabolism [J].Metabolomics,2016,12(8):134-149.
[58]Gang X,Yang Y,Jian Z,et al.P300 acetyltransferase regulates fatty acid synthase expression,lipid metabolism and prostate cancer growth [J].Oncotarget,2016,7(12):15135-15149.
Applications of Metabonomics in Nutriology Research
XU Teng,ZHANG Yue,ZHANG Hai-li,XIN Feng-jiao,WANG Yan,WANG Feng-zhong
(Institute of Agro-products processing Science and Technology,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
Metabonomics mainly investigates the quantitative detection of endogenous metabolites of biological system that is stimulated or disturbed,so as to study the dynamic metabolism changes induced by both internal and external factors.This review not only summarized the experimental methods and steps of metabonomics which included biological sample preparation,detection and analysis,data processing,differential metabolites identification and metabolic pathways analysis,but also summed up the application of metabonomics in nutriology research.In addition,the prospect and challenge of metabonomics technology in nutriology research were discussed,presented with a desire to be helpful for further study.
nutriology;metabonomics;NMR;GC-MS;LC-MS
农业部“948”项目(项目编号:2016-X31);中国农业科学院创新工程(项目编号:125161015000150013);北京市粮经作物产业创新团队(项目编号:BAIC09-2017);农产品质量安全监管(风险评估)项目(项目编号:GJFP2017011);西藏自治区科技重大专项(项目编号:Z2016B01N04)。
许 腾(1992— ),女,硕士研究生,研究方向:营养代谢组学。
王凤忠(1972— ),男,博士,研究员,研究方向:功能食品与生物活性物质;王 艳(1985— ),女,博士,助理研究员,研究方向:功能食品与生物活性物质、营养代谢组学。
(责任编辑 李婷婷)
