亚砜亚胺的合成研究进展
2017-12-19谢媛媛
童 踔,谢媛媛
(浙江工业大学药学院,浙江 杭州 310014)
亚砜亚胺的合成研究进展
童 踔,谢媛媛*
(浙江工业大学药学院,浙江 杭州 310014)
亚砜亚胺类化合物是一类重要的砜的含氮等电子体化合物,引起了人们的广泛关注。近十年来,亚砜亚胺类化合物在不对称催化合成、农药和药物化学领域都是一类重要的化合物。本文综述了亚砜亚胺类化合物的几种代表性的合成方法,并对合成方法进行了分析总结和前景展望。
亚砜亚胺类化合物;过渡金属催化;非金属催化
0 前言
亚砜亚胺(Sulfoximine)类化合物是砜的含氮的类似物,在不对称合成、农药和药物化学领域是一个很重要的活性化合物。虽然亚砜亚胺是砜的等电子体,但是氮原子增加了化合物的结构多样性,其中氮原子能够被芳基化、酰基化和烷基化,又能够同时作为质子的受体和供体形成氢键,大大增加化合物在极性溶剂中的溶解度,从而进一步提高其生物利用度。自从1950年,Whitehead和Bentleyl等人研究得到了L-甲硫氨酸亚砜亚胺 (Methionime sulfoximine)(Figure 1,a)[1],且证实它对生物合成谷胱甘肽的决速步骤具有催化作用以来,化学研究者对亚砜亚胺类化合物的生物活性和合成方法进行了大量的科学研究。例如:L-丁硫氨酸亚砜亚胺(Buthionmine sulfoximine)(Figure 1,b)能够恢复肿瘤细胞对美法仑的敏感能力[2];小分子化合物BAY 1000394(Figure 1,c)[3]对周期素依赖性蛋白激酶有非常好的抑制作用,现已进入临床研究阶段;维生素D3的类似物(Figure 1,d)[4]对细胞色素 P450C24 具有很好的抑制作用。其合成方法更是层出不穷,本文通过查阅和总结亚砜亚胺的合成文献,对其合成路线进行综述。
1 合成路线
目前,亚砜亚胺类化合物主要是通过亚砜类化合物与伯胺在过渡金属催化下发生亚胺化反应,再经过脱保护过程生成亚砜亚胺1(Figure 2,Path a),而每个不同的保护基团的脱去反应也在很大程度影响了方法的应用;其次,可以由亚砜直接亚胺化得到亚砜亚胺 (Figure 2,Path b);最后,硫醚经亚胺化,氧化,脱保护得到亚胺亚砜类化合物(Figure 2,Path c),但是由于化合物2在氧化条件下容易分解,故此方法应用不多。下面从这三个方向介绍一些亚砜亚胺化合物的合成方法。

Figure 2
1.1 Fe催化亚砜亚胺化
1999年,Christina Korber等人[5]利用叔丁氧羰基保护的叠氮化合物作为氮源,FeCl2作为催化剂在CH2Cl2中,室温反应12~24 h,得到叔丁氧羰基保护的亚砜亚胺类化合物3(Scheme 1),产物收率为40%~92%。该体系虽然反应条件温和、催化剂廉价易得、保护基团易于脱去且不需要密闭空间,但是其不仅使用了易爆的叠氮化合物,且反应时间太长,底物大大过量为5当量,催化剂的量高达25%,说明FeCl2催化活性很低,故此已基本不再使用该应用。

Scheme 1
1.2 Cu催化亚砜亚胺化
1998年,Muller等人[6]采用对甲苯磺酰基保护的亚胺化合物作为氮源,5%的三氟甲磺酸亚铜作为催化剂,在氩气保护下的甲苯中,室温反应12 h,得到磺酰基保护的亚砜亚胺类化合物4(Scheme 2),产物收率为70%~93%。该体系反应条件温和、催化剂活性高且底物适用性较强,但是反应需要在氩气保护的密闭空间。

Scheme 2
1.3 Rh催化亚砜亚胺化
2004年,Carten Bolm等人[7]开发了以二聚醋酸铑作为催化剂,对硝基苯磺酰基或甲基磺酰基或三氟乙酰基保护的伯胺作为氮源,氧化镁和二醋酸碘苯为添加剂的CH2Cl2中,室温反应1~12 h,得到保护的亚砜亚胺类化合物5(Scheme 3),产物收率为71%~98%。该反应条件温和,反应时间较短,底物使用性强,实现了三氟乙酰基保护的亚砜亚胺的合成,水解得到亚砜亚胺,水解条件较为温和和方便,收率较高,为90%~95%(Scheme 4)。但是其催化剂二聚醋酸铑价格昂贵且对环境不友好,且需要大量的添加剂。

Scheme 3
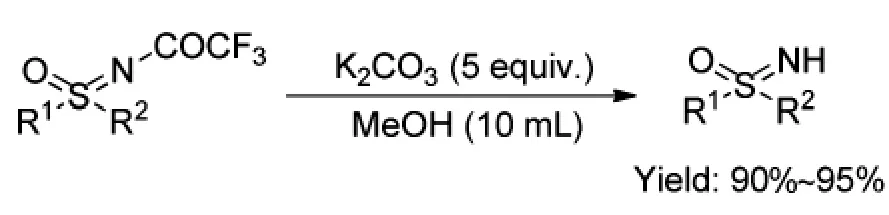
Scheme 4
2015年,Bull等人[8]又利用二聚醋酸铑作为催化剂,氨基甲酸酯作为氮源,氧化镁和二醋酸碘苯为添加剂的CH2Cl2中,于40℃下反应8 h,得到保护的亚砜亚胺类化合物6,产物收率为70%~97%(Scheme 5)。然后在三氟乙酸或Pd/C 条件下水解得到亚砜亚胺化合物。该体系的氮源氨基甲酸酯原料易得且相对更稳定,且化合物6的水解条件较为简便和温和,收率也较高,为77%~98%,但是其催化剂二聚醋酸铑价格昂贵且对环境不友好。

Scheme 5

Scheme 6
1.4 Ag催化亚砜亚胺化
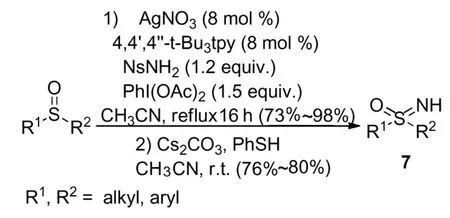
2005年,Carten Bolm等人[9]利用了硝酸银作为催化剂,4,4,4-三叔丁基三联吡啶为配体,对硝基苯磺酰胺为氮源,二醋酸碘苯为添加剂,在乙腈溶剂中回流反应16 h后再次得到对硝基苯磺酰基保护的亚砜亚胺类化合物7,产物收率为73%~98%,然后再在碳酸铯和苯硫酚的乙腈溶剂当中,室温条件下水解得到亚砜亚胺类化合物,水解收率为76%~80%(Scheme 7)。该反应实现了银离子对亚砜亚胺合成的催化作用,但是其反应需要价格较高的配体参与,而对硝基磺酰基保护的亚砜亚胺化合物水解条件较为苛刻且收率较低,为 76%~80%。
Scheme 7
1.5 亚砜直接亚胺化
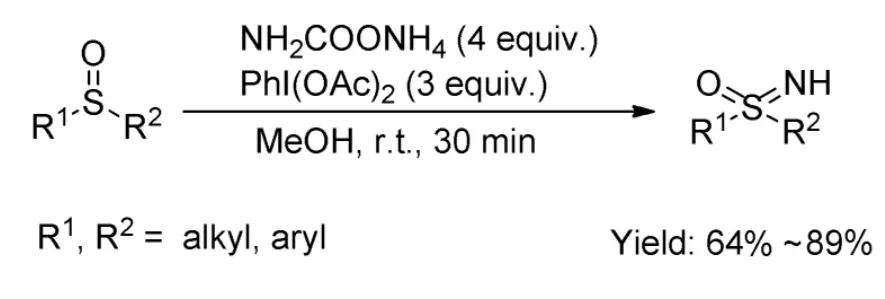
2016年,Bull等人[10]利用氨基甲酸铵盐脱羧提供氮源,二醋酸碘苯作为添加剂,在甲醇溶剂反应中,室温反应30 min后,直接生成亚砜亚胺类化合物,产物收率为64%~89%(Scheme 8)。该反应直接用氨基甲酸铵盐提供氮源,未采用过渡金属催化,符合绿色化学的发展趋势,反应时间也相对地大大降低,但是原料和添加剂都是大大过量,原子经济性不高,且产物收率相对有一点点降低。
Scheme 8
1.6 硫醚先亚胺化、氧化、再脱保护
2007年,Carten Bolm等人[11]开发了以硫醚为原料,首先用NBS和叔丁醇钾在甲醇溶剂中反应,生成 N-氰基硫亚胺(N-cyanosulfilimines)8,然后再用间氯过氧苯甲酸氧化N-氰基硫亚胺至N-氰基亚砜亚胺(N-cyanosulfoximines)9,最后再通过两步水解得到亚砜亚胺类化合物(Scheme 10)。该体系成功应用氨基乙腈作为氮源,并经过4步反应合成亚砜亚胺类化合物,但是总体收率较低,原子经济性不高。
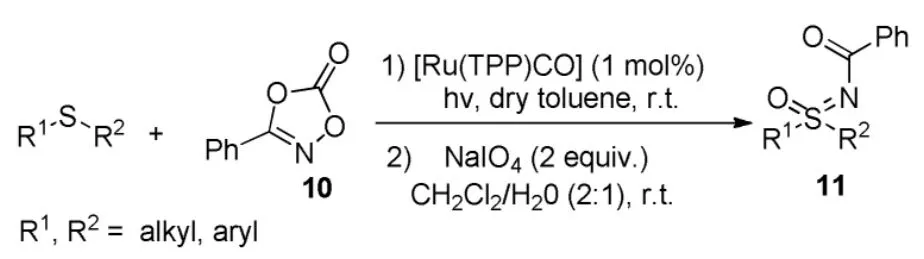
2014年,Carten Bolm等人[12]又利用在光照条件下,二恶唑酮10分解产生氮宾作为氮源,四苯基卟啉羰基钌作为催化剂,在除水甲苯溶剂当中室温反应直接得到各种N-酰基亚砜亚胺类化合物 11,产物收率为 72%~99%(Scheme 9)。该反应巧妙地利用了二恶唑酮的性质来提供了氮源,催化剂活性也相对较高,反应条件也温和,而且一步合成了更有价值的N-酰基磺酰亚胺(Sulfimides)和N-酰基亚砜亚胺类化合物。

Scheme 9
Scheme 10
2 小结
综上所述,亚砜亚胺类化合物作为重要有机中间体的合成方法得到了广泛的研究,突出了其在化工、医药当中的重要性。亚砜亚胺类化合物的合成关键在于选择合适的氮源和合适的催化剂,现有的氮源存在不稳定,不易得,原子经济性不高等缺点;而已有的过渡金属催化剂则存在催化活性低、价格昂贵且对环境不友好等缺点。因此,开发出更加高效、温和和环境友好的新合成方法具有重要的意义。
[1] Bentley H R,Mcdermott E E,Whitehead J K.Action of nitrogen trichloride on proteins:a synthesis of the toxic factor from methionine[J].Nature, 1950,165: 735-738.
[2] Anderson M E,MeisterA.Inhibition ofglutathione biosynthesis by prothionine sulfoximine (S-n-propyl homocysteine sulfoximine), a selective inhibitor of yglutamylcysteine synthetase[J].J.Bio.Chem., 1979,254:1205-1209.
[3] SiemeisterG,LuckingU,WengnerA M,etal.BAY 1000394, a novel cyclin-dependent cinase inhibitor, with potent antitumor activity in mono-and in combination treatment upon oral application[J].Mol.Cancer Ther.,2012,11(10): 2265.
[4] Korczak B,Posner G H.Potent, selective and lowcalcemic inhibitors of CYP24 hydroxylase:24-sulfoximine analogues of the hormone 1r,25-dihydroxyvitamin D3[J].J.Med.Chem., 2004, 47: 6854-6863.
[5] Bath T,Korber C. The preparation of N -tert-Butyloxycarbonyl-(Boc- ) protected sulfoximines and sulfimines by an iron (II)-mediated nitrene transfer from BocN3to sulfoxides and sulfides[J].Eur.J.Org.Chem.,1999,1999:1033-1039.
[6] Muller K,Voge P.Cu(I)-catalyzed sulfoximination[J].Tetra.Lett., 1998, 39: 4805-4806.
[7] Okamura H,Blom C.Rhodium-catalyzed imination of sulfoxides and sulfides:efficient preparation of N-unsubstituted sulfoximines and sulfilimines[J].Org.Lett., 2004, 6:1305-1307.
[8] Zenzola M,Bull J.Synthesis of sulfoximine carbamates to sulfoxides[J].J.Org.Chem., 2015, 80: 6391-6399.
[9] Cho G Y,Bolm C.Silver-catalyzed imination of sulfoxides and sulfides[J].Org.Lett., 2005,7: 4983-4985.
[10]Zenzola M,Bull J.Transfer of electrophilic NH using convenient source of ammonia:direct synthesis of NH sulfoximines from sulfoxides[J].Angew.Chem.Int.Ed., 2016,55:7203-7207.
[11]Mancheno O,Bolm C.Iodinane-and metal-free synthesis of N-cyano sulfilimines:novel and easy access of NH-sulfoximines[J].Org.Lett.,2007, 9: 3809-3811.
[12]Bizet V,Bolm C.Light-induced ruthenium-catalyzed nitrene transfer reactions:a photochemical approach towards N-acyl sulfumides and sulfoximines[J].Angew.Chem.Int.Ed., 2014, 53: 5639-5642.
The Synthesis Development of Sulfoximine
TONG Chuo,XIE Yuan-yuan*
(College of Pharmaceutical Sciences,Zhejiang University of Technology,Hangzhou,Zhejiang 310014, China)
Being mono-aza analogues of sulfones, sulfoximines is an important compounds in asymmetric synthesis,crop protection and medicinal chemistry.This article summarized some representative synthetic methods of sulfoximines and the advantages and disadvantages of these methods.
sulfoximine;transition metal-catalyzed;metal-free-catalyzed
1006-4184(2017)11-0004-04
2017-03-31
童踔(1992-),男,硕士研究生,主要从事药物及中间体的合成。
* 通讯作者:谢媛媛,E-mail: xyycz@zjut.edu.cn。
