贝母素乙对5种肿瘤细胞的化疗增敏作用研究Δ
2017-12-19唐倩倩王云飞聂勇战顾政一新疆维吾尔自治区药物研究所乌鲁木齐80004新疆医科大学药学院乌鲁木齐800肿瘤生物学国家重点实验室西安7002
唐倩倩,王云飞,聂勇战,顾政一#(.新疆维吾尔自治区药物研究所,乌鲁木齐80004;2.新疆医科大学药学院,乌鲁木齐800;.肿瘤生物学国家重点实验室,西安7002)
贝母素乙对5种肿瘤细胞的化疗增敏作用研究Δ
唐倩倩1,2*,王云飞1,聂勇战3,顾政一1#(1.新疆维吾尔自治区药物研究所,乌鲁木齐830004;2.新疆医科大学药学院,乌鲁木齐830011;3.肿瘤生物学国家重点实验室,西安710032)
目的:研究贝母素乙对5种肿瘤细胞的化疗增敏作用。方法:以人食管癌Eca-109细胞、人乳腺癌MCF-7细胞、人小细胞肺癌A549细胞、人肝癌HepG2细胞、人宫颈癌HeLa细胞为研究对象,采用MTT法检测最大无毒浓度(20 μg/mL)的贝母素乙与不同质量浓度梯度(0.026~2.1、0.026~2.1、0.125~2.0、0.125~2.0、0.062 5~0.10 μg/mL)的阿霉素共同作用于上述5种肿瘤细胞72 h后的细胞生长抑制率,并计算半数抑制浓度(IC50);采用结晶紫染色法观察最大无毒浓度的贝母素乙与低质量浓度(0.02、0.005、0.04、0.02、0.01 μg/mL)的阿霉素共同作用于上述肿瘤细胞7 d后的细胞增殖情况,并设溶剂对照和贝母素乙、阿霉素单用对照。结果:与阿霉素单用比较,贝母素乙和阿霉素联用后可不同程度提高5种肿瘤细胞的生长抑制率,大部分差异具有统计学意义(P<0.05或P<0.01);IC50值均明显减小,差异均具有统计学意义(P<0.05或P<0.01)。与溶剂对照比较,贝母素乙单用或阿霉素单用7 d对5种肿瘤细胞的增殖均无明显影响,而贝母素乙和阿霉素联用7 d均能明显抑制5种肿瘤细胞的增殖。结论:贝母素乙可不同程度地增强上述5种肿瘤细胞对阿霉素的敏感性,具有一定的化疗增敏作用。
贝母素乙;阿霉素;化疗增敏剂;食管癌;乳腺癌;肺癌;肝癌;宫颈癌
现今,恶性肿瘤的发病率较高且有升高趋势,对于大部分不适合手术切除的实体肿瘤,化疗常作为首选治疗方法。然而,长期化疗会导致耐药的发生,耐药现象已被证实是化疗失败的最主要原因[1]。因此,增强肿瘤细胞对化疗药物的敏感性,降低化疗药物的毒性尤为重要。
化疗增敏剂泛指一类剂量微小、与化疗药物共同作用于肿瘤细胞后可使化疗效果有明显提高的药物[2]。其在低浓度时或者药物自身无明显抗肿瘤活性,且自身毒副作用较小[2]。由于化疗药物在对肿瘤细胞有细胞毒性作用的同时也会对人体正常细胞有一定的损伤,所以寻找低毒和不良反应少的化疗增敏剂对提高化疗治疗效果具有重要意义。
伊贝母为百合科植物新疆贝母(Fritillaria walujew-ii Regel)的干燥鳞茎,是新疆丰富的药用植物资源,也是中药以及维药中常用的药用植物,具有止咳、祛痰、镇痛、抗炎等功效,被收载于2015年版《中国药典》(一部)中[3]。贝母素乙(Peiminine)是从伊贝母中提取、分离的生物碱类化合物,具有镇咳、祛痰及抗炎的活性[4]。笔者前期研究表明,贝母素乙可提高阿霉素(Adriamycin)对胃癌的化疗敏感性,使蛋白激酶B磷酸化表达和细胞周期蛋白D1表达降低,且可逆转胃癌的多药耐药[5-6]。本试验将进一步探究贝母素乙对其他5种肿瘤细胞的化疗增敏作用,观察贝母素乙是否可以增强人食管癌Eca-109细胞、人乳腺癌MCF-7细胞、人小细胞肺癌A549细胞、人肝癌HepG2细胞、人宫颈癌HeLa细胞对化疗药物阿霉素的敏感性。
1 材料
1.1 仪器
BY-400C-1型医用离心机(北京白洋医疗器械有限公司,最高转速:5 000 r/min);HERA Cell-150i型二氧化碳(CO2)培养箱和Varioskan Tlash型酶标仪(美国Thermo公司);RE-501型电子恒温水浴锅(上海光创科学仪器设备);BCM-1300A型超净工作台(苏州净化设备仪器厂);CKX31型倒置显微镜(Olympus公司);ZW-A型微量振荡器(常州国华电子有限公司)。
1.2 药品与试剂
贝母素乙(新疆维吾尔自治区药物研究所提取,批号:20140911,相对分子量:429.635 22,纯度:>95%);阿霉素(大连美仑生物有限公司,批号:25316-40-9,纯度:98%);结晶紫(碧云天生物技术有限公司,批号:C0121);MTT(上海恒远生物科技公司,批号:298-93-1);青链霉素双抗、1640细胞培养基和DMEM细胞培养基(美国Hyclone公司,批号:SV30010、AZG192448、AC10215860);二甲基亚砜(DMSO)和胰酶消化液(美国Gibco公司,批号:D2650、25200-072);胎牛血清(以色列BI公司,批号:04-001-1ACS)。
1.3 细胞
人食管癌Eca-109细胞、人乳腺癌MCF-7细胞、人小细胞肺癌A549细胞、人肝癌HepG2细胞、人宫颈癌HeLa细胞均由肿瘤生物学国家重点实验室提供。
2 方法
2.1 溶液的制备
贝母素乙溶液用DMSO配制,现用现配。阿霉素用生理盐水配制,质量浓度为2 mg/mL,现用现配。
2.2 细胞的培养
将细胞接种于5 cm×5 cm培养瓶中,加入培养基5 mL(Eca-109、A549细胞使用1640培养液,MCF-7、HepG2、HeLa细胞使用DMEM培养液,培养液中均含10%胎牛血清以及1%青链霉素双抗),置于37℃、5%CO2的恒温培养箱中常规培养。
2.3 MTT法检测贝母素乙对肿瘤细胞的细胞毒性
收集处于对数生长期的5种肿瘤细胞,以每孔3×103个细胞接种于96孔板中,在37℃、5%CO2的恒温培养箱中常规培养24 h。细胞贴壁后,分别加入质量浓度为5、10、20、40、80 μg/mL的贝母素乙溶液200 μL,每个质量浓度设4个复孔,每个质量浓度设加入同体积且不含药物的DMSO作为溶剂对照组。放置于恒温培养箱,孵育72 h后,每孔加入MTT(5.0 mg/mL)20 μL孵育4 h,使活细胞与MTT结合形成蓝紫色结晶物。吸弃孔内上清液,每孔加入150 μL的DMSO,振荡10 min,使用酶标仪在490 nm波长处测定溶解后结晶物的吸光度值。按照公式计算细胞存活率:细胞存活率(%)=加药组的吸光度值/溶剂对照组的吸光度值×100%。
2.4 MTT法检测贝母素乙和阿霉素联用对细胞增殖的影响
收集处于对数生长期的5种肿瘤细胞,以每孔3×103个细胞接种于96孔板中,在37℃、5%CO2的恒温培养箱中常规培养24 h,细胞贴壁后,加药处理。每种细胞分为3组进行试验:(1)对照组(阿霉素单用)。加入不同质量浓度梯度的阿霉素,其中Eca-109、MCF-7细胞中加入质量浓度为0.026、0.078、0.233、0.70、2.1 μg/mL的阿霉素,A549、HepG2细胞中加入质量浓度为0.125、0.25、0.50、1.0、2.0 μg/mL的阿霉素,HeLa细胞中加入质量浓度为0.062 5、0.125、0.25、0.50、1.0 μg/mL的阿霉素)。(2)试验组(贝母素乙和阿霉素联用)。加入最大无毒浓度(20 μg/mL)的贝母素乙以及与对照组相同质量浓度梯度的阿霉素。(3)溶剂对照组。加入同体积且不含药物的DMSO。按“2.3”项下方法检测并按公式计算细胞生长抑制率:生长抑制率(%)=(1-加药组的吸光度值/溶剂对照组的吸光度值)×100%。根据所得结果绘制对照组与试验组的药物浓度抑制曲线(横坐标为药物浓度,纵坐标为生长抑制率),计算半数抑制浓度(IC50)。
2.5 结晶紫染色法检测贝母素乙和阿霉素联用对细胞增殖的影响
收集处于对数生长期的5种肿瘤细胞,以每孔8×103个细胞接种于24孔板中[7],在37℃、5%CO2的恒温培养箱中常规培养24 h,细胞贴壁后,加药处理。每种细胞分为4组进行试验:(1)贝母素乙单用组,加入质量浓度为20μg/mL的贝母素乙;(2)阿霉素单用组,加入相应低质量浓度的阿霉素(Eca-109、MCF-7、A549、HepG2、HeLa细胞各加入0.02、0.005、0.04、0.02、0.01 μg/mL阿霉素,由预试验结果确定);(3)贝母素乙和阿霉素联用组,分别加入与单用组相同质量浓度的贝母素乙和阿霉素;(4)溶剂对照组,加入同体积且不含药物的DMSO。放置于恒温培养箱,孵育7 d后,小心吸弃培养液,磷酸盐缓冲液洗涤2次,加入甲醇1 mL固定15 min。弃固定液,洗净甲醇,加入结晶紫染色20 min。自来水冲洗洗去结晶紫染色液,置于空气中干燥,观察各组细胞染色情况。
2.6 统计学方法
采用SPSS 19.0软件进行统计分析,数据以x±s表示。组间均数差异采用单因素方差分析进行比较,采用独立样本t检验比较两组间的差异。P<0.05表示差异具有统计学意义。
3 结果
3.1 贝母素乙对肿瘤细胞的细胞毒性
结果显示,贝母素乙仅在高质量浓度(80 μg/mL)时对5种肿瘤细胞有细胞毒性作用。以细胞存活率>90%为标准,综合考虑确定贝母素乙对Eca-109、MCF-7、A549、HepG2、HeLa细胞的最大无毒浓度为20 μg/mL。不同质量浓度的贝母素乙对5种肿瘤细胞存活率的影响见表1。
表1 不同质量浓度的贝母素乙对5种肿瘤细胞存活率的影响(±s,n=4,%%)Tab 1Effect of peiminine with different mass concentrations on the survival rate of 5 kinds of cancer cells(±s,n=4,%%)

表1 不同质量浓度的贝母素乙对5种肿瘤细胞存活率的影响(±s,n=4,%%)Tab 1Effect of peiminine with different mass concentrations on the survival rate of 5 kinds of cancer cells(±s,n=4,%%)
细胞Eca-109 MCF-7 A549 HepG2 HeLa贝母素乙质量浓度,μg/mL 5 98.34±4.08 102.87±2.90 100.93±6.35 100.99±7.80 96.46±2.49 10 96.62±2.49 99.49±4.78 98.49±3.28 95.14±8.77 94.09±4.01 20 90.93±2.28 95.54±3.56 96.75±6.87 91.61±6.47 86.92±5.39 40 81.72±5.60 93.15±3.38 90.63±7.09 87.36±5.18 82.22±9.26 80 77.94±3.26 80.56±7.06 85.35±5.12 85.06±4.56 72.81±6.01
3.2 贝母素乙和阿霉素联用后细胞生长抑制率
与对照组比较,试验组5种肿瘤细胞明显丧失细胞活力,大部分细胞生长抑制率均明显提高,IC50值明显减小,差异均具有统计学意义(P<0.05或P<0.01)。这表明贝母素乙可不同程度地增强Eca-109、MCF-7、A549、HepG2、HeLa细胞对阿霉素的化疗敏感性。贝母素乙和阿霉素联用对Eca-109、MCF-7、A549、HepG2、HeLa细胞生长抑制率的影响见表2、表3、表4,IC50的测定结果见表5。
3.3 贝母素乙和阿霉素联用后细胞增殖染色情况
由结晶紫染色情况可以看出,与溶剂对照组比较,贝母素乙单用组的5种肿瘤细胞的紫色结晶程度无明显差异,阿霉素单用组的5种肿瘤细胞的紫色结晶程度略微减轻,贝母素乙和阿霉素联用组的5种肿瘤细胞的紫色结晶程度明显减轻。由此表明,最大无毒浓度(20μg/mL)的贝母素乙和阿霉素联用可明显抑制Eca-109、MCF-7、A549、HepG2、HeLa细胞的增殖。各组肿瘤细胞的增殖染色情况见图1。
表2 贝母素乙和阿霉素联用后Eca-109、MCF-7细胞的生长抑制率(±s,n=4,%%)Tab 2Growth inhibition rate of Eca-109,MCF-7cellsafterthecombinationuseof peiminine and adriamycin(±s,n=4,%%)

表2 贝母素乙和阿霉素联用后Eca-109、MCF-7细胞的生长抑制率(±s,n=4,%%)Tab 2Growth inhibition rate of Eca-109,MCF-7cellsafterthecombinationuseof peiminine and adriamycin(±s,n=4,%%)
注:与对照组比较,*P<0.05,**P<0.01Note:vs.control group,*P<0.05,**P<0.01
阿霉素质量浓度,μg/mL 2.1 81.02±4.65 91.74±3.49*80.28±5.66 93.31±3.55**细胞Eca-109组别对照组试验组对照组试验组MCF-7 0.026 6.83±3.36 20.70±3.18**10.81±3.17 35.88±5.55**0.078 28.09±2.24 37.45±3.12*29.02±2.99 58.43±8.58**0.233 39.05±4.20 50.17±4.74*50.40±8.24 74.93±6.80**0.70 68.67±2.64 79.38±5.41*66.67±5.18 86.76±4.77**
表3 贝母素乙和阿霉素联用后A549、HepG2细胞的生长抑制率(±s,n=4,%%)Tab 3Growth inhibition rate of A549,HepG2 cellsafterthecombinationuseof peiminine and adriamycin(±s,n=4,%%)

表3 贝母素乙和阿霉素联用后A549、HepG2细胞的生长抑制率(±s,n=4,%%)Tab 3Growth inhibition rate of A549,HepG2 cellsafterthecombinationuseof peiminine and adriamycin(±s,n=4,%%)
注:与对照组比较,*P<0.05Note:vs.control group,*P<0.05
2.0 89.32±3.23 92.55±2.32 87.62±5.84 95.41±2.59细胞A549阿霉素质量浓度,μg/mL HepG2组别对照组试验组对照组试验组0.125 35.86±9.76 51.13±6.28*31.82±3.23 33.39±2.87 0.25 45.66±10.24 61.15±4.08*42.79±7.54 57.38±4.91*0.50 56.83±4.08 66.59±6.27*56.13±5.94 72.31±7.29*1.0 71.75±2.66 82.21±5.45*75.47±3.34 84.23±3.67*
表4 贝母素乙和阿霉素联用后Hela细胞的生长抑制率(±s,n=4,%%)Tab 4Growth inhibition rate of Hela cells afterthecombinationuseofpeiminine and adriamycin(±s,n=4,%%)
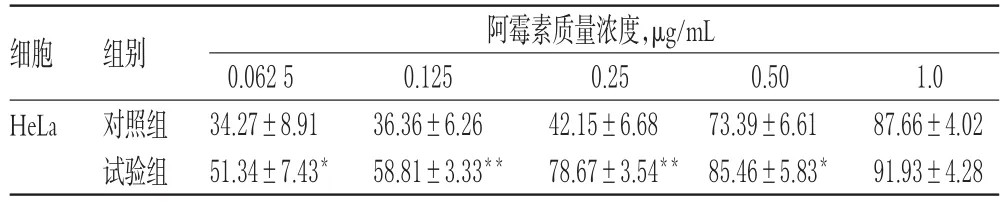
表4 贝母素乙和阿霉素联用后Hela细胞的生长抑制率(±s,n=4,%%)Tab 4Growth inhibition rate of Hela cells afterthecombinationuseofpeiminine and adriamycin(±s,n=4,%%)
注:与对照组比较,*P<0.05,**P<0.01Note:vs.control group,*P<0.05,**P<0.01
1.0 87.66±4.02 91.93±4.28细胞HeLa组别对照组试验组阿霉素质量浓度,μg/mL 0.062 5 34.27±8.91 51.34±7.43*0.125 36.36±6.26 58.81±3.33**0.25 42.15±6.68 78.67±3.54**0.50 73.39±6.61 85.46±5.83*
表5 阿霉素单用及其和贝母素乙联用对5种肿瘤细胞的IC50测定结果(±s,n=4,μg/mL)Tab 5The IC50determination results of single useofadriamycinanditscombination use with peiminine to 5 kinds of cancer cells(±s,n=4,μg/mL)

表5 阿霉素单用及其和贝母素乙联用对5种肿瘤细胞的IC50测定结果(±s,n=4,μg/mL)Tab 5The IC50determination results of single useofadriamycinanditscombination use with peiminine to 5 kinds of cancer cells(±s,n=4,μg/mL)
细胞Eca-109 MCF-7阿霉素单用0.37±0.06 0.32±0.23贝母素乙和阿霉素联用0.16±0.04*0.16±0.05**

图1 各组肿瘤细胞的增殖染色情况Fig 1Proliferation staining situation of cancer cells in each group
4 讨论
研究发现,部分中药提取物和单体有化疗增敏作用,这类药物大都作用靶点多样、毒性低、可保护脏器和调节机体免疫力、耐受性好,具有一定临床应用价值,在全球范围内越来越受到关注和青睐。临床疗效以及安全性评估结果显示,艾迪注射液联合TP方案治疗非小细胞肺癌有较好的治疗效果,且毒副反应小,可有效提高患者的生存质量以及免疫功能[8]。有大量的数据显示,具有生物活性的天然产物可作为化疗增敏剂[9]。例如:杨梅黄酮在体内外均可增强食管癌对5-氟尿嘧啶的化疗敏感性[10];山竹子素可提高头颈部鳞癌对顺铂的化疗敏感性[11];茶多酚可通过诱导肿瘤细胞的凋亡增强宫颈癌的化疗敏感性[12]。除此之外,姜黄素、槲皮素、藻蓝蛋白、甲基莲心碱、银杏叶多糖、白藜芦醇、康莱特注射液、葡萄籽多酚等也可作为化疗增敏剂,增强肿瘤细胞对化疗药物的敏感性,降低化疗药物的毒副作用。
阿霉素作为抗肿瘤抗生素,能明显抑制DNA以及RNA的合成,可嵌入DNA从而抑制核酸的合成。同时,阿霉素属于细胞周期非特异性药物,具有广谱抗肿瘤的特点。临床上阿霉素及其衍生物广泛应用于治疗肺癌、乳腺癌、急性淋巴细胞性白血病、胃癌、卵巢癌等的化疗以及联合化疗方案[13]。虽然阿霉素对肿瘤细胞有较好的细胞毒性作用,但其对脑、心以及肾等脏器会造成损伤,且毒副作用需要很长时间才能被发现,因此严重影响了阿霉素在临床的应用[14]。同时,阿霉素的广泛应用使其化疗敏感性降低,耐药性增强,导致治疗失败率上升[15]。目前已有研究表明,中药单体可增强阿霉素的化疗敏感性,如新藤黄酸可使乳腺癌细胞对阿霉素的敏感性增强,抑制乳腺癌细胞的增殖[16]。
MTT法又称作MTT比色法,常用于检测细胞存活、细胞生长情况。MTT法已广泛应用于抗肿瘤药物的筛选、细胞毒性试验、肿瘤放射敏感性测定、生物活性因子的活性检测等[17]。结晶紫是一种碱性染料,可以和细胞核中的DNA结合,把细胞核染成深紫色[18]。在细胞功能学实验中常用结晶紫染色法判断肿瘤细胞的增殖情况。本研究采用这两种方法考察细胞活力与增殖情况。
本研究结果提示,贝母素乙可不同程度地增强本文5种肿瘤细胞对阿霉素的敏感性,具有一定的化疗增敏作用,具有成为新型化疗增敏剂的潜力。然而,贝母素乙化疗增敏机制还需进一步研究。
[1]Gillet JP,Gottesman MM.Overcoming multidrug resistance in cancer:35 years after the discovery of ABCB1[J].Drug Resist Updat,2012,15(1):2-4.
[2]Chen GY,Meng CL,Lin KC,et al.Graphene oxide as a chemosensitizer:diverted autophagic flux,enhanced nuclear import,elevated necrosis and improved antitumor effects[J].Biomaterials,2015,40:12-22.
[3]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:141-142.
[4]Wang D,Wang S,Chen X,et al.Antitussive,expectorantandanti-inflammatoryactivities of four alkaloids isolated from bulbus of fritillaria wabuensis[J].J Ethnopharmacol,2012,139(1):189-193.
[5]顾政一,张裴,聂勇战,等.5种生物碱胃癌多药耐药逆转剂的筛选及机制研究[J].中草药,2012,43(6):1151-1156.
[6]唐倩倩,王云飞,聂勇战,等.贝母素乙对人胃癌BGC823细胞的化疗增敏作用及其相关机制研究[J].新疆医科大学学报,2017,40(4):481-485.
[7]Rudalska R,Dauch D,Longerich T,et al.In vivo RNAi screening identifies a mechanism of sorafenibresistanceinlivercancer[J].Nat Med,2014,20(10):1138-1146.
[8]施子夏,张劲,张兵兵,等.艾迪注射液联合TP方案治疗非小细胞肺癌的临床观察[J].中国药房,2016,27(23):3234-3237.
[9]Vinod BS,Maliekal TT,Anto RJ.Phytochemicals as chemosensitizers:from molecular mechanism to clinical significance[J].Antioxid Redox Signal,2013,18(11):1307-1348.
[10]Wang L,Feng J,Chen X,et al.Myricetin enhancechemosensitivityof5-fluorouracilon esophageal carcinoma in vitro and in vivo[J].Cancer Cell Int,2014,doi:10.1186/s12935-014-0071-2.
[11]Li F,Shanmugam MK,Siveen KS,et al.Garcinol sensitizes human head and neck carcinoma to cisplatin in a xenograft mouse model despite downregulation of proliferative biomarkers[J].Oncotarget,2015,6(7):5147-5163.
[12]Singh M,Bhui K,Singh R,et al.Tea polyphenols enhance cisplatin chemosensitivity in cervical cancer cells via induction of apoptosis[J].Life Sci,2013,93(1):7-16.
[13]Liu H,Li N,Yao L,et al.Prediction of doxorubicinsensitivityingastriccancersbased on a set of novel markers[J].Oncol Rep,2008,20(4):963-969.
[14]Tacar O,Sriamornsak P,Dass CR.Doxorubicin:an update on anticancer molecular action,toxicityandnoveldrugdeliverysystems[J].J Pharm Pharmacol,2013,65(2):157-170.
[15]Eker B,Meissner R,Bertsch A,et al.Labelfree recognition of drug resistance via impedimetricscreeningofbreastcancercells[J].PLoS One,2013,8(3):e57423.
[16]He Y,Ding J,Lin Y,et al.Gambogenic acid alters chemosensitivity of breast cancer cells toadriamycin[J].BMCComplementAlternMed,2015,doi:10.1186/s12906-015-0710-8.
[17]Wang X,Lu Y,Yang J,et al.Identification oftriosephosphateisomeraseasananti-drug resistance agent in human gastric cancer cells using functional proteomic analysis[J].J Cancer Res Clin Oncol,2008,134(9):995-1003.
[18]Fei C,Zhao Y,Guo J,et al.Senescence of bone marrow mesenchymal stromal cells is accompanied by activation of p53/p21 pathway in myelodysplasticsyndromes[J].EurJHaematol,2014,93(6):476-486.
Study on the Effect of Peiminine on Increasing the Chemosensitivity of 5 Kinds of Cancer Cells
TANG Qianqian1,2,WANG Yunfei1,NIE Yongzhan3,GU Zhengyi1(1.Xinjiang Uygur Autonomous Region Institute of Material Medical,Urumqi 830004,China;2.College of Pharmacy,Xinjiang Medical University,Urumqi 830011,China;3.State Key Laboratory of Cancer Biology,Xi’an 710032,China)
OBJECTIVE:To study the effect of peiminine on increasing the chemosensitivity of 5 kinds of cancer cells.METHODS:Using human esophageal cancer Eca-109 cell,human breast cancer MCF-7 cell,human small cell lung cancer A549 cell,human hepatoma HepG2 cell and human cervical cancer HeLa cell as objects,MTT colorimetric method was used to detect the growth inhibition rate of above-mentioned 5 kinds of cancer cells after treated by peiminine with maximal non-toxic mass concentration(20 μg/mL)and adriamycin with different gradient mass concentrations(0.026-2.1,0.026-2.1,0.125-2.0,0.125-2.0,0.062 5-0.10 μg/mL)for 72 h.The half inhibitory concentration(IC50)was calculated.Crystal violet staining method was adopted to observe the proliferation of above-mentioned cancer cells after treated by peiminine with maximal non-toxic mass concentration and adriamycin with low mass concentrations(0.02,0.005,0.04,0.02,0.01 μg/mL)for 7 d.Solvent control,single use of peiminine and adriamycin control were conducted.RESULTS:Compared with single use of adriamycin,the combination use of peiminine and adriamycin can improve the growth inhibition rate of 5 kinds of cancer cells to certain degree,most of the differences were statistically significant(P<0.05 or P<0.01);and IC50was obviously decreased,with statistical significances(P<0.05 or P<0.01).Compared with solvent control,single use of peiminine or adriamycin had no obvious effects on the proliferation of above-mentioned cancer cells in 7 d,and the combination use of peiminine and adriamycin can obviously inhibit the proliferation of above-mentioned cancer cells in 7 d.CONCLUSIONS:Peiminine can enhance the sensitivity of above-mentioned-mentioned 5 kinds of cancer cells to certain degree,showing certain chemosensitivity increasing effect.
Peiminine;Adriamycin;Chemosensitizers;Esophageal cancer;Breast cancer;Lung cancer;Liver cancer;Cervical cancer
R965.1
A
1001-0408(2017)34-4796-05
DOI10.6039/j.issn.1001-0408.2017.34.11
新疆维吾尔自治区重点实验室专项资金资助项目(No.2014KL006);新疆维吾尔自治区自然科学基金资助项目(No.2017D01B43)
*硕士研究生。研究方向:新药和新剂型研究与开发。电话:0991-2828537。E-mail:tangqianqian0916@163.com
#通信作者:研究员,博士生导师。研究方向:新药研究与开发。电话:0991-2828537。E-mail:zhengyi087@126.com
2017-05-09
2017-07-14)
(编辑:邹丽娟)
