全球短缺药品监测制度的循证评价Δ
2017-12-19张伶俐陈哲曾力楠归舸张扬李佳莲黄宗瑶宋好鑫四川大学华西第二医院药学部成都610041四川大学华西第二医院循证药学中心成都610041出生缺陷与相关妇儿疾病教育部重点实验室成都610041四川大学华西药学院成都610041四川大学华西临床医学院成都610041
张伶俐,陈哲,曾力楠,归舸,4,张扬,5,李佳莲,4,黄宗瑶,4,宋好鑫,4(1.四川大学华西第二医院药学部,成都610041;2.四川大学华西第二医院循证药学中心,成都610041;3.出生缺陷与相关妇儿疾病教育部重点实验室,成都610041;4.四川大学华西药学院,成都610041;5.四川大学华西临床医学院,成都610041)
全球短缺药品监测制度的循证评价Δ
张伶俐1,2,3*,陈哲1,2,3,曾力楠1,2,3,归舸1,2,3,4,张扬1,2,3,5,李佳莲1,2,3,4,黄宗瑶1,2,3,4,宋好鑫1,2,3,4(1.四川大学华西第二医院药学部,成都610041;2.四川大学华西第二医院循证药学中心,成都610041;3.出生缺陷与相关妇儿疾病教育部重点实验室,成都610041;4.四川大学华西药学院,成都610041;5.四川大学华西临床医学院,成都610041)
目的:系统评价全球短缺药品监测制度,为我国开展短缺药品监测提供循证依据和政策建议。方法:以“药品(廉价药、基本药物、急救药品)短缺”“短缺药品”“药品供应不足”“药品缺货”为中文关键词,“Drug shortage”“Out-of-stock drug”“Shortage of medicine”“Stock out of medicine”为英文关键词,检索各数据库建库起至2017年4月3日发表在PubMed、Embase、中国知网、万方和维普数据库中的相关文献,并检索百度、谷歌等网站及各国家或地区卫生行政部门网站,收集短缺药品监测制度相关文献,提取监测制度的基本信息、数据采集方法、数据审核方法、数据报告方法及反馈与改进措施等信息。结果与结论:共纳入25篇文献,并检索了20个国家或地区卫生行政部门网站。11个国家及欧盟建立了短缺药品监测制度;各国短缺药品上报主体各异,一般以生产企业、经营企业、医疗机构为主,上报方式以网络填报为主;数据审核以各国成立的短缺药品部门或小组为主;监测报告包括短缺药品和停产药品信息;各国针对短缺药品的解决措施包括寻找替代药品、鼓励企业生产、临时进口、寻找新的或其他的原料来源、加快短缺药品审批,预防措施包括制定短缺药品相应的法律法规和管理指南、加大与非政府部门的合作等。我国短缺药品监测制度尚待完善。建议我国建立短缺药品监测预警平台及短缺药品分级干预机制,完善短缺药品相关法律法规,制定短缺药品管理指南。
短缺药品;监测;制度;循证评价
药品短缺是一个全球性问题,其不仅发生在发展中国家,也发生在发达国家。实现药品可及、保障人人享有基本医疗保健是世界卫生组织(WHO)及各国药物政策的主要目标,但药品短缺已经成为实现这一目标的主要障碍,并引起国际社会的高度关注[1]。2016年5月28日,第69届世界卫生大会指出:“近年来,缺货和短缺的严重程度在世界上多数地方不断上升”[2]。目前,全球在解决短缺药品方面做了大量探索与尝试。因此,笔者在本文中系统检索国内外短缺药品监测制度,比较分析其基本情况、数据采集、数据审核、监测报告及解决措施等,为我国短缺药品监测平台的建设提供循证依据和政策建议。
1 资料与方法
1.1 文献检索
检索PubMed、Embase、中国知网、万方和维普等数据库,检索可使用英文进行检索的国家的卫生行政部门网站,补充检索百度、谷歌等网站。中文检索词:“药品(廉价药、基本药物、急救药品)短缺”“短缺药品”“药品供应不足”“药品缺货”;英文检索词:“Drug shortage”“Out-of-stockdrug”“Shortageofmedicine”“Stock out of medicine”。数据库的检索时限为各数据库建库起至2017年4月3日。
1.2 纳入与排除标准
纳入标准:能够获取全文的研究性中、英文文献,主题涉及短缺药品监测制度和解决措施的介绍。排除标准:与短缺药品主题无关的文献以及重复发表的文献。
1.3 文献筛选
由两位研究者根据纳入与排除标准,独立筛选文献。若遇分歧,通过相互讨论或咨询第三方达成一致。
1.4 数据提取与分析
设计统一的资料提取表,以1%的文献进行预试验,修订资料提取表并制订填表说明。提取内容包括:(1)短缺药物监测制度基本信息。包括地区、国家、监测制度名称、建立时间、负责机构、目的、流程等。(2)数据采集方法。包括上报主体、上报方式、上报频率、上报内容、上报网址等。(3)数据审核方法。包括负责部门、人员、频率、方法等。(4)数据报告方法。包括发布网站、报告机构、报告频率、报告形式、报告内容等。(5)反馈与改进措施。包括解决措施名称、时间、内容等。采用描述性分析方法,分析与比较全球短缺药品监测制度和解决措施。
1.5 统计分析
运用EndNote X7、Excel 2016软件对纳入文献进行统计分析。
2 结果
2.1 文献检索与筛选结果
可使用英文进行检索的国家的卫生行政部门网站共计20个,详见表1。
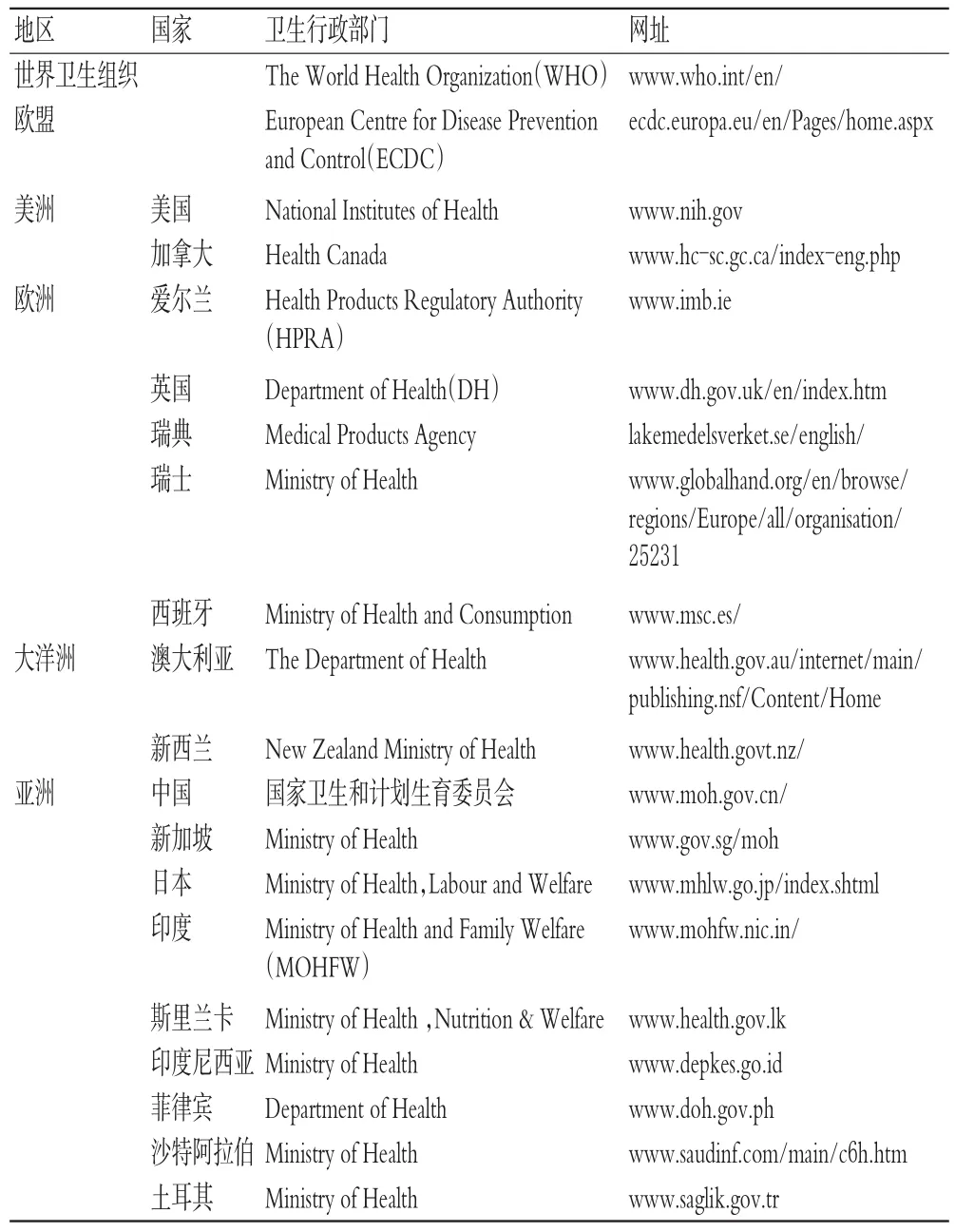
表1 国际和各国卫生行政部门官方网站Tab 1Official websites of international and nationalhealthadministrativedepartments
通过检索5个数据库及20个卫生行政部门网站,共检索文献5 900篇;去除重复4 750篇,阅读题目、摘要后,剔除不符合纳入标准的文献849篇;阅读全文后,排除无法阅读全文和无短缺药品监测信息的文献277篇。最终纳入文献25篇[1,3-26],其中中文文献19篇,英文文献6篇。文献筛选流程见图1。
2.2 短缺药品监测制度基本情况
全球现有短缺药品监测制度或试点制度的国家为11个(美国、加拿大、澳大利亚、荷兰、意大利、法国、比利时、德国、西班牙、英国、中国),以欧洲国家为主;另欧盟成员国间建立了欧洲药品短缺监测制度。此类制度多由各国卫生部门制定与实施。短缺药品监测目的均为收集和发布短缺药品信息,预防和解决短缺药品问题。监测制度的流程一般包括上报、审核、发布及更新。全球短缺药品监测制度基本情况见表2(由于语言差异,未见报道意大利、法国、比利时、德国、西班牙的短缺药品监测制度具体情况)。

图1 文献筛选流程Fig 1Literature screening process
2.3 短缺药品监测情况
为进一步了解各国短缺药品监测情况,本研究从数据采集方法、数据审核方法、数据报告方法、反馈与改进措施4个方面比较各国短缺药品监测制度。
2.3.1 数据采集方法共有6个国家或地区规定了数据采集相关情况。其中,各国短缺药品上报主体各异,包括生产企业、经营企业、医疗机构、协会、个人(患者或看护人员),一般以生产企业、经营企业、医疗机构为主。上报方式以网络填报为主,美国、澳大利亚、英国还存在邮件和电话报告两种方式。除中国为每月上报外,其余国家均为实时上报。上报内容一般包括药品信息(名称、剂型、规格等)、生产厂家信息(名称、联系方式等)、短缺信息(短缺原因、预计短缺时间等)等。各个国家或地区短缺药品数据采集情况见表3。
2.3.2 数据审核方法4个国家或地区规定了短缺药品数据审核方法。各国数据审核部门均为各国上报数据部门,一般由专门的部门、委员会或成立的短缺药品小组进行实时数据审核。但未查到欧洲、加拿大和澳大利亚详细的数据审核办法,仅美国有较详细的数据审核方法。各个国家或地区短缺药品数据审核情况见表4。

表2 全球短缺药品监测制度基本情况Tab 2General information of monitoring system for the global short drugs
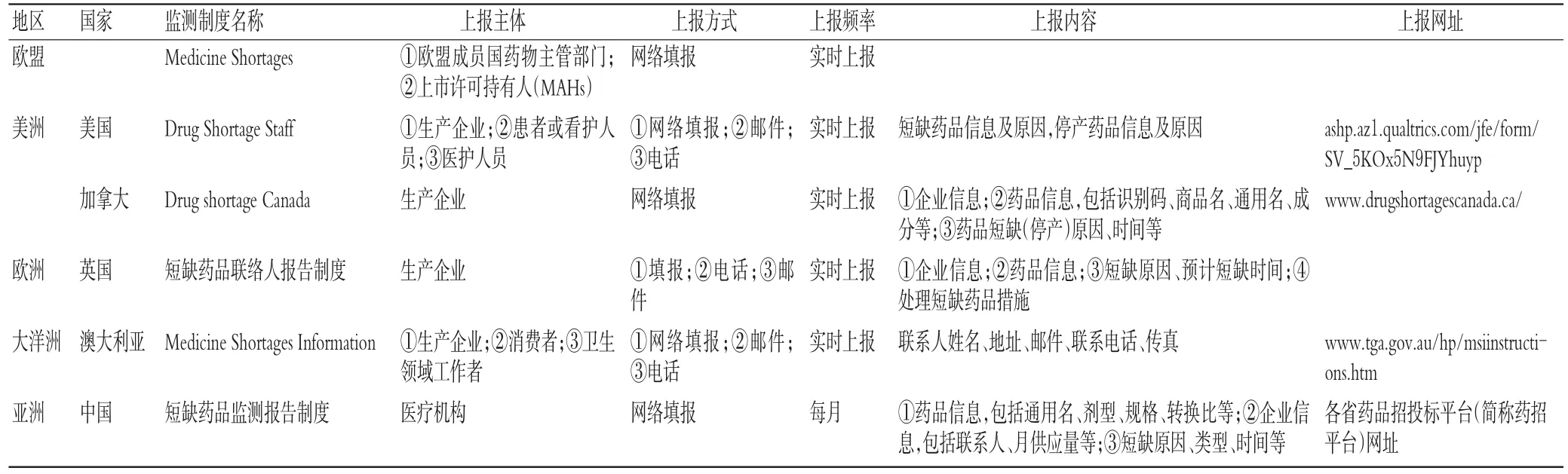
表3 短缺药品数据采集方法Tab 3Data collection method of short drugs

表4 短缺药品数据审核方法Tab 4Data validation method of short drugs
2.3.3 数据报告方法4个国家或地区规定了短缺药品数据报告相关情况。其中,短缺药品监测结果一般是实时报告,报告发布在网站上。报告内容一般包括:①短缺药品信息,包括已解决、正短缺、预计短缺药品3个维度信息,每条短缺药品信息包括药品名称、生产厂家、剂型、规格、短缺日期、预计短缺时间、短缺原因等;②停产药品清单,每条停产药品信息包括药品名称、生产厂家、剂型、规格、停产日期、停产原因等。各个国家或地区短缺药品监测结果报告情况见表5。
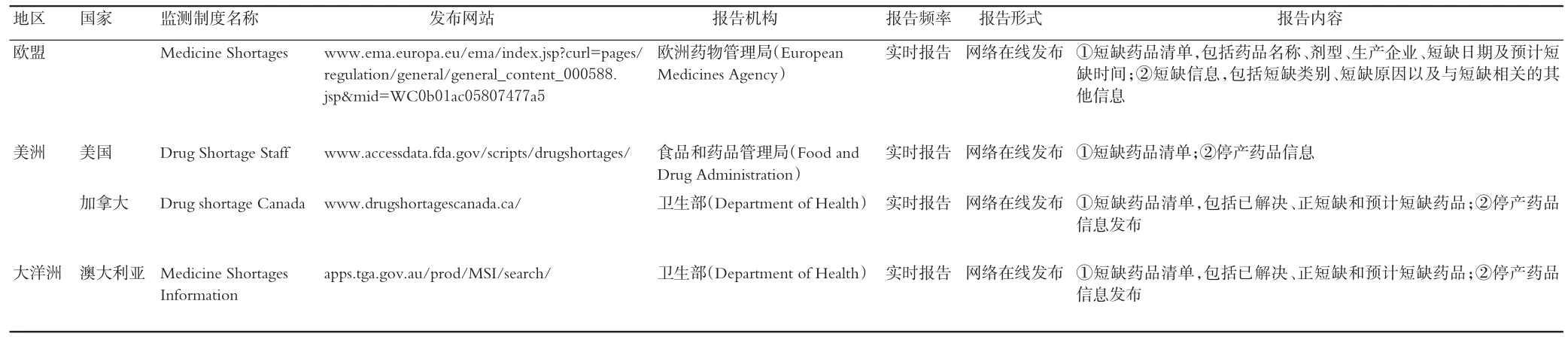
表5 短缺药品数据报告方法Tab 5Monitoring reporting method of short drugs
2.3.4 反馈与改进措施各个国家或地区短缺药品反馈与改进措施见表6。
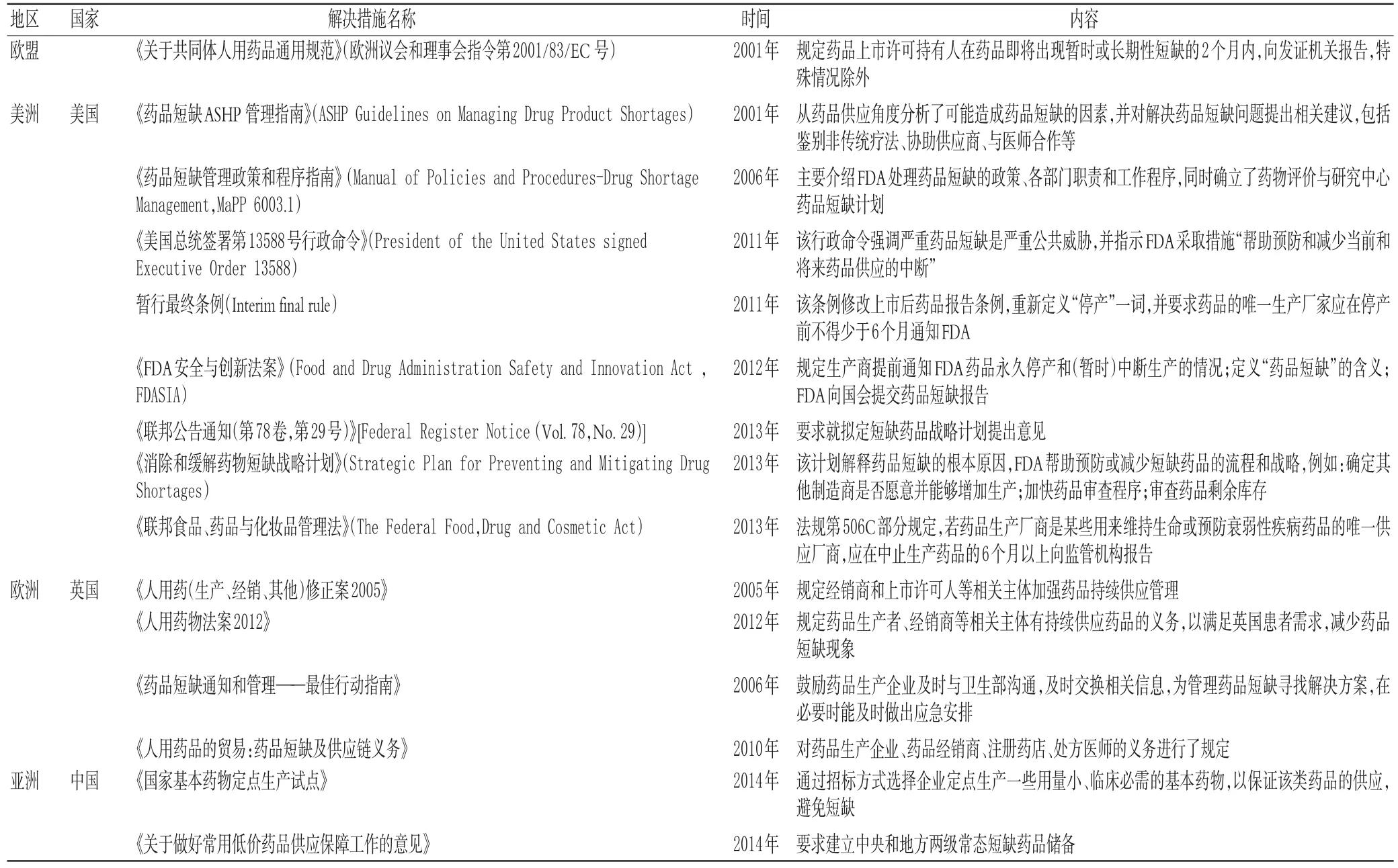
表6 短缺药品反馈与改进措施Tab 6Countermeasures for short drugs
由表6可知,各国家或地区短缺药品解决措施包括:①寻找替代药品;②与企业合作,通过税率优惠等手段,鼓励企业生产短缺药品,保证药品供应;③临时进口短缺药品;④寻找新的或其他的原料来源;⑤加快短缺药品审批。预防措施包括:①制定短缺药品相应的法律法规,以规范短缺药品管理,如加快短缺药品的审批流程、要求生产厂家应停产前不得少于6个月通知FDA;②制定短缺药品管理指南,明确短缺药品管理的目的、流程和各部门的职责,如美国、英国;③加大与非政府部门的合作,如FDA与美国药师协会合作,协同处理短缺药品监测问题。
3 讨论
本研究显示,全球多个国家或地区已开展短缺药品监测,以欧洲建立短缺药品监测制度的国家最多,而美国、英国、加拿大监测制度更完善,值得借鉴。全球短缺药品监测的主要负责机构为卫生行政部门,监测主体多为生产企业、经营企业、医疗机构;数据采集以网络填报为主,上报信息包括药品信息、生产企业信息、短缺信息;数据审核以各国成立的短缺药品部门或小组为主;监测报告包括短缺药品(已解决、正短缺、预计短缺)和停产药品信息;解决措施主要以发布法律或指南规范短缺药品管理。
2016年4月15 日,我国国家卫生和计划生育委员会办公厅下发《国家卫生计生委办公厅关于建立短缺药品监测报告制度试点的通知》(国卫办药政函〔2016〕384号),文件要求以省(区、市)为单位确定短缺药品监测点,依托省级药品集中采购平台开展短缺药品监测预警,并要求自2016年6月起,各省(区、市)在每月5日前汇总审核上月监测点报送信息及平台监测的药品短缺信息,上传至国家医药管理相关平台。
尽管我国短缺药品监测已广泛开展,但仍存在局限性:一是监测环节缺失。现行短缺药品监测的主体为医疗机构和少数药品经营企业(批发企业),仅涵盖药品使用及部分流通环节,未包括药品生产环节,且各环节数据上报力度、及时性、积极性不足。二是数据上报滞后。现行上报制度基于各省药招平台,经逐级审核后上报至国家层面的数据时效性和完整性不足,导致国家层面对药品短缺信息的掌握严重滞后。三是预警及分级干预机制缺乏。现行上报机制为单向上报,已上报的问题无法及时得到反馈与解决,导致上报积极性降低、短缺药品问题未得到根本解决;同时,由于缺乏对药品生产环节的监测,无法提前预警药品短缺情况,使得医疗机构常常无法及时有效应对短缺问题,导致临床突然无药可用。
4 对策与建议
借鉴全球短缺药品监测制度,对我国短缺药品监测工作建议如下。
4.1 建立基于各省药招平台的短缺药品监测预警平台
全球多个国家或地区(美国、加拿大、澳大利亚)均建立了国家层面的短缺药品监测平台,利用该平台各国可实时发布短缺药品和替代药品信息,使相关者充分了解短缺药品情况。基于我国短缺药品监测现状,建议建立基于各省药招平台的短缺药品监测预警平台,以便实时收集、审核、发布短缺药品与替代药品信息,为国家相关部委实时提供全国短缺药品统计数据,使其能及时掌握全国药品生产、供应情况;也为医疗机构、药品生产企业和经营企业提供短缺药品预警信息,使其能合理安排药品生产、使用。
4.2 建立短缺药品分级干预机制
根据药品短缺原因,建立国家级与省级分级干预机制。(1)国家级层面。若全国范围均无生产或省内无法调度的药品,则由国家卫计委协调国家相关部门解决。在国家层面协调与相关部委建立协调联动机制,包括发改委、工信部、国家食品药品监督管理总局及中医药管理局等,通过定点生产、完善国家药物储备、加快审批流程等手段,解决由药品原料短缺、药品垄断、突发事件等多环境原因导致的药品短缺。(2)省级层面。若省内有相同药品的不同厂家或配送企业可供应,则省内自行解决短缺药品。
4.3 完善短缺药品相关法律法规
根据系统评价结果,借鉴英、美国家通用做法,建议完善短缺药品相关法律法规。例如:药品为独家生产,应在药品停产前6个月向监管机构上报;明确生产企业职责,对未保证药品充足供应的生产企业给予行政处罚并处以罚金。
4.4 制定短缺药品管理指南
据系统评价结果,美国在2001年发布《药品短缺ASHP管理指南》、2006年发布《药品短缺管理政策和程序指南》,英国在2006年发布《药品短缺通知和管理——最佳行动指南》。建议我国制定短缺药品管理指南,内容包括短缺药品定义及范围、造成药品短缺的原因、处理短缺药品的政策、各部门职责和工作程序、解决方案等。
[致谢:国际合理用药网络中国中心组高风险用药人群药物管理组;教育部长江学者创新团队基金(No.IRT0935)]
[1]尚春成,郭冬梅.国外解决药品短缺的经验及其对我国的启示[J].现代中药研究与实践,2016,30(6):74-78.
[2]世界卫生组织.世卫组织与非国家行为者交往的框架[EB/OL].[2017-06-10].http://www.who.int/mediacentre/news/releases/2016/wha69-28-may-2016/zh/.
[3]武丽娜,方宇,杨才君,等.我国药品短缺问题研究进展评述[J].中国药事,2016,30(5):458-464.
[4]王志刚,田侃,喻小勇.美国FDA药物短缺应对策略及其对我国的启示[J].医学争鸣,2016,17(3):50-53.
[5]蔡文芳,杨才君,沈倩.国内外药品短缺问题研究进展[J].中国药事,2016,30(12):1190-1199.
[6]徐飞,冯国忠.美国食品药品监督管理局短缺药品信息平台对我国的启示[J].中国医院药学杂志,2016,36(24):2137-2140.
[7]杨悦,黄果,初智铭.美国处理药品短缺问题的经验及其对我国的启示[J].中国药房,2008,19(28):2173-2176.
[8]宋雅梅.美国药品短缺相关法规、指南及其对我国的启示[J].中国医院药学杂志,2012,32(11):890-893.
[9]邵蓉,孙海顺,张梦.英国短缺药品联络人报告制度对我国的启示[J].卫生经济研究,2016(12):22-24.
[10]陈慧,刘河,安卓玲,等.全国18个省市63家医疗机构药品短缺的调查分析及应对思考[J].药学服务与研究,2016,5(16):331-334.
[11]赵东升,王强,杨凌.ASHP药品短缺管理指南及其对我国的启示[J].中国医药导报,2013,17(10):166-168.
[12]张海波,宁玲,长青.部分药品短缺的成因分析与应对策略[J].南京医科大学学报(社会科学版),2012,12(2):115-117.
[13]陶立波.发达国家应对药品短缺问题的经验及启示[J].中国卫生政策研究,2008,1(3):38-42.
[14]郭冬梅.关于构建我国药品短缺风险预警管制体系的思考[J].广东药学院学报,2015,5(31):642-645.
[15]吕佳,吉生.基于数据库模型的药品短缺原因分析[J].今日药学,2013,23(12):843-851.
[16]赵东升,王强,杨凌.加拿大预防药品短缺策略简介及对我国的启示[J].中国医药导报,2013,10(6):155-157.
[17]高晨,王孝蓉.美国医院药剂师协会药品缺货管理指南[J].中国医院药学杂志,2006,26(10):1289-1290.
[18]袁雪丹,鸿鹏.全球药品短缺管理及其对我国的启示[J].中国卫生经济,2016,35(11):60-63.
[19]杨坚,汤少梁.我国基本药物短缺问题刍议[J].湖北中医药大学学报,2013,15(2):66-67.
[20]张翠莲,梅丹,李大魁.我国应对部分药品短缺的策略初探[J].中国药房,2009,20(25):1933-1936.
[21]ASHP Expert Panel on Drug Product Shortages,Fox ER,Birt A,et al.ASHP guidelines on managingdrugproductshortages[J].AmJHealth Syst Pharm,2009,66(15):1399-1406.
[22]Office of the Center Director.Drug shortage management[S].2014-03-09.
[23]Food and Drug Administration.Strategic plan forpreventingandmitigatingdrugshortages[S].2013-10.
[24]Department of Health.Notification and management of medicines shortages[S].2006-11-06.
[25]Pauwels K,Huys I,Casteels M,et al.Drug shortages in European countries:a trade-off between market attractiveness and cost containment[J].BMC Health Services Research,2014,14(1):438-447.
[26]Health Products Compliance Directorate.Guide toreportingdrugshortagesanddiscontinuations[S].2017-03-14.
Evidence-based Evaluation of Monitoring System for Global Short Drugs
ZHANG Lingli1,2,3,CHEN Zhe1,2,3,ZENG Linan1,2,3,GUI Ge1,2,3,4,ZHANG Yang1,2,3,5,LI Jialian1,2,3,4,HUANG Zongyao1,2,3,4,SONG Haoxin1,2,3,4(1.Dept.of Pharmacy,West China Second University Hospital,Sichuan University,Chengdu 610041,China;2.Evidence-based Pharmacy Center,West China Second University Hospital,Sichuan University,Chengdu 610041,China;3.Key Laboratory of Birth Defects and Related Diseases of Women and Children,Ministry of Education,Chengdu 610041,China;4.West China School of Pharmacy,Sichuan University,Chengdu 610041,China;5.West China School of Medicine,West China Hospital,Sichuan University,Chengdu 610041,China)
OBJECTIVE:To systematically evaluate the monitoring system for global short drugs,and provide evidence-based reference and policy recommendations for developing the short drug monitoring in China.METHODS:Relevant literatures published in PubMed,Embase,CNKI,Wanfang,VIP database from building to Apr.3rd in 2017 were retrieved by using“Drugs(cheap drugs,essential medicines,emergency drugs)storage”“Short drugs”“Insufficient supply of drugs”“Drug shortage”as Chinese keywords,and“Drug storage”“Out-of-stock drug”“Stortage of medicine”“Stock out of medicine”as English keywords.Literatures about monitoring system for short drugs in Baidu,Google and national or regional health administration websites were collected,and general information,data collection,data validation,data reporting method,feedback and improvement measures of monitoring system were extracted.RESULTS&CONCLUSIONS:Totally 25 literatures were included,20 national or regional health administration websites were retrieved.11 countries and European Union had established monitoring system for short drugs.The main reporting agencies in each country were different,which were production enterprises,business enterprises and medical institutions.It was mainly reported by network.Data validation was mainly conducted by specialized departments or groups for short drugs in each country.The monitoring reporting included information of short drugs and discontinued drugs.Countermeasures in each country mainly included looking for alternative drugs,encouraging production,temporary im-port,looking for new or other sources of raw materials and speeding up the approval of short drugs.Besides,precautions included implementation relevant laws and guidelines for short drugs,and increasing the cooperation with non-government departments,etc.Monitoring system for short drugs needs to be further improved in China.It is suggested to establish monitoring and early warning platform for short drugs,and hierarchical intervention mechanism,improving relevant laws and developing guidelines on managing short drugs.
Short drugs;Monitoring;System;Evidence-based evaluation
R95
A
1001-0408(2017)34-4753-06
DOI10.6039/j.issn.1001-0408.2017.34.01
国家卫生和计划生育委员会2017年委托课题(No.2017bwqt-008-wjw)
*主任药师,博士生导师,博士。研究方向:循证药物决策与管理、循证临床药学研究与实践。电话:028-85503205。E-mail:zhanglingli@scu.edu.cn
2017-07-07
2017-10-19)
(编辑:刘明伟)
