基于血清和肝代谢组学研究护肝片的保肝作用Δ
2017-12-19龚梦鹃巫圣乾岳贺王淑美梁生旺邹忠杰广东药科大学中药学院广州510006国家中医药管理局中药数字化质量评价技术重点研究室广州510006广东高校中药质量工程技术研究中心广州510006
龚梦鹃,巫圣乾,岳贺,王淑美,梁生旺,邹忠杰#(1.广东药科大学中药学院,广州510006;2.国家中医药管理局中药数字化质量评价技术重点研究室,广州510006;3.广东高校中药质量工程技术研究中心,广州510006)
基于血清和肝代谢组学研究护肝片的保肝作用Δ
龚梦鹃1,2,3*,巫圣乾1,2,3,岳贺1,2,3,王淑美1,2,3,梁生旺1,2,3,邹忠杰1,2,3#(1.广东药科大学中药学院,广州510006;2.国家中医药管理局中药数字化质量评价技术重点研究室,广州510006;3.广东高校中药质量工程技术研究中心,广州510006)
目的:从代谢通路角度阐明护肝片保肝作用的药效及作用机制。方法:将36只雄性SD大鼠随机分成正常组(0.5%羧甲基纤维素钠)、模型组(0.5%羧甲基纤维素钠)和护肝片组(1.7 g/kg),每组12只,每天ig给药1次,连续给药9 d。末次给药后1 h,模型组和护肝片组大鼠ip 50%四氯化碳(CCl4)花生油溶液1 mL/kg诱导肝损伤。造模24 h后,检测大鼠肝组织中丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)水平;利用核磁共振氢谱(1H-NMR)代谢组学技术建立大鼠血清和肝代谢物谱,分析护肝片对CCl4致急性肝损伤大鼠血清和肝代谢轮廓变化和潜在生物标志物的影响。结果:与正常组比较,模型组大鼠肝组织中MDA水平显著升高(P<0.05),SOD、GSH-Px水平显著降低(P<0.05);大鼠机体生理及物质代谢均发生了明显的改变,11种血清代谢潜在生物标志物和14种肝代谢潜在生物标志物水平均显著升高/降低(P<0.05)。与模型组比较,护肝片组大鼠肝组织中MDA水平显著降低(P<0.05),SOD、GSH-Px水平显著升高(P<0.05)。大鼠血清和肝代谢趋于正常,6种血清代谢潜在生物标志物(异亮氨酸、亮氨酸、3-羟基丁酸、丙酮、乙酰乙酸、胆碱)和8种肝代谢潜在生物标志物(3-羟基丁酸、丙氨酸、谷氨酸、丙酮酸、琥珀酸、胆碱、乳酸、葡萄糖)得到显著回调(P<0.05)。结论:护肝片保肝的机制可能与抗氧化应激及调控脂质代谢、糖代谢和氨基酸代谢有关。
护肝片;急性肝损伤;代谢组学;核磁共振;潜在生物标志物;大鼠
护肝片是保肝降酶的中成药,临床主要用于治疗慢性肝炎及早期肝硬化,并可预防及治疗脂肪肝、酒精肝、药物性肝损伤等症[1-2],疗效确切、显著。其处方来源于东汉张仲景所著《伤寒论》中的小柴胡汤和茵陈蒿汤,由柴胡、五味子、茵陈、板蓝根、猪胆粉、绿豆等6味药材组成。药理实验表明,护肝片有防治酒精性肝损伤、抗四氯化碳(CCl4)所致肝损伤、抗肝纤维化[3-5]等作用。
代谢组学是20世纪90年代中期发展起来的一门新兴学科,是通过考察生物体系受刺激或扰动后(如将某个特定的基因变异或环境变化后)其代谢产物的变化或随时间的变化,来研究生物体系的代谢途径的一种技术[6]。代谢组学的研究通过对某一病症相关特定组分的共性加以分析、判断,能够帮助人们更好地理解病变过程及机体内物质的代谢途径和代谢状况;同时代谢组学还有助于发现疾病的潜在生物标志物而达到辅助临床诊断的目的,其在中医药领域已有广泛应用[7]。本研究采用核磁共振氢谱(1H-NMR)代谢组学技术探讨CCl4致大鼠急性肝损伤后其血清和肝代谢轮廓变化及护肝片对相关代谢通路和潜在生物标志物的影响,从代谢通路角度阐明护肝片保肝作用的药效及作用机制。
1 材料
1.1 仪器
AVANCEⅢ500 MHz全数字化超导NMR仪(瑞士Bruker公司);UV-2401-PC紫外-可见分光光度计(日本岛津公司);1-14低温离心机(德国Sigma公司)。
1.2 药品与试剂
护肝片(黑龙江葵花药业股份有限公司,批号:201609128,规格:0.35 g/片);CCl4(分析纯,天津市大茂化学试剂厂,批号:20170102);丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、考马斯亮蓝试剂盒(南京建成生物工程研究所,批号分别为20170330、20170410、20170411、20170410);蛋白酶抑制剂Cocktail(美国Biotool公司,批号:NJ177437);氘水(D2O)、磷酸盐缓冲液(PBS)(美国Sigma公司,批号分别为1001484275、K40104)。
1.3 动物
SPF级SD大鼠36只,♂,体质量180~200 g,购自广州中医药大学实验动物中心,动物生产许可证号:SCXK-(粤)2013-0034。
2 方法
2.1 分组与给药
将36只大鼠随机分成正常组、模型组和护肝片组,每组12只。护肝片组大鼠ig护肝片混悬液(0.5%羧甲基纤维素钠溶解),剂量为1.7 g/kg[4];正常组和模型组大鼠ig等体积0.5%羧甲基纤维素钠溶液,每天给药1次,连续9 d。末次给药后1 h,模型组和护肝片组大鼠ip 50%CCl4花生油溶液1 mL/kg,正常组大鼠ip等体积不含CCl4的花生油溶液。每组随机选取6只大鼠用于测量肝组织生化指标水平,另外6只大鼠用于血清和肝代谢组学分析。
2.2 肝组织中生化指标水平检测
CCl4诱导肝损伤24 h后,处死大鼠,冰上分离出肝组织。取部分肝组织制成肝匀浆,然后以离心半径为5 cm、3 500 r/min低温离心15 min,取上清液。按相应试剂盒说明书操作,进行MDA、SOD、GSH-Px水平检测,并采用考马斯亮蓝法测定肝组织样品中蛋白含量。
2.3 血清和肝代谢组学分析
2.3.1 样本采集与处理CCl4诱导肝损伤24 h后,大鼠眼眶后静脉丛取血至离心管中,以离心半径为5 cm、3 500 r/min低温离心15 min,收集血清。取400 μL血清、50 μL磷酸缓冲液(Na2HPO4/NaH2PO4,pH 7.4)和50 μL氘水(D2O)加入到核磁管中,待测。处死大鼠,取肝组织匀浆,以离心半径为5 cm、12 000 r/min低温离心10 min,取上清液(750µL),冻干。冻干物用450µL磷酸缓冲液(Na2HPO4/NaH2PO4,pH 7.4)和450µL含有0.05%3-(三甲基甲硅烷基)丙酸-d4钠盐(TSP-d4)的D2O溶解,然后以离心半径为5 cm、12 000 r/min低温离心10 min,取上清液(550µL),加入到核磁管中,待测。
2.3.21H-NMR测定血清样本采用弛豫编辑脉冲序列(Carr-Purcell-Meiboom-Gill,CPMG)进行测定,采用预饱和方式抑制水峰;肝组织样本则采用预饱和的1D NOESY脉冲序列抑制水峰。
2.3.31H-NMR图谱处理分析对血清和肝1H-NMR图谱采用线宽为0.3 Hz的指数窗函数进行傅里叶变换,进行基线校正后,分别参照乳酸的甲基共振双重峰(δ1.33)和TSP-d4(δ0.0)对1H-NMR谱的化学位移进行定标。在δ 0.5~9.5区域按δ0.01等间隔分段积分,将剩余积分值进行归一化处理后,所得数据乘以10 000导入SIMCAP 12.0软件,然后进行正交偏最小二乘判别分析(OPLSDA)。质量评价指标包括R2X(表示X的变异百分比)、R2Y(表示Y的变异百分比)、Q2(表示累计预测结果的真实性,大于0.4时认为预测结果可接受,大于0.9时认为预测结果更可靠)。最后,通过使用OPLS-DA模型中变量重要性投影(Variable importance in the projection,VIP)和独立样本t检验来评价内源性代谢物相对峰面积在正常组和模型组间的差异。只有同时满足VIP>1和P<0.05的代谢物才被认为是潜在生物标志物。
2.4 统计学方法
3 结果
3.1 大鼠肝组织中MDA、SOD、GSH-Px水平
与正常组比较,模型组大鼠肝组织中MDA水平显著升高(P<0.05),SOD、GSH-Px水平显著降低(P<0.05);与模型组比较,护肝片组大鼠肝组织中MDA水平显著降低(P<0.05),SOD、GSH-Px水平显著升高(P<0.05),结果见表1。
表1 各组大鼠肝组织中MDA、SOD、GSH-Px水平测定结果(±s,n=6)Tab 1Determination results of MDA,SOD,GSHPxlevelsinlivertissueofratsin each group(±s,n=6)
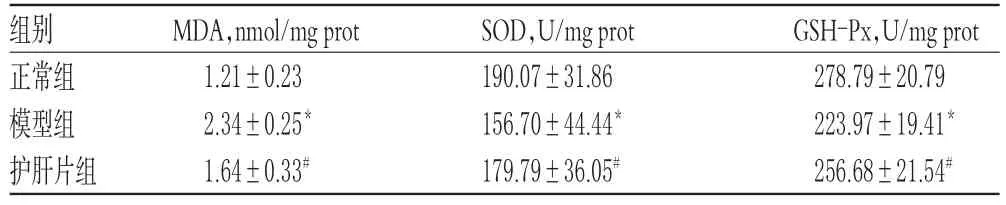
表1 各组大鼠肝组织中MDA、SOD、GSH-Px水平测定结果(±s,n=6)Tab 1Determination results of MDA,SOD,GSHPxlevelsinlivertissueofratsin each group(±s,n=6)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05
GSH-Px,U/mg prot 278.79±20.79 223.97±19.41*256.68±21.54#组别正常组模型组护肝片组MDA,nmol/mg prot 1.21±0.23 2.34±0.25*1.64±0.33#SOD,U/mg prot 190.07±31.86 156.70±44.44*179.79±36.05#
3.2 大鼠血清和肝组织的1H-NMR代谢物谱分析
代谢物谱峰的归属主要依据化学位移值、峰的裂分情况、耦合常数及参考文献报道[8-9]。血清和肝组织中的代谢物主要是与脂质代谢、氨基酸代谢和糖代谢有关的酮体、氨基酸、有机酸和糖等物质。大鼠血清和肝组织的1H-NMR图谱见图1。
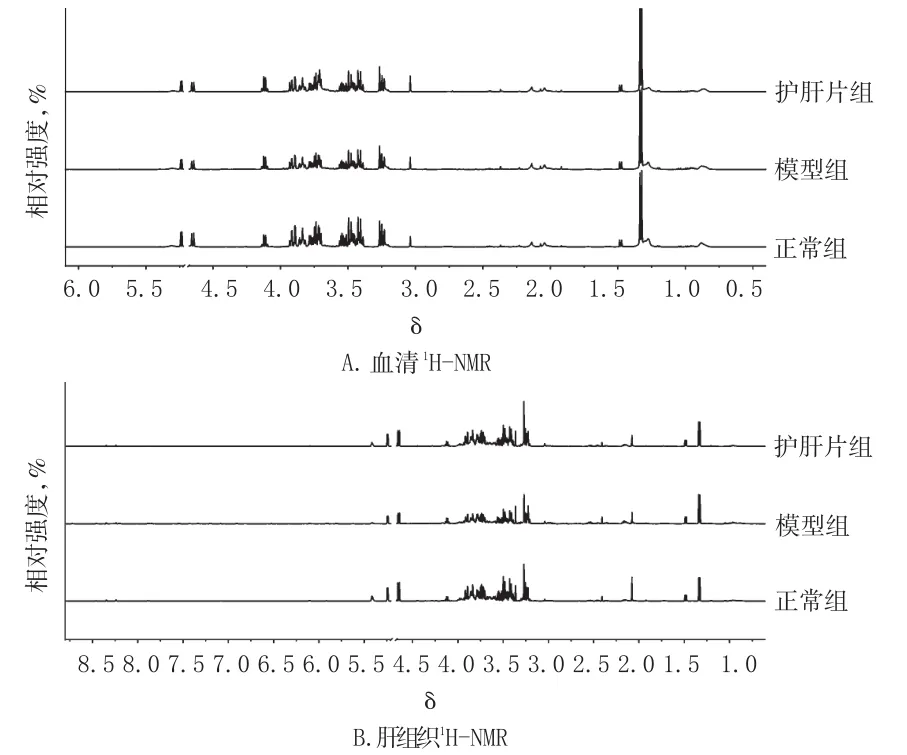
图1 各组大鼠血清和肝组织的1H-NMR图Fig 11H-NMR spectra of serum and liver tissue of rats in each group
3.3 大鼠代谢表型的变化
正常组和模型组大鼠血清和肝组织的样本点在PC1维可以完全区分开,说明CCl4诱导急性肝损伤后大鼠机体生理及物质代谢状况发生了明显的改变(见图2A和图2B)。本研究采用7倍交叉验证法对OPLS-DA模型的可靠性进行验证,得到了OPLS-DA模型的主要参数,血清:R2X(cum)=0.81,R2Y(cum)=0.97,Q2(cum)=0.87;肝:R2X(cum)=0.86,R2Y(cum)=0.99,Q2(cum)=0.96。从上述参数可以看出,本研究建立的模型具有较高的可靠性。护肝片组大鼠血清和肝组织的样本点与模型组样本点可以完全分离,且与正常组样本点接近,表明护肝片能对CCl4致急性肝损伤的大鼠血清和肝代谢紊乱进行有效的干预,并使之逐步恢复到正常状态(见图2C和图2D)。各组大鼠血清和肝组织的OPLS-DA得分结果见图2。
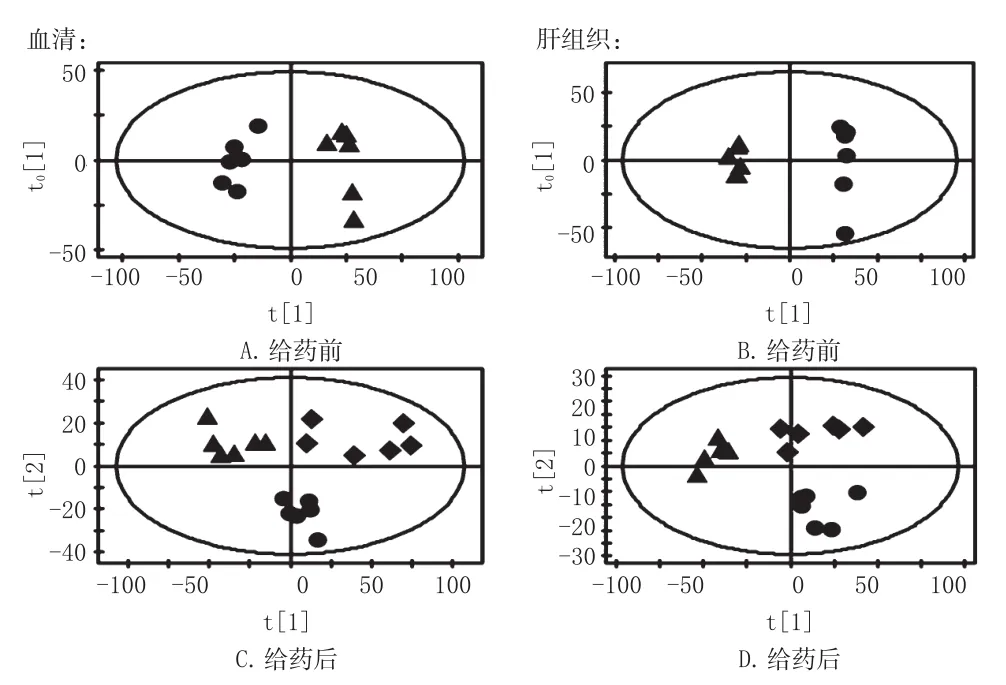
图2 各组大鼠血清和肝组织的OPLS-DA得分Fig2OPLS-DAscoringofserumandliver tissue of rats in each group
3.4 潜在生物标志物的检测结果
按“2.3.3”方法,最终在大鼠血清和肝组织中分别筛选得到11、14种与急性肝损伤相关的潜在生物标志物,其水平较正常组均显著上调/下调(P<0.05)。护肝片能使急性肝损伤大鼠血清中6种和肝组织中8种潜在生物标志物显著回调:护肝片组大鼠血清中异亮氨酸、亮氨酸、3-羟基丁酸、丙酮、乙酰乙酸、胆碱水平显著下调,与模型组比较差异具有统计学意义(P<0.05);护肝片组大鼠肝组织中3-羟基丁酸、丙氨酸、谷氨酸、丙酮酸、琥珀酸、胆碱、乳酸水平显著下调,葡萄糖水平显著上调,与模型组比较差异均具有统计学意义(P<0.05)。该结果与图2结果相一致,同样表明护肝片能对CCl4致急性肝损伤的大鼠血清和肝组织代谢紊乱进行有效的干预。与CCl4急性肝损伤相关的大鼠血清、肝组织代谢潜在生物标志物测定结果见表2、表3。
4 讨论
CCl4诱导的大鼠急性肝损伤模型是目前被广泛接受的用来研究肝损伤机制和药效评价的模型之一。CCl4在肝内经细胞色素P450代谢产生毒性自由基代谢产物三氯甲基和过氧三氯甲基自由基,二者诱导的氧化应激反应可以造成DNA断裂、蛋白质变性降解和脂质过氧化等多种细胞损伤[10]。MDA作为脂质过氧化反应的重要产物,其含量高低间接反映了机体细胞受自由基攻击的严重程度。SOD和GSH-Px是组成生物体体内酶促防御体系重要的抗氧化酶,其能有效地清除活性氧自由基并终止自由基链式反应。在本研究中,与模型组比较,护肝片组大鼠肝组织中SOD和GSH-Px水平显著升高,MDA水平显著降低。该结果说明护肝片能提高大鼠肝组织的抗氧化能力,对CCl4所致的大鼠肝损伤具有预防作用。
代谢组学研究中,CCl4诱导的氧化应激造成的肝细胞损伤表现为模型大鼠血清和肝组织中胆碱、磷酸胆碱、异亮氨酸、亮氨酸、缬氨酸、丙氨酸、谷氨酸和谷胱甘肽水平升高。氧化应激可以造成肝细胞膜脂质过氧化,胆碱是细胞膜和脂蛋白磷脂的重要组分,在维持细胞膜完整性和脂质代谢中发挥着重要作用。氧化应激对细胞膜的损伤可能造成了胆碱和磷酸胆碱水平的升高[11];氨基酸(异亮氨酸、亮氨酸、缬氨酸、丙氨酸和谷氨酸)水平升高可能体现了氧化应激造成蛋白质变性降解[12]及氨基酸代谢紊乱[13];谷胱甘肽水平升高可能是机体为拮抗过氧化的应激性反应。上述研究结果与文献[13]报道相一致。模型组大鼠血清和肝组织中葡萄糖水平下降,而琥珀酸、丙酮酸和乳酸水平升高,说明CCl4致肝损伤后机体能量需求增加,同时无氧糖酵解活动显著增强,这与CCl4导致的肝细胞缺氧状态相一致[14]。酮体是脂肪酸在肝中β-氧化后的中间代谢产物,是肝输出能源的一种形式。CCl4诱导的大鼠机体脂质代谢异常表现为血清极低密度脂蛋白/低密度脂蛋白升高,同时血清和肝中酮体(3-羟基丁酸、丙酮和乙酰乙酸)含量增加。此外,文献报道CCl4导致机体三磷酸腺苷(ATP)水平降低[14]。本研究中模型组大鼠肝组织腺苷水平升高,表明机体能量储备失衡[13]。护肝片能分别使大鼠血清中6种和肝组织中8种与急性肝损伤相关的潜在生物标志物显著性回调,表明护肝片能通过干预部分糖代谢、脂质代谢和氨基酸代谢通路来改善CCl4引起的急性肝损伤。
综上所述,护肝片可以有效地调节模型组大鼠肝组织中MDA、SOD、GSH-Px水平,并逆转CCl4致肝损伤模型大鼠机体的脂质代谢、糖代谢和氨基酸代谢紊乱。本研究从整体代谢表型和相关代谢标志物的角度阐释了护肝片的药效和作用机制,为护肝片的临床应用提供了一定的理论基础。
表2 与CCl4急性肝损伤相关的大鼠血清代谢潜在生物标志物测定结果(±s,n=6)Tab 2Determination results of potential biomarkers in serum of rats with CCl4-induced acute liver injury(±s,n=6)
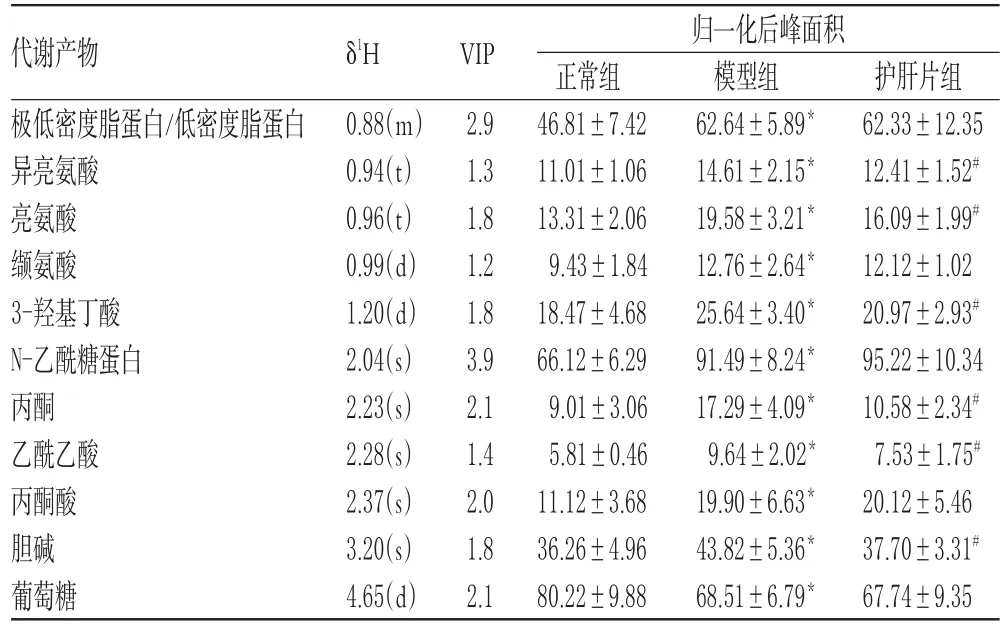
表2 与CCl4急性肝损伤相关的大鼠血清代谢潜在生物标志物测定结果(±s,n=6)Tab 2Determination results of potential biomarkers in serum of rats with CCl4-induced acute liver injury(±s,n=6)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;“s”为单峰,“d”为双重峰,“t”为三重峰,“m”为多重峰Note:vs.normal group,*P<0.05;vs.model group,#P<0.05;“s”was single peak,“d”was double peak,“t”was triple peak,“m”was multiple peak
护肝片组62.33±12.35 12.41±1.52#16.09±1.99#12.12±1.02 20.97±2.93#95.22±10.34 10.58±2.34#7.53±1.75#20.12±5.46 37.70±3.31#67.74±9.35代谢产物极低密度脂蛋白/低密度脂蛋白异亮氨酸亮氨酸缬氨酸3-羟基丁酸N-乙酰糖蛋白丙酮乙酰乙酸丙酮酸胆碱葡萄糖δ1H VIP 2.9 1.3 1.8 1.2 1.8 3.9 2.1 1.4 2.0 1.8 2.1归一化后峰面积0.88(m)0.94(t)0.96(t)0.99(d)1.20(d)2.04(s)2.23(s)2.28(s)2.37(s)3.20(s)4.65(d)正常组46.81±7.42 11.01±1.06 13.31±2.06 9.43±1.84 18.47±4.68 66.12±6.29 9.01±3.06 5.81±0.46 11.12±3.68 36.26±4.96 80.22±9.88模型组62.64±5.89*14.61±2.15*19.58±3.21*12.76±2.64*25.64±3.40*91.49±8.24*17.29±4.09*9.64±2.02*19.90±6.63*43.82±5.36*68.51±6.79*
表3 与CCl4急性肝损伤相关的大鼠肝代谢潜在生物标志物测定结果(±s,n=6)Tab 3Determination results of potential biomarkers in liver of rats with CCl4-induced acute liver injury(±s,n=6)
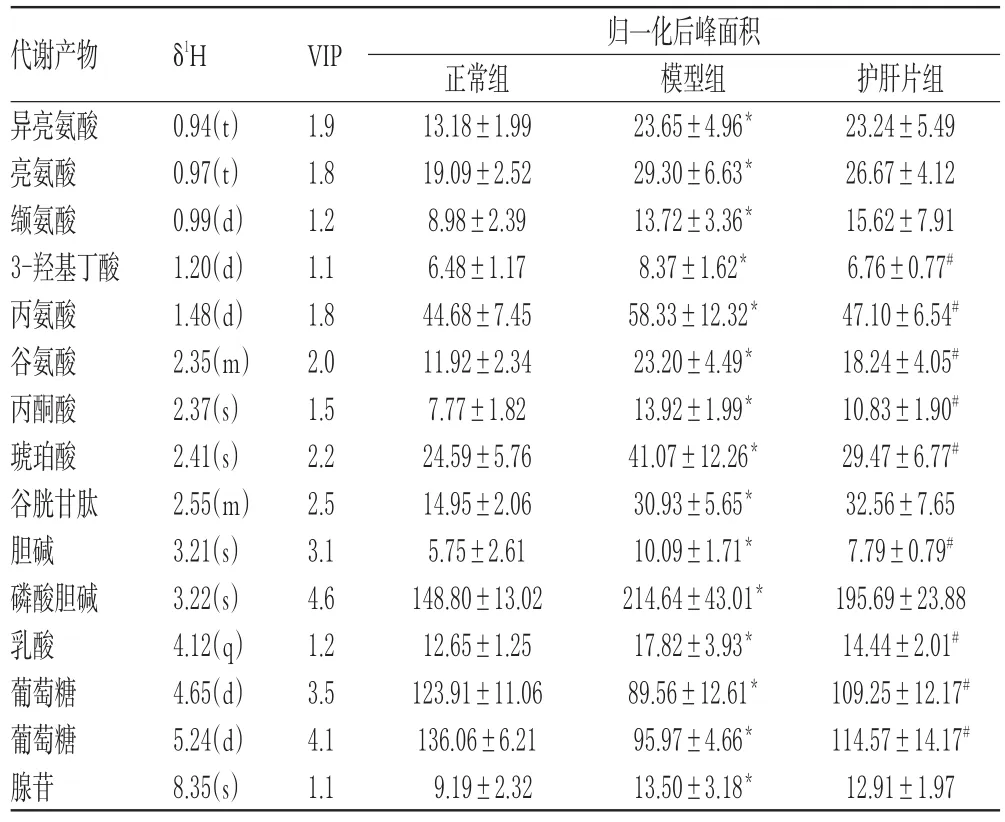
表3 与CCl4急性肝损伤相关的大鼠肝代谢潜在生物标志物测定结果(±s,n=6)Tab 3Determination results of potential biomarkers in liver of rats with CCl4-induced acute liver injury(±s,n=6)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;“s”为单峰,“d”为双重峰,“t”为三重峰,“q”为四重峰,“m”为多重峰Note:vs.normal group,*P<0.05;vs.model group,#P<0.05;“s”was single peak,“d”was double peak,“t”was triple peak,“q”was quadruple peak,“m”was multiple peak
护肝片组23.24±5.49 26.67±4.12 15.62±7.91 6.76±0.77#47.10±6.54#18.24±4.05#10.83±1.90#29.47±6.77#32.56±7.65 7.79±0.79#195.69±23.88 14.44±2.01#109.25±12.17#114.57±14.17#12.91±1.97代谢产物异亮氨酸亮氨酸缬氨酸3-羟基丁酸丙氨酸谷氨酸丙酮酸琥珀酸谷胱甘肽胆碱磷酸胆碱乳酸葡萄糖葡萄糖腺苷δ1H 归一化后峰面积0.94(t)0.97(t)0.99(d)1.20(d)1.48(d)2.35(m)2.37(s)2.41(s)2.55(m)3.21(s)3.22(s)4.12(q)4.65(d)5.24(d)8.35(s)VIP 1.9 1.8 1.2 1.1 1.8 2.0 1.5 2.2 2.5 3.1 4.6 1.2 3.5 4.1 1.1正常组13.18±1.99 19.09±2.52 8.98±2.39 6.48±1.17 44.68±7.45 11.92±2.34 7.77±1.82 24.59±5.76 14.95±2.06 5.75±2.61 148.80±13.02 12.65±1.25 123.91±11.06 136.06±6.21 9.19±2.32模型组23.65±4.96*29.30±6.63*13.72±3.36*8.37±1.62*58.33±12.32*23.20±4.49*13.92±1.99*41.07±12.26*30.93±5.65*10.09±1.71*214.64±43.01*17.82±3.93*89.56±12.61*95.97±4.66*13.50±3.18*
[1]朱小玉,于东,孟志刚,等.护肝片治疗非酒精性脂肪肝42例临床观察[J].北京医学,2006,28(8):489-490.
[2]刘启荣.护肝片在防治抗结核药物所致肝损伤的临床应用[J].中国热带医学,2011,11(12):1520-1521.
[3]白霜,金玲.护肝片预防小鼠酒精性肝损伤作用的实验研究[J].中国实验方剂学杂志,2008,14(6):64-66.
[4]杨琳,梁雪琰,赵洪海,等.护肝片降低CCl4肝损伤模型大鼠丙氨酸氨基转移酶作用及其机制[J].中医药信息,2014,31(3):114-117.
[5]吴义春,吴强,杨雁,等.护肝片对纤维化肝组织TGF-β1Ⅰ型受体表达的抑制作用[J].安徽中医学院学报,2005,24(3):28-31.
[6]Nicholson,JK,Connelly J,Lindon JC,et al.Metabonomics:a platform for studying drug toxicity and gene function[J].Nat Rev Drug Discov,2002,1(2):153-161.
[7]郑敏霞,沈洁.代谢组学方法及其在中医药中的应用[J].中国药房,2011,22(23):2201-2203.
[8]Wei L,Liao P,Wu H,et al.Metabolic profiling studies on the toxicological effects of realgar in rats by1H NMR spectroscopy[J].Toxicol Appl Pharmacol,2009,234(3):314-325.
[9]Ding L,Hao F,Shi Z,et al.Systems biological responses to chronic perfluorododecanoic acid exposurebyintegratedmetabonomicandtranscriptomic studies[J].J Proteome Res,2009,8(6):2882-2891.
[10]JiangL,HuangJ,WangY,etal.Metabonomic analysis reveals the CCl4-induced systems alterations for multiple rat organs[J].J Proteome Res,2012,11(7):3848-3859.
[11]Griffin JL,Mann CJ,Scott J,et al.Choline containingmetabolitesduringcelltransfection:an insight into magnetic resonance spectroscopy detectable changes[J].FEBS Lett,2001,509(2):263-266.
[12]Goldberg AL.Protein degradation and protection against misfolded or damaged proteins[J].Nature,2003,426(6968):895-899.
[13]Zira A,Kostidis S,Theocharis S,et al.1H NMR-based metabonomics approach in a rat model of acute liver injury and regeneration induced by CCl4administration[J].Toxicology,2013,303(1):115-124.
[14]HarveyPJ,GreadyJE,HickeyHM,etal.31P and1H NMR spectroscopic studies of liver extractsofcarbontetrachloride-treatedrats[J].NMR Biomed,1999,12(6):395-401.
Study on the Hepatoprotective Effects of Hugan Tablets Based on Serum and Liver Metabonomics
GONG Mengjuan1,2,3,WU Shengqian1,2,3,YUE He1,2,3,WANG Shumei1,2,3,LIANG Shengwang1,2,3,ZOU Zhongjie1,2,3(1.School of TCM,Guangdong Pharmaceutical University,Guangzhou 510006,China;2.Key Laboratory of Digital Quality Evaluation of Chinese Materia Medica of State Administration of TCM,Guangzhou 510006,China;3.Engineering Technology Research Center for Chinese Materia Medica Quality of the Universities of Guangdong Province,Guangzhou 510006,China)
OBJECTIVE:To elucidate the efficacy and mechanism of Hugan tablets in hepatoprotective effects from perspective of metabolic pathways.METHODS:36 male rats were randomly divided into normal group(0.5%sodium carboxymethyl cellulose),model group(0.5%sodium carboxymethyl cellulose)and Hugan tablets group(1.7 g/kg),12 in each group,intragastrically administrated once a day,for 9 d.After 1 h of last administration,rats in model group and Hugan tablets group were intraperitoneally injected 50%CCl4peanut oil solution 1 mL/kg to induce liver injury.After 24 h of modeling,malondialdehyde(MDA),superoxide dismutase(SOD),glutathione peroxidase(GSHPx)levels in liver tissue of rats were detected.Nuclear magnetic resonance spectroscopy(1H-NMR)metabolomics technique was adopted to establish the serum and liver metabolite profiles of rats,and the effects of Hugan tablets on changes of metabolic profile and potential biomarkers in serum and liver of rats with CCl4-induced acute liver injury were analyzed.RESULTS:Compared with normal group,MDA level in liver tissue of rats in model group was significantly increased(P<0.05),SOD and GSH-Px levels were significantly reduced(P<0.05).Both body physiology and material metabolism of rats were obviously changed,and levels of 11 metabolic potential biomarkers in serum and 14 metabolic potential biomarkers in liver were significantly increased/decreased(P<0.05).Compared with model group,MDA level in liver tissue in Hugan tablets group was significantly reduced(P<0.05),SOD and GSHPx levels were significantly increased(P<0.05).Serum and liver metabolism tended to be normal,6 metabolic potential biomarkers(isoleucine,leucine,3-hydroxybutyrate,acetone,acetoacetate,choline)in serum and 8 metabolic potential biomarkers(3-hydroxybutyrate,alanine,glutamate,pyruvate,succinate,choline,lactate,glucose)in liver got significant callback(P<0.05).CONCLUSIONS:The hepatoprotective mechanism of Hugan tablets may be associated with antioxidative stress and regulation of lipid metabolism,glucose metabolism and amino acid metabolism.
Hugan tablets;Acute hepatic injury;Metabonomics;Nuclear magnetic resonance spectroscopy;Protential biomarkers;Rats
R285.5
A
1001-0408(2017)34-4776-05
DOI10.6039/j.issn.1001-0408.2017.34.06
国家自然科学基金青年科学基金项目(No.81603397、81403075)
*副教授,硕士。研究方向:中药药理学。电话:020-39352612。E-mail:gongmengjuan@139.com
#通信作者:教授,博士。研究方向:中药药效物质基础、代谢组学。电话:020-39353240。E-mail:zouzhongjie@139.com
2017-06-16
2017-09-22)
(编辑:林静)
