高脂食物诱导的肥胖小鼠不同脑区即刻早期蛋白和酪氨酸羟化酶的变化*
2017-12-19杨慧娣
辛 雪,杨 铮,杨慧娣
(内蒙古医科大学基础医学院,呼和浩特010110)
高脂食物诱导的肥胖小鼠不同脑区即刻早期蛋白和酪氨酸羟化酶的变化*
辛 雪,杨 铮△,杨慧娣△
(内蒙古医科大学基础医学院,呼和浩特010110)
目的:在高脂食物诱导肥胖的小鼠中检测多巴胺神经元的表达。方法:10只雄性小鼠饲喂高脂膳食作为高脂食物组(HFD),10只雄性小鼠饲喂10%脂肪膳食作为对照组(NCD)。实验第10周,小鼠禁食12 h后称重,尾静脉取血测定基础血糖水平;实验11周进行葡萄糖耐受(GTT)测试和胰岛素抵抗实验(ITT);实验12周,动物禁食4 h后处死,测定血清胰岛素和瘦素(leptin)浓度,免疫组织化学法检测即刻早期蛋白(c-Fos-ir)和酪氨酸羟化酶(TH-ir)的表达。结果:饲喂12周高脂食物后,HFD组体重明显增加。GTT测试显示HFD组在15 min和30 min血糖浓度均明显高于NCD组(p<0.05)。ITT测试显示HFD组在15 min和30 min血糖浓度均显著高于NCD组(p<0.05)。同时,禁食后,HFD组的胰岛素浓度和leptin浓度显著高于NCD组(p<0.01)。免疫组化结果表明HFD组在伏隔核、下丘脑室旁核、腹侧背盖区和黑质的c-Fos-ir细胞数均明显多于NCD组(p<0.01),且腹侧被盖区和黑质的TH-ir和共表达TH/Fos-ir细胞也显著多于NCD组(p<0.01)。而且HFD组VTA区和SN区TH-ir的细胞数与HFD组小鼠的终体重呈正相关(p<0.05)。结论:长期饲喂高脂食物导致的肥胖与奖赏系统多巴胺神经元的可塑性有关。【关键词】高脂食物;肥胖;即刻早期蛋白;酪胺酸羟化酶
体重过高和肥胖已经成为一个重要的医疗和公共健康问题。肥胖能增加心血管疾病、II型糖尿病和某些癌症的发病率[1]。胰岛素抵抗(insulin resistance)是某些代谢性疾病的一个共同特征,在肥胖和2型糖尿病的发生和发展中起到重要作用。它是指脂肪细胞、肌肉细胞和肝细胞对正常浓度胰岛素反应不足的现象,导致胰岛素促进葡萄糖摄取和利用的效率下降,机体代偿性的分泌过多胰岛素产生高胰岛素血症,以维持血糖的稳定[2],而它的分子机制还不清楚。
由脂肪细胞分泌的瘦素(leptin)是一种厌食性的神经肽,通过血脑屏障作用于下丘脑调节能量平衡和摄食行为[3]。下丘脑是调节摄食和能量平衡的重要中枢,从弓状核 (arcuate nucleus,ARC)投射到下丘脑其它核如室旁核 (paraventricular nucleus,PVN),腹正中核 (ventromedial hypothalamus,VMH)的神经环路对调节摄食和体重起到重要的作用[4,5]。摄入过多高能量的食物是导致肥胖的一个重要因素。可口的高糖和高脂食物令人愉悦,能重塑一些神经通路[5]。这些食物的摄入与大脑奖赏环路有关。多巴胺神经元起源于中脑腹侧背盖区(ventral tegmental area,VTA)和黑质 (substantia nigra,SN),它支配边缘系统,包括伏隔核 (nucleus accumbens,NAcc)和背侧纹状体 (dorsal striatum),是组成动机和奖赏的神经回路的一个重要部分[1,5]。多巴胺系统在自然和人为的奖赏中,起着核心的作用。然而,引起肥胖的食物对多巴胺神经的影响仍然不清楚[4]。c-Fos蛋白是研究各脑区功能性的神经解剖学的一个非常有用的工具。酪氨酸羟化酶(tyrosine hydroxylase,TH),儿茶酚胺合成的限速酶,是多巴胺的一个标记物[4,5]。本实验假设小鼠长期暴露于高脂食物,探讨肥胖与DA信号的改变之间的关系。
1 材料与方法
1.1 实验动物与饲养
C57BL/6小鼠,雄性,10周大,体重 20 g,购买于内蒙古大学实验动物中心,清洁级。单笼饲养,饲料为普通饲料,自由摄食饮水。每日更换饮水和饲料,保持动物生活环境通风及清洁卫生。动物房内温度为 (22±1)℃,光照时间为每日 8:00~20:00。
1.2 实验设计
20只C57BL/6小鼠单笼饲养1周,之后根据动物体重随机分成对照组和高脂组(n=10),对照组饲喂10%脂肪食物(脂肪产能占能量的10%,下同),高脂组饲喂45%高脂食物,实验12周。每周测定1次摄食量和体重。实验第10周,小鼠禁食12 h后称,尾静脉取血测定基础血糖水平;实验11周进行葡萄糖耐受(glucose tolerance tests,GTT)测试和胰岛素抵抗(insulin tolerance tests,ITT)实验;实验 12周,动物禁食4 h后处死,测定血清胰岛素和leptin浓度,免疫组织化学法检测即刻早期蛋白c-Fos-ir和酪氨酸羟化酶(TH-ir,多巴胺转化的限速酶)的表达。
1.3 主要试剂
10%和 45%脂肪食物(Research Diet Co.);Ultrasensitive mouse insulin ELISA试剂盒(瑞士Mercodia公司,货号10-1249-01);Leptin ELISA试剂盒(美国Alpco公司,货号 47-ADPMS-E01);c-Fos抗体,1∶8 000(Santa Cruz Biotechnology);羊抗兔 IgG,1∶300(Vector,Burlingame公司,货号BA-1000);抗生物素蛋白-生物素复合物(Vector,Burlingame公司,货号 Vectastain Elite);Tyrosine Hydroxylase,1∶8 000(Chemicon公司,货号 AB152)。
1.4 葡萄糖耐受测试
在第10周,小鼠禁食12 h后称重,尾静脉取血测定基础血糖水平。腹腔注射50%葡萄糖2.0 mg/g后,分别在 15 min,30 min,60 min和 120 min后取血测定其血糖浓度。
1.5 胰岛素耐受测试
葡萄糖耐受测试后,小鼠恢复1周,测定胰岛素抵抗。小鼠禁食4 h,腹腔注射重组人胰岛素(0.75 U/kg),取血测定0 min、10 min、30 min和60 min时血糖浓度。
1.6 血清胰岛素和Leptin浓度的测定
动物禁食4 h处死后,用ELISA试剂盒测定血清胰岛素和Leptin浓度。Ultrasensitive mouse insulin ELISA试剂盒,测定胰岛素浓度。Leptin ELISA试剂盒,测定leptin的浓度。详细的操作步骤参照ELISA试剂盒中的说明书进行。
1.7 免疫组织化学测定多巴胺神经元(DA)的表达
每组实验动物 (n=5)以10 g/L戊巴比妥钠腹腔麻醉(40 mg/kg),经左心室向升主动脉匀速灌注37℃生理盐水和4%多聚甲醛的磷酸缓冲液 (pH 7.2,0.1 mol/L)。将脑移入多聚甲醛中固定 4 h。移入含30%蔗糖的磷酸缓冲液中,4℃过夜。-20℃冰冻连续切片(冠状切片),片厚20μm。间隔80μm的切片用以前已经建立的方法做c-Fos和TH的免疫组化[1]。简短地说,切片在1%硼氢化钠中孵育20 min。10%山羊血清1 h。切片在兔抗c-Fos抗体,4℃孵育24 h。之后,切片在生物素化的羊抗兔IgG,室温孵育2 h,抗生物素蛋白-生物素复合物室温90 min,DAB(加入镍粉)显色。之后,切片在兔抗-TH室温过夜,切片在生物素化的羊抗兔IgG室温孵育2 h,抗生物素蛋白-生物素复合物,室温90 min,DAB显色。
每只小鼠各取3张不同断面切片。并用Image J分析软件在各脑区随意选取三个视野,测量DA阳性神经元胞体个数(反映DA相对含量)。计算每组切片单位面积内DA阳性神经元数目(平均密度)。
1.8 统计学处理
结果用平均值 ±标准误(¯x±SE)表示,采用SPSS17.0软件 (SPSSInc.,Chicago,IL,USA)进行数据分析。在统计分析前,所有数据用 Kolmogorov-Smirnov和Levene分别进行正态性和方差齐性检验。体重和摄食量采用重复测量,进一步的差异用 t-test检测。胰岛素、c-Fos-ir、TH-ir和 TH/c-Fos细胞的组间差异采用 t-test。
2 结果
2.1 体重和摄食量的改变
与饲喂10%脂肪食物的NCD组相比,饲喂45%高脂食物后,HFD组的体重从第6周开始显著增加(p<0.05,p<0.01,表 1),而摄食量没有变化(表2)。
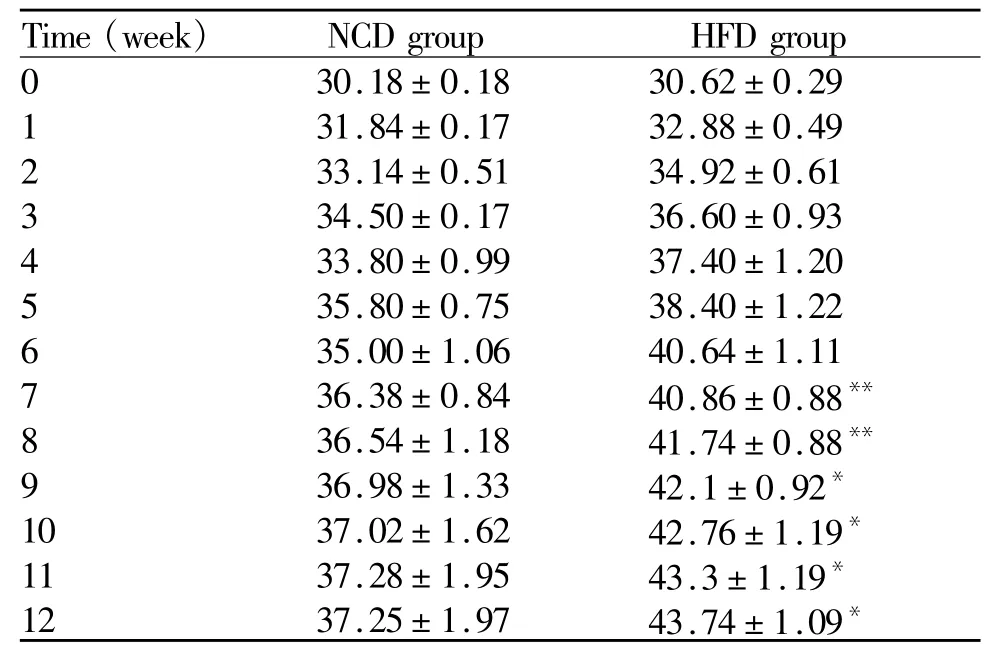
Tab.1 Body weight in C57BL/6 during 12 weeks(g,¯x±¯sx,n=10)

Tab.2 Food intake in C57BL/6 during 12 weeks(g,¯x±s¯x,n=10)
2.2 葡萄糖耐受测试和胰岛素耐受的变化
GTT测试显示15 min和30 min HFD组的血液中葡萄糖的浓度高于对照组(图 1a,p<0.05)。HFD组的血糖曲线下的面积AUG值高于NCD组(t=1.865,p<0.05,图 1b)。表明 HFD组胰岛素调节血糖的能力下降。GTT测试期间,血糖的浓度受胰岛素敏感性和胰岛素浓度的影响。为了检测是胰岛素敏感性降低还是葡萄糖刺激的胰岛素反应降低了。因此,又做了ITT测试。ITT测试发现,血糖的浓度在15 min和30 min HFD组小鼠血糖浓度明显高于 NCD组(p<0.05,p<0.01,图 2a),且 HFD组的血糖曲线下的面积AUG值也显著高于NCD组(p<0.01,图 2b)。

Fig.1 Glucose tolerance tests(GTT)(¯x±s¯x,n=10)a:Blood glucose;b:Area-under-concentration curve(AUC)value of glucose in GTT NCD:Control group;HFD:High fat diet group*p<0.05 vs NCD group

Fig.2 Insulin tolerance tests(ITT)(¯x±s¯x,n=10)a:Blood glucose;b:Area-under-concentration curve(AUC)value of glucose in ITT NCD:Control group;HFD:High fat diet group*p<0.05 vs NCD group
2.3 胰岛素和Leptin的浓度的改变
HFD组的胰岛素浓度比NCD组高出4倍(p<0.05,图3a),提示发生胰岛素抵抗。同时,HFD组的leptin浓度比 NCD组高出 2.5倍(p<0.05,图3b)。

Fig.3 Plasma insulin(a)and leptin concentration(b)(¯x±s¯x,n=5)NCD:Control group;HFD:High fat diet group*p<0.05 vs NCD group
2.4 c-Fos-ir和DA神经元在脑中的表达
饲喂高脂食物12周后,HFD组c-Fos-ir细胞表达在下丘脑和中脑系统的某些区有差异表达;TH-ir阳性细胞在下丘脑PVN区和ARC区及中脑VTA区和SN区表达差异显著。具体地说,HFD组的c-Fosir阳性细胞在NAcc区(表3,图4a),下丘脑 PVN区(表 3,图 4b)和中脑 VTA区、SN区(表 3,图 4c)与NCD组相比显著增加(p<0.01)。下丘脑LH、VMH和ARC区,HFD组和NCD组的c-Fos-ir阳性细胞没有任何差异。HFD组TH-ir阳性细胞在PVN区(表3,图 4b),VTA区(表 3,图 4c)和 SN区(表 3,图 4c)明显比NCD组增高(p<0.05)。且VTA区和SN区TH-ir阳性细胞数与HFD组小鼠的终体重呈正相关(p<0.05,图 5a、5b)。但是,在 ARC区 NCD组和HFD组的TH-ir阳性细胞数没有任何差异。HFD组c-Fos-ir/TH-ir共表达阳性细胞在 PVN区(表 3,图4b),中脑 VTA区(表 3,图 4c)和 SN区(表 3,图 4c)显著高于NCD组(p<0.05),但是在ARC区没有任何变化。

Tab.3 Group differences in c-Fos-ir,TH-ir,and TH-ir/c-Fos-ir labeling in the brain of male mice that were fed normal food(NCD)or high fat food(HFD)(¯x±s¯x,n=5)
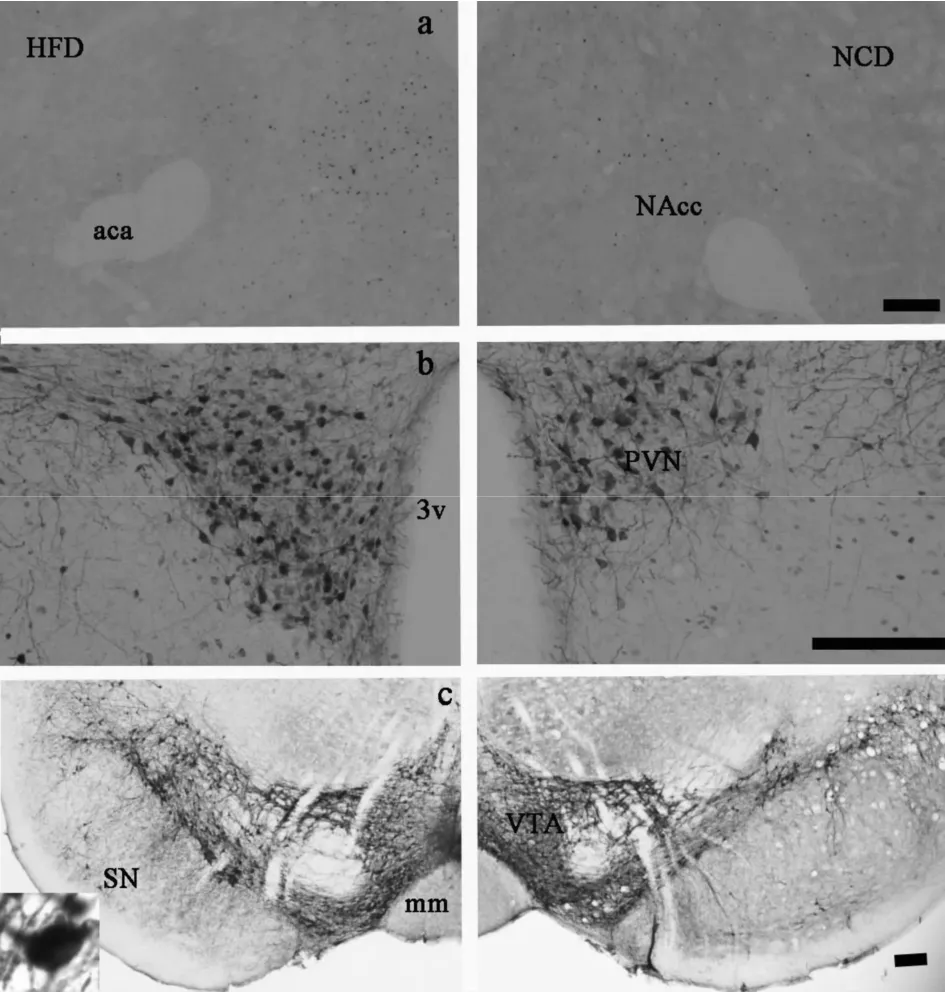
Fig.4 Photomicrographs displaying cells labeled for Fos-ir(blackunctuate nuclear staining)or TH in the NAcc(a)or PVN(b),VTA(c)and SN(c)(Scale bar=100μm)aca:Anterior commissure;NAcc:Nucleus accumbens;3v:3rd ventricle;PVN:Paraventricular nucleus of the hypothalamus;VTA:Ventral tegmental;mm:Medial mammillary nucleus medial part;SN:Substantia nigra

Fig.5 Significant correlations were found between the final body weight and the levels of TH-ir positive cells in the ventral tegmental area(VTA,a)and substantia nigra(SN,b)of high HFD mice(n=5)
3 讨论
本研究结果表明小鼠饲喂12周45%高脂食物后,体重明显增加。GTT测试表明胰岛素调节血糖的能力下降;ITT实验结果显示HFD组胰岛素敏感性降低;同时禁食后HFD组胰岛素的浓度高于NCD组;这些结果都证明HFD组发生了胰岛素抵抗。此外,VTA区和SN区的TH-ir的阳性细胞数和TH/c-Fos共表达的细胞数明显高于NCD组。VTA区和SN区的TH-ir的阳性细胞数量与HFD组小鼠的终体重呈正相关关系,暗示中脑多巴胺神经元增多参与HFD组体重调节。HFD组前脑NAcc的活性显著增加。这些结果暗示中脑奖赏系统可能参与体重增加的调节。
小鼠饲喂12周45%高脂食物后,与对照组(NCD组)相比增加10 g,但是摄食量没有变化。由于GTT期间,葡萄糖的浓度受胰岛素敏感性和胰岛素浓度的影响;所以测试ITT用来检测是外周组织的胰岛素敏感性降低,还是血糖刺激胰岛素的反应减少。ITT实验结果暗示胰岛素的敏感性降低,而相似的结果在 fat-1小鼠中也被发现[6]。HFD组胰岛素降低血糖的能力受到影响,发生了胰岛素抵抗。这与大鼠的研究结果一致[7]。这些结果表明食物中脂肪含量的增多会损伤小鼠的葡萄糖耐受和胰岛素敏感,从而使血糖增多,诱导肥胖的发生。
能量平衡的调节依赖于脑对饥饿和饱腹时循环因子变化的适应能力。下丘脑是控制能量平衡的重要结构[4]。脂肪细胞分泌leptin的浓度HFD组高出NCD组2.5倍。这些结果表明HFD组的能量高于NCD组。一个经典的基底神经节的奖赏系统包括从VTA区投射到腹侧纹状体即NAcc核的多巴胺神经元[3]。VTA-NAcc通路对奖赏和药物滥用的巩固特别重要[3,8,9]。NAcc是调节奖赏行为的一个重要的前脑结构[3]。应用c-fos描绘与摄食反应有关的脑区和调节奖赏行为的核团时,发现只有HFD组下丘脑PVN核c-Fos-ir阳性细胞表达增加,而下丘脑的其他核团如LH、VMH和ARC区没有变化,表明PVN区是下丘脑调节能量平衡的一个重要区。同时,HFD组 TH-ir阳性细胞及 TH-ir/c-Fos共表达的阳性细胞在HFD组的VTA和SN区显著增加,表明摄入高脂食物会激活中脑奖赏系统,从而增加摄食的欣快感,这解释了为什么两组摄食量没有差异。本结果与小鼠饲喂40%高脂食物的结果一致,发现饲喂40%高脂食物20周后,多巴胺受体在 NAcc、VTA区和SN区D2、D4和TH mRNA的表达增加[10]。此外,许多研究发现通过VTA区 leptin受体,leptin剂量依赖性的调节多巴胺神经元。本实验的结果发现HFD组的leptin浓度增加,同时VTA的多巴胺神经元表达增多,这些结果提示leptin可能调节多巴胺神经元的调节,但是需要进一步的验证。高脂食物诱导多巴胺神经的可塑性增加肥胖和胰岛素抵抗,但是具体机制还需进一步的验证。
[1] Sharma S,Fulton S.Diet-induced obesity promotes depressive-like behaviour that is associated with neural adaptations in brain reward circuitry[J].Int J Obes,2013,37(3):382-389.
[2] O’Neill BT,Lauritzen HP,Hirshman MF,et al.Differential role of insulin/IGF-1 receptor signaling in muscle growth and glucose homeostasis[J].Cell Rep,2015,11(8):1220-1235.
[3] Neto S,Varatharajan R,Joseph,et al.Nasal administration of leptin dose-dependently increases dopamine and serotonin outflow in the rat nucleus accumbens[J].J Neural Transm(Vienna),2016,123(11):1247-1254.
[4] Viggiano E,Mollica MP,Lionetti L,et al.Effects of an high-fat diet enriched in lard or in fish oil on the hypothalamic Amp-activated protein kinase and inflammatory mediators[J].Front Cell Neurosci,2016,10:150.
[5] Sharma S,Fernandes MF,Fulton S.Adaptations in brain reward circuitry underlie palatable food cravings and anxiety induced by high-fat diet withdrawal[J].Int J Obes,2013,37(9):1183-1191.
[6] Ji S,Hardy RW,Wood PA.Transgenic expression of n-3 fatty acid desaturase(fat-1)in C57/BL6 mice:Effects on glucose homeostasis and body weight[J].J Cell Biochem,2009,107(4):809-817.
[7] Holness MJ,Smith ND,Greenwood GK,et al.Acuteω-3 fatty acid enrichment selectively reverses high-saturated fat feeding-induced insulin hypersecretion but does not improve peripheral insulin resistance[J].Diabetes,2004,53(suppl 1):S166-171.
[8] 杨慧娣,杨 铮,刘陶迪.多巴胺激动剂阿朴吗啡对东莨菪碱诱导小鼠学习记忆障碍的影响[J].中国应用生理学杂志,2014,30(3):244-248.
[9] 赵钢勇,崔蕾高,娟代瑞,等.BDNF基因工程细胞对帕金森大鼠纹状体多巴胺及其代谢物影响的研究[J].中国应用生理学杂志,2013,29(1):82-86.
[10]Huang XF,YuY,Zavitsanou K,et al.Differential expression of dopamine D2 and D4 receptor and tyrosine hydroxylase mRNA in mice prone,or resistant,to chronic high-fat dietinduced obesity[J].Molecular Brain Research,2005,135(1-2):150-161.
Immediate-early c-fos and tyrosine hydroxylase protein expression in different brain regions in high-fat induced obesity in mice
XIN Xue,YANG Zheng△,YANG Hui-di△
(Basic Medical School of Inner Mongolia Medical University,Huhehaote 010110,China)
Objective:To examine brain dopamine expression in chronic high-fat diet(HFD)-induced obese mice.Methods:Ten male mice were fed by a high-fat diet(HF:45%of calories from fat)for 12 weeks and then classified as HFD group.Ten male mice were fed a low-fat diet(LF:10%of calories from fat)and used as control group(NCD).In the 10thweek,the blood of the caudal vein was collected to determine the basal blood glucose level after both groups mice were fast for 12 h.Intraperitoneal(IP)glucose tolerance test(GTT)and insulin tolerance(ITT)were performed in HFD and NCD mice in the 12thweek.Animals were sacrificed after fasting for 4 hours at the 12thweek.Brain tissues were processed for Fos-ir and TH-ir by immunohistochemistry.Results:After 12 weeks of feeding,body weight was significant higher in HFD mice than that in NCD ones.During GTT and ITT,HFD mice had significantly decreased glucose tolerance and insulin tolerance at 15 min and 30 min respectively than NCD ones(p<0.05).There were higher plasma insulin concentration and leptin concentration in HFD mice than those in NCD ones(p<0.05).High fat-induced increased body weight was associated with increased cellular activation,indicated by Fos immunoreactive(ir)staining,in nucleus accumbens(NAcc),paraventricular nucleus(PVN),ventral tegmental area(VTA)and substantia nigra(SN)than those of NCDones(p<0.05);and also significantly associated with enhanced in the number of cells labeled for tyrosine hydroxylase(TH-ir),and the number of cells co-labeled for TH-ir/Fos-ir in the VTA and SN than those of NCD ones(p<0.01).Moreover,there was significantly relationship TH-ir positive cell numbers with final body weight in VTA and SN in HFD mice(p<0.05).Conclusion:The results showed that chronic consumption of high-fat food was associated with plasticity-related changes in reward circuitry in mice.
high fat diet; obesity; immediate-early c-fos; tyrosine hydroxylase
R73-3
A
1000-6834(2017)06-572-05
10.12047/j.cjap.5484.2017.135
内蒙古自治区自然科学基金面上项目(2016MS0367)
2016-08-08
2017-06-23
△【通讯作者】Tel:0471-6657570;E-mail:yanghuidi1980@163.com,670598470@qq.com
