柴芩承气汤对重症急性胰腺炎并发肝损伤大鼠的治疗作用及其机制*
2017-12-19张晓芹许小凡李芳芳
党 琳,张晓芹,刘 芳,许小凡,李芳芳,魏 旭,张 红△
柴芩承气汤对重症急性胰腺炎并发肝损伤大鼠的治疗作用及其机制*
党 琳1,张晓芹1,刘 芳1,许小凡2,李芳芳2,魏 旭1,张 红2△
(1.陕西中医药大学基础医学院,2.医学科研实验中心,咸阳712046)
目的:研究柴芩承气汤(CQCQD)对重症急性胰腺炎(SAP)并发肝损伤大鼠的治疗作用及其机制。方法:72只SD大鼠随机分为3组(n=24):假手术(sham)组,重症急性胰腺炎模型(SAP)组和柴芩承气汤治疗(CQCQD)组。去氧胆酸钠胰胆管逆行注射建立SAP大鼠模型,CQCQD组给予柴芩承气汤治疗,于造模后1 h、5 h、10 h观察各组不同时间点的胰腺、肝脏组织病理学变化,检测血清中淀粉酶(AMS)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)活性、白介素-6(IL-6)水平及胰腺、肝脏组织单核细胞趋化蛋白-1(MCP-1)和IL-6 mRNA的表达情况。结果:与sham组比较,SAP组血清AMS、ALT、AST活性及IL-6水平明显升高,胰腺、肝脏组织MCP-1及IL-6 mRNA表达升高(p<0.05);与SAP组比较,CQCQD组血清AMS、ALT、AST活性及IL-6水平明显降低;胰腺和肝脏组织病理损伤减轻,胰腺、肝脏组织MCP-1及IL-6 mRNA表达明显减弱(p<0.05)。结论:MCP-1参与了SAP并发肝损伤的进展;柴芩承气汤能显著抑制胰腺、肝脏组织MCP-1的表达,减轻SAP时胰腺、肝脏组织病理损伤,对SAP并发肝损伤起到治疗作用。
柴芩承气汤;重症急性胰腺炎;肝损伤;单核细胞趋化因子蛋白-1;大鼠
重症急性胰腺炎 (severe acute pancreatitis,SAP)是外科常见的危重症,具有并发症多、病情凶险和病死率高等特点[1]。SAP不仅是胰腺的局部炎症病变,而且是涉及胰腺外多个脏器的全身性疾病,可引起多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)、全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)等[2,3]。Halonen等对178个SAP并发MODS的病人调查发现,SAP并发肝损伤的死亡率为83%[4]。近来的研究表明:SAP的各种致病因素,既可造成胰腺腺泡细胞损伤,也会激活炎症细胞,产生的细胞因子和炎性介质,使胰腺的局限性炎症迅速转变为全身的炎症反应[5]。且在SAP病情发展过程中,肝损伤出现较早,严重的肝损伤导致肝脏对SAP产生的炎症介质及细胞因子的解毒和清除作用明显下降[6,7]。柴芩承气汤(Chai Qin Cheng Qi Decoction,CQCQD)具有清热解毒、活血化瘀和通里攻下的功效,在临床上已广泛运用于SAP的治疗。本课题组前期的研究发现[8]:柴芩承气汤可以减轻SAP并发的肝损伤,但其是否可以调控炎症介质的产生进而发挥抗SAP并发肝损伤的作用机制,目前尚不十分清楚。本研究复制大鼠SAP模型,并给予柴芩承气汤,观察柴芩承气汤对SAP并发肝损伤大鼠胰腺和肝脏组织单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的表达的变化,为柴芩承气汤治疗SAP并发肝损伤的临床应用提供理论依据。
1 材料与方法
1.1 材料
10~12周龄健康 SD大鼠72只,雌雄各半,体质量240~280 g,购自西安交通大学医学院实验动物中心,许可证号:SCXK(陕)2012-003;胰腺组织、肝脏组织总RNA提取,反转录及实时荧光定量PCR试剂盒均购自 TOYOBO公司;血清淀粉酶(amylase,AMS)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)及白介素-6(interleukin-6,IL-6)试剂盒购自南京建成生物工程研究所,其余试剂均为市售分析纯。柴胡、黄芩、厚朴、枳实、川芎、丹参、栀子、生大黄、芒硝购自咸阳市天天乐医药有限公司。7500型荧光定量PCR仪(ABI),Zeiss A1研究级正置数码显微镜(蔡司光学仪器国际贸易有限公司)。
1.2 柴芩承气汤制备
柴胡 10 g、黄芩 10 g、厚朴 10 g、枳实 10 g、川芎10 g、丹参 10 g、栀子 10 g、生大黄 15 g(后下)、芒硝10 g(烊化),中药加水浸泡 1~1.5 h,前 7味中药煎沸后文火20 min,再加入生大黄煎5 min,然后将汤液浓缩至100 ml,加入芒硝烊化,制成生药浓度为1 000 g/L的药液[8]。
1.3 动物模型制备
SD大鼠适应性饲养1周后随机分为3组(n=24):假手术组(sham组)、SAP组及 CQCQD组。各组又分为1 h、5 h、10 h三个时间点(各时间点 n=8);术前12 h禁食,不禁水。各组大鼠均以4.5 ml/kg体质量尾静脉注射10 g/L戊巴比妥钠麻醉,75%乙醇腹部消毒。上腹正中开口,露出胰腺,sham组仅轻缓翻动胰腺组织数次即关腹;SAP组和CQCQD组找到胰胆管,在近肝处用动脉夹作暂时性阻断,用0.5 ml注射器经十二指肠壁插入胰胆管开口处,逆行注射 35 g/L的去氧胆酸钠溶液(1 ml/kg)注射后拔针,继续压迫穿刺点5 min,观察造模成功后,松开动脉夹关腹。术后各组大鼠下肢肌内侧注射生理盐水5 ml,以补充术中失水。CQCQD 1 h组在造模成功后1 h;5 h组在造模成功后 1 h、5 h;10 h组在造模成功后 1 h、5 h、10 h分别按 10 ml/kg给予 1 000 g/L柴芩承气汤灌胃 1次。Sham组和 SAP组在CQCQD组对应各时间点分别按10 ml/kg给予生理盐水灌胃 1次[8]。
1.4 标本采集
Sham组和SAP各组分别在末次生理盐水灌胃后1 h,CQCQD各组在末次柴芩承气汤灌胃治疗后1 h,麻醉处死大鼠,下腔静脉取血 2~2.5 ml,分离血清用于 AMS、ALT、AST活性及 IL-6水平检测;取胰腺、肝脏组织,一部分于10%中性甲醛溶液中固定,HE染色进行病理学观察;另切取1.0 cm×0.3 cm×0.2 cm大小的胰腺及肝脏组织标本,迅速置入液氮中,后转入-80℃低温保存,待提取RNA进行实时荧光定量PCR(QPCR)MCP-1 mRNA和IL-6 mRNA的表达。
1.5 生物化学指标测定
血清AMS、ALT、AST活性及IL-6水平检测均按照试剂盒说明书严格操作。
1.6 胰腺、肝脏组织HE病理学观察
胰腺、肝脏组织经脱水、石蜡包埋、切片,HE染色进行病理学观察。
1.7 QPCR检测胰腺、肝脏组织中 MCP-1、IL-6 mRNA表达
应用 Primer-Express软件(PE Biosystems)设计引物。MCP-1特异性引物上游序列:5′-ATG CAG TTA ATG CCC CAC TC-3′,下游:5′-TTC CTT ATT GGG GTCAGCAC-3′;IL-6特异性引物上游序列:5′-CCG GAG AGG AGA CTT CAC AG-3′,下游:5′-ACG ATG CAT CAT CGC TGT TC-3′;内参-actin特异性引物上游序列:5′-TCTTCCAGCCTTCCTTCCTG-3′,下游:5′-CACACA GAG TAC TTG CGA TC-3′。按照试剂盒说明书的操作步骤提取胰腺、肝脏组织总RNA,逆转录生成cDNA,以cDNA为模板进行QPCR。反应体系为 20μl体系,SYBGreen qPCR Mix:10μl,上游引物(10μmol/L):0.4μl,下游引物(10μmol/L):0.4 μl,模板:5μl,ROX reference dye:0.4μl加入灭菌蒸馏水 3.8μl。扩增条件:预热 50℃ 2 min,预变性95℃10 min,变性 95℃ 15 s,退火 60℃ 30 s,延伸72℃ 30 s,共 35个循环;以 2-△△Ct值表示目标基因MCP-1和 IL-6 mRNA。
1.8 统计学处理
数据以均数±标准差(¯x±s)表示,实验数据采用SPSS 21.0软件进行统计分析,数据比较采用重复测量数据的方差分析法。
2 结果
2.1 各组胰腺组织病理学变化
Sham组大鼠各时间点胰腺组织及周围均未见病理学改变;SAP组大鼠腹腔内可见血性腹水,胰腺肿胀明显,且有散在的点片状出血,表明造模成功。HE染色结果可见:SAP 1 h组:胰腺腺泡小片状坏死,间质少量炎细胞浸润;SAP 5 h组:胰腺腺泡大片状坏死,间质血管扩张,炎细胞浸润;SAP 10 h组:胰腺腺泡广泛性坏死,间质充血、出血,大量炎细胞浸润。CQCQD组大鼠胰腺组织损伤较SAP组各对应时间点均明显减轻,仅见胰腺腺泡轻度肿胀,间质小血管充血、炎症细胞浸润、坏死面积明显减少(图1,见彩图页Ⅵ)。
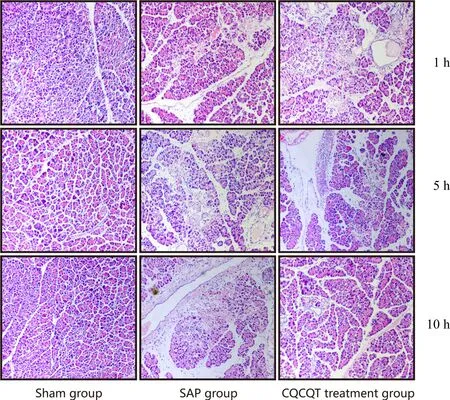
Fig. 1 Histological morphology in pancreatic tissue of rats in different groups(HE ×100)SAP:Severe acute pancreatitis;CQCQD:Chai Qin Cheng Qi Decoction
2.2 各组大鼠肝脏组织病理学变化
HE染色结果可见Sham组大鼠各时间点肝小叶结构清晰,肝索及血窦均无异常。SAP 1 h、5 h组大鼠肝小叶中多处可见灶状坏死,大量炎细胞浸润,血窦扩张,肝索排列紊乱;SAP 10 h组大鼠可见肝细胞大片坏死。CQCQD组大鼠各时间肝细胞损伤明显减轻,炎细胞少见,小叶结构尚存,未见明显坏死(图2,见彩图页Ⅵ)。
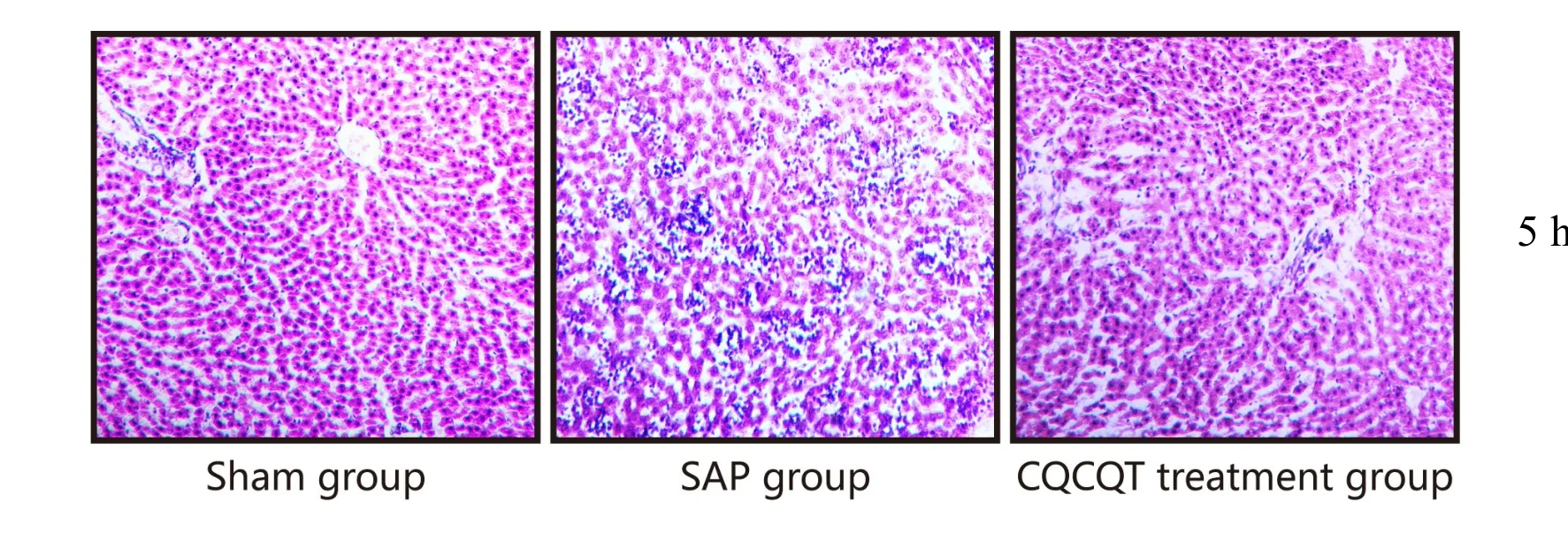
Fig. 2 Histological morphology in liver tissue of rats in different groups of 5 h group(HE ×100)
2.3 大鼠血清AMS、ALT、AST活性及IL-6含量的变化
Sham组大鼠各时间点血清AMS、ALT、AST活性及IL-6含量处于较低水平。与sham组比较,SAP组大鼠血清AMS、ALT、AST活性及IL-6含量均显著升高(p<0.05);CQCQD组大鼠血清 AMS、ALT、AST活性及IL-6含量较同一时间点SAP组均显著下降(p<0.05,表 1)。
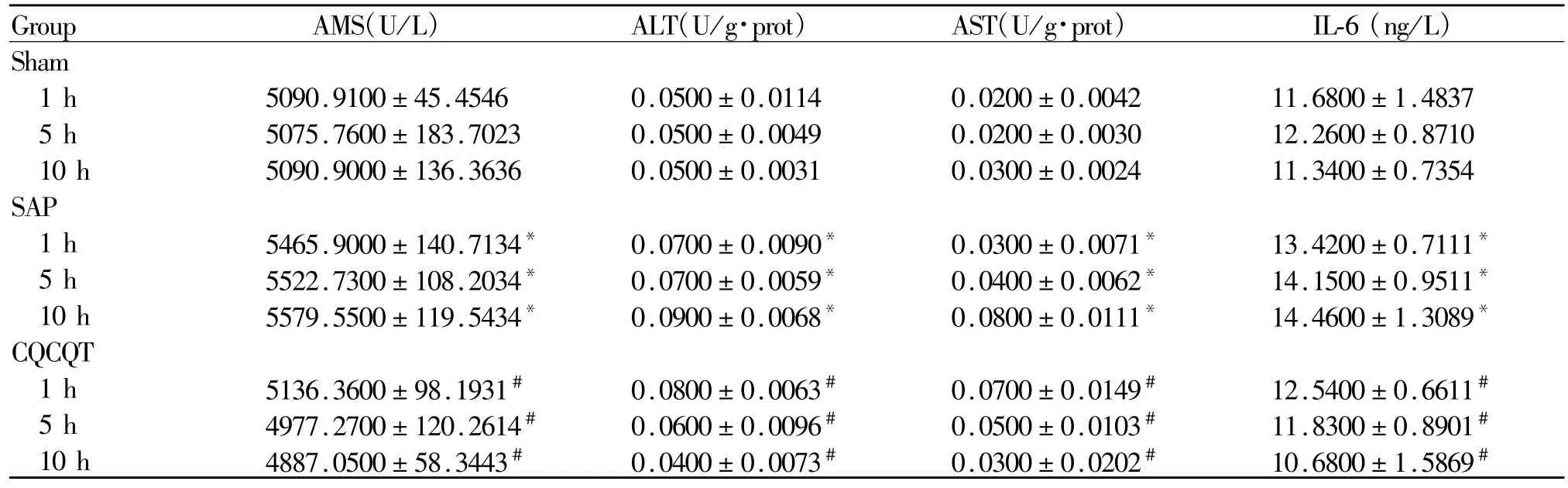
Tab.1 Comparison of the levels of AMS,ALT,AST and IL-6 of rats among the groups in different time points(¯x±s,n=24)
2.4 胰腺组织MCP-1、IL-6 mRNA表达的变化
Sham组胰腺组织中MCP-1、IL-6 mRNA表达差异均无统计学意义,与Sham组比较,SAP各组大鼠胰腺组织中MCP-1、IL-6 mRNA表达量均随时间延长有逐渐升高趋势(p<0.05);CQCQD组大鼠胰腺组织中MCP-1、IL-6 mRNA表达量较同一时间点SAP组均显著下降(p<0.05,表 2)。
2.5 肝脏组织MCP-1、IL-6 mRNA表达的变化
假手术组肝脏组织中MCP-1、IL-6 mRNA表达差异均无统计学意义。与假手术组比较,SAP各组大鼠肝脏组织中MCP-1、IL-6 mRNA表达量均随时间延长有逐渐升高趋势(p<0.05);CQCQD组大鼠肝脏组织中MCP-1、IL-6 mRNA的表达量较同一时间点SAP组均显著下降(p<0.05,表 3)。
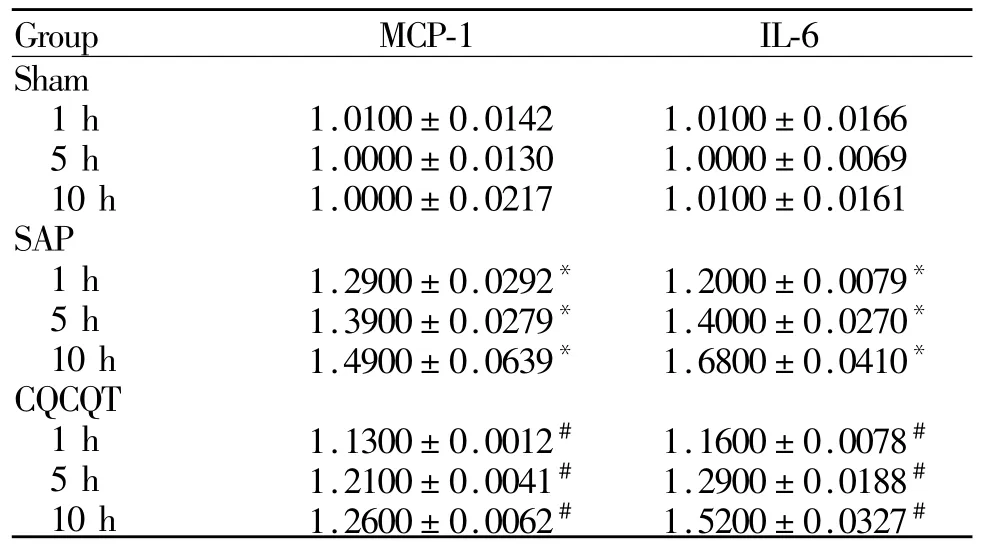
Tab.2 Expression of MCP-1 and IL-6 mRNA levels in pancreatic(¯x±s,n=24)
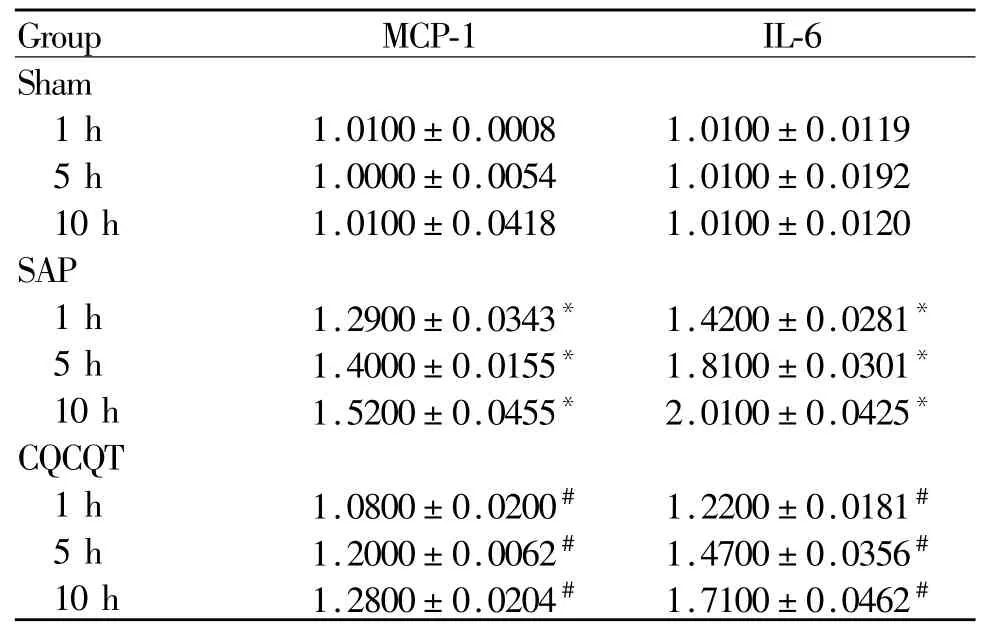
Tab.3 Expression of MCP-1 and IL-6 mRNA levels in livers(¯x±s,n=24)
3 讨论
SAP是多种病因引起的,以胰腺出血、坏死为主要特征的临床急腹症,病变不仅发生在胰腺,而且也可在肝、肺、肾等器官发生。研究发现SAP并发肝脏损害程度与胰腺炎重症化的程度成正相关[9],而且会影响其病程和预后。近年来对急性胰腺炎并发肝损伤的发病机制做了大量的研究,多种细胞因子和炎性介质在SAP的发病中的重要地位已得到了公认[10]。
MCP-1是趋化因子家族中具有代表性的一员,作为炎症级联反应的始动因子,主要功能为趋化和激活单核细胞/巨噬细胞释放过量的促炎因子及炎症介质至炎症部位[11],使之释放更多的炎性因子从而加重组织的损伤,这一级联放大的恶性循环在维持急性胰腺炎的重症化进展中发挥重要作用[12]。尚献会等[13]通过观察MCP-1在SAP大鼠血清、胰腺及肠黏膜组织中的表达,发现MCP-1在血清、胰腺及回肠组织中的表达均上调。Zhou等[14]以MCP-1抑制剂宾达利(bindarit)处理大鼠SAP模型后,可见大鼠血清淀粉酶活性显著降低,MCP-1 mRNA及蛋白在肺组织中表达减弱,肺组织病理损伤减轻。本研究胰腺、肝组织MCP-1mRNA的表达增加参与了急性胰腺炎并发肝损伤的病理过程。
IL-6是由多种细胞产生的一个重要的促炎因子,也是一个前炎性因子,可能直接激活炎症细胞,催化和放大炎性反应并能损伤血管内皮细胞,与SAP病情严重程度呈正相关[15]。临床相关研究显示,IL-6升高的程度和持续时间与急性胰腺炎的重症化显著相关[16,17]。本研究结果显示:SAP 1 h组肝脏、胰腺组织IL-6 mRNA表达开始增加,随着病程的进展IL-6 mRNA表达进一步升高,与胰腺、肝脏组织中炎症细胞的浸润及病理损伤呈正相关,同时与MCP-1 mRNA的表达呈同一趋势。由此提示:SAP时,胰腺损伤,可导致MCP-1活化,从而趋化和激活更多炎症细胞,产生大量IL-6。与Chan等的研究结果一致。Chan等[18]研究认为胰腺腺泡细胞受损后胰酶释放、单核-巨噬细胞激活,导致大量炎症介质及细胞因子(IL-6,IL-1等)释放,细胞因子一旦产生,就不但可以自身激活 ,还能通过扳机样作用,促进其他细胞因子产生,特别是趋化因子,能吸附炎细胞,而这些炎细胞反过来又释放细胞因子,引起连锁和放大效应。
本研究发现柴芩承气汤不仅可以降低血清淀粉酶水平,减轻胰腺的病理损伤,而且可以降低血清ALT、AST活性,减轻SAP并发的肝脏损伤。同时发现,柴芩承气汤可以降低血清IL-6含量,抑制胰腺及肝脏组织MCP-1mRNA、IL-6mRNA的表达。本实验结果提示:柴芩承气汤可能通过抑制MCP-1活性,减少炎症细胞趋化和单核巨噬细胞的活化,降低IL-6的产生,从而减轻SAP时胰腺的炎症损伤及其并发的肝损伤。
[1] 熊小兰,林 波,曹天生,等.中药清胰汤联合思他宁治疗重症急性胰腺炎的临床观察[J].中国现代药物应用,2012,6(2):7-8.
[2] 孙 备,董承刚,王 刚,等.重症急性胰腺炎死亡的高危因素分析[J].中华外科杂志,2007,45(23):1619-1622.
[3] 王 琛,樊 勇.急性胰腺炎常见并发症及防治[J].中国普外基础与临床杂志,2010,17(10):1107-1108.
[4] Halonen KI,Pettila V,Leppaniemi AK,et al.Multiple organ dysfunction associated with severe acute pancreatitis[J].Crit Care Med,2002,30(6):1274-1279.
[5] Papachristou GI.Predication of severe acute pancreatitis:current knowledge and novel insight[J].World J Gasrtoenterol,2008,14(41):6273-6275.
[6] 李国庆,王旺河,张 超,等.肿瘤坏死因子TNF-α、Fas/FasL在急性胰腺炎肝细胞凋亡中的作用[J].中华实验外科杂志,2010,27(5):600-602.
[7] Tiegs G.Celluar and cytokine-mediated mechanisms of inflamination and its modulation in immune-mediated liver injury[J].J Gastroenterol,2007,45(1):63-73.
[8] 党 琳,张晓芹,刘 芳,等.柴芩承气汤对重症急性胰腺炎并肝损伤大鼠肝组织氧化应激的影响[J].新乡医学院学报,2015,32(12):1059-1063.
[9] 李海燕,陈瑞芬.急性胰腺炎肝损害的发生机制[J].首都医科大学学报,2002,23(3):281-283.
[10] Ammori BJ.Gut barrier dysfunction in patients with acute pancreatitis[J].J Hepatobiliary Pancreat Surg,2002,9(4):411-412.
[11]王 筝,梁丽娟,王聪慧,等.肾络通煎剂对梗阻性肾病大鼠肾间质纤维化的影响[J].中国中西医结合杂志,2014,34(10):1238-1243.
[12]Nacy DV,María B,Javier D,et al.Induction of monocyte chemoattractant protein-1 and interleukin-10 by TGFb1 in melanoma enhances tumor infiltration and immunosuppression[J].Caner Res,2011,71(3):812-821.
[13]尚献会,李建国,范振海,等.MCP-1在SAP大鼠胰腺及肠黏膜组织中的表达[J].中国普外基础与临床杂志,2014,21(7):822-826.
[14] Zhou GX,Zhu XJ,Ding XL,et al.Protective effects of MCP-1 inhibitor on a rat model of severe acute pancreatitis[J].Hepatobiliary Pancreat Dis Int,2010,9(2):203-207.
[15]Yagci G,Gul H,Simsek A,et al.Beneficial effects of N-acetyl-cysteine on sodium taurocholate-induced pancreatitis in rats[J].J Gastroenterol,2004,3(9):268-276.
[16]谭崇友,曹丹丹,覃雪莲,等.重症急性胰腺炎患者不同时期肠内营养对肠源性感染影响的临床研究[J].中华医院感染学杂志,2013,23(21):5205-5207.
[17]范永熙,单海滨,李兆然,等.急性胰腺炎患者血清PCT、IL-6和 hs-CRP水平变化的临床意义[J].中国现代医学杂志,2014,24(10):46-49.
[18]Chan YC,Leung PS.Acute pancreatitis:animal models and recent advances in basic research[J].Pancreas,2007,34(1):1-14.
Therapeutic effects of Chai Qin Cheng Qi decoction on severe acute pancreatitis complicated liver damage in rats and its mechanisms
DANG Lin1,ZHANGXiao-qin1,LIU Fang1,XU Xiao-fan2,LI Fang-fang2,WEI Xu1,ZHANGHong2△
(1.School of Basic Medicine,2.Experimental Center of Medical Science and Research,Shanxi University of Traditional Chinese Medicine,Xianyang 712046,China)
Objective:To study the effects of Chai Qin Cheng Qi Decoction(CQCQD)(Traditional Chinese Medicine)on severe acute pancreatitis(SAP)complicated liver damage in rats.Methods:Seventy-two SD rats were randomly divided into three groups(n=24):Sham group,SAPgroup and CQCQD treatment group.SAPmodel was induced by retrograde injection with sodium taurocholate.The rats in CQCQD group
treatment with CQCQD.After modeling1 h,5 h,10 h,pancreas and liver histopathological changes were observed.The serum levels of interleukin-6(IL-6),amylase(AMS),alanine aminotransferase(ALT)and aspartate transaminase(AST)were detected.IL-6 and monocyte chemotactic protein 1(MCP-1)mRNA in pancreas and liver were assayed.Results:Compared with sham group,the activities of AMS,ALT and AST and the serum level of IL-6 in SAPgroup were increased significantly.The levels of MCP-1 and IL-6 mRNA in pancreas and liver tissue were increased(p<0.05).Compared with SAPgroup,the activities of AMS,ALTand AST and the level of IL-6 in CQCQD group were reduced significantly(p<0.05).The pancreas and liver tissue pathological damage alleviated.The levels of IL-6 and MCP-1mRNA in pancreas and liver were decreased significantly(p<0.05).Conclusion:MCP-1 takes part in the progression of SAPcomplicated liver damage;CQCQD can significantly inhibit the expression of pancreas and liver MCP-1,alleviate pathological damage of pancreas and liver in SAPand play a therapeutic role in SAPcomplicated liver damage.
Chai Qin Cheng Qi Decoction(CQCQD); severe acute pancreatitis(SAP); liver damage; MCP-1; rat
R576
A
1000-6834(2017)06-550-05
10.12047/j.cjap.5491.2017.130
陕西中医药大学2016年度自然科学培育基金项目(2016PY06)
2016-09-14
2017-06-22
△【通讯作者】Tel:18691068302;E-mail:zhangh1227@163.com
