APPswe/PS1d E9转基因小鼠小脑内突触素及BDNF/Trk-B蛋白表达的变化*
2017-12-19董雪帆焦娟娟曲雪松祁金顺
董雪帆,王 婷,李 甜,焦娟娟,曲雪松,祁金顺,杨 威
APPswe/PS1d E9转基因小鼠小脑内突触素及BDNF/Trk-B蛋白表达的变化*
董雪帆,王 婷,李 甜,焦娟娟,曲雪松,祁金顺,杨 威△
(山西医科大学生理学系,细胞生理学省部共建教育部重点实验室,太原030001)
目的:观察APP/PS1转基因小鼠小脑突触素及BDNF/Trk-B蛋白表达变化。方法:选用9月龄APP/PS1雄鼠(n1)和同窝对照野生型 WT雄鼠(n2)。采用 Western blot(n1=6;n2=6)、免疫组化(n1=4;n2=4)两种方式定量、定位测定小脑组织功能活性依赖蛋白突触素、脑源性神经营养因子(BDNF)和其高亲和力受体(Trk-B)的蛋白表达。用透射电镜观察小脑皮质突触超微结构变化(n1=2;n2=2)。结果:与WT组相比,APP/PS1组小脑皮质内突触素、BDNF/Trk-B表达明显减少;突触间隙增宽,突触后致密区变薄,密度降低。结论:APP/PS1小鼠小脑皮质中突触素、BDNF/Trk-B蛋白含量均明显降低,突触超微结构也发生明显改变,提示AD小脑突触数量及形态变化可能与BDNF合成及释放减少有关。
APP/PS1转基因小鼠;小脑;突触素;BDNF/Trk-B;突触
阿尔茨海默病(Alzheimer’s disease,AD)是老龄人中最常见的认知功能进行性下降的疾病,是发生在中枢神经的一种病因未明的原发性神经退行性疾病。其主要病理改变为Aβ淀粉样斑块沉积、神经原纤维缠结、大量神经元丢失和脑萎缩[1]。“Aβ学说”认为Aβ的集聚及其神经毒性作用是AD的主要病因[2]。研究表明,AD患者或AD模型鼠的大脑皮层颞叶和海马内有大量Aβ沉积,并且突触结构和突触传递效能也受到明显损害[3,4]。动物体外研究发现,Aβ可直接引发突触传递功能异常[5],影响树突棘的密度和稳定性,突触前神经递质的合成与释放,突触结构和突触传递效能也受到明显损害。因此,Aβ神经毒性作用导致的突触丢失或突触功能异常被广泛认为是AD认知损害的潜在机制。
小脑是随动物运动的复杂化而逐渐进化的脑部结构。长期以来,人们认为小脑只有运动功能,但随着小脑非运动功能(如感觉、知觉、语言及认知功能等)的发现及证实[6,7],小脑在 AD认知障碍中的作用也逐渐引起重视。临床尸检病理研究显示,在晚期AD病人小脑内Aβ1-42水平增高,细胞形态和功能发生明显改变。例如,浦肯野细胞数量大量丢失,树突长度变短,树突末端分支减少等[8]。
APPswe/PS1dE9转基因小鼠是目前常用的AD转基因模型鼠。其优势在于将两个易感基因结合在一起,从而缩短病理变化时间,并使病理特征多样化,能够较好的模拟AD患者的早期病理和行为特征。研究发现,7~8月龄 APPswe/PS1dE9转基因AD小鼠小脑内含有高水平可溶性Aβ1-42,并出现散在Aβ斑块[9]。突触传递效能的长时程抑制(longtermpotentiation,LTD)是小脑学习记忆的细胞突触模式和神经基础。小脑LTD受损将导致动物依赖自身运动信息的空间定位航行能力明显降低,而运动功能却不受影响。最新研究表明,APPswe/PS1dE9转基因小鼠小脑内浦肯野细胞兴奋性降低,LTD明显减小[10]。以上研究结果提示,在AD的发生过程中小脑神经元突触形态和功能会发生明显改变,但目前尚缺乏形态学证据支持,其具体机制还不十分清楚。
脑源性神经营养因子(brain-derive neurotrophic factor,BDNF)是一种有促进和维持神经元生长、存活、和执行功能作用的活性蛋白因子,在突触活动和突触可塑性中发挥着重要的调控作用。突触素(synaptophysin)是突触前囊泡蛋白释放神经递质的标志物[11],与突触的生长、修复、再生和突触重塑密切相关。本研究将利用APPswe/PS1dE9双转基因小鼠,应用Western blot,免疫组织化学和透射电镜实验手段,观察AD转基因模型小鼠小脑内突触相关蛋白表达以及超微结构的变化,揭示AD小脑内突触相关结构的形态学改变,为进一步探讨小脑突触传递功能变化的可能机制提供新的理论依据。
1 材料与方法
1.1 实验动物与分组
APPswe/PS1dE9(APP/PS1)双转基因小鼠和同窝同月龄野生型(wild type,WT)C57BL/6J小鼠,9月龄各12只,均为雄性,由中国医学科学院医学实验动物研究所基因工程平台提供。饲养环境自然昼夜节律光照,自由摄食进水,通风良好,(21±2)℃恒温。
1.2 仪器和试剂
冰冻切片机(LEICA CM1850),光学显微镜(OLYMPUS1X71),图像采集系统(OLYMPUSDP71),电泳仪(BIO-RAD),转膜仪(BIO-RAD),凝胶成像系统(BIO-Rad),Scanscope数字病理切片扫描成像系统(Aperio)。本 实 验 一 抗 为 β-actin(博 士 德 生 物BM0627,小鼠单克隆抗体),6E10(Sigma USA,小鼠单克隆抗体),Synaptophysin(abcam ab32127,兔单克隆抗体),BDNF(abcam ab108319,兔单克隆抗体),TrkB(abcam ab18987,兔单克隆抗体)。二抗为山羊抗兔(博士德生物 BA1054),山羊抗小鼠(博士德生物 BA1050)。
1.3 Western blot实验
小鼠腹腔注射过量的5%水合氯醛后断头,在冰上取新鲜小脑组织。称重,剪碎组织,加入组织裂解液,在4℃静置30 min。再加入 PMSF后,立即在超声中混匀后,在4℃下静置4 h后,离心,测蛋白浓度后备用。配置12%的分离胶和5%的浓缩胶后,取定量组织进行SDS-PAGE电泳。浓缩胶稳压80 V,分离胶稳压120 V。转印至PVDF膜上,5%的牛血清白蛋白(ABS)室温封闭1 h。分别加入6E10(1:500),Synaptophysin(1:60 000),BDNF(1:5 000),TrkB(1:1 000)。4℃过夜。用 TBST洗膜 3次 ×5 min,然后分别加入辣根过氧化酶标记的山羊抗兔(1:3 000),山羊抗小鼠(1:4 000)的二抗。室温下孵育2 h。用TBST洗膜3次×5 min,电泳凝胶成像分析仪采集结果。用AlphaView SA软件进行光密度值分析,储存目的蛋白与内参β-actin的光密度比值[12]。
1.4 免疫组织化学实验
将小鼠用5%水合氯醛麻醉后,PBS和4%的多聚甲醛行心脏灌注,取脑。置于4%多聚甲醛溶液中固定过夜,30%蔗糖脱水、包埋、切片,脑片厚度30μm。脑片用PBS漂洗,5%H2O2常温避光孵育脑片15 min,PBS再次漂洗,5%正常血清室温孵育30 min;滴加一抗 Synaptophysin(1:250),BDNF(1:200),TrkB(1:40)。4℃孵育过夜后,室温孵育 2 h;PBS漂洗,滴加二抗羊抗兔 IgG(1:100),室温孵育 2 h后PBS漂洗,ABC复合物室温孵育2 h;漂洗后滴加DAB显色剂避光反应30 min,蒸馏水清洗后加苏木素复染。酒精脱水,二甲苯透明,中性树胶封片,放于阴凉通风处保存[13]。免疫组化结果用Aperio公司的cytoplasmic v2软件进行灰度值分析,再转换成相应的光密度值进行统计。
1.5 透射电镜实验
将小脑皮层切成1mm×1mm×1mm的组织块,用4%多聚甲醛固定4 h(4℃)后,用磷酸缓冲液(pH 7.2)冲洗,置于1%锇酸中后固定2 h,双蒸水冲洗后系列酒精脱水,丙酮与包埋剂混合液室温浸透3 h,包埋剂环氧树脂618包埋,40℃24 h浸透,60℃48 h聚合。超薄切片机(瑞典 LKB)切片(60~90 nm),醋酸铀-柠檬酸铅双染,透射电镜(JEM-1011)下观察并拍照。
1.6 统计学处理
所有数据结果以均数±标准差(¯x±s)表示,采用SPSS 18.0统计学软件进行处理,两组间比较用独立配对 t检验。
2 结果
2.1 APP/PS1转基因小鼠小脑内Aβ沉积情况
如图1所示,9月龄 APP/PS1组(图1B)转基因小鼠小脑内有Aβ斑块的沉积。且Aβ沉积主要部位为小脑的Ⅵ、Ⅶ小叶。而同龄的WT组(图1A)则没有Aβ斑块的沉积(图1,见彩图页Ⅲ)。
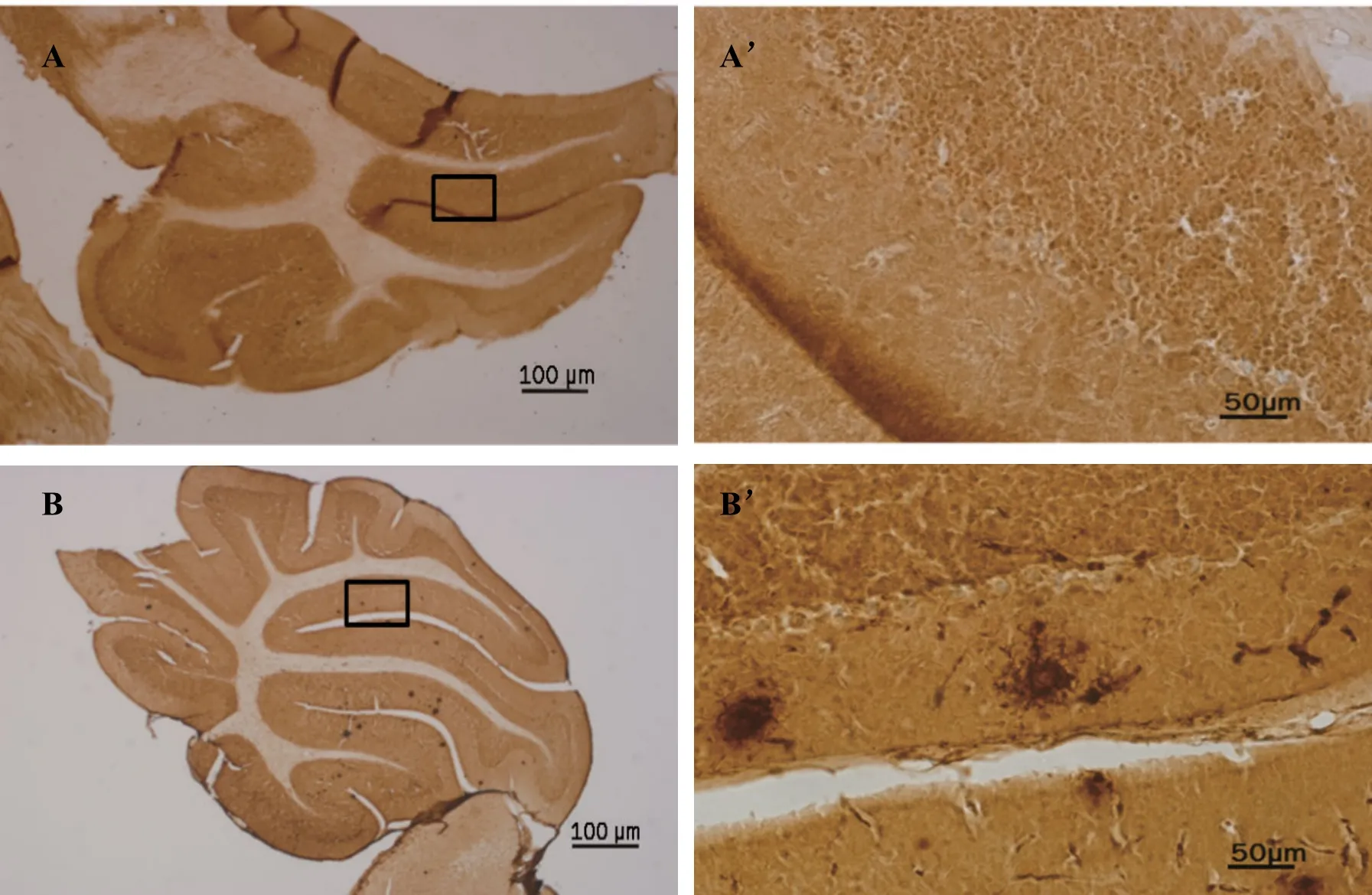
Fig. 1 The deposition of Aβ plaques in cerebellar A-A’:Representative image of total Aβ plaques in the cerebellar of 9 months old of WT mice;B’-B’:Representative image of total Aβ plaques in the cerebellar of 9 months old of APP/PS1 mice;A:Wild type mice group;B:App/PS1 mice group;A-B:IHC-Fr×10;A’-B’:IHC-Fr ×40
2.2 APP/PS1转基因小鼠小脑内突触素蛋白含量和形态的改变
小脑由小脑皮质和小脑核构成。用Western blot技术可以分析整个小脑的蛋白表达含量,而单纯对于小脑皮质的分析则可以依靠免疫组织化学。两个技术可以相互应证,也可互为补充。突触素是一种钙结合糖蛋白,位于轴突终末的突触前囊泡膜上,其定位和定量可准确反映突触的分布和功能状态,从而反映其可塑性。
图2所示,与 WT对照组(1.000±0.476)相比,APP/PS1转基因组(0.200±0.176)小鼠小脑组织的突触素表达下调(p<0.05)。
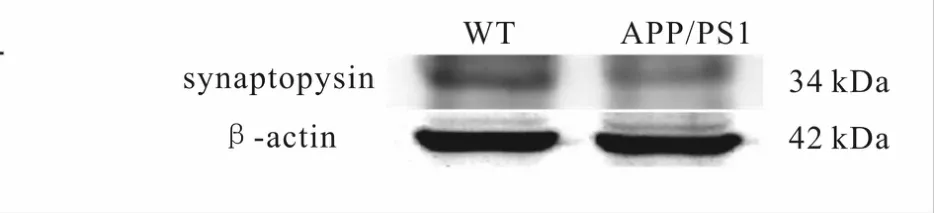
Fig.2 The expression of synaptophysin in the cerebellum of mice.Western blot of homogenized cerebella from wild-type(WT)and APP/PS1 mice.Synaptopysin was normalized toβ-actin.Note that,there was a decrease of protein optical density in APP/PS1 mice(n=6)
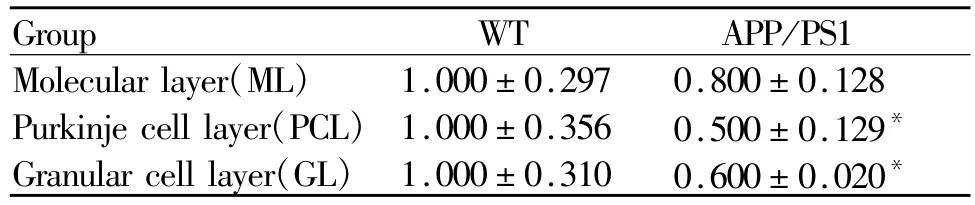
图3,表1所示,小脑皮质分为3层,分别为分子层,浦肯野细胞层和颗粒细胞层。突触素阳性反应表现为棕褐色颗粒,它在APP/PS1组小鼠小脑中出现的比重少。同WT对照组相比,APP/PS1组小鼠小脑分子层突触素含量减少,但是没有统计学差异(P>0.05)。在浦肯野细胞层(p<0.01)和颗粒细胞层(p<0.05)都有明显的减少,尤以浦肯野细胞层明显,极个别浦肯野细胞的胞浆呈弱阳性反应。然而,两组浦肯野细胞均为单层排列,呈梨形或烧瓶形,细胞直径约25~30μm,形态上并无明显差别(图3,见彩图页Ⅲ)。
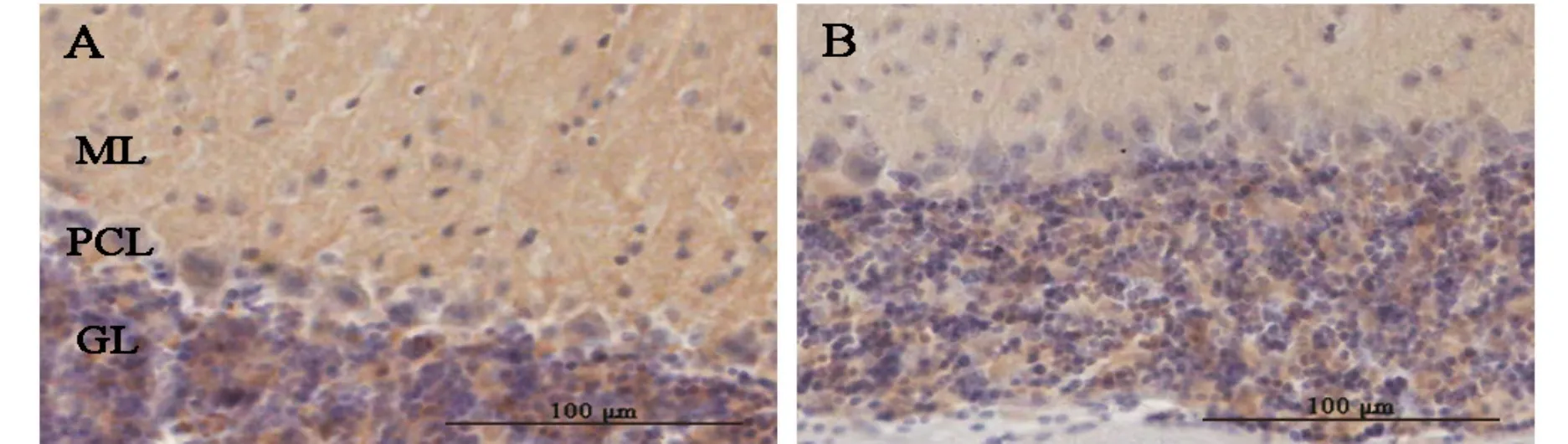
Fig. 3 Synaptophysin expression in cerebellar cortex of mice(IHC-Fr ×400)A-B:Digital images of immunohistochemical staining for synaptophysin in molecular layer(ML),purkinje cell layer(PCL)and granular layer(GL)from wild-type(WT)and APP/PS1 mice. There were weak positive reaction in the purkinje cell layer(PCL)and granular layer(GL)in APP/PS1 mice(n=4)
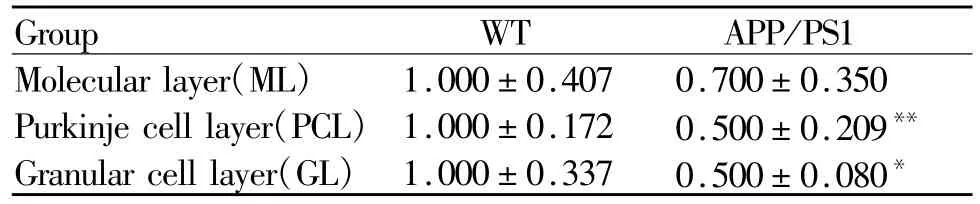
Tab.1 The relative optical density of synaptophysin in cerebellar cortex of mice
2.3 APP/PS1转基因小鼠小脑内的BDNF以及其高亲和力受体Trk-B的含量
BDNF/Trk-B信号通路不仅作用于突触前,对突触后也有重要的作用,它可以改变突触前的递质释放而影响突触强度的改变。
图4,表2所示,与WT对照组相比,APP/PS1转基因小鼠小脑组织的 BDNF表达下调(p<0.01),Trk-B的表达下调(p<0.05)。
图5A和表3所示,免疫组化实验中,BDNF阳性反应表现为棕褐色颗粒,它在APP/PS1组小鼠小脑皮质浦肯野细胞层和颗粒细胞层中出现的比重大。与WT对照组相比,APP/PS1组小鼠小脑分子层BDNF含量减少,但是没有统计学差异(P>0.05),在浦肯野细胞层(p<0.05)和颗粒细胞层(p<0.05)都有明显的减少,浦肯野细胞树突也变得短小,分枝少。而浦肯野细胞单层排列整齐,形态无明显差异(图5,见彩图页Ⅳ)。
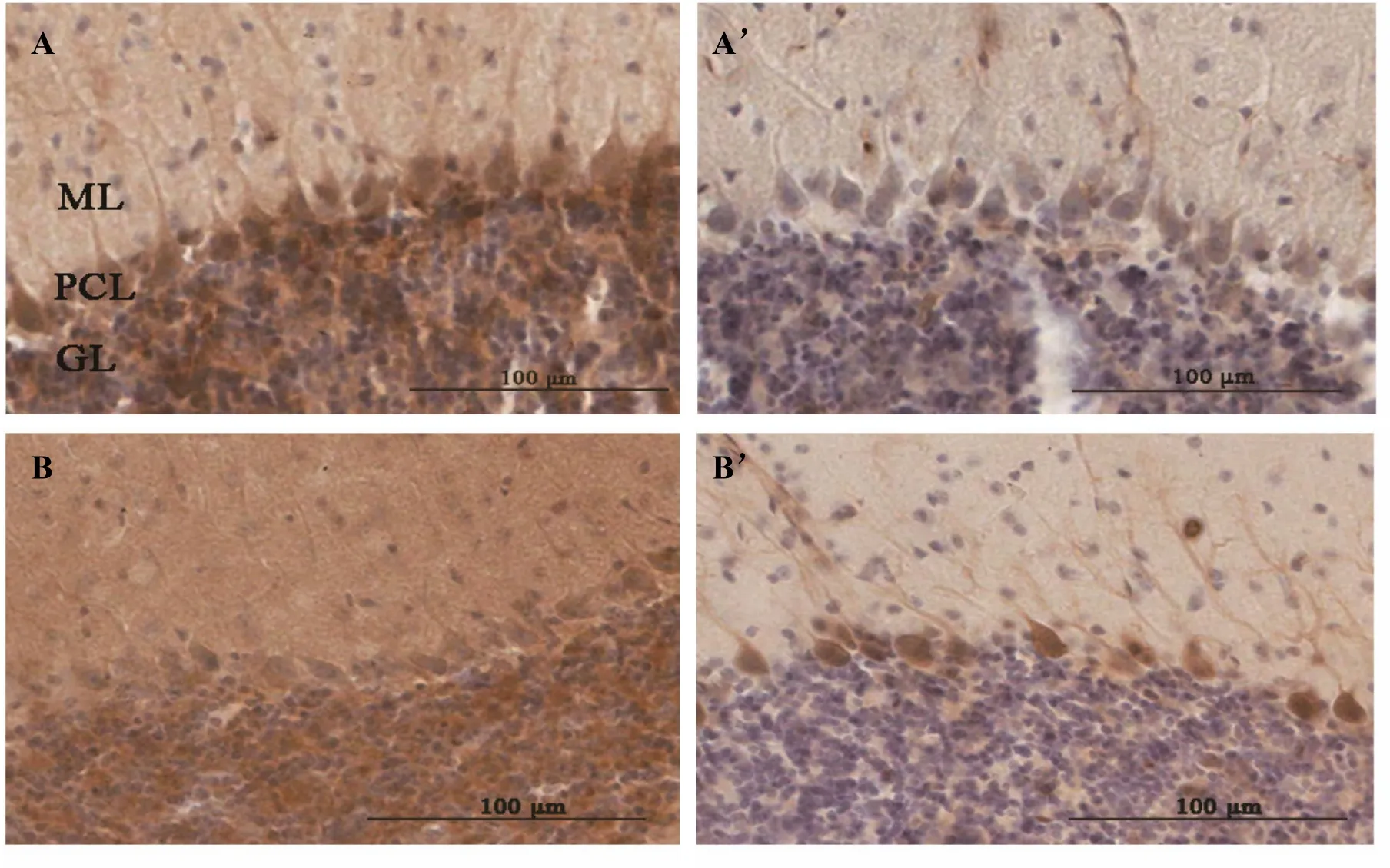
Fig. 5 Brain-derived neurotrophic factor(BDNF,A-A')/Tyrosine kinase B(Trk-B,B-B')expression in cerebellar cortex of mice A-B':Digital images of immunohistochemical staining for BDNF/Trk-B in molecular layer(ML),purkinje cell layer(PCL)and granular layer(GL)from wild-type(WT)and APP/PS1 mice(IHC-Fr ×400). There was weak positive reaction in the purkinje cell layer(PCL)and granular layer(GL)in APP/PS1 mice stained BDNF. All the cortex had weak positive reaction in APP/PS1 mice stained Trk-B(n=4)
图5B和表4所示,Trk-B阳性反应仍表现为棕褐色颗粒,与WT对照组相比,APP/PS1组小鼠小脑皮质Trk-B在分子层,浦肯野细胞层和颗粒细胞层均有明显的表达下调趋势(p<0.01)。浦肯野细胞树突也变得短小,分枝减少。而浦肯野细胞形态并无明显差异。
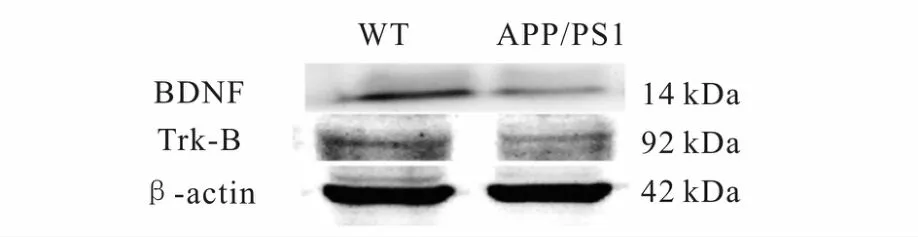
Fig.4 The expression of BDNF/Trk-Bin the cerebellum of mice.Western blot of homogenized cerebellar from wild-type(WT)and APP/PS1 mice.BDNF/Trk-Bwere normalized toβ-actin.Note that,there was a decrease of protein optical density in APP/PS1 mice(n=6)
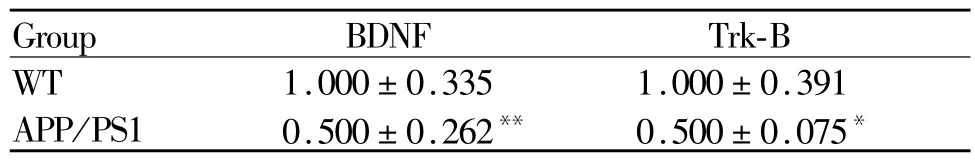
Tab.2 The relative optical density of BDNF/Trk-B in the cerebellum of mice
Tab.3 The relative optical density of BDNF in cerebellar cortex of mice
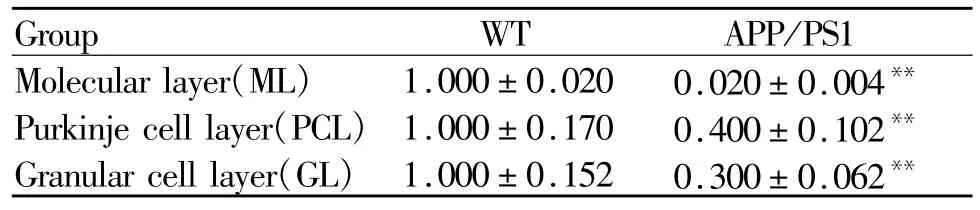
Tab.4 The relative optical density of Trk-Bin cerebellar cortex of mice
2.4 APP/PSl转基因小鼠小脑皮质形态学的改变
以上结果证实小鼠小脑突触发生了改变。而电镜超微结构更能清楚直观的反应突触形态的改变。因为用超微电镜观察时小脑皮质的3层结构之间没有明显分界线,我们无法明确区别这3层结构,故而没有分层描述。我们发现,WT组(图6A),突触结构清晰,突触间隙分界明显,突触后膜上的突触后致密区密度高,弧度小,较平滑。线粒体结构完整,双层膜结构完整,线粒体嵴排列整齐。APP/PS1组(图6B),突触间隙分界模糊,突触后致密区变薄,密度降低。弧度大,向突触前膜突出明显。线粒体结构不完整,水肿胀大,双层膜结构不完整。
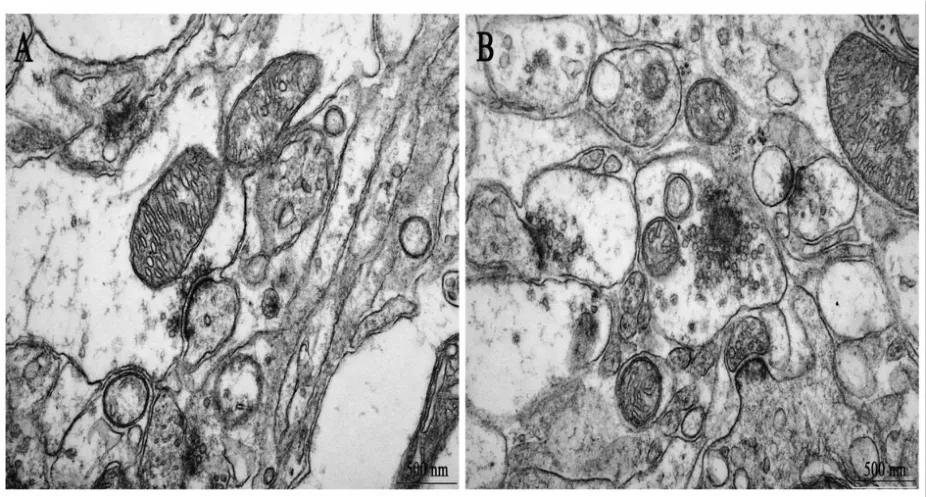
Fig.6 Electron micrographs of the cerebellar cortex in WT(A)and APP/PS1(B)mice(TEM×50 000)(n=2)
3 讨论
小脑是随动物运动的复杂化而逐渐进化的脑部结构。以前人们认为小脑只有运动功能,是维持自体平衡,调节肌张力和协调运动的控制中枢。但近30年来日益增多的证据表明,小脑具有多种非运动功能,如感觉、知觉、语言及认知功能等,参与时间,知觉,空间判断,并在抽象思维事件、复杂问题解决等过程中起重要作用[14]。近年来研究发现,AD患者小脑细胞形态和功能会发生明显改变,与其它认知相关脑区之间的功能联系在AD发病早期就出现异常,提示小脑在AD认知障碍的发生发展中可能起着不可忽视的作用。
APPswe/PS1dE9双转基因小鼠模型是目前国内外比较公认的AD转基因动物模型之一,其优势在于将两个易感基因结合在一起,从而缩短病理变化时间,并使病理特征多样化,能够较好的模拟AD患者的早期病理和行为特征[15]。本研究结果显示,同龄的WT组(图1A)没有Aβ斑块的沉积,而9月龄APP/PS1组(图1B)转基因小鼠小脑内出现Aβ斑块沉积,这与相关研究报道一致[16]。并且通过我们的实验发现,Aβ沉积主要部位为小脑的Ⅵ、Ⅶ小叶。近些年的研究发现,小脑内与认知相关的区域位于小脑后叶,主要包括第Ⅵ小叶、第ⅦA小叶(含crusⅠ和 crusⅡ)以及第ⅦB小叶[17]。本文研究发现,Aβ斑块出现在Ⅵ、Ⅶ小叶的居多,提示AD可能对小脑的认知功能造成损害。
小脑浦肯野细胞是一类分泌GABA作为神经递质的抑制性神经元,它通过细胞表面的棘突接受传入小脑的数万个信息,在胞体整合后,由轴突将输出信息传至小脑深核,是小脑皮质唯一的传出性神经元。有研究表明,APPswe/PS1dE9转基因小鼠小脑内浦肯野细胞兴奋性降低,LTD明显减小[10],提示小脑突触可塑性发生改变。突触素是突触前囊泡蛋白释放神经递质的标志物[11],与突触的生长、修复、再生和突触重塑密切相关。神经细胞间突触传递依赖于突触前终末内储存神经递质的突触囊泡的胞吐作用,为Ca2+依赖性的递质释放。突触素的存在对于Ca2+依赖性的递质释放是必需的。另外,突触素可以评估突触数量和神经终末密度。本研究结果显示,与WT组相比,APP/PS1组小鼠小脑突触素表达含量明显降低,突触超微结构也明显受损,提示AD小脑内细胞的突触传递功能发生改变。
为探究小脑突触可塑性变化的可能机制,我们进一步观察小脑各层BDNF及其受体Trk-B的蛋白表达情况。结果表明,与WT组相比,APP/PS1组小鼠小脑组织中BDNF/Trk-B的表达总含量均有所下降;其中小脑皮质浦肯野细胞层和颗粒细胞层内BDNF/Trk-B的蛋白含量均明显下降。BDNF是一种有促进和维持神经元生长、存活、和执行功能作用的活性蛋白因子,在突触活动、联系神经元连接和突触可塑性中发挥着重要的调控作用。颗粒细胞是小脑皮质合成BDNF的主要位点。颗粒细胞内合成的BDNF可以通过顺行轴浆运输转运到轴突(平行纤维),并随递质囊泡一起释放入轴突间隙,进而调节突触传递功能[18]。缺乏BDNF将导致小脑突触超微结构及功能发生改变。研究表明,BDNF-/-小鼠浦肯野细胞(purkinje cell,PC)的树突形态异常,平行纤维(parallel fiber,PF)末梢终末肿胀。虽然 PF/PC的突触数量没有减少,但电生理学实验却发现PF/PC突触传递效能出现异常[19],据此推测 APP/PS1组小鼠小脑突触形态异常可能与BDNF合成释放减少有关。
近年来的研究表明,小脑在AD认知障碍的发生发展中可能起着不可忽视的作用。但目前关于AD小脑的相关研究主要集中在临床影像学研究,AD模型鼠,特别是AD转基因鼠小脑的相关研究较少,更缺乏其突触相关形态学的研究。本实验结果表明APP/PS1小鼠小脑皮质中突触素、BDNF/Trk-B表达含量均明显降低,突触超微结构也发生明显变化,提示AD小脑内突触传递功能改变。本研究丰富了AD转基因小鼠小脑突触形态学的相关资料,为进一步探究AD小脑突触形态及功能变化的可能机制提供新的理论依据,为早期诊断AD提供新的思路和方向。
[1] Toba J,Nikkuni M,Ishizeki M,et al.PPARgamma agonist pioglitazone improves cerebellar dysfunction at pre-Abeta deposition stage in APPswe/PS1dE9 Alzheimer’s disease model mice[J].Biochem Biophys Res Commun,2016,473(4):1039-1044.
[2] Mattson MP,Guo Q.Cell and molecular neurobiology of presenilins:a role for the endoplasmic reticulumin the pathogenesis of Alzheimer’s disease[J]?J Neurosci Res,1997,50(4):505-513.
[3] 郝 明,仝嘉庆,张 军,等.雷帕霉素对淀粉样β蛋白所致大鼠工作记忆和突触可塑性损伤的作用观察[J].中国应用生理学杂志,2016,32(1):18-21.
[4] 杨 菊,张 军,原 丽,等.双受体激动剂CI-1206拮抗Aβ1-42所致小鼠空间学习记忆损伤的作用 [J].中国应用生理学杂志,2016,32(6):567-570.
[5] Nimmrich V,Ebert U.Is Alzheimer’s disease a result of presynaptic failure?Synaptic dysfunctions induced by oligomeric beta-amyloid[J].Rev Neurosci,2009,20(1):1-12.
[6] Gordon N.The cerebellum and cognition[J].Eur J Paediatr Neurol,2007,11(4):232-234.
[7] Schmahmann JD,Sherman JC.The cerebellar cognitive affective syndrome[J].Brain,1998,121(Pt 4):561-579.
[8] Fukutani Y,Cairns NJ,Rossor MN,et al.Purkinje cell loss and astrocytosis in the cerebellum in familial and sporadic Alzheimer’s disease[J].Neurosci Lett,1996,214(1):33-36.
[9] Kuwabara Y,Ishizeki M,Watamura N,et al.Impairments of long-term depression induction and motor coordination precede Abeta accumulation in the cerebellum of APPswe/PS1dE9 double transgenic mice[J].J Neurochem,2014,130(3):432-443.
[10] Hoxha E,Boda E,Montarolo F,et al.Excitability and synaptic alterations in the cerebellum of APP/PS1 mice[J].PloSOne,2012,7(4):e34726.
[11]Pan W,Han S,Kang L,et al.Effects of dihydrotestosterone on synaptic plasticity of the hippocampus in mild cognitive impairment male SAMP8 mice[J].Exp Ther Med,2016,12(3):1455-1463.
[12]Real CC,Garcia PC,Britto LR,et al.Different protocols of treadmill exercise induce distinct neuroplastic effects in rat brain motor areas[J].Brain Res,2015,1624:188-198.
[13]Duffy AM,Holscher C.The incretin analogue D-Ala2GIPreduces plaque load,astrogliosis and oxidative stress in an APP/PS1 mouse model of Alzheimer’s disease[J].Neuroscience,2013,228:294-300.
[14] Freeman JH.Cerebellar learning mechanisms[J].Brain Res,2015,1621:260-269.
[15]Webster SJ,Bachstetter AD,Nelson PT,et al.Using mice to model Alzheimer’s dementia:an overview of the clinical disease and the preclinical behavioral changes in 10 mouse models[J].Front Genet,2014,5:88.
[16]Purushothuman S,Johnstone DM,Nandasena C,et al.Near infrared light mitigates cerebellar pathology in transgenic mouse models of dementia[J].Neuroscience letters,2015,591:155-159.
[17]Bodranghien F,Bastian A,Casali C,et al.Consensus paper:revisiting the symptoms and signs of cerebellar syndrome[J].Cerebellum,2016,15(3):369-391.
[18]Chen AI,Zang K,Masliah E,et al.Glutamatergic axon-derived BDNF controls GABAergic synaptic differentiation in the cerebellum[J].Sci Rep,2016,6:20201.
[19] Carter AR,Chen C,Schwartz PM,et al.Brain-derived neurotrophic factor modulates cerebellar plasticity and synaptic ultrastructure[J].J Neurosci,2002,22(4):1316-1327.
Expressions of synaptophysin and BDNF/Trk-B in cerebellum of APPswe/PS1dE9 transgenic mice
DONGXue-fan,WANGTing,LI Tian,JIAO Juan-juan,QU Xue-song,QI Jin-shun,YANGWei△
(Department of Physiology,Key Laboratory of Cellular Physiology,Ministry of Education,Shanxi Medical University,Taiyuan 030001,China)
Objective:To observe the expressions of synaptophysin and BDNF/Trk-Bin cerebellum of APPswe/PS1dE9 transgenic mice.Methods:The healthy 9-month old APP/PS1 male mice(n1)and the same wild type male mice(n2)were divided into two groups,APP/PS1 group and wild-type(WT)group.The expressions of synaptophysin and brain-derived neurotrophic factor/tyrosine kinase B(BDNF/Trk-B)in cerebellum were determined by Western blot(n1=6;n2=6)and immunohistochemical(n1=4;n2=4).The possible synaptic changes in APP/PS1 group were observed by using electron microscopy.Results:Compared with WTgroup,the expressions of synaptophsin and BDNF/Trk-B in cerebellum were decreased in APP/PS1 group.Increased width of the synaptic cleft and decreased thickness of postsynaptic density were also observed.Conclusion:In APP/PS1 group,expressions of synaptophsin and BDNF/Trk-Bin cerebellum were decreased;changes in ultrastructure of synapses seemed to be widespread alterations.These findings suggest a possible association between expression of BDNF/TrkB and synaptic plasticity in AD cerebellum.
APP/PS1 transgenic mouse; cerebellum; synaptophysin; BDNF; Trk-B; synapse
R338
A
1000-6834(2017)06-488-07
10.12047/j.cjap.5530.2017.116
山西省回国留学人员科研资助项目(2016060)
2016-11-28
2017-05-23
△【通讯作者】Tel:13293910485;E-mail:vividmail@163.com
