1株猪鼻支原体特异性单克隆抗体的制备及鉴定
2017-12-13,,,,2,,,,3
,, , ,2,,,,3
·论著·
1株猪鼻支原体特异性单克隆抗体的制备及鉴定
田瑞雨1,4,熊祺琰1,倪博1,王佳1,2,韦艳娜1,冯志新1,邵国青1,3
目的制备与鉴定猪鼻支原体单克隆抗体,用于猪鼻支原体诊断及致病机理的研究。方法将猪鼻支原体全菌蛋白免疫小鼠,利用杂交瘤技术制备单克隆抗体。鉴定其抗体亚型并对纯化单抗的效价、特异性进行鉴定。将该单抗用于菌落免疫杂交试验、间接免疫荧光试验。结果获得了1株猪鼻支原体单抗,命名为Mhr-08。该单抗的亚型属于IgG1,轻链为κ型。ELISA测定该纯化单抗效价为1∶102 400,Western-blot检测结果表明,该单抗与猪鼻支原体全菌蛋白在43 kDa处出现特异性反应条带,与猪其他支原体、大肠杆菌及KM2培养基无交叉反应;该单抗为猪鼻支原体表面膜蛋白抗体,可成功应用于菌落免疫杂交试验;将其用于间接免疫荧光试验可成功检测出黏附于猪气管上皮细胞上的猪鼻支原体。结论成功制备和鉴定出1株猪鼻支原体单克隆抗体,该特异性单抗的获得为猪鼻支原体的诊断及致病机理的研究提供了工具。
猪鼻支原体;单克隆抗体;特异性
猪鼻支原体(Mycoplasmahyorhinis)是猪呼吸道中存在的一种常见病原菌[1],可引起猪的关节炎、结膜炎、中耳炎、咽鼓管炎及肺炎等多种慢性炎症[2-7],通常由母猪或大猪经呼吸道传染给小猪,进而从呼吸道侵染全身引发疾病的发生。猪鼻支原体也是实验室细胞培养物的常见污染物[8],同时近年来研究者发现猪鼻支原体与人胃癌、大肠癌有高度相关性,并已经从胃癌组织中直接分离到了猪鼻支原体[9],而且Namiki等人发现猪鼻支原体可诱导肿瘤细胞恶性程度增加[8],Duan等人发现它还可以促进肿瘤细胞迁移[10]。
高敏感及高特异性的诊断方法对疾病控制具有重要意义。目前,猪鼻支原体的实验室诊断方法主要包括病原的分离与鉴定、双抗体夹心ELISA、间接免疫荧光试验、胶体金免疫层析法、PCR方法等[11-12],其中免疫学试验中所用抗体的质量直接影响检测效果。猪的不同支原体之间存在许多交叉抗原,针对猪鼻支原体特异性单克隆抗体可为该病诊断方法的建立提供重要工具。因此,本研究制备获得1株特异性单抗,可为猪鼻支原体特异性检测方法的建立提供工具,同时也为猪鼻支原体致病机理的研究提供重要材料。
1 材料与方法
1.1主要材料和试剂 猪鼻支原体由本实验室分离,PCR鉴定[13]并保存;胎牛血清购自杭州四季青生物工程材料有限公司;弗氏完全佐剂、弗氏不完全佐剂、聚乙二醇(PEG4000)购自Sigma公司;HRP、FITC标记的羊抗鼠二抗均购自武汉博士德生物工程公司;亚型鉴定试剂盒购自proteintech公司;其他试剂均为分析纯等级。
1.2猪鼻支原体全菌抗原的制备 猪鼻支原体在KM2无细胞培养基中生长至对数期,将培养物于12 000 r/min离心30 min收集菌体。用无菌PBS缓冲溶液洗涤3次后,将菌体重悬于PBS缓冲液中,以55%功率,超声3 s,暂停5 s,超声破碎5 min即为免疫用抗原,BCA试剂盒测定蛋白浓度,分装,-20 ℃保存备用。
1.3BALB/c小鼠的免疫 将猪鼻支原体全菌抗原与弗氏完全佐剂等体积混合,并充分乳化,皮下多点注射接种6周龄雌性BALB/c 小鼠10只(每只接种量25 μg)。4周后皮下注射弗氏不完全佐剂处理的抗原(佐剂与抗原1∶1乳化),25 μg/只接种。4周后腹腔注射等量生理盐水混合的抗原,细胞融合前3 d,用等量不加佐剂的抗原直接加强免疫1次,即可进行细胞融合。
1.4单克隆抗体杂交瘤细胞株的建立 按常规方法,将小鼠脾细胞与骨髓瘤细胞融合,于96孔细胞板中进行培养。细胞融合后第7 d,培养板孔底长出肉眼可见的克隆,吸取上清液,经间接ELISA方法(见1.7)筛选只与猪鼻支原体反应而不与猪肺炎支原体、猪滑液支原体、絮状支原体反应的阳性杂交瘤细胞。采用有限稀释法将细胞悬液连续稀释至统计上每孔加样仅含单个细胞,转移至96孔板培养,经过数次克隆化操作,直至所有克隆化细胞孔检测阳性率为100%时,即可确定已获得分泌单克隆抗体的杂交瘤细胞株。将获得的阳性杂交瘤细胞在细胞培养瓶中扩大培养,冻存。
1.5腹水的制备及单克隆抗体的纯化 取6周龄健康雌性小鼠,腹腔注射0.5 mL液体石蜡致敏,一到两周后,每只小鼠腹腔注射1~2×106个杂交瘤细胞,观察小鼠状态。7~10 d后待小鼠腹腔明显膨大后收集腹水,离心取上清液即为腹水。以饱和硫酸铵法纯化单克隆抗体。
1.6单抗类型及亚型鉴定 应用小鼠单克隆抗体亚型鉴定试剂盒进行测定。
1.7间接ELISA测定纯化抗体效价 将猪鼻支原体全菌蛋白以10 μg/mL包被于ELISA反应板,用含5% 牛血清白蛋白(BSA)的PBS封闭,将该单克隆抗体及鼠阴性血清对照用封闭液从1∶200开始做2倍递增稀释,37 ℃作用1 h,洗涤后加入1∶10 000稀释的HRP-羊抗鼠IgG,作用30 min后洗涤3次,TMB显色10 min,酶标仪测定OD450-630nm值。
1.8单抗特异性鉴定 利用Western-blot方法对该单抗的特异性进行鉴定,按照常规方法进行。将猪鼻支原体、猪肺炎支原体、絮状支原体、猪滑液支原体及大肠杆菌全菌蛋白每种15 μg进行SDS-PAGE电泳分离,经半干式电转印装置恒压15V转印20 min电转移至硝酸纤维素膜(PVDF膜),用含3% BSA 的PBS 37 ℃封闭2 h,TBST洗涤后,以该纯化单抗(1∶1 000稀释)4 ℃过夜孵育。洗涤后加入1∶5 000稀释的HRP-羊抗鼠IgG,作用1 h后洗涤3次,ECL显色拍照。
1.9 单抗与膜蛋白的反应性鉴定
1.9.1支原体膜蛋白的提取 将猪鼻支原体菌液300 mL 12 000 r/min,4 ℃,离心30 min,收集菌体沉淀。菌体沉淀用无菌PBS反复洗涤3次,离心弃上清。向沉淀内加入3 mL PBS混匀,重悬液放置-70 ℃冻存。取冻存的猪鼻支原体重悬液测定蛋白浓度,将蛋白浓度调整至2 mg/mL,加入等体积含2%的吐温的PBS,混匀后,37 ℃孵育90 min,超速离心机50 000 g离心1 h,取上清0.22 μm滤器过滤即猪鼻支原体膜蛋白,分装-70 ℃保存备用。
1.9.2Western-blot检测纯化单抗与膜蛋白反应性
按照1.8方法,将猪鼻支原体全菌蛋白及膜蛋白同时进行Western-blot鉴定,确定该单抗的目的蛋白是否属于膜蛋白。
1.10菌落免疫杂交试验 将猪鼻支原体菌液以KM2培养基稀释1 000倍,取100 μL稀释后菌液涂布固体平板,大约1周后支原体在平板上长出单菌落,将PVDF膜放在菌落上,稍用力按压5 min,然后将膜取下晾干,以3% BSA的PBS 37 ℃封闭2 h。TST洗涤3次后加入猪鼻支原体单抗(1∶200稀释),4 ℃过夜;洗涤后加入HRP标记的羊抗鼠二抗(1∶5 000稀释),37 ℃ 作用1 h,洗涤后,ECL显色。
1.11间接免疫荧光鉴定试验 将猪鼻支原体按照107CCU/mL接种于猪气管上皮细胞,1 mL/孔,37 ℃粘附6 h,PBS洗涤3次后,以4%多聚甲醛固定15 min;洗涤3次后加入含0.2% Triton X-100的PBS透化处理3 min,洗涤后以5% BSA封闭30 min,加入待鉴定的单抗,4 ℃过夜;洗涤后加入FITC 标记的羊抗小鼠二抗,37 ℃作用1 h,洗涤后于荧光显微镜下观察。
2 结 果
2.1单克隆抗体杂交瘤细胞株的建立 以洗涤的猪鼻支原体全菌抗原为免疫原免疫小鼠,融合的杂交瘤细胞经间接ELISA筛选阳性克隆,对阳性孔进行3次亚克隆,最终获得1株稳定分泌特异性抗体的杂交瘤细胞株,命名为Mhr-08。
2.2亚型鉴定 该特异性单抗在酶标板的G1和κ孔呈阳性,OD450值最高,其余孔不显色,表明该单抗的亚型属于IgG1,轻链为κ型(见表1)
表1 纯化的Mhr-08单抗亚型鉴定结果
Tab.1 Subtype identification of the purified monoclonal antibody

IgAIgMIgG1IgG2aIgG2bIgG3κλOD4500.1030.1131.5990.110.1250.1521.2480.146
2.3纯化抗体效价测定 经ELISA检测方法检测,选择P/N值≥2的最大稀释度为该单抗ELISA的效价,因此判定该单抗效价为1∶102 400(见表2)。
表2 纯化的Mhr-08单抗ELISA效价
Tab.2 The ELISA titer of the purified monoclonal antibody
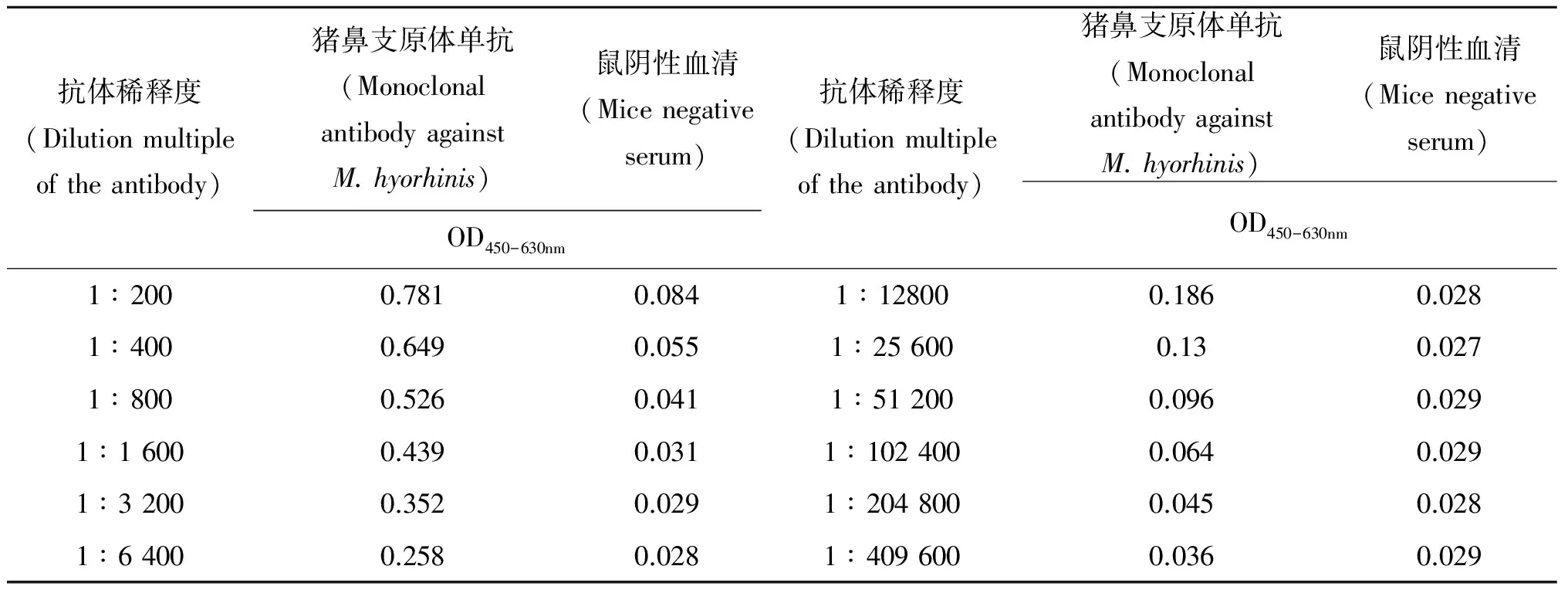
抗体稀释度(Dilutionmultipleoftheantibody)猪鼻支原体单抗(MonoclonalantibodyagainstM.hyorhinis)鼠阴性血清(Micenegativeserum)OD450-630nm抗体稀释度(Dilutionmultipleoftheantibody)猪鼻支原体单抗(MonoclonalantibodyagainstM.hyorhinis)鼠阴性血清(Micenegativeserum)OD450-630nm1∶2000.7810.0841∶128000.1860.0281∶4000.6490.0551∶256000.130.0271∶8000.5260.0411∶512000.0960.0291∶16000.4390.0311∶1024000.0640.0291∶32000.3520.0291∶2048000.0450.0281∶64000.2580.0281∶4096000.0360.029
2.4单抗特异性鉴定 将猪鼻支原体、猪肺炎支原体、絮状支原体、猪滑液支原体及大肠杆菌全菌蛋白及KM2培养基分别进行SDS-PAGE(图1A),并用该猪鼻支原体单抗做Western-blot鉴定,得出该单抗与猪鼻支原体全菌蛋白在43 kDa左右有特异性条带,且与其他支原体无交叉反应(图1B)。
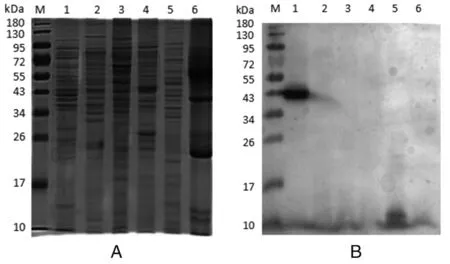
M: Protein molecular weight standard; 1: M. hyorhinis; 2: M. hyopneumoiae; 3: M. flocculare; 4: M. hyosynoviae; 5: E. coli; 6: KM2 mediumA: SDS-PAGE of the whole bacteria protein; B: Western-blot identification of specificity of the prepared monoclonal antibody图1 猪鼻支原体单抗特异性鉴定Fig.1 Specificity identification of M. hyorhinis monoclonal antibody
2.5单抗与猪鼻支原体膜蛋白反应 将猪鼻支原体全菌蛋白及膜蛋白同时进行SDS-PAGE电泳,转印后用该单抗孵育,可以看到膜蛋白与全菌蛋白一样在43 kDa处出现特异性条带。说明该单抗目的蛋白为猪鼻支原体膜蛋白。
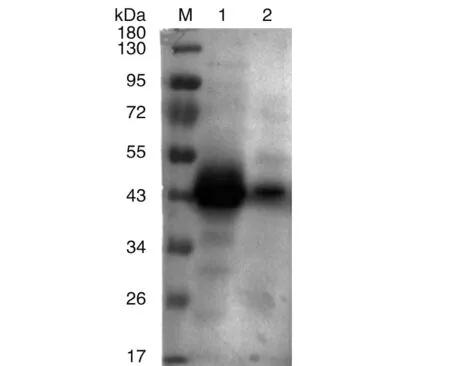
M: Protein molecular weight standard; 1: the whole M. hyorhinis protein; 2: M. hyorhinis membrane protein.图2 单抗与猪鼻支原体膜蛋白反应Fig.2 Reaction of the prepared monoclonal antibody to Mycoplasma hyorhinis membrane protein
2.6菌落免疫杂交 该单抗与转移到PVDF膜上的猪鼻支原体菌落出现特异性反应,如图3。
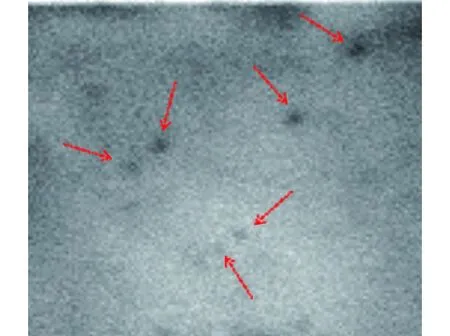
图3 单抗用于菌落免疫杂交检测(箭头表示阳性杂交菌落)Fig.3 Colony immunobinding with the prepared monoclonal antibody(arrow indicates the positive colony)
2.7间接免疫荧光鉴定 将猪鼻支原体与猪气管上皮细胞孵育6 h,洗去未结合支原体,加入该单抗检测黏附细胞的猪鼻支原体,结果显示出现特异性荧光,未感染支原体的阴性对照细胞无荧光,说明该单抗可特异性检测猪鼻支原体,如图4。
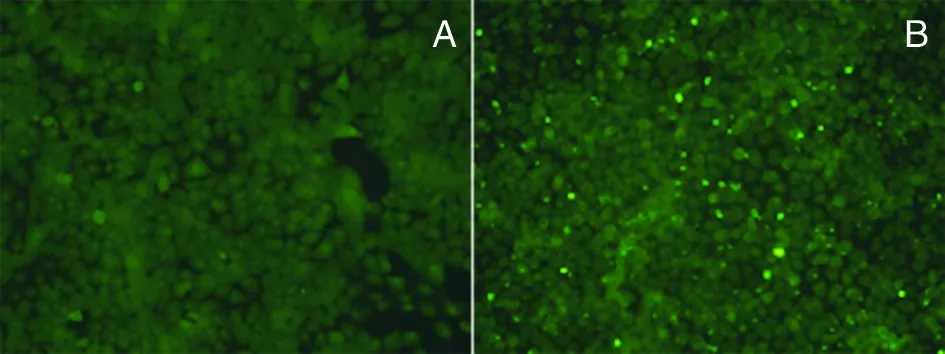
A: Negative control; B: Cytoadhesion of Mycoplasma hyorhinis图4 单抗用于间接免疫荧光检测猪鼻支原体黏附猪气管上皮细胞(400×)Fig.4 Indirect immunofluorescence detection of Mycoplasma hyorhinis adhesion to swine tracheal epithelial cells with the prepared monoclonal antibody(400×)
3 讨 论
猪鼻支原体在猪场感染率极高,常与猪繁殖与呼吸综合征病毒、猪圆环病毒2型等病原混合感染,造成严重的猪呼吸道综合征,致使断奶仔猪的死亡率显著升高,给我国养猪业的发展造成巨大的经济损失[14-15]。此外,猪鼻支原体还与多种人类肿瘤的发生有关,属于人兽共患性病原体。目前,猪鼻支原体病的诊断技术尚不完善,也没有商业化的试剂盒,研制高特异性高灵敏度的抗体对诊断具有重要意义,同时也是该病的致病机理研究的必要工具。
通过大肠杆菌原核表达系统表达蛋白免疫小鼠是制备单克隆抗体的常用方法,但是由于对猪鼻支原体表面蛋白的了解十分有限,本实验利用超声波裂解破碎的猪鼻支原体全菌蛋白免疫小鼠制备单抗。由于支原体体外培养对营养要求复杂,需要在培养基中加入血清提供支原体生长所需要的营养成分,为排除血清干扰,本研究制备抗原时,利用PBS将抗原离心洗涤3次,将支原体充分洗涤干净,避免产生针对血清的单抗。
猪的不同支原体之间存在许多交叉抗原,比较基因组学分析发现猪肺炎支原体、猪鼻支原体和絮状支原体之间共同编码序列占总数的58.9%以上[16]。为获得只针对猪鼻支原体的特异性单抗,在杂交瘤细胞株筛选的过程中,以猪鼻支原体全菌蛋白为包被抗原,同时将猪肺炎支原体、絮状支原体、猪滑液支原体的全菌蛋白作为对照,筛选仅与猪鼻支原体反应的细胞。最终制备的单抗纯化后再次经Western-blot鉴定,证明与猪其他支原体、大肠杆菌及KM2培养基均无交叉反应,为猪鼻支原体特异性单抗。支原体缺乏细胞壁,菌体外层由细胞膜构成,细胞膜表面的膜脂蛋白是支原体与宿主互作的关键成份,也是诊断技术和疫苗研制的重要靶标。本试验获得的单克隆抗体可以有效地和猪鼻支原体表面膜蛋白结合,菌落免疫杂交结果同样也证实其可以有效结合猪鼻支原体表面,膜抗原单抗的获得对于猪鼻支原体致病机制和诊断技术研究而言有重要帮助。
本研究成功制备了1株针对猪鼻支原体的单克隆抗体,Western-blot证明,该单抗特异性好,仅与猪鼻支原体反应,与猪其他支原体及培养基不反应,且为猪鼻支原体的膜蛋白抗体,成功应用于菌落免疫杂交、间接免疫荧光等试验,该单抗的获得为猪鼻支原体病原诊断、致病机理的研究提供了实用工具。
[1] Lu CP.Veterinary microbiology[M]. Beijing: China Agriculture Press, 2013:236.(in Chinese)
陆承平. 兽医微生物学[M].北京:中国农业出版社,2013:236.
[2] Duncan JR, Ross RF. Experimentally inducedMycoplasmahyorhinisarthritis of swine:pathologic response to 26th postinoculation week[J]. Am J Vet Res, 1973, 34 (3): 363-366.
[3] Friis NF. A serologic variant ofMycoplasmahyorhinisrecovered from the conjunctiva of swine[J]. Acta Vet Scand, 1976, 17 (3): 343-353.
[4] Gois M, Kuksa F. Intranasal infection of gnotobiotic piglets withMycoplasmahyorhinis: differences in virulence of the strains and influence of age on the development of infection[J]. Zentralbl Veterinarmed B, 1974, 21 (5): 352-361.
[5] Lin JH, Chen SP, Yeh KS, et al.Mycoplasmahyorhinisin Taiwan: diagnosis and isolation of swine pneumonia pathogen[J]. Vet Microbiol, 2006, 115 (1-3):111-116.DOI:10.1016/j.vetmic.2006.02.004
[6] Morita T, Fukuda H, Awakura T, et al. Demonstration ofMycoplasmahyorhinisas a possible primary pathogen for porcine otitis media[J]. Vet Pathol, 1995, 32 (2): 107-111.DOI:10.1177/030098589503200202
[7] Morita T, Ohiwa S, Shimada A, et al. Intranasally inoculatedMycoplasmahyorhiniscauses eustachitis in pigs[J]. Vet Pathol, 1999, 36 (2): 174-178.DOI:10.1354/vp.36-2-174
[8] Namiki K, Goodison S, Porvasnik S, et al. Persistent exposure toMycoplasmainduces malignant transformation of human prostate cells[J]. PLoS One, 2009, 4(9): e6872.DOI: 10.1371/journal.pone.0006872
[9] Ma HC, Ma H, Zhang YL,et al. Detection and confirmation ofMycoplasmahyorhinisin gastric carcinoma specimens by culture and PCR[J]. Chin J Zoonoses, 2003,19(2):31-33.(in Chinese)
马华崇, 马泓, 张艳丽,等.胃癌组织中猪鼻支原体的分离培养与鉴定[J]. 中国人兽共患病杂志, 2003,19(2):31-33.
[10] Duan H, Qu L, Shou C. Persistent exposure toMycoplasmainducesmalignant transformation of human prostate cells[J]. Cancer Cell Int, 2014, 14(1): 135.DOI: 10.1371/journal.pone.0006872
[11] Bai FF, Wu YZ, Jin MM et al. Establishment and application of nested PCR assay for detection ofMycoplasmahyorhinis[J]. Chin J Vet Sci, 2013,33(7):1007-1010. (in Chinese)
白方方,武昱孜,靳蒙蒙,等. 巢式PCR检测猪鼻支原体方法的建立及应用[J]. 中国兽医学报,2013,33(7):1007-1010.
[12] Wang T, Zhao ML, Sun WD. Establishment of indirect hemagglutination and ELISA for detection ofMycoplasmahyorhinis[J]. Chin Livestock Poult Breed, 2012,11:31-33.(in Chinese)
王涛,赵满丽,孙卫东. 猪鼻支原体间接血凝及ELISA检测方法的初步建立[J]. 中国畜禽种业,2012,11:31-33.
[13] Maingi JW,Xiong QD,Wei YN,et al.Detection of respiratory pathogensMycoplasmahyorhinisandMycoplasmahyopneumoniaefrom clinically infected porcine using nested PCR in Jiangsu Province, China[J]. Chin J Zoonoses, 2014, 30(8). DOI: 10.3969/cjz.j.issn.1002-2694.2014.08.006
[14] Lee JA, Oh Y, Hwang MA, et al.Mycoplasmahyorhinisis a potential pathogen of porcine respiratory disease complex that aggravates pneumonia caused by porcine reproductive and respiratory syndrome virus[J]. Vet Immunol Immunopathol, 2016, 177: 48-51.DOI: 10.1016/j.vetimm.2016.06.008
[15] Chen DJ. Studies on synergetic pathogenicity of co-infection with porcine circovirus type 2 andMycoplasmahyorhinis[D]. Beijing:Chin Academ Agricul Sci, 2015.(in Chinese)
陈冬杰. 猪圆环病毒2型与猪鼻支原体共感染协同致病性研究[D].北京:中国农业科学院,2015.
[16] Siqueira FM, Thompson CE, Virginio VG, et al. New insights on the biology of swine respiratory tract mycoplasmas from a comparative genome analysis[J]. BMC Genomics, 2013, 14: 175.DOI: 10.1186/1471-2164-14-175
PreparationandidentificationofamonoclonalantibodyagainstMycoplasmahyorhinis
TIAN Rui-yu1,4, XIONG Qi-yan1, NI Bo1, WANG Jia1,2, WEI Yan-na1, FENG Zhi-xin1, SHAO Guo-qing1,3
(1.InstituteofVeterinaryMedicine,JiangsuAcademyofAgriculturalSciences/KeyLaboratoryofVeterinaryBiologicalEngineeringandTechnology,MinistryofAgriculture/NationalCenterforEngineeringResearchofVeterinaryBio-products,Nanjing210014,China;2.KeyLaboratoryofFoodQualityandSafetyofJiangsuProvince-StateKeyLaboratoryBreedingBase,Nanjing210014,China;3.JiangsuCollaborativeInnovationCenterforMeatProduction,ProcessingandQualityControl,Nanjing210095,China;4.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China)
The aim of this study was to produce a monoclonal antibody againstMycoplasmahyorhinis, which would be useful in the diagnosis and pathogenesis researches ofM.hyorhinis. BALB/c mice were immunized with whole cell protein ofM.hyorhinis, and then the monoclonal antibody (McAb) was prepared by hybridoma technique. The isotype of the McAb was identified, and then the titer and specificity were analyzed. The prepared McAb was used to detectM.hyorhinisin the colony immunoboltting assay and indirect immunofluorescence assay. A hybridoma cell line was obtained, and was named Mhr-08. The McAb belonged to IgG1 isotype, and the light chain was κ type. The titer was detected to be 1∶102 400 by ELISA. The result of Western-blot indicated that this McAb strongly reacted to a 43 kDa protein ofM.hyorhinis, without cross-reaction with other swine mycoplasmas,Escherichiacolior KM2 medium. It revealed that the McAb recognized a surface membrane protein and was successfully applied to detectM.hyorhinisin colony immunoboltting assay. The mycoplasmas bound to the tracheal epithelial cells was successfully detected by using this McAb in indirect immunofluorescence assay. In conclusion, a McAb againstM.hyorhiniswas successfully prepared, which provides as a useful tool for the diagnosis and pathogenesis researches.
Mycoplasmahyorhinis; monoclonal antibody; specificity
s: Shao Guo-qing, Email: gqshaonj@163.com;Xiong Qi-yan, Email: qiyanxiongnj@163.com
10.3969/j.issn.1002-2694.2017.11.003
国家重点研发计划(No. 2016YFD0500702)
邵国青,Email:gqshaonj@163.com;
熊祺琰,Email: qiyanxiongnj@163.com
1.江苏省农业科学院兽医研究所·农业部兽用生物制品工程技术重点实验室·国家兽用生物制品工程技术研究中心,南京 210014;
2.省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室,南京 210014;
3.江苏省肉类生产与加工质量安全控制协同创新中心,南京 210095;
4.南京农业大学动物医学院,南京 210095
R375
A
1002-2694(2017)11-0962-05
Supported by the National Key Research and Development Plan(No. 2016YFD0500702)
2017-04-17编辑王晓欢
