不同产地石上柏抗氧化和抗肿瘤活性比较
2017-12-12*
*
1.遵义医学院医学与生物学研究中心,贵州 遵义 563099;2.遵义医学院药学院,贵州 遵义 563099
药物研究
不同产地石上柏抗氧化和抗肿瘤活性比较
李三华1黎丹2蒋永梅2袁仕梦2魏玮2王刚2*
1.遵义医学院医学与生物学研究中心,贵州 遵义 563099;2.遵义医学院药学院,贵州 遵义 563099
目的比较不同产地的石上柏抗氧化和抗肿瘤活性的差异。方法将采集于广西、贵州、重庆和四川的十批石上柏样品用乙醇提取后再以石油醚、乙酸乙酯和正丁醇萃取。采用DHHP自由基清除、ABTS自由基清除和FRAP法测定三种萃取物的抗氧化活性;以肺癌A549和肝癌SMMC-7721细胞的增殖活性测定三种萃取物的抗肿瘤活性。结果10批样品中,贵州产地的石上柏的抗氧化活性最高,广西产地的石上柏抗肿瘤活性最高;乙酸乙酯萃取物的2种生物活性均高于其他2种萃取物(P<0.05)。结论石上柏的乙酸乙酯萃取物具有良好的抗氧化和抗肿瘤活性,不同产地的石上柏生物活性有一定差异。
石上柏;双黄酮;抗氧化;抗肿瘤
中药石上柏来自于卷柏科植物深绿卷柏(SelaginelladoederleiniiHieron)的全草,又名大叶菜、深绿卷柏和地侧柏等,主要产于我国南方地区;其味甘中带涩、性温平,主要含有双黄酮类、生物碱、有机酸等活性成分[1-5];具有清热解毒、抗癌止血等多种功效,临床中主要用于治疗肺癌、鼻咽癌、慢性肝炎和风湿等疾病[6-8]。石上柏在临床上有广泛的使用,但由于产地或来源不同,其活性成分的种类或含量具有差异性而导致药效的不同。研究采集了贵州、四川、重庆及广西4省市的10批次石上柏药材,以石油醚、乙酸乙酯、正丁醇三种不同极性的试剂进行活性物质萃取,对不同萃取物进行抗氧化和抗肿瘤活性检测分析,为中药石上柏的合理使用提供理论依据。
1 材料与方法
1.1 材料与试剂 石上柏(SelaginelladoederleiniiHieron)采自于贵州、四川、重庆和广西,经遵义医学院药学院天然药物研究所杨建文副教授鉴定为正品(表1)。葡聚糖凝胶色谱填料、C18柱层析填料(北京绿百草公司);硅胶GF254(青岛海洋化工厂);乙醇、石油醚、乙酸乙酯、正丁醇、硫酸等化学试剂均为分析纯(贵州遵义双巨化学试剂公司);胎牛血清(杭州四季青公司);1640培养基(Hyclon);CCK8细胞增殖检测试剂盒(上海碧云天生物技术有限公司);2,2-二苯基-1-苦基肼(DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)等分析试剂(国药集团试剂公司)。
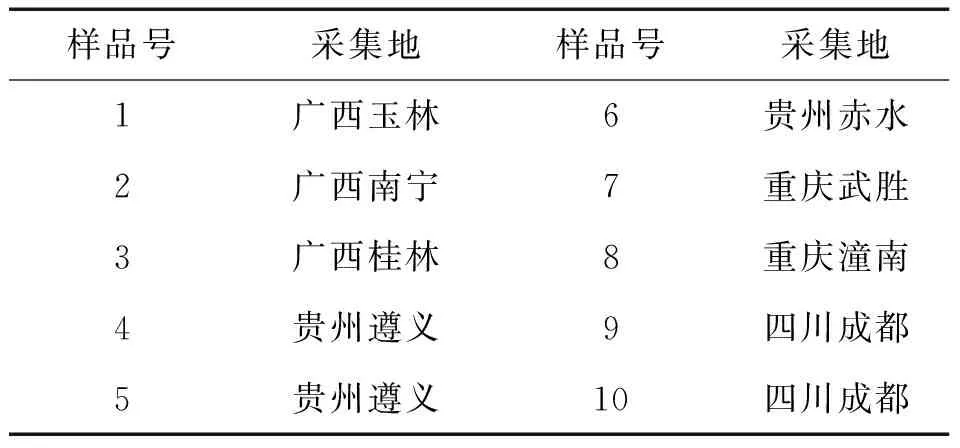
表1 石上柏不同产地来源
1.2 仪器 MF-10A型旋转蒸发仪(日本东京理化公司);400MHz型核磁共振仪(瑞士Bruker公司);MAT95XP高分辨质谱仪(美国Thermo公司);CKX41型倒置显微镜(日本奥林巴斯公司);WD-9417B酶标仪(苏州奇乐电子科技有限公司);旋转蒸发仪(西安太康生物科技有限公司);5810R型高速离心机(德国Eppendorff公司);CO2恒温培养箱(美国Forma公司);SCV4AI型超净工作台(美国Shellab公司)。
1.3 样品制备 称取10个产地石上柏药材各200g,粉碎,采用10倍量75%乙醇提取3次,每次1h,过滤,合并提取液,提取液在40℃下旋转蒸发浓缩,浓缩液用适量热水溶解,再经石油醚、乙酸乙酯、正丁醇依次萃取、浓缩,分别得到石油醚、乙酸乙酯和正丁醇萃取物。取3种萃取物用95%乙醇稀释,分别配置成25、50、100、150、200、250、300 μg/mL,4℃存放备用。
1.4 DPPH自由基清除活性测定 取0.5 mL不同浓度的样品溶液分别加入0.2 mmol/L的DPPH乙醇溶液各2 mL,溶液充分混合并室温避光反应30 min,在517 nm处测定样品的吸光值(Ax),以0.5 mL乙醇代替样品与DPPH乙醇溶液反应作为空白对照组,吸光值为(A0)。按照公式:清除率=(A0-Ax)/A0×100%,计算不同浓度的样品对DPPH自由基的清除率;根据自由基清除率作线性回归方程,计算每个样品清除自由基的IC50值。实验重复3次。
1.5 ABTS自由基清除活性测定 用蒸馏水将ABTS配制成7 mmol/L储备液,与140 mmol/LK2S2O8溶液等体积混匀,在室温下避光静置反应过夜;然后用磷酸盐缓冲液稀释反应完成的ABTS+·溶液,使其在734 nm下吸光值为(0.700±0.020)。将0.4 mL不同浓度样品溶液加入2.5 mLABTS+·溶液,在室温下放置10 min后734 nm测定样品吸光值(Ax);以0.4 mL乙醇代替样品与ABTS+·溶液反应作为空白对照组,吸光值为(A0);按以下公式计算ABTS自由基清除率:清除效率=(A0-Ax)/A0×100%,根据自由基清除率作回归方程,计算各样品清除自由基的IC50值。实验重复3次。
1.6 总抗氧化能力(FRAP法) 测定 0.5 mL不同浓度样品溶液加入1.18 mL TPTZ工作液(由0.13mol/L醋酸盐缓冲液25 mL,10 mmol/L TPTZ溶液2.15 mL,20 mmol/LFeCl3溶液215 mL组成),混匀后在37℃条件下反应10 min;在593 nm处测定样品吸光度,以1.0 mmol/LFeSO4为标准,样品抗氧化活性以达到同样吸光度所需的FeSO4的摩尔质量表示。实验重复3次。
1.7 抗肿瘤活性测定 取人肺腺癌A549和人肝癌SMMC-7721细胞在1640培养基中(含有L-谷氨酰胺2nmol/L,10%胎牛血清,链霉素100IU/mL和青霉素100IU/mL)于37℃、5%CO2常规培养。取生长旺盛细胞接种于96孔板中,每孔细胞8000个;石上柏萃取物以DMSO溶解,培养基稀释;细胞培养24h后加入石上柏萃取物,设立6个浓度组,使萃取物终浓度分别为25、50、100、200、400、800 μg/mL,以加入相同终体积的DMSO作为溶媒对照组;药物作用48h后加入每孔10 μLCCK8试剂继续培养2 h后于560 nm测定实验组吸光值(Ax)和对照组吸光值(A0)。按下列公式抑制率(%)=(A0-Ax)/Ax×100%计算不同产地石上柏萃取物对肿瘤细胞的抑制率;根据每种萃取物的抑制率计算抑制肿瘤细胞的IC50值。实验重复3次。
1.8 数据处理 数据采用SPSS20.0进行统计,采用多因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 抗氧化活性
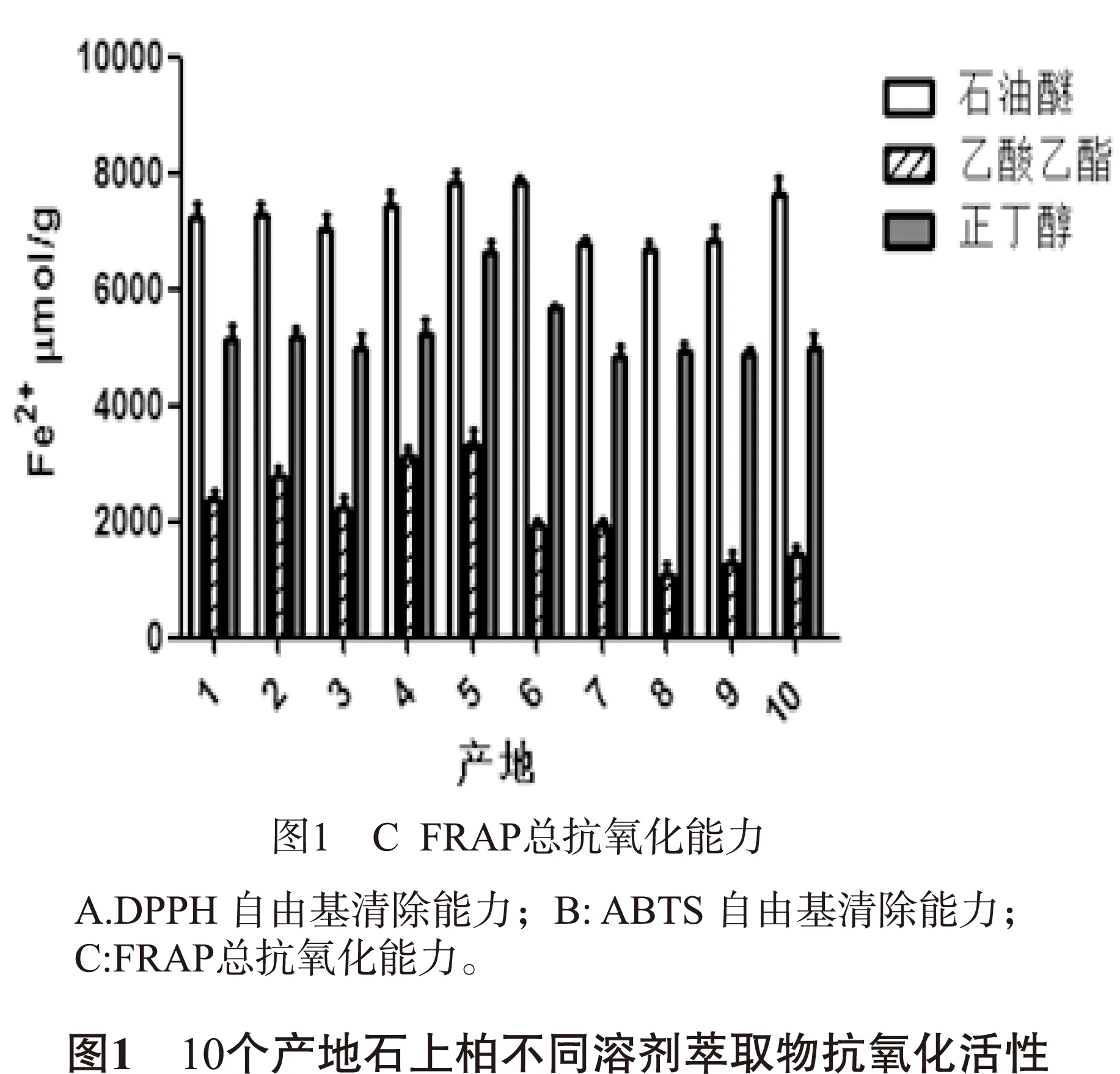
2.1.1 DPPH自由基清除能力 由图1A可知,6号产地石上柏清除能力最强(其石油醚、乙酸乙酯和正丁醇萃取物的IC50分别为74.14 μg/mL、32.24 μg/mL和49.43 μg/mL);7号产地石上柏清除能力最弱(其石油醚、乙酸乙酯和正丁醇萃取物的IC50分别为205.44 μg/mL、89.32 μg/mL和136.96 μg/mL)。
2.1.2 ABTS自由基清除能力 由图1B可知,5号产地石上柏清除能力最强(其石油醚、乙酸乙酯和正丁醇萃取物的IC50分别为133.29 μg/mL、53.32 μg/mL和88.86 μg/mL);10号产地石上柏清除能力最弱(其石油醚、乙酸乙酯和正丁醇萃取物的IC50分别为261.39 μg/mL、104.56 μg/mL和174.26 μg/mL)。
2.1.3 FRAP法总抗氧化能力 由图1C可知,5号产地石上柏总抗氧化能力最强(其石油醚、乙酸乙酯和正丁醇萃取物的FRAP值分别为3219.46 μmol/g、8536.24 μmol/g和5597.31 μmol/g);8号产地石上柏抗氧化能力最弱(其石油醚、乙酸乙酯和正丁醇萃取物FRAP值分别为939.46 μmol/g、7416.34 μmol/g和4787.15 μmol/g)。
不同产地的石上柏的抗氧化能力不同,不同试剂萃取物的抗氧化能力也有差异,来自贵州的4-6号石上柏样品抗氧化能力较强,而来自重庆和四川7-10号石上柏抗氧化能力较弱;各个样品不同溶剂萃取物抗氧化效果则均是乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物(P<0.05)。

2.2 抗肿瘤活性 由图2可知,对于肺癌A549细胞,3号产地石上柏抑制能力最强(其石油醚、乙酸乙酯和正丁醇萃取物IC50分别为133.56 μg/mL、23.58 μg/mL和92.44 μg/mL);9号产地石上柏抑制能力最弱(其石油醚、乙酸乙酯和正丁醇萃取物IC50分别为323.57 μg/mL、57.13 μg/mL和223.94 μg/mL)。对于肝癌SMMC-7721,2号产地石上柏抑制能力最强(其石油醚、乙酸乙酯和正丁醇萃取物IC50分别为142.03 μg/mL、25.07 μg/mL和98.30 μg/mL);7号产地石上柏抑制能力最弱(其石油醚、乙酸乙酯和正丁醇萃取物IC50分别为434.82 μg/mL、76.77 μg/mL和300.94 μg/mL)。
产地广西的1-3号石上柏样品抗肿瘤能力较强,产地重庆和四川的7-10号石上柏样品抗肿瘤能力较弱;各样品不同溶剂萃取物的抗肿瘤效果仍然均是乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物(P<0.05)。

3 讨论
研究中,产地贵州的石上柏的抗氧化活性优于广西和川渝地区的,而广西的石上柏的抗肿瘤能力则优于贵州和川渝地区的;无论是抗氧化或抗肿瘤功效,乙酸乙酯萃取物的作用最为明显。研究发现,石上柏的乙酸乙酯萃取物的主要成分是穗花杉双黄酮、银杏杉双黄酮、橡胶树双黄酮等双黄酮类物质,这些双黄酮物质具有抗肿瘤活性[9-14]。一些具有抗肿瘤功效的药材也具有抗氧化作用,比如姜黄、白芍、虎杖等对DHHP具有非常强的清除作用,且这些药材都具有较高含量的黄酮类物质[15];黄酮类物质则是公认的良好的抗氧化物质,由此推测天然抗氧化剂与抗肿瘤具有一定相关性。研究中不同产地的石上柏的乙酸乙酯提取物显示出较强的抗氧化作用和抗肿瘤作用,但两种功效的强弱并非完全重叠,这可能与不同产地石上柏中的单体双黄酮物质的种类与含量存在一定的差异,值得进一步探索研究。
[1]黎霜, 黄可龙. 深绿卷柏的研究进展[J]. 时珍国医国药, 2010, 21 (10): 2637-2639.
[2]戴卫波, 梅全喜, 曾聪彦. 石上柏化学成分、药理作用及临床应用研究进展[J]. 中国药业, 2011, 20(2): 15-16.
[3]赵倩, 王彩霞, 李艳玲, 等. 石上柏化学成分及生物活性的研究[J]. 中草药, 2013, 44(23):3270-3275.
[4]Wang G, Yao S, Cheng L, et al.Antioxidant and anticancer effection of the Volatile Oil from Various Habitats ofSelaginelladoederleiniiHieron[J]. Technology and Health Care,2015,23 Suppl 1 (s1):S21.
[5]Dan Li, Yan Qian, Yu JiaTian, et al. Optimization of Ionic Liquid-Assisted Extraction of Biavonoids fromSelaginelladoederleiniiand Evaluation of Its Antioxidant and Antitumor Activity[J]. Molecules,2017, 22(5): 586-602.
[6]南京中医药大学.中药大词典[M].2版.上海:上海科学技术出版社, 2006:831.
[7]郭振南. 肺癌的药膳食疗方[J].药膳食疗研究,2001(3):25.
[8]周同冲, 林晓丹, 宋先璐, 等. 中药石上柏联合放疗治疗晚期鼻咽癌的长期疗效观察[J]. 中国医院药学杂志, 2008, 28(24): 2122-2123.
[9]孙颖桢, 陈科力, 殷丹, 等. 细叶卷柏双黄酮化合物对肝癌细胞Bel-7402的抑制作用[J]. 中国医院药学杂志, 2009, 29(14): 1156-1158.
[10]孙颖桢, 陈科力, 刘震. 江南卷柏总黄酮对HT-29细胞增殖及COX-2mRNA表达的抑制作用[J]. 中成药, 2010, 32(9): 1590-1591.
[11]黄建勇, 李少光, 李宇翔, 等. 石上柏抗肿瘤活性部位及其化学成分研究[J]. 福建医科大学学报, 2013, 47(1): 1-5.
[12]齐冰, 包永睿, 孟宪生,等. 正交试验量效比对法优选卷柏抗SMMC-7721肝肿瘤组分总黄酮的提取工艺[J]. 中国实验方剂学, 2014, 20 (2): 1-4.
[13]克迎迎, 袁培培, 翟英英,等. 卷柏总黄酮及穗花杉双黄酮对HepG2细胞胰岛素抵抗的改善作用[C]//2013年中国药学大会暨第十三届中国药师周, 2013.
[14]Wang JZ, Li J, Zhao P, et al. Antitumor Activities of Ethyl Acetate Extracts fromSelaginelladoederleiniiHieron In Vitro and In Vivo and Its Possible Mechanism[J]. Evidence-based Complementary and Alternative Medicine,2014,2014(24):8657114.
[15]张新国, 刘英娟, 曹心张, 等. 22种常见抗肿瘤中草药的抗氧化活性研究[J].中医药学报, 2015, 43 (5): 31-35.
ComparisonofAntioxidationandAntitumorActivityofSelaginelladoederleiniiHieronfromDifferentHabitats
LI Sanhua1LI Dan2JIANG Yongmei2YUAN Shimeng2WEI Wei2WANG Gang2*
1. Research Center for Biology and Medicine, Zunyi Medical University, Zunyi 563099,China;2. School of Pharmacy, Zunyi Medical University, Zunyi 563099,China
ObjectiveTo investigate the difference of antioxidation and antitumor activity ofSelaginelladoederleiniiHieron which harvested from different habitats.Methods10 batches ofSelaginelladoederleiniiHieronwere collected from GuangXi, GuiZhou,ChongQing and SiChuan and then extracted by alcohol followed by further extracted with petroleum benzin,ethyl acetate and n-butyl alcohol in turn. Antioxidation activity of three kinds of extract was estimated by the clearance capacity of DHHP and ABTS free radical together with reduction capacity by FRAP method.Antitumor activity was estimated through the proliferation of A549 and SMMC-7721 cancer cells.ResultsAmong the 10 batches ofSelaginelladoederleiniiHieron ,theSelaginelladoederleiniiHieron from GuiZhou had the highest Antioxidation activity while which from Guangxi had the highest Antitumor activity. These two bioactivities ofethyl acetate extract were higher than which of other two kinds of extract(P<0.05).ConclusionThe ethyl acetate extract ofSelaginelladoederleiniiHieron has good antioxidation and antitumor activity. Differences of bioactivity exist among theSelaginelladoederleiniiHieron which derived from different habitats.
SelaginelladoederleiniiHieron; Biflavones; Antioxidation; Antitumour
国家自然科学基金地区基金项目(NO.:81302639)。
李三华(1979-),女,硕士研究生,副教授,研究方向为天然活性物质抗肿瘤研究。E-mail:zyzmclsh@163.com
王刚(1977-),男,博士研究生,教授,研究方向为药用植物与抗肿瘤研究。E-mail:wg8855350@163.com
R285.5
A
1007-8517(2017)22-0011-04
2017-09-29 编辑:邓佳丽)
