人参水提取物对羟自由基的抑制作用
2017-12-12
辽宁中医药大学药学院,辽宁 大连 1166001
人参水提取物对羟自由基的抑制作用
李红艳倪雪娇张旭陈宏伟
辽宁中医药大学药学院,辽宁 大连 1166001
目的比较人参不同水溶性提取物对羟自由基(·OH)的抑制作用。方法运用正交试验设计,提取人参水溶性有效部位;采用水杨酸法测定·OH清除率;通过方差分析和样本聚类分析优选·OH抑制剂提取工艺。结果共提取得到16个样品,其中12号样品·OH清除率最大,在1g/L浓度下,其抑制率可达105.08%。结论人参水提取物中含有羟自由基清除剂,其最佳提取工艺为:pH8,料液比1∶10,4℃提取3次,每次12h。
人参水提取物;正交试验;羟自由基;抗氧化
人参(PanaxginsengC.A.Meyer.)是我国传统中草药,具有抗氧化、增强免疫、神经保护等多种药理作用[1-2]。总结文献发现,人参多种作用都与其抗氧化活性密切相关,有关人参有效成分的抗氧化活性已有多篇报道[3-5],作者前期也报道了人参的抗氧化作用[2],并对多种抗氧化酶尤其是人参SOD进行了大量研究。然而,目前报道多是对某种成分进行抗氧化研究,很少进行活性导向下的有效成分分离,对人参中·OH抑制剂的提取分离实验者尤其未见报道。笔者通过正交实验制备不同提取条件下的人参水提取物,并测定其·OH清除率,为探索人参中·OH抑制剂的提取工艺及其活性导向下的有效成分分离奠定实验基础。
1 材料与方法
1.1 材料与试剂 生晒参购自阳光大药房,产地为吉林长白山,经本校鉴定教研室张慧教授鉴定,为4~5年生园参;BP-211D电子天平(Sartorius);ALPHA12冷冻干燥机(Christ);MR-96A型酶标仪(深圳迈瑞生物医疗电子股份有限公司)。
1.2 方法
1.2.1 人参水提取物的制备 生晒参,粉碎,平均分成16份,每份0.5 g。按照正交设计助手Ⅱv3.0L16(45)正交设计表,采用缓冲溶液(0.2MNa2HPO4-柠檬酸缓冲液,pH4.0;0.2MNa2HPO4-NaH2PO4缓冲液,pH6.0;0.2MNH4Cl-氨水缓冲液,pH8.0、pH10.0)提取,考察的因素水平如下:pH4、6、8、10;料液比1∶5、1∶10、1∶15、1∶20(m∶v);提取时间6、12、18、24h;提取温度4、20、40、60℃;提取次数1、2、3、4次。各提取液4℃5000rpm离心10 min,收集上清,合并各次上清液,0.45μM滤膜过滤,各留取1 mL用于实验,标记为1-16号样品,其余液体冷冻干燥后,-20℃保存。
1.2.2 羟自由基清除能力测定 参照文献[6],采用Fenton法,于96孔板中分别加入FeSO4(6mM)、样品、H2O2(6mM)各20 μL,静置10 min,加入水杨酸溶液(6mM)20 μL,静置30min,测定510 nm处的吸光度A值,以蒸馏水作空白,每个样品3个复孔,计算羟自由基清除率。清除率=A空-(A样-A对)/A空。A空为不加样品的A值,A对为不加水杨酸时的A值。
1.2.3 样本聚类分析 以样品提取率和·OH清除率为聚类要素,运用SPSS13.0软件,对16个样品进行分析,采用离差平方和法(Ward'Method)计算类间距离。
1.2.4 验证性实验 根据羟自由基清除率,优选提取工艺,并按此工艺,重复试验3次,按照上述方法测定并计算提取液羟自由基清除能力(1g/L),进行验证性实验。
1.2.5 数据统计分析 采用正交设计助手Ⅱv3.0进行数据统计分析,以R值最小列为误差项,进行数据显著性检验,P<0.05表示差异有统计学意义。
2 结果
2.1 人参水提取物的制备 利用正交实验,共制备得到16个样品,各样品的提取条件及提取率见表1。
2.2 人参水提物对羟自由基的抑制作用 利用Fenton法测定各样品的·OH清除率,并根据样品浓度及其实验用体积,折算出各样品单位浓度即1g/L(提取物浓度)下的羟自由基清除率(表1);同时,以·OH清除率(提取物1g/L)为评价指标,对实验结果进行方程分析(表2)。由表1可见,12号和14号样品羟自由基清除率最高且相近;由表2可见,提取温度(D)和料液比(B)对实验结果影响显著(P<0.05)。

表1 人参水提取物的羟自由基清除率
注:A→E五因素的四个水平(1→4)分别为:pH4、6、8、10;料液比(倍)5、10、15、20;提取时间(h)6、12、18、24;提取温度(℃)4、20、40、60;提取次数1、2、3、4次。样品提取率=冻干后样品质量/用于冻干的样品体积×样品总体积/0.5×100%
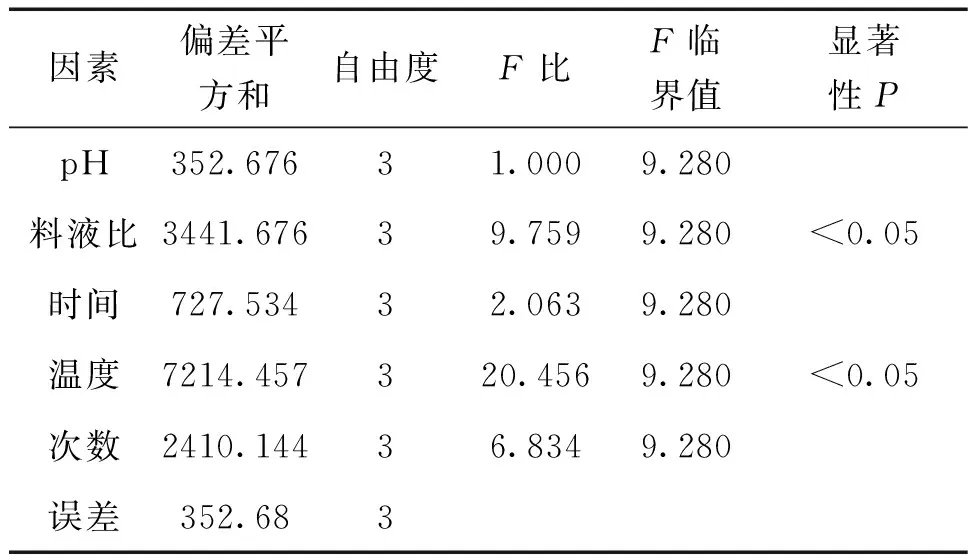
表2 羟自由基清除率方差分析
2.3 16个样品的聚类分析 为了方便比较各样品间的差距,对16个样品以提取率、·OH清除率(提取物)和·OH清除率(生药)为评价指标进行聚类分析,结果见图1。·OH清除率%(生药,1g/L)等于·OH清除率%(提取物,1g/L)与样品提取率的乘积(结果未列)。由图1可见,当距离为5时,16个样品被聚为2类,即12、14、7聚为一类,其余聚为1类,这与单纯以·OH清除率(提取物)为评价指标的聚类结果(未列)一致。比较各样品的提取条件,不难看出,低温和弱碱性pH是获取较高活性·OH抑制剂的共性条件。

综合图1和表1,12号(A3B4C2D1E3)和14号(A4B2C3D1E4)样品羟自由基清除率最高且相近;同时,据表1直观分析结果,A3与A4、B4与B2、C2与C3接近,考虑到成本的节约和工艺的可行性,最终确定人参水提物中·OH抑制剂的最佳提取条件是A3B2C2D1E3,即pH8,料液比1∶10,4℃提取3次,每次12h。
2.4 验证性实验 按照上述优选的提取方法A3B2C2D1E3,精密称取0.200g生晒参粉,3次浸提液合并,实验平行3份,所得样品羟自由基清除率分别为100.64%、98.25%、94.38%,平均值97.76%,表明该提取工艺下的人参水提取物羟自由基抑制率较高且稳定可行。
3 讨论
前期研究表明,人参中含有多种抗氧化酶[7],其中人参SOD已被分离得到[8],其体外活性已有多篇报道[5-7],对·OH抑制剂的研究目前未见报道。论文参考前期抗氧化酶的提取工艺,考虑到中医的传统用药习惯和人类追求健康饮食的心里,避免使用有机溶剂,采用缓冲溶液提取法制备人参水溶性提取物,并基于正交实验能够较全面地考察多因素多水平,具有实验次数少、方法简便、结果准确可靠等优点。运用正交试验设计优选·OH抑制剂的提取工艺,结果表明,人参水提物中含有·OH抑制剂,其活性受温度、料液比、pH等影响,尤其受温度影响最大,以低温活性较高。根据实验结果,并参考前期研究结果[7],推测该·OH抑制剂很可能是一种抗氧化酶类,如过氧化氢酶(CAT)。
比较各提取物·OH清除率,以12号样品最高(105.08%);但比较相同生药浓度(1g/L)下各样品·OH清除率,则4号样品最高(3.11%)。因4号样品的提取率(6.72)是12号样品(1.67)的4倍(表1),但其·OH清除率(1g/L生药)仅为12号样品的1.8倍(3.11%4号,1.75%12号),笔者认为,12号样品的提取条件更有利于获得高活性·OH抑制剂。综合实验结果,作者以提取物·OH清除率为评价指标,确定A3B2C2D1E3为最佳提取工艺。当然,本实验仅是对·OH抑制剂提取工艺的初步研究,更为理想的提取方法还需要在此基础上,缩小各水平的跨度做进一步探索。另外,本实验为实验室小试,放大生产后,提取条件可能会发生变化,其活性导向下的有效成分的分离纯化尚需进一步研究。
[1]江玉翠, 毕蕾, 高静, 等. 人参水提液通过免疫调节TAMs影响A549增殖[J]. 中成药, 2016, 38(8): 1689-1695.
[2]Li H, Song J, Zhang J, et al. Ginseng Protein Reverses Amyloid Beta Peptide and H2O2 Cytotoxicity in Neurons, and Ameliorates Cognitive Impairment in AD Rats Induced by a Combination of D‐Galactose and AlCl3[J]. Phytotherapy Research, 2017, 31 (2): 284-295.
[3]张语迟, 李赛男, 刘春明, 等. 人参叶提取物的提取工艺及抗氧化活性评价研究[J]. 中华中医药学刊, 2017, 35 (2): 326-329.
[4]姚姝凤, 高建强, 成江, 等. 响应面法优化土人参根中总黄酮提取及其抗氧化活性研究[J]. 中国现代应用药学, 2017, 34 (6): 858-863.
[5]万茜淋, 焦丽丽, 马林, 等. 人参花多糖抗氧化活性研究[J]. 食品安全导刊, 2016 (6): 146-148.
[6]李启艳, 祝清芬, 刘春霖, 等. 党参多糖分离纯化及抗氧化活性研究[J].中草药, 2017, 48 (5): 907-912.
[7]李红艳. 人参蛋白活性研究[D].长春:长春中医药大学, 2010.
[8]Li H, Zhao Y, Cao Y, et al. Purification and characterization of a superoxide dismutase from Panax ginseng[J]. Biomedical Chromatography, 2010, 24 (11):1203-1207.
[9]姚刚, 刘宏, 欧阳昌汉. 人参水溶性蛋白的提取及SOD活性测定[J]. 时珍国医国药, 2012, 23 (5): 1153-1154.
[10]李红艳, 赵雨, 张鑫, 等. 不同产地不同生长年限人参 SOD 的比较[J]. 中国医院药学杂志, 2010 (12): 994-996.
[11] 齐滨, 赵大庆, 刘莉, 等. 人参西洋参中超氧化物歧化酶的稳定性研究[J]. 时珍国医国药, 2014, 25(2): 293-294.
InhibitoryEffectofGinsengWaterExtractonHydroxylRadical
LI Hongyan NI Xuejiao ZHANG Xu CHEN Hongwei
College of Pharmacy, Liaoning University of Traditional Chinese Medicine, Dalian 116600, China
ObjectiveComparing the inhibitory effect of different Water-soluble Extracts on Hydroxyl Radical.MethodsUsing orthogonal test design, extraction of ginseng water soluble effective parts; the hydroxyl radical scavenging rate of each extract was determined by salicylic acid method.ResultsSample No. 4 the highest yield (6.72%), Sample No. 12 hydroxyl radical scavenging maximum (105.08%).ConclusionGinseng water extract contains hydroxyl radical scavenger, the optimum extraction process is pH 8, feed ratio 1∶10,extraction 3 times, each time 12h at 4℃.
Ginseng Water Extract; Orthogonal Test; Hydroxyl Radicals; Anti-oxidation
辽宁省教育厅项目(L201606);中国博士后科学基金项目(2013M530945)。
李红艳(1982-),女,汉族,博士研究生,副教授,研究方向为中药药理学。E-mail:lhywaiw @163.com
R285.5
A
1007-8517(2017)22-0018-03
2017-09-08 编辑:邓佳丽)
