温度对银耳胞外酶活力及营养品质特性的影响
2017-12-11谢会川石文娟柴佳炎龚胡荣
陈 岗,詹 永,杨 勇,吴 振,谢会川,石文娟,柴佳炎,龚胡荣,罗 杨,*
(1.重庆市中药研究院,重庆 400065;2.重庆市银耳营养食品企业工程技术研究中心,重庆 409003)
温度对银耳胞外酶活力及营养品质特性的影响
陈 岗1,詹 永1,杨 勇1,吴 振1,谢会川2,石文娟2,柴佳炎2,龚胡荣2,罗 杨1,*
(1.重庆市中药研究院,重庆 400065;2.重庆市银耳营养食品企业工程技术研究中心,重庆 409003)
研究不同温度对银耳栽培过程中生长发育各阶段的7 种胞外酶活力和银耳品质特性的影响;采用相关性分析和通径分析2 种数据分析方法,探讨各胞外酶平均酶活力与银耳品质的关系,揭示各胞外酶对银耳品质的相对重要性,为银耳工厂化高质、高产栽培提供可靠理论依据。结果表明,在适宜的温度范围内,同种胞外酶活力变化规律相似,不同胞外酶活力变化具有明显的阶段性;对比研究发现,在栽培温度(23.0±0.5)℃时,成熟银耳的干生物学效率、多糖含量和蛋白质含量在7 个温度组中最高,分别为35.67%、21.51%和8.53%。相关性分析表明,所测胞外酶的平均酶活力(除羧甲基纤维素酶外)与干生物学效率和多糖含量呈正相关性,蛋白质含量与7 种胞外酶平均酶活力均呈正相关性;进一步通径分析发现,蛋白酶是影响银耳营养品质的关键胞外酶。综上所述,在栽培温度(23.0±0.5)℃时,基质中主要胞外酶具有高活力,银耳的营养品质最高,可将此温度作为银耳工厂化栽培的指导温度。
温度;银耳;胞外酶;酶活力;营养品质
银耳(Tremella fuciformis),又称白木耳、雪耳、银耳子等,为典型腐生异养大型担子菌门真菌,其含有多糖、酚类、黄酮类和多种氨基酸等生物活性成分,被誉为“食用菌之王”[1]。我国是银耳主产国,产地主要分布在福建古田、四川通江、重庆黔江等地。至20世纪80年代福建古田成功研究出银耳袋料栽培技术,银耳栽培逐渐实现工厂化人工生产。袋料银耳栽培选用木屑、棉子壳、麦麸等物质构成栽培培养基,其中含有大量的木质素、纤维素和半纤维素。为满足自身生长发育的需求,需将大分子碳水化合物、蛋白质等分解为小分子的营养物质,从而进行吸收和转化,而这些分解利用和转化的过程与菌丝分泌的胞外酶的活性紧密相关。营养菌丝阶段营养分解、吸收和转化的程度,直接决定后期成熟子实体的产量和品质,因此,深入研究不同培养温度条件下,菌丝胞外酶活力的变化规律,对于明确不同栽培温度下银耳生理的变化情况非常必要。
目前关于银耳栽培技术的研究主要集中在高产菌种的选育[2]、袋料基质的优化筛选[3]、栽培工艺[4]等方面,但培养温度对银耳栽培过程中生理的影响缺乏研究,相关报道很少。本实验从与银耳生长发育密切相关的几类胞外酶,包括木质素酶系(漆酶和锰过氧化物酶(manganese peroxidase,MnPs))、纤维素酶系(羧甲基纤维素酶(carboxymethyl cellulase,CMCs)和滤纸纤维素酶(filter paper cellulase,FPs)、半纤维素酶(hemicellulase,HCs)、淀粉酶、蛋白酶开展研究,探讨培养温度对银耳发育和营养品质特性的影响,揭示各胞外酶对银耳品质相对重要性,为银耳工厂化高质、高产栽培提供理论依据。
1 材料与方法
1.1 材料与试剂
银耳菌株(DD 1号)和香灰菌株(XH 3号)由重庆市银耳营养食品企业工程技术研究中心提供,从福建古田引进。
栽培培养基质:棉籽壳69%(质量分数,下同)、麸皮19%、杂木屑10%、蔗糖1%、磷酸二氢钾0.3%、硫酸镁0.2%、石膏0.5%。
2,2’-联氮-(3-乙基苯并噻唑啉-6-磺酸)-二氨盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)和木聚糖 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
DHG-9240A电热恒温鼓风干燥箱、DK-8D三孔电热恒温水槽 上海齐欣科学仪器有限公司;UV-2450紫外-可见分光光度计 日本岛津公司;BS224S电子天平德国赛多利斯公司;Z300K离心机 德国Hermle公司。
1.3 方法
1.3.1 栽培管理
实验在重庆市银耳营养食品企业工程技术研究中心的银耳栽培室内进行,栽培室内的温度、湿度及通风采用自动设备进行调控。
实验采用袋料栽培法,选用规格12 cm×8 cm×0.03 cm的聚丙烯塑料袋,每袋装菌料600 g(m(干料)∶m(水)=4∶6),每袋在横侧面打1 个接种孔并用专用胶布封口,126 ℃条件下高压灭菌2 h,冷却后接种,每孔接种量为1.5 g。将已接种的银耳菌袋分别放入温度为(17.0±0.5)、(19.0±0.5)、(21.0±0.5)、(23.0±0.5)、(25.0±0.5)、(27.0±0.5)、(29.0±0.5)℃的7 个栽培室,每个温度组设置500 袋,放置于同一水平位置的栽培架内。
栽培室其他环境条件控制参照GB/T 29369—2012《银耳生产技术规范》[5]并略有修改。银耳菌丝营养生长期间,湿度为自然状态,避光,每天使用风机换气1 次(每次30 min);原基形成期间,相对湿度控制为80%~85%,自然光照,每天风机换气2 次(每次30 min);子实体生长期间,相对湿度控制为90%~95%,自然光照,每天风机换气3 次(每次30 min)。
1.3.2 采样方法及粗酶液制备
把银耳生长期分为7 个阶段:菌丝1/2满袋(阶段1)、菌丝满袋(阶段2)、吐黄水期(阶段3:接种孔内出现琥珀色黄水)、原基期(阶段4:接种孔出现淡黄色原基)、菌蕾期(阶段5:原基分化舌状耳片,呈食指大)、开片期(阶段6:耳片完全展开,呈疏松状)、子实体成熟期(阶段7:耳片略有收缩、褶皱,耳片加厚)。在不同阶段采样时,每一温度组随机抽取3 袋菌棒,每一菌棒先去除原种和子实体,再刮去表层约厚1 cm的培养料,取表层下3~6 cm深度的菌丝与培养料混合物100 g,置于-20 ℃保存。
准确称取同一待测样品2 份,每份5 g,1 份用于制备粗酶液,另1 份在80 ℃恒温干燥箱内干燥至质量恒定(用于测干质量)。将5 g样品放入100 mL三角瓶中,加蒸馏水25 mL,在30 ℃恒温水浴锅内浸提2 h,过滤,于8 000 r/min离心10 min,上清液即为粗酶液。每个样品分别取样3 次进行测定。
1.3.3 胞外酶活力测定
漆酶和MnPs活力分别参照ABTS法[6]和Wariishi等[7]的方法测定,酶活力单位均定义为每克干培养基质每分钟吸光度增加0.01;CMCs活力参照安琪等[8]的方法测定,酶活力单位定义为每克干培养基质每分钟水解CMC-Na生成1 mg葡萄糖所需的酶量;FPs活力参照赵玉萍等[9]的方法测定,酶活力单位定义为每克干培养基质每分钟内水解底物生成1 mg葡萄糖所需的酶量;HCs活力参照李江华等[10]的方法,酶活力单位定义为每克干培养基质每分钟内催化木聚糖水解生成1 mg木糖所需的酶量;淀粉酶活力参照王玉万等[11]的方法测定,酶活力单位定义为每克干培养基质每分钟内催化底物释放1 mg葡萄糖的酶量;蛋白酶活力测定参照GB/T 23527—2009《蛋白酶制剂》[12]中“蛋白酶活力的测定(福林法)”,酶活力单位定义为每克干培养基质每分钟内催化底物释放1 μg酪氨酸的酶量。
1.3.4 银耳营养品质测定
采用苯酚-硫酸法[13]测定总糖含量,还原糖含量测定采用3,5-二硝基水杨酸法[14],多糖含量按照公式(1)计算;蛋白质含量的测定参考GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》[15]中分光光度法;干生物学效率的测定参照魏润黔[16]、孔维丽[17]等的方法并略作修改,将采收后的新鲜银耳在75 ℃鼓风干燥箱中干燥至恒质量,记录每袋银耳干品质量,按照公式(2)计算干生物学效率。

1.4 数据统计与分析
采用SPSS 19.0软件对数据进行统计分析、相关性分析和通径分析,Duncan’s新复极差法比较各处理间差异。
2 结果与分析
2.1 银耳栽培周期内胞外酶活力的变化
2.1.1 不同温度条件下漆酶和MnPs活力的变化
木质素是一种高度复杂的以苯丙烷为基本结构单元构成的芳香族高分子化合物,植物组织中木质素与纤维素以共价键形式紧密结合,并将纤维素分子包埋在其中,影响由菌丝分泌的纤维素酶对纤维素的降解[18]。食用菌在生长过程中通过菌丝分泌木质素酶将木质素彻底分解为CO2、H2O,从而利用组织内部的纤维素、半纤维素等碳源物质[19]。木质素酶主要包括漆酶、MnPs以及木质素过氧化物酶等,其中木质素过氧化物酶只有几种白腐菌能够产生[20]。
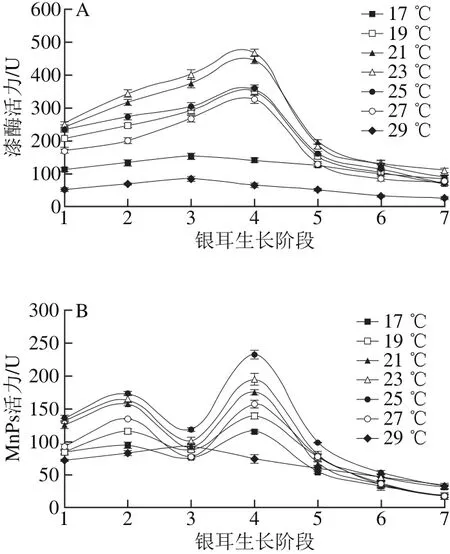
图1 不同培养温度条件下漆酶(A)和MnPs(B)活力Fig. 1 Changes in laccase (A) and MnPs (B) activity under different temperature conditions
由图1A可知,不同温度组的漆酶活力变化趋势较为一致,呈“上升-下降”的单峰形态,但酶活力峰值出现的生长阶段却有差异。在栽培温度(19.0±0.5)~(27.0±0.5)℃范围内,在阶段4时漆酶活力达到峰值,随后呈下降趋势;(23.0±0.5)℃条件下漆酶活力最强,为467.46 U。在低温(17.0±0.5)℃和高温(29.0±0.5)℃条件下,漆酶活力在阶段3达到峰值后便逐渐下降,且在整个生长期间处于较低水平。
在不同温度条件下,MnPs活力的变化规律与漆酶有一定差别(图1B)。在(17.0±0.5)~(27.0±0.5) ℃温度范围内,MnPs活力在阶段2和阶段4出现双峰值,且在阶段4出现最大值;在(25.0±0.5)℃时,MnPs活力在各生长阶段均为最高。在高温(29.0±0.5)℃条件下,MnPs活力在阶段3达到峰值后便逐渐下降,酶活力变化趋势与其他温度组不同。
2.1.2 不同温度条件下CMCs和FPs活力的变化
纤维素是一种超分子结构的高分子,需在纤维素酶的作用下降解为纤维二糖,最后水解为葡萄糖,才能被食用菌菌丝所吸收利用[21]。组成纤维素酶系的酶主要有3 种,分别是CMCs、FPs和β-葡萄糖甘酶,其中CMCs和FPs为食用菌的主要胞外酶[22]。
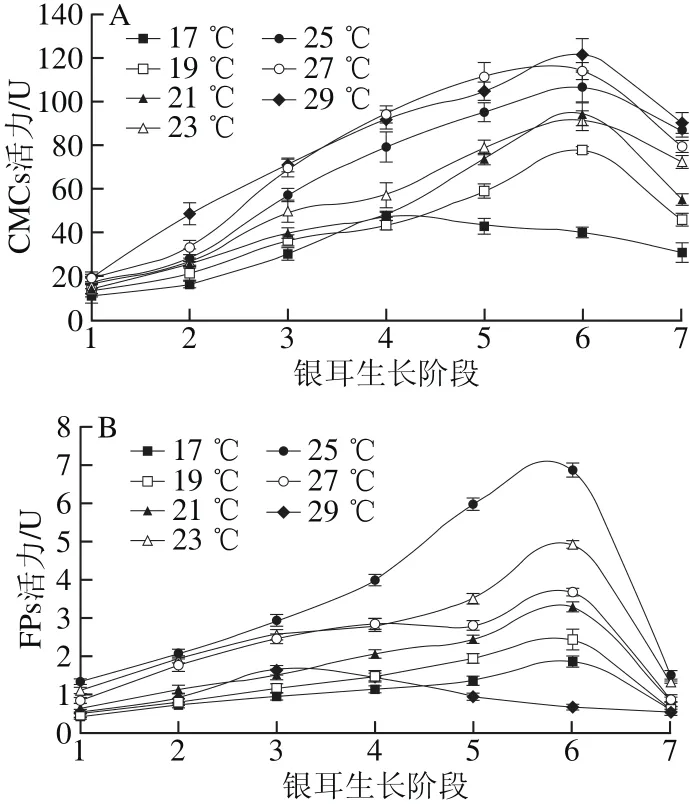
图2 不同培养温度条件下CMCs(A)和FPs(B)活力Fig. 2 Changes in CMCs (A) and FPs (B) activity under different temperature conditions
由图2A可知,不同温度组的CMCs活力变化趋势较为一致,呈先上升后下降的单峰形态,且随温度升高酶活力逐渐增强,在(29.0±0.5)℃时酶活力最高;在(17.0±0.5)℃条件下,CMCs活力在阶段4达到峰值后便逐渐下降,且在整个生长期间处于较低水平。
在不同温度条件下,FPs活力的变化规律与CMCs的总体趋势相似(图2B)。在栽培温度(17.0±0.5)~(27.0±0.5)℃时,FPs活力峰值出现在阶段6,之后酶活力下降;(25.0±0.5)℃温度组的FPs活力在各生长阶段均为最高,其酶活力峰值为6.52 U。
2.1.3 不同温度条件下HCs活力的变化
半纤维素是植物细胞中除纤维素外包括木糖、阿拉伯糖、甘露糖、乳糖和糖醛酸等混合组分的一种杂多糖,在植物的纤维物质中起着黏接作用。木聚糖是半纤维素的主要组成成分之一,木聚糖酶是HCs的主要诱导酶,半纤维素的降解可以促进纤维素及整个纤维素类物质的降解,因此菌株分泌木聚糖酶能力的高低在一定程度上能够反映其对基质中半纤维素的降解能力[23]。
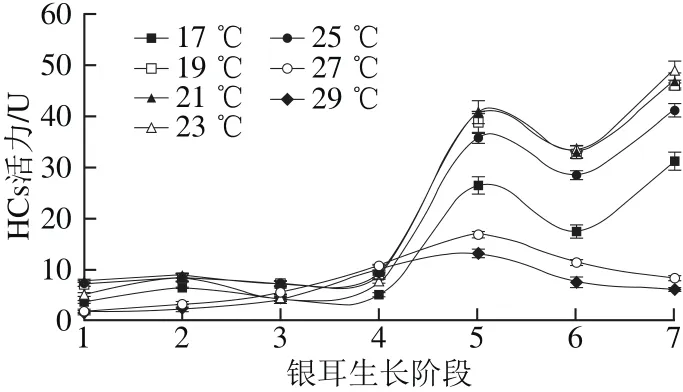
图3 不同培养温度条件下HCs活力Fig. 3 Changes in HCs activity under different temperature conditions
由图3可知,在(17.0±0.5)~(25.0±0.5)℃温度范围内,HCs活力变化趋势较为一致,在阶段4前,HCs活力较低,然后呈“N”型变化,在阶段7达到最大值;(23.0±0.5)℃温度条件下,酶活力峰值最高,为49.17 U。
2.1.4 不同温度条件下淀粉酶活力的变化
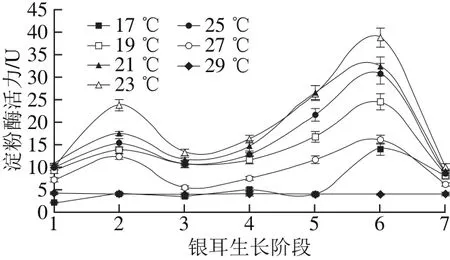
图 4 不同培养温度条件下淀粉酶活力Fig. 4 Changes in amylase activity under different temperature conditions
淀粉是栽培基质中主要的非木质纤维素营养物质,淀粉酶能促进淀粉降解为菌丝容易吸收的小分子物质。由图4可知,在栽培温度(19.0±0.5)~(27.0±0.5)℃时,淀粉酶活力变化趋势呈“M”型,在阶段2和阶段6出现双峰,且在阶段6出现最大值;(23.0±0.5)℃时淀粉酶活力在各生长阶段均为最高,在阶段6的酶活力为38.82 U。在高温(29.0±0.5)℃条件下,淀粉酶在整个生长期间酶活力变化平缓,维持在3.98~4.30 U之间;低温(17.0±0.5)℃时,淀粉酶活力在阶段6前维持在较低水平,仅在阶段6出现酶活力峰值,其最大酶活力为14.1 U。
2.1.5 不同温度条件下蛋白酶活力的变化
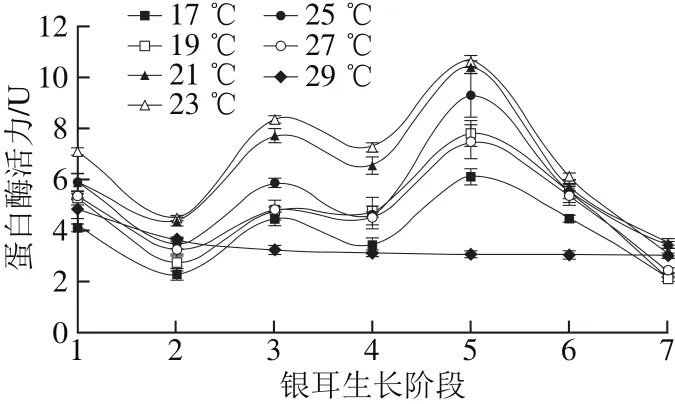
图5 不同培养温度条件下蛋白酶活力Fig. 5 Changes in protease activity under different temperature conditions
氮源是合成菌丝细胞壁、蛋白质和核酸等物质的重要原料,蛋白酶能催化蛋白质水解为氨基酸,为菌丝的生长和向子实体的转化提供有效氮源[24]。由图5可知,在栽培温度(17.0±0.5)~(27.0±0.5)℃时,蛋白酶活力变化趋势相似,呈“波浪”型。在阶段1活力较高,随后下降,在阶段3达到第一个峰值后略有降低,在阶段5达到最高值,此后快速下降;在高温(29.0±0.5)℃条件下,蛋白酶在阶段1活力出现峰值,为4.86 U,然后缓慢下降。在(23.0±0.5)℃条件下,蛋白酶活力高于其他温度组。
2.2 胞外酶活力与银耳品质的相关性分析及通径分析
2.2.1 栽培温度对胞外酶平均酶活力和银耳品质的影响食用菌不含叶绿素,主要依靠多种胞外酶将周围环境中的纤维素、半纤维素、木质素、淀粉和蛋白质等大分子物质水解成小分子物质,维持生命过程,完成生活史。因此胞外酶活力的高低决定着食用菌对培养基质中物质的降解速率,影响食用菌对营养的吸收和利用速率,进而决定着食用菌的产量和品质。
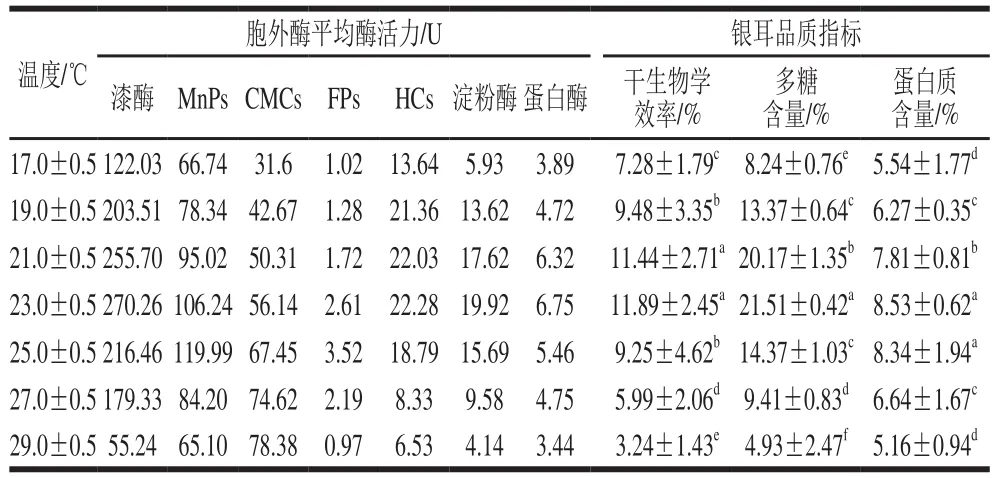
表1 温度对胞外酶平均酶活力和银耳品质的影响Table 1 Effect of cultivation temperature on extracellular enzyme average activities and quality of Tremella fuciformis
干生物学效率是食用菌栽培生产中一个重要指标,反映了食用菌对栽培料营养物质转化利用能力。干生物学效率越高,表示食用菌获得的营养物质越多,产量越高。由表1可知,在实验温度范围内,(21.0±0.5)、(23.0±0.5) ℃温度组银耳产品的干生物学效率比其他温度组明显高(p<0.05),其中(23.0±0.5) ℃温度组的干生物学效率最高,为(11.89±2.45)%,是(29.0±0.5)℃温度组的3.67倍,说明温度是影响银耳干生物学效率的一个重要因素。研究发现,温度对银耳干生物学效率的影响是通过影响栽培过程中胞外酶活力而实现的。在栽培温度为(23.0±0.5)℃时,漆酶、HCs、淀粉酶和蛋白酶的平均酶活力最高;而在栽培温度为(29.0±0.5)℃时,这4 种胞外酶平均酶活力最低,说明银耳干生物学效率的高低与这4 种胞外酶平均酶活力有一定关联性。胞外酶对干生物学效率的影响可能与食用菌品种、栽培料基质组成等因素有关。研究发现,草菇的生物学效率与胞外酶CMCs、木聚糖酶和漆酶活力呈正相关性,其中漆酶是关键的限制性因子[25],而黑木耳的生物学效率与漆酶和多酚氧化酶活力呈正相关性,与CMCs活力不相关[26];Ahlawat等[27]在研究不同栽培基质对草菇胞外酶活力及产量的影响时发现,在经巴氏消毒后的水稻秸秆栽培基质实验组中,内切葡聚糖酶、漆酶和多酚氧化酶是影响草菇产量的关键胞外酶,而在以堆制发酵后的水稻秸秆栽培基质实验组中,木聚糖酶和β-葡萄糖甘酶是影响草菇产量的关键胞外酶。
多糖与蛋白质是评价银耳品质的2 个重要指标。由表1可知,在实验温度范围内,(23.0±0.5)℃温度组的银耳产品多糖含量最高,为(21.51±0.42)%,与其他温度组差异显著(p<0.05);(23.0±0.5)、(25.0±0.5)℃温度组银耳产品的蛋白质含量与其他温度组有显著差异(p<0.05),两组产品的蛋白质含量分别为(8.53±0.62)%和(8.34±1.94)%。在高温(29.0±0.5)℃条件下,除CMCs外其他胞外酶平均酶活力均低于其他温度组,造成所得银耳品质相对较低,其多糖含量和蛋白质含量仅为(4.93±2.47)%和(5.16±1.94)%。
2.2.2 胞外酶活力与银耳品质的相关性分析
为考察不同胞外酶活力大小对银耳产品品质的影响,对7 种胞外酶在不同温度条件下所得银耳产品的3 个品质指标与平均酶活力进行相关分析,结果见表2。所测胞外酶的平均酶活力除CMCs外与干生物学效率和多糖含量2 个银耳品质呈正相关性。其中,银耳产品的干生物学效率与漆酶、HCs和淀粉酶的平均酶活力呈现极显著正相关(p<0.01),与蛋白酶的平均酶活力显著正相关(p<0.05);银耳产品的多糖含量与漆酶、淀粉酶和蛋白酶的平均酶活力呈极显著正相关关系(p<0.01),与HCs的平均酶活力显著正相关(p<0.05)。蛋白质含量与7 种胞外酶平均酶活力均呈正相关,与漆酶、MnPs、淀粉酶和蛋白酶的平均酶活力呈极显著正相关(p<0.01),与FPs的平均酶活力显著正相关(p<0.05)。CMCs的平均酶活力与3 个品质指标的相关性不显著(P>0.05)。
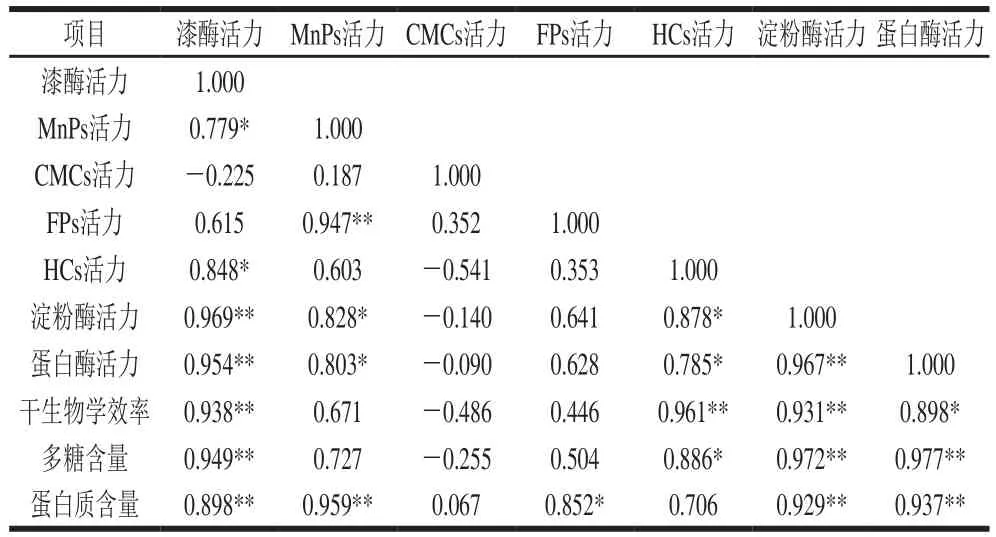
表2 胞外酶平均酶活力与银耳品质的相关性分析Table 2 Correlation between the average activity of extracellular enzymes and the quality of Tremella fuciformis
2.2.3 胞外酶活力与银耳品质的通径分析
胞外酶活力与银耳品质之间的相关性分析只能表明两者之间的直接关系,而不同酶之间相互作用对银耳品质的影响没有直观表现,因此需在相关性分析基础上进行通径分析,把胞外酶活力与银耳品质的相关性分解为直接作用和间接作用,以明确不同胞外酶活力的相互作用对品质的效应大小。
分别以银耳品质指标——干生物学效率、多糖含量和蛋白质含量为因变量Y1、Y2和Y3,漆酶、MnPs、CMCs、FPs、HCs、淀粉酶和蛋白酶的平均酶活力为自变量X1、X2、X3、X4、X5、X6和X7,采用偏回归分析法建立Y1、Y2和Y3的最优多元回归方程(剔除偏回归系数不显著的自变量),分别为Y1=0.371-0.039X3+0.186X5+1.430X7(F=396.804,p<0.001),Y2=-11.845-0.010X1-0.703X4+0.283X5+4.699X7(F=22 842.602,p<0.001),Y3=0.874+0.039X2+0.523X7(F=1 378.535,p<0.001),3 个方程的显著性检验表明具有显著意义,进一步做通径分析。
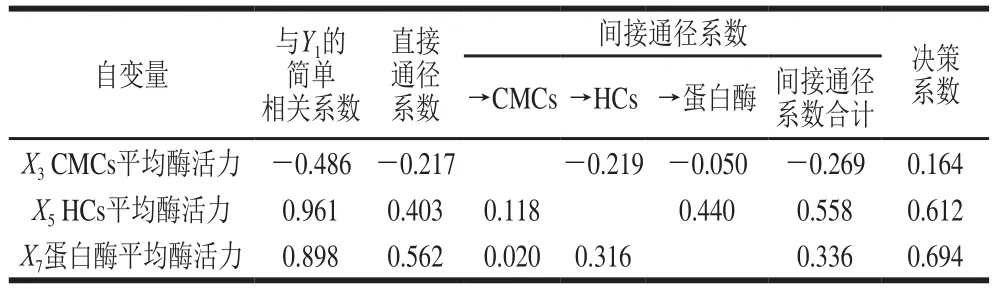
表3 以干生物学效率为因变量的通径分析Table 3 Path analysis using drying biology eff i ciency as dependent variable
由表3可以看出,在与干生物学效率(Y1)的简单相关性中,3 个自变量与Y1的相关性程度大小为X5>X7>X3,直接通径作用的关联程度为X7>X5>X3。通过分析各个间接通径系数发现,X5通过X3和X7对Y1的间接作用高于X7通过X3和X5对Y1的间接作用(0.558>0.336),从而使X5对Y1的影响高于X7;X3对Y1的直接和间接作用均表现为负效应,说明当栽培基质中CMCs酶活力高时,将降低银耳产品的干生物学效率。决策系数是通径分析中的决策指标,用于自变量对因变量的综合作用进行排序,确定主要决策变量和限制变量[28]。3 个自变量对Y1的决策性大小为X7>X5>X3,说明蛋白酶变量对Y1的综合作用是最大的,这种影响效应包括直接作用以及与其他胞外酶的协同作用。
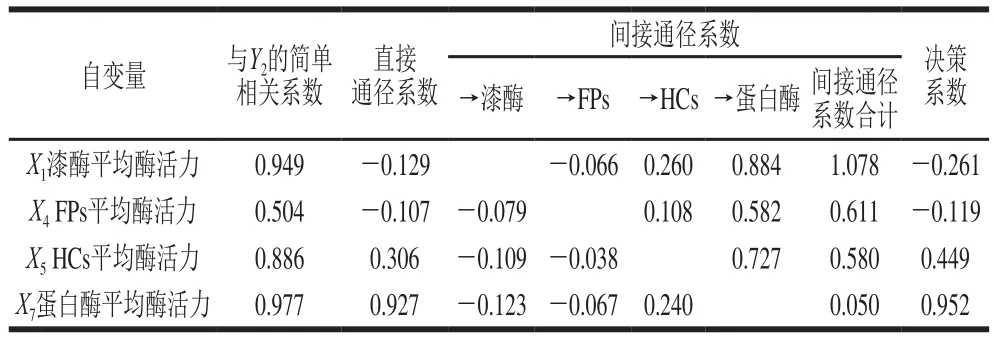
表4 以多糖含量为因变量的通径分析Table 4 Path analysis using polysaccharide content as dependent variable
由表4可以看出,在与多糖含量(Y2)的简单相关性中,4 个自变量与Y2的相关性程度大小为X7>X1>X5>X4,直接通径作用的关联程度为X7>X5>X1>X4。X7与Y2的相关程度和直接通径作用均为最大,表明在以提高银耳产品多糖含量的目标中应重点把握蛋白酶这一因素;虽然X1和X4对Y2的直接通径作用表现为负影响,但二者通过与X5和X7的间接作用而表现出对Y2的正影响,而且间接作用程度较大,所以与Y2的正相关程度仍然很高;X5对Y2的直接通径作用小于通过蛋白酶变量的间接作用;决策系数的大小说明蛋白酶变量对Y2的综合作用是最大的。
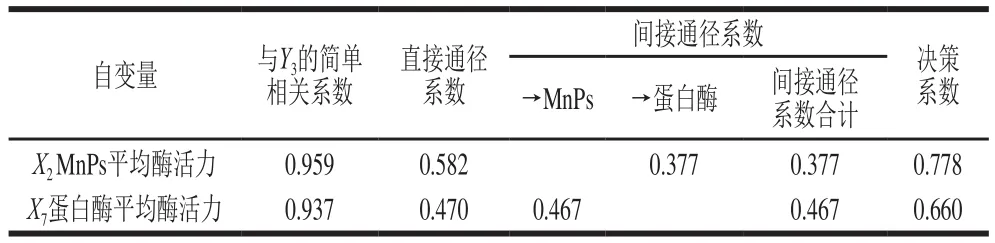
表5 以蛋白质含量为因变量的通径分析Table 5 Path analysis using protein content as dependent variable
由表5可知,X2和X7均与蛋白质含量(Y3)有较大的正相关性;X2对Y3的直接作用大于X7;X7通过X2对Y3的间接作用大于X2的间接作用;决策系数说明X2对Y3的综合作用是最大的。
3 讨 论
研究发现温度对银耳栽培基质中的7 种胞外酶活力的影响主要体现在两方面,一是温度对胞外酶活力变化规律的影响;二是温度对各种胞外酶活力大小的影响。在栽培温度(19.0±0.5)~(27.0±0.5)℃范围内,不同温度组的银耳漆酶活力变化规律是一致的,说明此温度范围是漆酶活力适宜温度条件,(23.0±0.5)℃温度组的漆酶活力最高。同理,MnPs、FPs和蛋白酶活力的适宜温度范围为(17.0±0.5)~(27.0±0.5)℃,HCs酶活力的适宜温度范围为(17.0±0.5)~(25.0±0.5)℃,淀粉酶活力的适宜温度范围为(19.0±0.5)~(27.0±0.5)℃。银耳CMCs是一种中高温酶,在实验温度范围内,其酶活力随温度的升高而增加,在(29.0±0.5)℃条件下酶活力最高。银耳7 种胞外酶中除MnPs、CMCs和FPs外,其余4 种胞外酶活力的最适温度为(23.0±0.5)℃,可将此温度作为银耳工厂化栽培的指导温度。
食用菌胞外酶活力与菌丝生长和子实体发育有密不可分的关系[29]。当食用菌各种胞外酶活力的动态变化符合菌体生长及发育的规律时,才能完成由营养生长向生殖生长的转变[30]。在适宜的温度范围内,银耳栽培基质中7 种胞外酶的活力变化具有明显的阶段性。在银耳菌丝生长期,培养基质中的木质素酶系(漆酶和MnPs)酶活力较强,同时淀粉酶和蛋白酶也表现出较高活力(可能主要作用于基质中已有的少量淀粉和蛋白质底物);在银耳菌丝营养生长向生殖生长过度期间,木质素酶系的酶活力达到最大峰值,纤维素酶系(CMCs和FPs)酶活力在此阶段逐渐增强,蛋白酶活力出现峰值;在银耳子实体生长发育期,纤维素酶系、HCs、淀粉酶和蛋白酶均出现最大酶活力,木质素酶系酶活力呈快速下降趋势。由此可见,银耳菌丝先降解基质中木质素等结构复杂的非碳源物质,再直接利用已存在的淀粉和蛋白质,为后续降解提供有利条件;等到子实体发育阶段需要大量能量时,再降解纤维素、半纤维素等物质。银耳胞外酶这种阶段性的变化规律与在香菇[31]、平菇[32]、金针菇[33]、白灵菇[34]、黑木耳[35]、双孢蘑菇[36]等食用菌上的研究结果相似。
基质中胞外酶活力的变化和强弱常能反映出菌丝生理生化的活跃程度和基质中化学组分的降解特性,胞外酶的活跃程度和食用菌生长发育及生物量息息相关。研究发现,在不同温度条件下,银耳胞外酶平均酶活力大小存在较大差异性,造成各组银耳产品的干生物学效率、多糖含量和蛋白质含量差异显著。在栽培温度(23.0±0.5)℃时,基质中主要胞外酶具有高活力,所得银耳的干生物学效率、多糖含量和蛋白质含量在7 个温度组中最高;在(29.0±0.5)℃时,银耳胞外酶(除CMCs外)的平均酶活力最低,造成所得银耳品质也最低。将银耳胞外酶的平均酶活力与银耳品质进行相关性分析发现,所测胞外酶平均酶活力(除CMCs外)与干生物学效率和多糖含量2 个银耳品质呈正相关性,蛋白质含量与7 种胞外酶平均活力均呈正相关性。为进一步考察不同胞外酶之间相互作用对银耳品质的影响,采用逐步线性回归法在相关性分析基础上进行通径分析,结果表明,蛋白酶对干生物学效率的综合作用是最大的,这种影响效应包括直接作用和HCs、CMCs的间接作用;同时,蛋白酶通过直接作用和漆酶、FPs、HCs的间接作用对多糖含量影响最大;MnPs和蛋白酶通过直接及相互间接作用影响银耳蛋白质含量。由此可见,蛋白酶是影响银耳营养品质的关键胞外酶。此结论与庄庆利[37]的研究结果相似,他发现平菇胞外蛋白酶活力与第一茬菇产量有极显著的正相关性,依据不同的生长阶段淀粉酶、蛋白酶、过氧化物酶和CMCs活力的高低可预测第一茬菇产量的高低。
综上所诉,在栽培温度(23.0±0.5)℃时,基质中主要胞外酶具有高活力,银耳的营养品质指标(干生物学效率、多糖含量、蛋白质含量)最高,因此可将此温度作为银耳工厂化栽培的指导温度;蛋白酶是影响银耳营养品质的关键胞外酶,在工厂化生产中,可通过调节栽培温度、改良基质配方(调整基质中C/N)及良种培育等技术手段提升蛋白酶活力,以达到增产增效的目的。
[1] 刘波. 中国真菌志(第二卷)[M]. 北京: 科学出版社, 1992: 78-80.
[2] 贺元川, 陈仕江, 杨勇, 等. 有性杂交选育银耳优良菌株的初步研究[J]. 生物技术通报, 2015, 31(2): 148-152. DOI:10.13560/j.cnki.biotech.bull.1985.2015.02.022.
[3] 张莉, 常明昌, 孟俊龙, 等. 工厂化栽培银耳配方筛选[J]. 山西农业科学, 2016, 44(2): 190-192; 203. DOI:10.3969/j.issn.1002-2481.2016.02.16.
[4] 丁湖广. 银耳生物特性及高优栽培关键技术[J]. 科学种养,2015(12): 30-31. DOI:10.13270/ j.cnki.kxzh.2015.12.015.
[5] 国家质量监督检验检疫总局. 银耳生产技术规范: GB/T 29369—2012[S]. 北京: 中国标准出版社, 2012: 4-5.
[6] MURUGESAN K, NAM I H, KIM Y D. Decolorization of reactive dyes by a thermostable laccase produced by Ganoderma lucidum in solid state culture[J]. Enzyme and Microbial Technology, 2007, 40(7):1662-1672. DOI:10.1016/j.enzmictec.2006.08.028.
[7] WARIISHI H, VALLI K, GOLD M H. Manganese (Ⅱ) oxidation by manganese peroxidase from the basidiomycete Phanerochaete chrysosporium. Kinetic mechanism and role of chelators[J]. Journal of Biological Chemistry, 1992, 267(33): 23688-23695.
[8] 安琪, 吴雪君, 吴冰, 等. 不同碳源和氮源对金针菇降解木质纤维素酶活性的影响[J]. 菌物学报, 2015, 34(4): 761-771. DOI:10.13346/j.mycosystema.150060.
[9] 赵玉萍, 杨娟. 四种纤维素酶酶活测定方法的比较[J]. 食品研究与开发, 2006, 27(3): 116-118. DOI:10.3969/j.issn.1005-6521.2006.03.046.
[10] 李江华, 房峻. 半纤维素酶高产菌种的选育及产酶条件[J]. 无锡轻工大学学报, 2004, 23(5): 48-52. DOI:10.3321/j.issn:1673-1689.2004.05.011.
[11] 王玉万, 王云. 构菌栽培过程中对木质纤维素的降解和几种多糖分解酶的活性变化[J]. 微生物学通报, 1989, 16(3): 137-140.DOI:10.13344/j.microbiol.china.1989.03.004.
[12] 卫生部. 蛋白酶制剂: GB/T 23527—2009[S]. 北京: 中国标准出版社, 2009: 6-8.
[13] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ac60111a017.
[14] WOOD I P, ELLISTON A, RYDEN P, et al. Rapid quantif i cation of reducing sugars in biomass hydrolysates: improving the speed and precision of the dinitrosalicylic acid assay[J]. Biomass and Bioenergy,2012, 44: 117-121. DOI:10.1016/j.biombioe.2012.05.003.
[15] 卫生部. 食品安全国家标准 食品中蛋白质的测定: GB 5009.5—2010[S].北京: 中国标准出版社, 2010: 4-6.
[16] 魏润黔. 生物学效率小议[J]. 中国食用菌, 1990, 9(1): 45.DOI:10.13629/j.cnki.53-1054.1990.01.041.
[17] 孔维丽, 张玉亭, 康源春, 等. 培养料含水量对平菇菌丝生长和生物学效率的影响[J]. 河南农业科学, 2013, 42(12): 110-111; 114.DOI:10.3969/j.issn.1004-3268.2013.12.026.
[18] 李春凤, 王力生. 白腐真菌降解木质素酶系特性及其应用[J]. 现代农业科技, 2009(11): 274-275. DOI:10.3969/j.issn.1007-5739.2009.11.182.[19] 倪滔滔, 谭琦, BUSWELL J A. 杏鲍菇栽培周期木质素酶变化规律的研究[J]. 上海农业学报, 2011, 27(2): 14-17. DOI:10.3969/j.issn.1000-3924.2011.02.004.
[20] 池玉杰, 伊洪伟. 木材白腐菌分解木质素的酶系统-锰过氧化物酶、漆酶和木质素过氧化物酶催化分解木质素的机制[J]. 菌物学报,2007, 26(1): 153-160. DOI:10.13346/j.mycosystema.2007.01.027.
[21] 郭立忠, 郭华, 李维峰, 等. 七个巴西蘑菇菌株胞外酶活性的测定与分析[J]. 莱阳农学院学报, 2002, 19(3): 210-212. DOI:10.3969/j.issn.1674-148X.2002.03.014.
[22] 孙萌. 大球盖菇菌丝培养及胞外酶活性变化规律研究[D]. 延吉: 延边大学, 2013: 7-9.
[23] 高金权, 刘朝贵, 李成琼. 稻草秸秆栽培金针菇基质降解特性研究[J]. 中国农学通报, 2005, 21(12): 260-264. DOI:10.3969/j.issn.1000-6850.2005.12.072.
[24] 张乐, 白羽嘉, 谢现英, 等. 温度对阿魏侧耳胞外酶活性及原基形成的影响[J]. 新疆农业科学, 2014, 51(9): 1692-1698. DOI:10.6048 /j.issn.1001-4330.2014.09.018.
[25] 吴圣进, 王灿琴, 韦仕岩, 等. 草菇木质纤维素酶活测定及其对木薯渣生物转化效率的影响[J]. 南方农业学报, 2014, 45(5): 749-753.DOI:10.3969/j:issn.2095-1191.2014.5.749.
[26] 韩增华, 张丕奇, 孔祥辉, 等. 黑木耳胞外酶活变化与栽培性状比较的研究[J]. 食用菌学报, 2007, 14(4): 41-46. DOI:10.16488/j.cnki.1005-9873.2007.04.006.
[27] AHLAWAT O P, GUPTA P, DHAR B L, et al. Profile of the extracellular lignocellulolytic enzymes activities as a tool to select the promising strains of Volvariella volvacea (Bull. ex Fr.) sing[J]. Indian Journal of Microbiology, 2008, 48(3): 389-396. DOI:10.1007/s12088-008-0015-4.
[28] 袁志发, 周静芋, 郭满才, 等. 决策系数: 通径分析中的决策指标[J].西北农林科技大学学报(自然科学版), 2001, 29(5): 131-133.DOI:10.13207/j.cnki.jnwafu.2001.05.035.
[29] 任鹏飞, 宫志远, 李陆军, 等. 香菇几种胞外酶活性变化及与农艺性状的相关性分析[C]//第二届全国食用菌中青年专家学术交流会. 杭州: 中国菌物学会工作部, 2008: 182-186.
[30] 郭倩, 何庆邦. 四孢蘑菇生长过程中四种胞外酶活性和木质纤维素降解的变化规律[J]. 食用菌学报, 1998, 5(2): 13-17. DOI:10.16488/j.cnki.1005-9873.1998.02.003.
[31] 王伟科, 陆娜, 周祖法, 等. 8 种胞外酶在香菇不同生长阶段的活性变化[J]. 浙江农业科学, 2014(4): 498-501. DOI:10.16178/j.issn.0528-9017.2014.04.026.
[32] 申进文, 吴婷婷, 庄庆利, 等. 平菇栽培过程中胞外酶活性变化[J]. 食用菌学报, 2010, 17(2): 56-59. DOI:10.3969/j.issn.1005-9873.2010.02.011.
[33] PAL M, CALVO A M, TERRÓN M C, et al. Solid-state fermentation of sugarcane bagasse with Flammulina velutipes and Trametes versicolor[J]. World Journal of Microbiology and Biotechnology,1995, 11(5): 541-545. DOI:10.1007/BF00286370.
[34] 冯作山, 邹亚杰, 胡清秀. 白灵侧耳栽培过程中胞外酶和呼吸酶活及离子流速的研究[J]. 菌物学报, 2014, 33(2): 341-354.DOI:10.13346/j.mycosystema.140005.
[35] 韩增华, 张介驰, 张丕奇, 等. 黑木耳原种胞外酶活性的研究[J]. 生物技术, 2009, 19(5): 14-16. DOI:10.16519/j.cnki.1004-311x.2009.05.028.
[36] CLAYDON N, ALLAN M, WOOD D A. Fruit body biomass regulated production of extracellular endocellulase during periodic fruiting by Agaricus bisporus[J]. Transactions of the British Mycological Society,1988, 90(1): 85-90. DOI:10.1016/S0007-1536(88)80183-9.
[37] 庄庆利. 平菇生理活性与产量相关性研究[D]. 郑州: 河南农业大学,2010: 43-44.
Effect of Cultivation Temperature on Extracellular Enzyme Activities and Nutritional Quality Characteristics of Tremella fuciformis
CHEN Gang1, ZHAN Yong1, YANG Yong1, WU Zhen1, XIE Huichuan2, SHI Wenjuan2, CHAI Jiayan2, GONG Hurong2, LUO Yang1,*
(1. Chongqing Academy of Chinese Materia Medica, Chongqing 400065, China;
2. Chongqing Engineering Research Center for Tremella Nutrition Food Enterprises, Chongqing 409003, China)
In order to provide a theoretical basis for growth regulation and eff i cient cultivation of Tremella fuciformis, the effects of different cultivation temperatures on seven extracellular enzyme activities at various growth and development stages and nutritional quality characteristics of Tremella fuciformis were studied. Meanwhile, the relative importance of seven extracellular enzymes for the nutritional quality of Tremella fuciformis was discussed by correlation analysis and path analysis. The results showed that the changes in the activity of extracellular enzymes of the same type were similar and the changes in all enzyme activities tested were stepwise in the appropriate temperature range. Comparative study revealed that the dry biological eff i ciency, polysaccharide content and protein content of mature Tremella fuciformis were the highest at (23.0 ± 0.5)℃ among seven cultivation temperatures, which were 35.67%, 21.51% and 8.53%, respectively.Correlation analysis showed that the average activity of all extracellular enzymes except carboxymethyl cellulase was positively correlated with dry biological eff i ciency and polysaccharide content, and protein content was positively correlated with the average activity of all seven extracellular enzymes. Further, path analysis showed that protease was a key factor for the nutritional quality of Tremella fuciformis. Collectively, these results indicated at (23.0±0.5)℃, the activity of key extracellular enzymes was higher and the nutritional quality of Tremella fuciformis was the best. Therefore, (23.0 ± 0.5)℃can be recommended for industrial cultivation of Tremella fuciformis.
temperature; Tremella fuciformis; extracellular enzyme; enzyme activity; nutritional quality
10.7506/spkx1002-6630-201723019
TS255.1;S318
A
1002-6630(2017)23-0113-08
2016-09-13
重庆市科技攻关项目(cstc2013yykfa80004);重庆市科技支撑示范工程项目(cstc2015jcsf-kjfp80014);重庆市社会事业与民生保障科技创新专项(cstc2016shmszx80077)
陈岗(1978—),男,助理研究员,硕士,研究方向为食用菌的开发利用。E-mail:zyychengang@163.com
*通信作者:罗杨(1986—),女,助理研究员,硕士,研究方向为中药健康食品研发。E-mail:122056563@qq.com
陈岗, 詹永, 杨勇, 等. 温度对银耳胞外酶活力及营养品质特性的影响[J]. 食品科学, 2017, 38(23): 113-120.
DOI:10.7506/spkx1002-6630-201723019. http://www.spkx.net.cn
CEHEN Gang, ZHAN Yong, YANG Yong, et al. Effect of cultivation temperature on extracellular enzyme activities and nutritional quality characteristics of Tremella fuciformis[J]. Food Science, 2017, 38(23): 113-120. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723019. http://www.spkx.net.cn
