脉冲强光在食品工业中的研究和应用进展
2017-12-11张瑞雪张文桂袁勇军
张瑞雪,张文桂,管 峰,袁勇军
(浙江万里学院生物与环境学院,浙江 宁波 315100)
脉冲强光在食品工业中的研究和应用进展
张瑞雪,张文桂,管 峰,袁勇军*
(浙江万里学院生物与环境学院,浙江 宁波 315100)
脉冲强光是一种非热物理杀菌新技术,利用氙气灯瞬时高强度、广谱的脉冲光来杀灭固体表面、气体和透明液体中营养细菌及芽孢、真菌和真菌孢子、病毒和原生动物等腐败病原微生物,具有能耗低、杀菌效率高、对产品质量和营养的负面影响较低等优点。本文综述了脉冲强光设备的工作原理、杀菌机理、杀菌影响因素及在果蔬、食品包装材料、水处理等中的研究和应用进展。
脉冲强光;杀菌;杀菌机理;应用
脉冲强光(pulsed light,PL)又称脉冲紫外光[1]、高强度宽谱脉冲光[2]、脉冲白光[3],是一种新型的非热杀菌技术。PL技术起源于20世纪70年代后期的日本,1984年在美国注册专利,1996年美国食品药品监督管理局(Food and Drug Administration,FDA)允许在食品加工中使用,规定PL处理食品的剂量不能超过12 J/cm2[4]。PL对固体表面、气体和透明液体中的微生物均有较好的杀灭作用[5-8]。PL开始主要应用于医疗器械表面和透明药剂溶液杀菌消毒,随着该杀菌技术和设备的成熟,逐渐过渡应用到食品杀菌保藏中[9]。PL具有耗能低、瞬时、广谱等优点[10],市场前景广阔。
1 脉冲强光工作原理和设备
PL以交流电为电源,由一个动力单元和一个氙灯单元组成。氙灯接收由动力单元提供的高压电流脉冲能量,能发出由紫外(ultraviolet,UV)至近红外区域的光谱,包括UV光区(180~400 nm)、可见光区(400~700 nm)、近红外光区(700~1 100 nm),与太阳光谱分布相似,但每一次脉冲的光强度约为到达海平面处太阳光强度的2×104倍[11]。输入的市电经设备变压器升压后,对高压直流发生器的电容器进行充电,通过强光发生器(氙灯两端)形成直流高压。经系统触发器产生高压脉冲,升压后电流触发产生瞬时电感使氙气电离导通形成持续时间极短的闪光。电容放电后,高压下降,为下一次闪光积蓄能量[12]。最早的商业化设备为PureBrightTM系统,目前主要是德国的SteriBeam系统和美国的Xenon系统[13]。在我国,周万龙[14]、马凤鸣[15]等自主设计PL杀菌装置以用于研究。
PL系统可设计为固定批次处理或连续流动操作。一个基本的PL对固体样品批次处理系统,将样品置于处理室,通过沿着位于腔室壁上的一个或多个灯发出PL进行处理(图1);连续PL系统,需要固体样品和灯之间相对运动,设置样品通过PL的速率来实现所需处理时间。PL系统用于液体样品根据所需处理时间控制透明管内流量[16](图2)。

图1 固体批次处理脉冲系统Fig. 1 Typical schematic for a batch PL system for solid foods
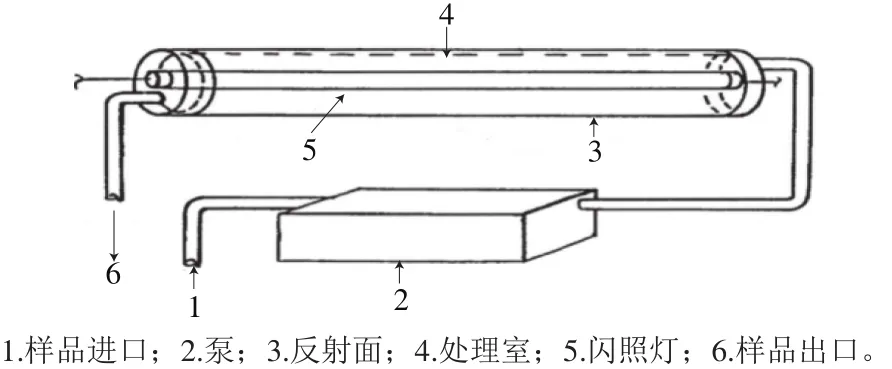
图2 液体样品连续流动系统Fig. 2 Typical scheme for a continuous PL system for liquid food
2 脉冲强光杀菌机理
2.1 光化学作用
UV波段通常被认为是PL发挥杀菌效应的主要区域,DNA变性是杀菌的主要原因。微生物在PL照射下DNA吸收UV波段波长(200~280 nm),DNA逐渐开始裂解,结构改变,形成对DNA不利的胸腺嘧啶二聚体,阻碍DNA复制和细胞分裂,微生物自身的新陈代谢机能出现障碍,遗传性出现问题,导致细胞死亡或孢子钝化[17]。UV光谱中对微生物的杀菌作用最重要的是UV-C波段(200~275 nm)。UV-C可引起DNA双链、单链断裂,诱导环丁烷嘧啶二聚体产生(图3)。Wang等[18]利用单色仪过滤光谱发现杀灭Escherichia coli的有效波长为230~360 nm,270 nm达最大杀菌性能,300 nm以上未发现有杀菌现象,证明PL起杀菌作用的光谱成分主要是UV,其中UV-C在杀菌中起重要作用。江天宝[19]采用不同的光学玻璃材料来过滤PL中不同光谱成分来研究杀菌效果,发现不同玻璃材料过滤的PL杀菌效果都有一定程度的减弱,即可见光、红外光、UV均对各种微生物存在杀菌效果,UV杀菌效果尤为突出,缺失UV-C光谱与全光谱杀菌效果相差大,复合任意两种光谱较单一光谱杀菌效果都会增强。结果表明UV在PL杀菌光谱作用中占重要作用,UV-C尤为明显,可见光和红外线对PL杀菌具有协同增效作用。

图3 PL杀菌机理Fig. 3 Mechanism of sterilization by PL
微生物自身存在修复系统,对UV所引起损伤作用可及时修复。光复活作用意味着UV损伤的逆转,在可见光(340~400 nm)照射下,黑暗条件下与嘧啶二聚体结合的光裂合酶被激活,环丁烷二聚体单体化[20]。Lasagabaster等[21]研究在不同温度和光照条件对PL处理后的Listeria innocua生长的影响。在37 ℃和4 ℃两种处理温度下,PL均使L. innocua菌体浓度大幅降低(>3 lg(N0/N))。而在日光照射下PL处理后可培养的L. innocua数量较黑暗条件下高2.2 lg(N0/N)。结果表明,PL闪照处理后,L. innocua光修复机制的裂合酶活性仍然存在。光修复机制的裂合酶活性不仅依赖于光,而且依赖时间。由于PL的瞬时性,从PL可见光部分获得的修复时间受到限制,因而PL的光修复有限。有报道证实Staphylococcus aureus和L. monocytogenes最优光修复作用波长在360~380 nm,低剂量脉冲时,光修复补偿水平较低,小于1 lg(N0/N),在高剂量脉冲时,光修复将受到抑制[22]。除对DNA损伤外,微生物的蛋白质吸收UV辐射后,因蛋白质结构被破坏而变性,导致酶失活及细胞死亡[23]。同时UV还可与臭氧共同作用,使臭氧经过照射后与水分子反应生成了具有强氧化性·OH,从而达到消毒杀菌目的[13]。
2.2 光热作用
PL中的近红外光能辐射能量,使细胞表面局部温度升高至50~150 ℃,破坏细菌的细胞壁,使细胞液蒸发,彻底破坏细胞结构,导致死亡[6](图3)。PL产生的热效应与热处理不同,只使物体表面温度快速升高,没有显著的体积、温度变化[24]。
2.3 光物理作用
PL除具有光化、光热作用外,还存在光物理作用,PL的穿透性和瞬时冲击性损坏细胞壁和其他细胞成分,导致细胞死亡(图3)。PL系统中矩形波脉冲在周期一定的情况下,脉冲功率的峰值随着占空比的增大而增大,脉冲信号频率范围减小。脉冲信号频带作用范围扩大,脉冲信号功率谱频带范围越宽,信号的高频分量就越加丰富,对位移电流密度的影响较大,会引起器件的脉冲效应[25]。有研究结果表明脉冲形式提供能量主要表现在脉冲次数和脉冲持续时间,在达到相等总能量的情况下,脉冲提供的功率较连续光辐照功率更大,每次脉冲的持续时间更短,峰值功率越高,具有更高的渗透能力[26]。
3 脉冲强光处理效果的影响因素
PL杀菌是复杂的过程,针对不同处理对象,需了解影响PL杀菌效果的因素,以此优化PL参数设置。
3.1 脉冲强光对不同微生物杀菌效果
国内外很多学者对PL对不同微生物的杀菌效果进行了研究,总结其研究结果如表1所示。
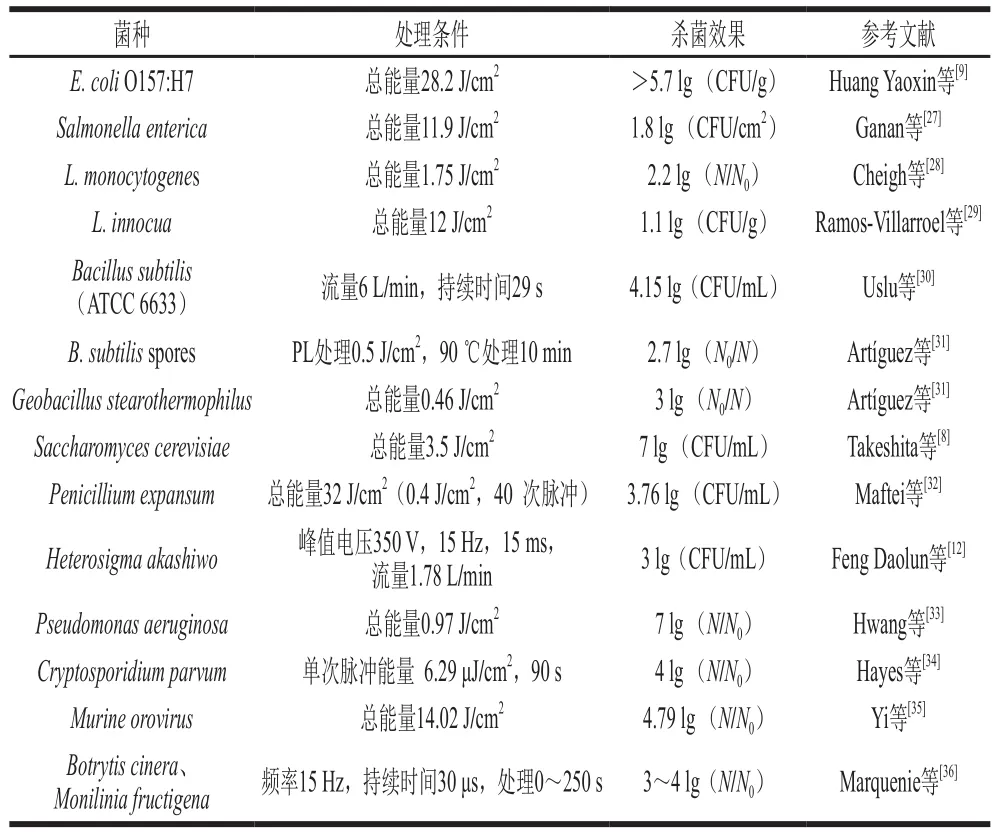
表1 脉冲强光对不同微生物的杀菌效果Table 1 Sterilization eff i ciency of different microorganisms by PL
由表1可以看出,不同的微生物对PL的敏感性不同,Artíguez等[31]研究了PL对B. subtilis和Geobacillus stearothermophilus的营养细胞和芽孢的杀菌效果,实验结果表明PL的杀菌作用随着细菌浓度的增大而减小,低细菌浓度时,营养细胞较芽孢更为敏感;较高细菌浓度时,芽孢比营养细胞更为敏感;在相同细菌浓度时,B. subtilis营养细胞比G. stearothermophilus细胞对PL更敏感;G. stearothermophilus孢子不能耐受PL。Ogihara等[37]研究了PL在液体环境中对食源性病原菌的杀灭效果。一次脉冲闪照处理(500 J、10 cm)13 种食源性微生物(Streptococcus faecalis、Enterobacter cloacae、Enterobacter aerogenes、E. coli、Serratia marcescens、L. monocytogenes、S. aureus、Aeromonas hydrophila、Providencia alcalifaciens、Pseudomonas aeruginosa、Salmonella enteritidis、Salmonella typhimurium、Yersinia enterocolitica),液体环境中除了E. aerogenes和S. typhimurium外,其他食源性微生物菌减少都超过6 个数量级。E. aerogenes和S. typhimurium能产生细胞外物质吸收部分UV,比其他微生物具有更高的UV耐受力。结果表明,革兰氏阴性菌对PL照射敏感性较革兰氏阳性菌更低。
3.2 脉冲强光参数影响杀菌效果
脉冲总能量是PL杀菌效果最重要的决定因素。脉冲闪光灯发出的能量与到达样品表面的能量不同,受到脉冲次数、单次脉冲能量、脉冲频率、闪照距离、传播介质(空气、水、苹果汁等)的影响。由于PL的光线穿透力有限,样品厚度以及处理对象成分都会影响PL的杀菌效果。
王勃等[38]利用响应面法优化PL对面包表面细菌的杀菌工艺,结果表明,采用PL杀菌技术可以有效杀灭面包表面污染的细菌,实验因素对杀菌效果影响主次顺序为:闪照次数>闪照能量>闪照距离。Cheigh等[28]研究PL对固体培养基上L. monocytogenes的杀菌影响,杀菌效果与脉冲次数呈正相关,每次脉冲条件为1.75 mJ/cm2,脉冲300 次可减少4 lg(N/N0);增加次数到900 次,数量可减少6 lg(N/N0)。杀菌效果随脉冲次数增加而增加的趋势在干腌肉中的L. monocytogenes和S. enterica同样适用[27]。Maftei等[32]分别采用不同脉冲数(5、10、15、20、30和40)对苹果汁中Penicillium expansum的杀菌研究发现,随着脉冲次数的增加,杀菌效果也随之增加。5 次减少1.2 lg(CFU/mL),当脉冲数为40时减少3.21 lg(CFU/mL)。
脉冲处理时间对杀菌效果的影响随着处理时间的延长而增强。Yi等[35]自行设计了半工业规模的PL系统,测试了40、32、20、12 L/min流速条件下对应处理89、113、179、290 s的杀菌效果,随着处理时间的延长,E. coli C600数量由减少了2.21 lg(N/N0)变为减少了4.79 lg(N/N0)。
脉冲电压对杀菌效果的影响随着电压的增加而增强。输入电压分别为1.0、1.5、2.0、2.5 kV,对琼脂上B. subtilis进行杀菌处理。随着输入电压的增加,细菌数量的对数差值也逐渐增大。2.5 kV处理电压可减少6 lg(N/N0)的B. subtilis[39]。
不同的基质影响光的穿透性,因此菌液深度不同也会影响杀菌效果。Nicorescu等[40]研究PL对悬浮液和香料中B. subtilis营养细胞杀菌的影响,结果发现B. subtilis浓度在液体条件下且PL为0.6 J/cm2时减少了8 lg(CFU/mL),细胞形态不受影响;B. subtilis浓度在香料中且PL为10 J/cm2时减少了1 lg(CFU/mL),其细胞壁结构严重破坏。结果表明PL对液体和固体状态下的作用机制不同,其所导致的杀菌效果也有很大区别。
4 脉冲强光的应用进展
4.1 脉冲强光在果蔬中的应用
新鲜果蔬高水分、高糖、低pH值等特征有利于微生物繁殖,加速果蔬变质、缩短货架期,造成巨大的经济损失。为有效延长果蔬的货架期,有较多学者将PL应用于果蔬加工中。
Ramos-Villarroel等[29]用PL(12 J/cm2)对鳄梨、西瓜、蘑菇表面接种的L. innocua和E. coli进行处理,结果发现脉冲对表面接种的L. innocua和E. coli均具有杀菌作用,分别减少0.91~1.1 lg(CFU/g)和1.92~2.97 lg(CFU/g),L. innocua对PL更耐受,经脉冲处理后鲜切水果可于4 ℃贮存至少两个星期。Salinas-Roca等[41]采用PL(20 次脉冲,每次脉冲0.4 J/cm2)、苹果酸浸泡(2%苹果酸(malic acid,MA))及可食涂层(2%藻酸盐涂层(alginate coating,ALC))处理3 种方法相结合对鲜切芒果的安全性和质量进行研究,结果表明接种于芒果表面的L. innocua数量在MA-PL和PL-ALC-MA处理后分别减少了4.5 lg(CFU/g)和3.9 lg(CFU/g),在4 ℃贮藏14 d后,其微生物总数仍低于6 lg(CFU/g)。在4 ℃贮藏过程中芒果的颜色参数和总可溶性固形物含量有所降低,pH值接近新鲜程度,综上,PL结合不同处理方法可以尽量延长货架期。Oms-Oliu等[42]研究了PL对鲜切蘑菇质量和抗氧化性质的影响,当使用4.8、12、28 J/cm2PL处理蘑菇时,微生物的数量可减少0.6~2.2 lg(CFU/g),4.8 J/cm2处理鲜切蘑菇可在5 ℃条件下保存15 d,没有显著影响其质构和抗氧化性质。
Llano等[43]发现鲜切苹果表面褐变程度会随着PL强度的增大而加深。通过光学显微镜下观察果肉细胞微观结构,可以将褐变原因归因于切割后的苹果细胞失去了区域化功能,使得酶与底物接触机会更多,而过高剂量的PL能加速组织褐变。Ramos-Villarroel等[44]认为PL会给鲜切西瓜的色泽、硬度等品质带来副作用,可能因为使用不当的强度(12 J/cm2)促进了酚酶活性升高,引起的热效应加速组织水分蒸发。同时PL也会降低花色苷的含量[45]。
PL还可以应用于对果蔬中农药残留的光降解。Baranda等[46]研究了PL对农药残留的降解作用,1.8~2.3 J/cm2的PL可以使初始质量浓度为1~1 000 μg/L农药含量减少50%,低于法律规定质量浓度,且无有害降解产物产生。由于PL的短时性,高脉冲使得有害副产物衍生物所需物质无法形成,因而PL可应用于农残光降解。
鲜切果蔬由于其便利性而受到广大消费者青睐。微生物控制对保证鲜切果蔬品质至关重要。切割这一步骤降低了果蔬对微生物的抵抗力并且在加工过程中易造成二次污染。PL可有效减少微生物和钝化酶活力。PL应用于果蔬保鲜要控制辐照剂量在一定范围内,在减少微生物、钝化酶活力和延长货架期的同时,又要防止高脉冲剂量造成褐变等不利因素产生。
PL除保证果蔬的品质安全外,还有利于改善果蔬品质,如提高葡萄、香菇中白藜芦醇含量,芒果中非酶抗氧化活性等。de Almeida Lopes等[47]研究发现低剂量(0.6 J/cm2)的PL处理‘Tommy Atkins’芒果在20 ℃贮藏7 d后芒果的颜色加深,总抗氧化活性提高130%,非酶抗氧化活性增强,同时不改变芒果细胞组织。有研究发现PL处理后的葡萄中白藜芦醇质量浓度比未处理的葡萄升高2.5 倍,酿造的葡萄酒中含有0.58 mg/L的反式白藜芦醇[48]。PL在葡萄酒制作过程中,可提高抗氧化物质外,还能有效降低SO2的含量[49]。
4.2 PL在即食肉制品中的应用
即食肉制品是一类无需加热处理便可在出售地点食用的食品,主要包括酱卤肉、熏烧烤肉、肉干、熏煮香肠火腿、发酵肉、熟制腌腊制品等[50]。因食用方便快捷,已成为我国居民喜爱的一类食品,但是即食肉制品在加工过程中易造成二次污染。
为提高即食肉制品的安全性并延长货架期,可采用PL对食品进行处理。Ganan等[27]研究PL对即食干腌肉制品中接种于表面的L. monocytogenes和S. enterica的杀菌作用。结果表明当脉冲能量在11.9 J/cm2时,两种菌分别减少1.5 lg(CFU/cm2)和1.8 lg(CFU/cm2),并在灭菌后室温贮存30 d后感官以及颜色等均未出现变化。Nicorescu等[51]对PL对猪肉和鲑鱼的灭菌作用和感官属性进行了研究,PL对生的烤猪排、熟的烤猪排、生三文鱼中接种的Pseudomonas fluorescens具有显著的杀菌效果,减少3.4 lg(CFU/g);在30 J/cm2脉冲能量下猪排的色泽具有显著变化,在3~10 J/cm2的条件下,不引起脂质过氧化,但丙二醛含量大幅升高。
4.3 PL在食品包装材料中的应用
食品生产中的污染可以从食品接触表面和包装材料转移到食物本身,导致食品腐败变质,病原微生物还会引起公共卫生问题,因而对包装材料的灭菌也是非常必要的。全世界有超过100 家工厂合并PL系统到包装线中用于消毒,并有研究证实使用PL系统几乎瞬时减少超过5 lg(CFU/cm2)芽孢[52]。对包装材料的研究重点集中在物理稳定性、机械稳定性以及化学迁移和可能产生的安全问题方面。Haughton等[53]研究了PL技术(3 Hz,每次脉冲最大505 J,脉冲维持时间360 μs)去除生鸡肉及其包装材料表面的微生物,主要研究对PL辐照接种于包装材料(不锈钢、聚乙烯砧板、黑色聚丙烯托盘(black polypropylene tray,BPP)、白色聚丙烯托盘(white polypropylene tray,WPP)、蓝色聚丙烯托盘、铝盘(aluminium tray,AL)、聚烯烃(polyolefin,PO)、聚乙烯聚丙烯、聚氯乙烯(polyvinyl chloride,PVC))表面的Campylobacter jejuni、E. coli、S. enteritidis杀菌效果。结果发现,距离14 cm、脉冲时间1 s,除BPP和PO材料,其余材料表面C. jejuni全部杀灭;延长脉冲时间到5 s,所有材料表面C. jejuni全部杀灭。脉冲距离11.5 cm、脉冲时间5 s,PVC和AL上的E. coli全部杀灭,其他材料减少了1.5~4.7 lg(CFU/cm2)E. coli。相同脉冲条件处理后,在PVC和WPP上的S. enteritidis全部杀灭,而其他材料减少了2.52~4.5 lg(CFU/cm2)S. enteritidis。Levy等[54]接种单层Bacillus subtilis到聚苯乙烯上,PL对其进行处理后发现,不论采取何种方法(点样和喷洒)接种至聚苯乙烯上,其处理后浓度均显著减少,大于6 lg(spore/cm2)。Gómez-López等[55]研究PL对接种于低密度聚乙烯、高密度聚乙烯、聚乙烯铝箔纸板层压板、聚对苯二甲酸乙二醇酯和聚乙烯涂层纸板表面的L. innocua的杀菌效果,0.67 J/cm2剂量脉冲1~12 次分别减少1.9~7.1、1.7~7.2、1.0~3.5、1.0~4.4、1.1~4.5 lg(CFU/coupon),说明PL对不同材料表面细菌的杀灭效果不同。
材料表面的性质如凹凸程度、粗糙度、反射率等均会影响PL的杀菌效率。此外,由于PL中含有的UV可降低材料表面的疏水性,为了解PL对包装材料的影响,还应检测材料的结构、表面疏水性、透气率等。
4.4 PL在水处理中的应用
目前国内外水处理中的消毒方法有很多,包括生物法、化学法和物理法。我国在水处理中经常采用的消毒方法主要有氯消毒、臭氧消毒和UV消毒,但这些方法均存在一些安全隐患。因此,有学者研究PL作为一种相对安全的消毒方法应用于水处理中。
Feng Daolun等[56]研究了PL对压载水中Heterosigma akashiwo的杀菌作用,结合TiO2膜共同作用在300 V的脉冲峰值电压、15 Hz频率和5 ms脉冲宽度下,对H. akashiwo的杀菌率达99.89%,比传统UV压舱水处理系统能耗效率高1.51~2.51 倍。Cryptosporidium parvum在一般水处理中很难去除,PL(6.29 μJ/cm2)处理90 s即可减少4 lg(N/N0),通过毒理学评价PL处理的水未表现出任何毒性[36]。Kasahara等[57]研究PL对山羊乳中E. coli杀菌效果及其感官属性,PL在10 J/cm2条件下E. coli减少6 lg(CFU/mL),芳香物发生改变,但物理性质和组成成分无显著变化,这是因为致密介质的高光吸收,使得PL的穿透有限。PL的杀菌作用与饮料的光学性质有关,PL可使矿泉水和等渗饮料中P. aeruginosa减少7 lg(N/N0)(0.97 J/cm2),使苹果汁、碳酸饮料、酸梅汤中P. aeruginosa减少7 lg(N/N0)(12.17~24.35 J/cm2)。PL能渗透到液体中的决定因素是高透射和低消光系数,消光系数与杀菌作用呈指数(曲线)函数关系[33]。
4.5 脉冲强光在其他方面的应用
PL最早是应用于医药方面的,医院中隔离房间的空气要求高,传统采用UV消毒,英国一所医院对PL设备应用于隔离房间的消毒效果进行评价,结果发现PL可以减少78.4%的细菌,能减少5 lg(CFU/mL)耐药菌。PL对隔离室中内表面的微生物有显著杀菌作用,但是不能彻底从环境中去除微生物污染。PL所采用的脉冲氙气-UV灯深受医院清洁和工作人员好评,对病人流动影响程度最小[58]。
PL可以诱导大分子物质的改变。Panozzo等[59]研究了PL对谷蛋白结构和免疫应答反应的影响。谷蛋白引起免疫反应即过敏反应。谷蛋白光反应性受水合作用影响,PL诱导面筋粉褐变,通过二硫化物的交换促使部分水化面筋蛋白解聚,使谷蛋白免疫活性明显降低,达到降低过敏反应的目的。
PL在皮肤治疗中也有显著的效果,PL对成纤维细胞具有增殖作用,可以诱导基因表达和细胞外基质蛋白的产生,可用于治疗真皮细胞外蛋白综合征[60]。PL还能改善治疗良性色素病变、血管病变、红斑痤疮、粉刺等[61]。
5 结 语
在食品工业中病原微生物的控制是最为重要的环节,PL在1996年就已被FDA批准使用于食品加工、生产及处理方面。PL杀菌技术具有操作简单、快速、无残留、对环境污染小等特点,使得PL具有巨大的商业潜力。实现其工业化,需要积累大量可靠数据,以保证食品的安全。
PL比传统的杀菌方法具有优势,但是要将其商业化仍然存在一些问题需要研究和解决。PL对固体表面及透明液体具有较好的杀菌效果;而由于存在遮光效应、光的折射、反射、散射等的作用,PL对于颜色较深液体、凹凸不平的物体表面的杀菌效果较低;PL渗透力有限,样品厚度也会影响灭菌效果。多种杀菌技术串联使用能有效提高杀菌效果,互补杀菌技术中的缺陷。如结合水辅助PL对果蔬等热敏性食物,可避免由于温度造成的不利影响[62]。PL结合苹果酸浸泡也能有效提高其杀菌效果[8]。PL与声热处理[63]、超声波技术[17]、热处理[64]结合均能有效提高杀菌效果。对于复合杀菌方法需要大量实验对其进行研究,技术的先后顺序是其研究的一个重点。
PL作用机制研究较少,主要集中对微生物学的研究,最为常见的是通过电子显微镜观察PL对微生物形态的影响,但是从分子生物学角度去研究PL作用机理相对较少。例如UV照射后大肠杆菌存在phr位点的产物酶和uvrA、uvrB、uvrC基因编码的核酸外切酶复合物可以对损伤的部位进行修复,但是PL造成的多为不可逆杀菌作用,PL对这些基因是否存在影响鲜有研究。有研究显示固体状态下和液体条件下PL的杀菌机理有所区别,缺少研究阐明PL的具体杀菌过程和机制。对于耐受PL的微生物,其耐受机制也有待进一步研究。
PL除了应用于杀菌外,对光催化、光诱导方面的研究也可作为未来研究的方向之一,例如利用PL诱导产生抗菌肽,诱导葡萄、花生、香菇等中的白藜芦醇等抗氧化成分的产生的研究也是食品工业中的研究方向之一。
[1] SHARMA R R, DEMIRCI A. Inactivation of Escherichia coli O157:H7 on inoculated alfalfa seeds with pulsed ultraviolet light and response surface modeling[J]. Journal of Food Science, 2003, 68:1448-1453. DOI:10.1111/j.1745-4565.2002.tb00334.x.
[2] ROBERTS P, HOPE A. Virus inactivation by high intensity broad spectrum pulsed light[J]. Journal of Virological Methods, 2003, 110:61-65. DOI:10.1016/S0166-0934(03)00098-3.
[3] MARQUENIE D, MICHIELS C W, VAN IMPE J F, et al. Pulsed white light in combination with UV-C and heat to reduce storage rot of strawberry[J]. Postharvest Biology and Technology, 2003, 28: 455-461. DOI:10.1016/S0925-5214(02)00214-4.
[4] Food and Drug Administration. Pulsed light for the treatment of food:21 CFR 179. 4—1996[S]. USA: Food and Drug Administration, 1996.
[5] ROWAN N J, VALDRAMIDIS V P, GÓMEZ-LÓPEZ V M. A review of quantitative methods to describe efficacy of pulsed light generated inactivation data that embraces the occurrence of viable but non culturable state microorganisms[J]. Trends in Food Science &Technology, 2015, 44: 79-92. DOI:10.1016/j.tifs.2015.03.006.
[6] HUANG Y X, SIDO R, HUANG R Z, et al. Application of water-assisted pulsed light treatment to decontaminate raspberries and blueberries from Salmonella[J]. International Journal of Food Microbiology, 2015, 208: 43-50. DOI:10.1016/j.ijfoodmicro.2015.05.016.
[7] GARVEY M, STOCCA A, ROWAN N. Development of a combined in vitro cell culture-quantitative PCR assay for evaluating the disinfection performance of pulsed light for treating the waterborne enteroparasite Giardia lamblia[J]. Experimental Parasitology, 2014,144: 6-13. DOI:10.1016/j.exppara.2014.06.001.
[8] TAKESHITA K, SHIBATO J, SAMESHIMA T, et al. Damage of yeast cells induced by pulsed light irradiation[J]. International Journal of Food Microbiology, 2003, 85: 151-158. DOI:10.1016/S0168-1605(02)00509-3.
[9] HUANG Yaoxin, CHEN Haiqiang. Inactivation of Escherichia coli O157:H7, Salmonella and human norovirus surrogate on artificially contaminated strawberries and raspberries by water-assisted pulsed light treatment[J]. Food Research International, 2015, 72: 1-7.DOI:10.1016/j.foodres.2015.03.013.
[10] HSU L, MORARU C I. A numerical approach for predicting volumetric inactivation of food borne microorganisms in liquid substrates by pulsed light treatment[J]. Journal of Food Engineering,2011, 105: 569-576. DOI:10.1016/j.jfoodeng.2011.03.025.
[11] CHEN B Y, LUNG H M, YANG B H B, et al. Pulsed light sterilization of packaging materials[J]. Food Packaging and Shelf Life, 2015, 5: 1-9.DOI:10.1016/j.fpsl.2015.04.002.
[12] FENG Daolun, SHI Jidong, SUN Dan. Inactivation of microalgae in ballast water with pulse intense light treatment[J]. Marine Pollution Bulletin, 2015, 90: 299-303. DOI:10.1016/j.marpolbul.2014.09.006.
[13] GÓMEZ-LÓPEZ V M, RAGAERT P, DEBEVERE J, et al. Pulsed light for food decontamination[J]. Trends in Food Science &Technology, 2007, 18: 464-473. DOI:10.1016/j.tifs.2007.03.010.
[14] 周万龙, 高大维, 任赛玉, 等. 自控脉冲强光杀菌装置的试验研究[J].华南理工大学学报(自然科学版), 1998, 26(7): 69-71. DOI:10.3321/j.issn:1000-565X.1998.07.013.
[15] 马凤鸣, 张佰清, 徐江宁. 脉冲强光杀菌装置的初步设计研究[J]. 包装与食品机械, 2005, 23(4): 10-11; 16. DOI:10.3969/j.issn.1005-1295.2005.04.004.
[16] 袁勇军, 唐敏, 陈伟, 等. 脉冲强光对连续流动状态下黄酒杀菌效果及品质的影响[J]. 中国酿造, 2011, 30(1): 71-74. DOI:10.3969/j.issn.0254-5071.2011.01.021.
[17] FERRARIO M, GUERRERO S. Effect of a continuous flowthrough pulsed light system combined with ultrasound on microbial survivability, color and sensory shelf life of apple juice[J]. Innovative Food Science and Emerging Technologies, 2016, 34: 214-224.DOI:10.1016/j.ifset.2016.02.002.
[18] WANG T, MACGREGOR S J, ANDERSON J G, et al. Pulsed ultraviolet inactivation spectrum of Escherichia coli[J]. Water Research,2005, 39(13): 2921-2925. DOI:10.1016/j.watres.2005.04.067.
[19] 江天宝. 脉冲强光杀菌技术及其在食品中应用的研究[D]. 福州: 福建农林大学, 2007: 48-55. DOI:10.7666/d.y1175396.
[20] CONDÓN S, ÁLVAREZ I, GAYÁN E. Non-thermal processing:pulsed UV Light[J]. Encyclopedia of Food Microbiology, 2014: 974-981. DOI:10.1016/B978-0-12-384730-0.00398-0.
[21] LASAGABASTER A, DE MARAÑÓN I M. Survival and growth of Listeria innocua treated by pulsed light technology: impact of post-treatment temperature and illumination conditions[J]. Food Microbiology, 2014, 41: 76-81. DOI:10.1016/j.fm.2014.02.001.
[22] LUO W, CHEN A J, CHEN M, et al. Comparison of sterilization efficiency of pulsed and continuous UV light using tunable frequency UV system[J]. Innovative Food Science and Emerging Technologies,2014, 26: 220-225. DOI:10.1016/j.ifset.2014.10.002.
[23] UESUGI A R. Mechanisms of inactivation and microbial inactivation kinetics in the pulsed light treatment of foods[D]. USA: Cornell University, 2011: 22-50.
[24] CACACE D, PALMIERI L. High-intensity pulsed light technology[M]// SUN D W. Emerging Technologies for Food Processing, New York: Academic Press, 2014: 239-258. DOI:10.1016/B978-0-12-411479-1.00013-9.
[25] ARTÍGUEZ M L, LASAGABASTER A, DE MARAÑÓN I M.Factors af f ecting microbial inactivation by pulsed light in a continuous flow-through unit for liquid products treatment[J]. Procedia Food Science, 2011, 1: 786-791. DOI:10.1016/j.profoo.2011.09.119.
[26] GÓMEZ-LÓPEZ V M. Pulsed light technology[G]// Reference Module in Food Sciences. Netherland: Elsevier, 2016: 1-5. DOI:10.1016/B978-0-08-100596-5.03304-7.
[27] GANAN M, HIERRO E, HOSPITAL X F, et al. Use of pulsed light to increase the safety of ready-to-eat cured meat products[J]. Food Control, 2013, 32: 512-517. DOI:10.1016/j.foodcont.2013.01.022.
[28] CHEIGH C, HWANG H J, CHUNG M S. Intense pulsed light (IPL)and UV-C treatments for inactivating Listeria monocytogenes on solid medium and seafoods[J]. Food Research International, 2013, 54: 745-752. DOI:10.1016/j.foodres.2013.08.025.
[29] RAMOS-VILLARROEL A Y, MARTIN-BELLOSO O, SOLIVAFORTUNY R. Combined effects of malic acid dip and pulsed light treatments on the inactivation of Listeria innocua and Escherichia coli on fresh-cut produce[J]. Food Control, 2015, 52: 112-118.DOI:10.1016/j.foodcont.2014.12.020.
[30] USLU G, DEMIRCI A, REGAN J M. Disinfection of synthetic and real municipal wastewater effluent by flow-through pulsed UV-light treatment system[J]. Journal of Water Process Engineering, 2016, 10:89-97. DOI:10.1016/j.jwpe.2016.02.004.
[31] ARTÍGUEZ M L, DE MARTINEZ I M. Inactivation of spores and vegetative cells of Bacillus subtilis and Geobacillus stearothermophilus by pulsed light[J]. Innovative Food Science and Emerging Technologies, 2015, 28: 52-58. DOI:10.1016/j.ifset.2015.01.001.
[32] MAFTEI N A, RAMOS-VILLARROEL A Y, NICOLAU A I, et al.Inf l uence of processing parameters on the pulsed-light inactivation of Penicillium expansum in apple juice[J]. Food Control, 2014, 41: 27-31. DOI:10.1016/j.foodcont.2013.12.023.
[33] HWANG H J, CHEIGH C I, CHUNG M S. Relationship between optical properties of beverages and microbial inactivation by intense pulsed light[J]. Innovative Food Science and Emerging Technologies,2015, 31: 91-96. DOI:10.1016/j.ifset.2015.06.009.
[34] HAYES J, KIRF D, GARVEY MARY, et al. Disinfection and toxicological assessments of pulsed UV and pulsed-plasma gasdischarge treated-water containing the waterborne protozoan enteroparasite Cryptosporidium parvum[J]. Journal of Microbiological Methods, 2013, 94: 325-337. DOI:10.1016/j.mimet.2013.07.012.
[35] YI J Y, LEE N H, CHUNG M S. Inactivation of bacteria and murine norovirus in untreated groundwater using a pilot-scale continuousflow intense pulsed light (IPL) system[J]. LWT-Food Science and Technology, 2016, 66: 108-113. DOI:10.1016/j.lwt.2015.10.027.
[36] MARQUENIE D, LAMMERTYN J, GEERAERD A H, et al.Inactivation of conidia of Botrytis cinerea and Monilinia fructigena using UV-C and heat treatment.[J]. International Journal of Food Microbiology, 2002, 74(1/2): 27-35. DOI:10.1016/S0168-1605(01)00719-X.
[37] OGIHARA H, MORIMURA K, URUGA H, et al. Inactivation of food-related microorganisms in liquid environment by pulsed xenon flash light treatment system[J]. Food Control, 2013, 33: 15-19.DOI:10.1016/j.foodcont.2013.02.012.
[38] 王勃, 刘昕, 马涛, 等. 响应面法优化脉冲强光对面包表面细菌的杀菌工艺[J]. 食品科学, 2014, 35(18): 74-77. DOI:10.7506/spkx1002-6630-201418014.
[39] LEVY C, AUBERT X, LACOUR B, et al. Relevant factors af f ecting microbial surface decontamination by pulsed light[J]. International Journal of Food Microbiology, 2012, 152(3): 168-174. DOI:10.1016/j.ijfoodmicro.2011.08.022.
[40] NICORESCU I, NGUYEN B, MOREAU-FERRET M, et al. Pulsed light inactivation of Bacillus subtilis vegetative cells in suspensions and spices[J]. Food Control, 2013, 31: 151-157. DOI:10.1016/j.foodcont.2012.09.047.
[41] SALINAS-ROCA B, SOLIVA-FORTUNY R, WELTI-CHANES J, et al. Combined effect of pulsed light, edible coating and malic acid dipping to improve fresh-cut mango safety and quality[J]. Food Control, 2016, 66: 190-197. DOI:10.1016/j.foodcont.2016.02.005.
[42] OMS-OLIU G, AGUILÓ-AGUAYO I, MARTÍN-BELLOSO O, et al. Ef f ects of pulsed light treatments on quality and antioxidant properties of fresh-cut mushrooms (Agaricus bisporus)[J]. Postharvest Biology and Technology,2010, 56(3): 216-222. DOI:10.1016/j.postharvbio.2009.12.011.
[43] LLANO K R A, MARSELLÉS-FONTANET A R, MARTÍNBELLOSO O, et al. Impact of pulsed light treatments on antioxidant characteristics and quality attributes of fresh-cut apples[J]. Innovative Food Science and Emerging Technologies, 2016, 33: 206-215.DOI:10.1016/j.ifset.2015.10.021.
[44] RAMOS-VILLARROEL A Y, ARON-MAFTEI N, MARTÍNBELLOSO O, et al. Influence of spectral distribution on bacterial inactivation and quality changes of fresh-cut watermelon treated with intense light pulses[J]. Postharvest Biology and Technology, 2012, 69:32-39. DOI:10.1016/j.postharvbio.2012.03.002.
[45] 王正东, 戚向阳, 曹少谦. 脉冲强光处理对杨梅汁中酚类物质、色泽及抗氧化活性的影响[J]. 果蔬学报, 2012, 29(4): 661-667.DOI:10.13925/j.cnki.gsxb.2012.04.001.
[46] BARANDA A B, BARRANCO A, DE MARAÑÓN I M. Fast atrazine photodegradation in water by pulsed light technology[J]. Water Research, 2012, 46: 669-678. DOI:10.1016/j.watres.2011.11.034.
[47] DE ALMEIDA LOPES M M, SILVA E O, CANUTO KIRLEY, et al.Low fluence pulsed light enhanced phytochemical content and antioxidant potential of ‘Tommy Atkins’ mango peel and pulp[J].Innovative Food Science and Emerging Technologies, 2016, 33: 216-224. DOI:10.1016/j.ifset.2015.12.019.
[48] GUERRERO R F, PUERTAS B, FERNÁNDEZ M I, et al. Induction of stilbenes in grapes by UV-C: comparison of different subspecies of Vitis[J]. Innovative Food Science & Emerging Technologies, 2010,11(1): 231-238. DOI:10.1016/j.ifset.2009.10.005.
[49] GUERRERO R F, PUERTAS B, JIMENEZ M J, et al. Monitoring the process to obtain red wine enriched in resveratrol and piceatannol without quality loss[J]. Food Chemistry, 2010, 122(1): 195-202.DOI:10.1016/j.foodchem.2010.02.057.
[50] 翟明爽, 徐斐, 曹慧, 等. 即食熟肉制品中主要致病菌的半定量风险评估[J]. 微生物学杂志, 2014, 34(2): 92-98. DOI:10.3969/j.issn.1005-7021.2014.02.019.
[51] NICORESCU I, NGUYEN B, CHEVALIER S, et al. Effects of pulsed light on the organoleptic properties and shelf-life extension of pork and salmon[J]. Food Control, 2014, 44: 138-145. DOI:10.1016/j.foodcont.2014.03.052.
[52] HEINRICH V, ZUNABOVIC M, BERGMAIR J, et al. Post-packaging application of pulsed light for microbial decontamination of solid foods[J]. Innovative Food Science and Emerging Technologies, 2015,30: 145-156. DOI:10.1016/j.ifset.2015.06.005.
[53] HAUGHTON P N, LYNG J, MORGAN D J, et al. Efficacy of highintensity pulsed light for the microbiological decontamination of chicken, associated packaging, and contact surfaces[J]. Foodborne Pathogens and Disease, 2011, 8(1): 109-117. DOI:10.1089/fpd.2010.0640.
[54] LEVY C, BORNARD I, CARLIN F. Deposition of Bacillus subtilis spores using an airbrush-spray or spots to study surface decontamination by pulsed light[J]. Journal of Microbiological Methods, 2011, 84: 223-227. DOI:10.1016/j.mimet.2010.11.021.
[55] GÓMEZ-LÓPEZ V M. Pulsed light and packaging[G]// Reference Module in Food Sciences. Netherland: Elsevier, 2016: 1-4.DOI:10.1016/B978-0-08-100596-5.03279-0.
[56] FENG Daolun, XU Shihong, LIU Gang. Application of immobilized TiO2photocatalysis to improve the inactivation of Heterosigma akashiwo in ballast water by intense pulsed light[J]. Chemosphere,2015, 125: 102-107. DOI:10.1016/j.chemosphere.2014.11.060.
[57] KASAHARA I, CARRASCO V, AGUILAR L. Inactivation of Escherichia coli in goat milk using pulsed ultraviolet light[J].Journal of Food Engineering, 2015, 152: 43-49. DOI:10.1016/j.jfoodeng.2014.11.012.
[58] HOSEIN I, MADELOSO R, NAGARATNAM W, et al. Evaluation of a pulsed xenon ultraviolet light device for isolation room disinfection in a United Kingdom hospital[J]. American Journal of Infection Control, 2016, 44: 157-161. DOI:10.1016/j.ajic.2016.01.044.
[59] PANOZZO A, MANZOCCO L, LIPPE G, et al. Ef f ect of pulsed light on structure and immunoreactivity of gluten[J]. Food Chemistry, 2016,194: 366-372. DOI:10.1016/j.foodchem.2015.08.042.
[60] CUERDA-GALINDO E, DÍAZ-Gil G, PALOMAR-GALLEGO M A, et al. Intense pulsed light induces synthesis of dermal extracellular proteins in vitro[J]. Lasers in Medical Science, 2015, 30(7): 1931-1939. DOI:10.1007/s10103-015-1787-5.
[61] GONZÁLEZ-RODRÍGUEZA J, LORENTE-GUALR. Current indications and new applications of intense pulsed light[J]. Actas Dermo-Sifiliográficas, 2015, 106(5): 350-364. DOI:10.1016/j.ad.2014.10.004.
[62] HUANG Y X, CHEN H Q. A novel water-assisted pulsed light processing for decontamination of blueberries[J]. Food Microbiology,2014, 40: 1-8. DOI:10.1016/j.fm.2013.11.017.
[63] MUÑOZ A, CAMINITI I M, PALGAN I, et al. Effects on Escherichia coli inactivation and quality attributes in apple juice treated by combinations of pulsed light and thermosonication[J].Food Research International, 2012, 45(1): 299-305. DOI:10.1016/j.foodres.2011.08.020.
[64] MARQUENIE D, GEERAERD A H, LAMMERTYN J, et al.Combinations of pulsed white light and UV-C or mild heat treatment to inactivate conidia of Botrytis cinerea and Monilia fructigena[J].International Journal of Food Microbiology, 2003, 85(1/2): 185-196.DOI:10.1016/S0168-1605(02)00538-X.
Advances in Research and Application of Pulsed Light in Food Industry
ZHANG Ruixue, ZHANG Wengui, GUAN Feng, YUAN Yongjun*
(College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, China)
Pulsed light (PL) is a non-thermal sterilization technology which uses instantaneous high intensity broad spectrum pulsed light emitted by a xenon lamp for microbial decontamination. PL treatment can inactivate a wide variety of pathogenic and spoilage microorganisms which are present on a solid surface, in gases or in transparent liquids including bacteria,spores, fungi, fungal spores, viruses and protozoa, and has the advantages of low energy consumption, high bactericidal efficiency, and low negative impact on the product quality and nutrition. This paper reviews the working principle of a PL generator, the mechanism and af f ecting factors of microbial inactivation by PL, and recent advances in the application of PL in the sterilization of vegetables and fruits and food packaging materials and in water treatment.
pulsed light; sterilization; microbial inactivation mechanism; application
10.7506/spkx1002-6630-201723048
TS201.6
A
1002-6630(2017)23-0305-08
张瑞雪, 张文桂, 管峰, 等. 脉冲强光在食品工业中的研究和应用进展[J]. 食品科学, 2017, 38(23): 305-312.
10.7506/spkx1002-6630-201723048. http://www.spkx.net.cn
ZHANG Ruixue, ZHANG Wengui, GUAN Feng, et al. Advances in research and application of pulsed light in food industry[J]. Food Science, 2017, 38(23): 305-312. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723048. http://www.spkx.net.cn
2016-08-01
浙江省重中之重学科学生创新项目(CX2016012);宁波市高校院所研发投入补助项目(2011B22012);
宁波市江北区农业项目(2012B04)
张瑞雪(1991—),女,硕士研究生,研究方向为食品化学工程与安全控制。E-mail:ruixuefennian@aliyun.com
*通信作者:袁勇军(1976—),男,副教授,博士,研究方向为微生物及其生物技术。E-mail:yuan2007019@aliyun.com
