番茄中交链孢菌及其产毒的防治技术研究进展
2017-12-11姜冬梅韦迪哲
王 瑶,姜冬梅,姜 楠,韦迪哲,王 蒙*
(北京农业质量标准与检测技术研究中心,农业部农产品质量安全风险评估实验室(北京),北京 100097)
番茄中交链孢菌及其产毒的防治技术研究进展
王 瑶,姜冬梅,姜 楠,韦迪哲,王 蒙*
(北京农业质量标准与检测技术研究中心,农业部农产品质量安全风险评估实验室(北京),北京 100097)
交链孢属真菌是导致番茄采后病害的主要病原菌,腐烂的番茄不仅造成巨大的经济损失,而且会在其腐烂部位及其周围健康组织中积累大量的真菌毒素。目前加工工艺的限制导致番茄制品也可能受到真菌毒素的污染,进而对人类和动物健康造成潜在的威胁(包括致癌、致畸、致突变等作用)。因此,本文综述了国内外番茄及其制品中交链孢毒素的污染情况,以及交链孢菌及其毒素污染防治技术的研究进展,以期为降低番茄及其制品的风险隐患提供参考。
交链孢菌;交链孢毒素;污染;防控
番茄是世界范围内最重要的蔬菜作物之一,但在其生产过程中易受数十种病原真菌的危害,其中交链孢菌(Alternaria spp.)可引起番茄的多种病害,如早疫病、茎枯病等,造成十分严重的经济损失[1-2]。不仅如此,该病原菌也是造成贮藏期番茄腐烂损失的主要原因。在适宜的条件下,交链孢菌浸染番茄果实后会积累交链孢毒素,对番茄及其加工制品的食用安全性造成威胁。长期以来,由于鲜食的果蔬在食用过程中会去除腐烂部位,番茄中的真菌毒素污染未引起足够的重视。由于当前果蔬加工技术的限制,在番茄汁、番茄酱等制品的工业生产过程中,主要是通过剔除腐烂部分降低毒素及致病菌污染的风险,但是这并不能有效消除番茄制品受真菌毒素污染的潜在风险。已有研究表明:番茄酱、番茄汁、番茄浆等制品中交链孢毒素检出率较高[3-7],特别是细交链孢酮酸(tenuazonic acid,TeA)的检出率最高,交链孢酚(alternariol,AOH)和交链孢酚单甲醚(alternariolmonometyl ether,AME)也有检出。AOH和AME具有诱变性和致癌性,已有研究显示这两种毒素与我国某些地区食管癌高发密切相关[8];欧洲食品安全局(European Food Safety Authority,EFSA)风险评估的结果也表明,随膳食摄入的AOH和AME对公众健康存在威胁[9]。TeA与AOH、AME具有协同作用,同时具有动物急性毒性[10]。尽管EFSA风险评估结果表明:随膳食摄入的TeA对欧洲居民健康不存在潜在威胁[9];但我国国家风险评估中心的结果表明:随膳食摄入的TeA对2~6 岁儿童存在健康威胁[11]。目前食品中的交链孢毒素污染已成为一个重要的公共卫生问题。本文就番茄及其制品中交链孢菌和交链孢毒素的污染、理化性质和防治措施等方面进行了综述,以期为降低番茄及其制品的真菌毒素污染风险提供参考。
1 交链孢菌及交链孢毒素
1.1 交链孢菌性质及其侵染方式
交链孢菌是一类既可腐生生长又可寄生生长的植物病原真菌,广泛存在于自然界中,以分生孢子进行无性繁殖,菌丝呈暗褐色、灰黑色至黑色。全世界已描述的500多个交链孢菌种级分类单位中,95%以上能够寄生在植物上,引起多种植物病害,引起番茄交链孢病害的病原菌主要是互隔交链孢(Alternaria alternata)和茄交链孢(Alternaria solani)[12-13]。交链孢菌能在低温条件下生长繁殖,生长所需的水分活度(water activity,aw)在0.84以上,是造成贮运过程中番茄腐烂变质的重要原因。在番茄种植期,病原菌能够穿透表皮侵染果实,也可从气孔侵入,一般有3 d左右的潜伏期,病发后形成病斑。分生孢子借助风雨向周围飘散,逐步扩大污染范围。病菌可在10~35 ℃温度范围内发育,最适温度为18~25 ℃[9]。采后交链孢菌侵染番茄主要有2 种形式:第一种是采后病原菌经过机械伤口侵染[12];第二种是生长期间的潜伏侵染。潜伏侵染是指交链孢菌侵入番茄组织后,由于果实抗性的存在不立即发病,而是等到环境条件和寄主条件适宜才表现出症状的一种侵染现象[14]。在潜伏阶段,病原菌保持低的代谢速率,当病原菌开始大量繁殖,寄生关系在番茄组织中开始显现,交链孢菌对番茄的侵染是一个主动的过程,它可分泌各种水解酶类(如角质酶、果胶酶、纤维素酶、半纤维素酶、磷脂酶和蛋白酶等)对番茄细胞壁进行水解,造成细胞的渗透胁迫,导致原生质体破裂死亡。
1.2 交链孢毒素
番茄腐烂部位及其周边健康组织能够积累大量真菌毒素。交链孢属真菌能够产生70多种次生代谢产物,统称为交链孢毒素(Alternaria toxins,ATs)[8]。Pose等[15]在番茄培养基上研究了aw和温度对互隔交链孢菌产毒情况的影响。结果表明,互隔交链孢菌在温度和aw分别为15~35 ℃和0.954~0.982时,均可产生AOH、AME和TeA,其中AOH的最适产生温度和aw分别为21 ℃和0.954;AME的最适产生温度和aw分别为35 ℃和0.954;而TeA的最适产生温度和aw分别为21 ℃和0.982;因此,21 ℃和较高的aw有利于互隔交链孢菌产生AOH和TeA,而较高温度和较高aw有利于产生AME。
根据毒素对寄主植物是否具有特异生理活性和高度专化作用位点,可将真菌毒素分为寄主特异性毒素(host-specific toxin,HST)和非寄主特异性毒素(nonhost specific toxin,NHST)。一般而言,HST是决定病原菌致病性的直接因素,而NHST可作为辅助因子参与致病过程[16],且一些如AME、AOH等毒素还可能对人类和动物的健康产生潜在危险。
1.2.1 寄主特异性交链孢毒素
HST对寄主具有较高的选择性,即只对产生该毒素的病原菌浸染的感病寄主表现毒性,而对抗病寄主或非寄主则不表现毒性。这类毒素是决定交链孢菌寄生范围和寄主高度专化性的直接致病因子,通常是具有不同结构的低分子质量次级代谢产物,只对具有毒素受体的相应寄主品种产生毒性[17]。现已报道有9 种交链孢菌产生的HST为AK、ACT、AAL、AF、ACR、AM、AT、AB、AP毒素[18-19]。各HST的寄主和致病作用如表1所示[20]。

表1 部分寄主特异性毒素的寄主范围及致病作用Table 1 Host range and pathogenic role of some host-speci fi c toxins
AAL毒素是从番茄交链孢(Alternaria alternata f. sp.lycopersici)中发现的一类HST(图1),其感病寄主是番茄,是交链孢菌引起番茄茎枯病的重要致病因子[21-22]。AAL毒素是丙三羧酸酯类化合物,包括TA1、TA2、TB1、TB2等,其中研究最多且毒性最强的是TA。它们的结构及毒性与伏马菌素相似,结构式如图1a、b所示。AAL毒素能抑制番茄组织中神经酰胺合成酶的活性,导致络合态神经酰胺的消耗及游离态鞘氨醇类自由基的积累,从而引起番茄组织中鞘脂类代谢发生中断,从而导致细胞死亡[23]。
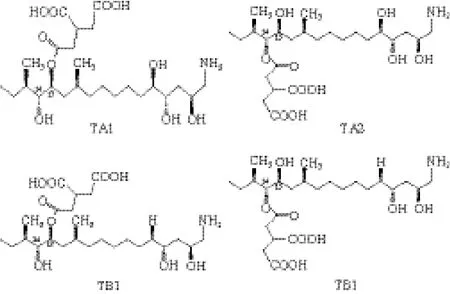
图1 AAL毒素 TA1、TA2、TB1和TB2的化学结构式Fig. 1 Structure of ALL (TA1、TA2、TB1、TB2)
1.2.2 非寄主特异性交链孢毒素
非寄主特异性交链孢毒素对寄主不表现选择性,能污染多种果蔬以及粮食作物,例如番茄、苹果、柑桔、小麦等。根据化学结构和理化性质的不同,可将非寄主特异性交链孢毒素分为4 类[8-9]。
第1类是二苯-α-吡喃酮类化合物,主要包括AOH、AME和交链孢烯(altenuene,ALT)。这类毒素在自然界中产毒量最高,分布最广,其毒性相对较小;但近期研究表明,AOH、AME、ALT能导致人体细胞突变[25],对胚胎和母体具有毒性,甚至可诱发培养的人食管上皮组织细胞癌变[26]。
第2类是四价酸类化合物,主要包括TeA及其异构体——异细交链格孢酮酸(iso-TeA)。TeA是导致动物急性中毒死亡的主要毒素,有催吐及心血管毒性两种基本毒性,可使动物表现多涎、呕吐、厌食、血液浓缩,造成循环系统损伤和出血性胃肠病,从而致动物死亡[31]。
第3类是二萘嵌苯醌类(戊醌类)化合物,主要包括交链孢毒素Ⅰ(altertoxin Ⅰ,ATX-Ⅰ)、ATX-Ⅱ和ATX-Ⅲ。
第4类是包括腾毒素(tentoxin,TEN)在内的其他结构类毒素。TEN是环四肽类毒素,它能干扰叶绿体合成,破坏其片层结构,抑制光合磷酸化作用,引起植物幼苗褪绿[33]。
部分NHST的名称及毒性如表2所示。
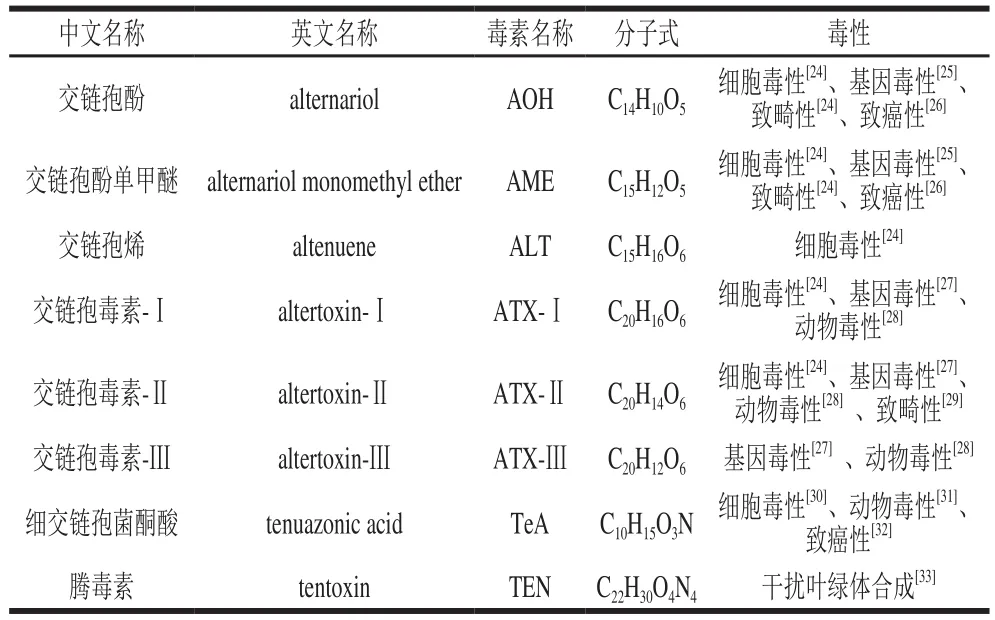
表2 部分非寄主特异性毒素分子式及毒性Table 2 Molecular formulaS and toxicity of some non-host speci fi c toxins
1.2.3 交链孢毒素风险评估及限量标准
由于一些交链孢毒素具有致突变性和遗传毒性等特点,EFSA食物链污染物专家组应欧洲委员会的要求,采用毒理学关注阈值(threshold of toxicological concern,TTC)法开展了食品中交链孢毒素对人类健康影响的风险评估工作。评估结果表明,对于具有基因毒性的AOH和AME,长期低剂量暴露超过了其相应TTC,因此可对AOH和AME的毒性作进一步研究。对于没有基因毒性的TeA和TEN,长期低剂量暴露未超过了其相应TTC,虽然这两种毒素对人体健康造成危害的风险较低,但仍需进一步关注[9]。目前为止,国内外现行有效的谷物、食品和饲料中真菌毒素限量标准中尚未规定交链孢毒素的限量。
2 番茄及其制品中交链孢毒素的污染情况
番茄极易受交链孢菌污染而发生腐败,与此同时在果实中积累交链孢毒素。目前番茄及其制品中交链孢毒素的检出率较高,特别是TeA。截至目前,已有不少国家和地区对当地番茄及番茄制品中交链孢毒素污染情况进行了调查。
早在1981年,Stinson等[34]调查美国市场上被交链孢菌侵染的番茄、苹果、桔子和柠檬时发现,番茄中的主要交链孢毒素是TeA,还有少量AOH、AME和ALT,其中TeA的检出率为57.9%,最高含量达139 mg/kg,果实中平均含量为17.6 mg/kg。Stack等[35]用液相色谱对来自美国番茄酱加工厂生产线的142 个番茄样品进行分析,结果发现73 个样品中检出TeA,果实中含量范围为0.4~70.0 mg/kg。
Motta等[3]用液相色谱对巴西番茄制品中交链孢毒素污染情况进行检测,结果表明,TeA的检出率最高,且未检测出AOH和AME。TeA在番茄浆和番茄酱中的检出率分别为31.8%和16.7%,含量分别为39~111 μg/kg和29~76 μg/kg。
Terminiello等[4]调研了阿根廷市售番茄酱中交链孢毒素污染情况,结果发现,番茄酱中TeA、AME和AOH的检出率较低,分别为28.8%、26.3%和6.3%。然而,阿根廷市售番茄酱中交链孢毒素含量较高,上述3 种毒素最高污染值分别为4.0、1.7 mg/kg和8.8 mg/kg。
Noser等[5]建立了一种超高效液相色谱-质谱检测方法,用于检测瑞士市售番茄及番茄制品中交链孢毒素。样品经酸性乙腈-水-甲醇提取后用固相萃取柱(solid phase extraction cartridges,SPE)净化,通过调节提取液的pH值可实现对TeA与其他5 种交链孢毒素的同时测定。对85 份来自瑞士市售的番茄制品进行了检测,结果发现,TeA的检出率为95.3%,最高含量达0.79 mg/kg,AOH和AME的检出率均为30.6%,其含量分别为4~33 μg/kg和1~9 μg/kg;另外在2 份番茄干样品中检测到了ALT和TEN,含量都为2 μg/kg。
Ackermann等[6]从苹果和番茄制品中筛选得到AOH的抗体,并建立了基于单克隆和多克隆抗体的2 种酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)快速检测方法,检测限分别为(35±6.9)pg/mL和(59±16)pg/mL。利用该方法对来自德国市售的番茄及其制品中AOH进行了测定,结果表明:AOH检出率为100%,检出的含量范围为1.0~13.0 μg/kg。Hickert等[7]利用改进的高效液相色谱-串联质谱法,定量检测来自德国市售的番茄酱中的9 种交链孢毒素,发现番茄制品中,AOH、AME和TeA的检出率分别为70.6%、79.4%和91.2%,平均污染量分别为13.0、2.5 μg/kg和200.0 μg/kg。
Zhao Kai等[11]对来自中国市场上的番茄及其制品中交链孢毒素的污染情况进行了检测分析,结果也表明,TeA是番茄制品中的主要交链孢毒素,31 个番茄酱样品中TeA、AOH、TEN和AME的检出率分别为100%、45.2%、83.9%和90.3%,含量分别为10.2~1 787.0、2.5~300.0、1.53~15.80 μg/kg和0.32~8.00 μg/kg。9 份番茄汁样品中未检测到AOH,而TeA、TEN和AME的检出率分别为100.0%、33.3%和77.8%,含量分别为7.4~278.0、1.85~5.70 μg/kg和0.2~5.8 μg/kg。
Lopez等[36]利用高效液相色谱-质谱法,对来自荷兰市面的8 个番茄酱样品交链孢毒素污染量进行检测,结果表明:番茄酱中AOH、AME和TeA的检出率均较高,分别为50%、50%和100%,含量分别为2.0~25.0、1.0~7.8 μg/kg和66~462 μg/kg。
3 交链孢毒素的防治措施
腐败果实中交链孢毒素的污染影响着人们的健康,因此,交链孢毒素的防治十分重要,目前主要是通过防止交链孢菌的污染来控制其毒素的污染,防治措施包括采前防治和采后防治。
3.1 采前防治
采前防治一般使用杀菌剂和诱抗剂控制病害,杀菌剂能够杀灭病原菌,减少果实受病原菌侵染几率,发病前需喷药保护,发病后应及时喷药控制病情,常用的杀菌剂有杀毒矾500 倍液、75%百菌清可湿性粉剂600倍液、58%甲霜灵锰锌可湿性粉剂500倍液、50%多菌灵可湿性粉剂500倍液等;诱抗剂防治是指在果实采前使用诱抗剂诱导果实采后对病菌的抗性,番茄果实经壳寡糖处理后,发病率明显降低,且发病果实的病斑明显减小[37]。同时也可配合采用种子消毒、轮作种植、合理密植、均衡施肥、合理灌溉等手段提高番茄植株免疫能力,从而减少病原菌的感染机会[38]。
3.2 采后防治
番茄属于典型的呼吸跃变型果实,采后容易发生衰老,且极易染病腐烂。因此,研究番茄的采后防治措施显得尤为重要,目前,番茄采后防治措施分为物理防治、化学防治和生物防治。
3.2.1 物理防治
3.2.1.1 热处理
利用果蔬的热学和其他物理化学特性,在贮藏前将果蔬置于35~50 ℃的热水、热空气或热蒸汽等热的环境中处理一段时间,以杀死病原菌或抑制其活动,可以调节果蔬的生理生化机能,从而达到防腐保鲜的目的[39]。热处理是国内外广泛研究的一种物理保鲜技术,具有无毒、无农药残留等优点,因而在新鲜果蔬贮藏中具有较好的应用前景。研究表明适当的热处理可以延长番茄的贮藏期,交链孢菌的孢子经60 ℃热处理15 s后,萌发率可降低48%[40]。由于热处理对番茄的贮藏品质有一定的影响,因此要选用适当的处理温度与处理时间组合。贮藏前38 ℃长时间(48~72 h)热空气处理或38~45 ℃短时间(1 h)热水处理可有效防止番茄腐烂,延长贮藏时间[40]。
3.2.1.2 短波紫外线处理
在果实贮藏前期,利用短波紫外线(ultraviolet-C,UV-C)(波长小于280 nm的紫外线)进行照射,可有效控制果实腐烂、延长采后贮藏期。Liu等[41]采用不同剂量(1.3~40.0 kJ/m2)的UV-C处理贮藏前的番茄果实,结果表明,低剂量(7.5 kJ/m2)UV-C照射处理番茄果实10 min后,果实的交链孢病害发病率降低了67%,病斑直径减少了9 mm,并且该处理能够显著延缓果实的后熟衰老,延长其贮藏期。此外,宋瑞芬等[42]的研究结果表明UV-C处理能抑制番茄的呼吸作用,并且能降低果实乙烯的释放量,因此,低剂量UV-C处理能不仅能杀菌,还能推迟呼吸和乙烯释放量高峰的出现。
3.2.1.3 γ射线辐照处理
食品辐照技术是一种利用γ射线、X射线以及电子束等电离辐射射线与物质产生物理、化学或生物效应,从而达到杀虫灭菌、防止霉变等目的的食品杀菌防霉技术。研究表明γ射线对交链孢菌的生长有较好的抑制作用,辐照剂量为5 kGy时,可有效抑制交链孢菌生长,当辐照剂量为10 kGy时,可完全抑制交链孢菌生长[43]。此外,γ射线照射能有效去除番茄制品中的交链孢毒素,如4 kGy的γ射线照射可完全消除番茄酱的TeA,3 kGy的γ射线可完全去除番茄汁中的TeA[44]。
3.2.2 化学防治
3.2.2.1 人工合成化学试剂
除一些传统的化学杀菌剂外,其他化学诱抗剂具有使用量少、污染小的优点,常用于番茄采后交链孢菌病害的防治,诱抗剂是基于病菌激发子和植物诱导抗病性原理而起防治植物病害作用的物质。常用的诱抗剂包括壳寡糖、水杨酸[45]、茉莉酸[46]、草酸、CaCl2、康壮素(harpin)、β-氨基丁酸等。壳寡糖常用于番茄采后交链孢病害抗性的诱导,其是由壳聚糖降解的聚合度很低的水溶性低聚糖[47],且无毒。祖庆勇[37]的研究结果表明,壳寡糖对交链孢菌孢子的萌发有明显的抑制作用,经壳寡糖处理的番茄果实发病率明显降低,且病斑直径明显减小。外源壳聚糖处理也可诱导番茄果实抗性物质日齐素(rishitin)的增加,进而抑制了贮藏期间AOH和AME毒素的累积[48]。Wojciechowska等[49]的研究结果表明,绿原酸能够降低交链孢菌在采后番茄上的定殖效率,当绿原酸质量浓度为650 μg/mL时,交链孢菌的定殖效率降低50%,同时,AOH和AME的合成受到抑制。
3.2.2.2 天然产物
一些天然植物提取物也对交链孢菌有一定的抑菌作用(表3)。植物精油具有抑菌谱广泛、环境友好和无毒无害等优点,添加植物精油可能成为未来果实采后贮藏控制的趋势。此外,姜、大蒜、七叶树树皮、黑茶藨子叶子提取物[50]、龙葵提取液[51]等对交链孢菌也有一定的抑菌作用。目前还有一些关于采后中草药抑菌的报道,黄连根茎提取液对交链孢菌的最小抑菌质量浓度为0.05 g/L,抑菌率达到100%[52]。北豆根、黄柏、鹿蹄草素、厚朴等中草药都对交链孢菌有抑菌效果[53-54]。

表3 部分抑制交链孢菌的精油Table 3 Partially inhibition of plant oils to Altenaria spp.
3.2.3 生物防治
利用拮抗微生物可重新建立果蔬表面的微生物类群,利用微生物之间的拮抗作用,选用对果蔬没有危害的微生物来抑制病害发生。拮抗微生物防治果实采后病害机理尚不明确,目前比较受认可的观点有以下几方面:利用拮抗微生物与病原菌之间的竞争作用(如竞争营养和空间);利用拮抗微生物产生的抑菌物质抑制病原菌生长;拮抗菌附着在病原菌菌丝上抑制病原菌生长;拮抗菌分泌诱导果实抗病性的物质。近年来,国内外相继对利用拮抗菌防治果蔬采后病害做了广泛研究。拮抗菌的分离主要有以下几种途径:从果实表面分离;从过失伤口处分离;从土壤、根系等处分离;从果实内部分离。对交链孢菌有拮抗作用的细菌主要包括假单胞菌属(Pseudomonas spp.)、芽孢杆菌属(Bacillus spp.)、红酵母(Rhodotorula glunitis)和沙雷菌属(Serratia spp.)等。真菌主要有木霉(Trichoderma spp.)、粉红黏帚霉(Gliocladium roseum)、出芽短梗霉菌(Aureobasidium pullulans)等。另外,酵母菌也是一类主要的生防菌,罗伦隐球酵母(Cryptococcus laurentii)[59]、海洋黏红酵母(Rhodosporidium paludigenum)[60]等均对交链孢菌表现出较明显的拮抗作用。酵母菌作为拮抗菌的优势在于:能够在干燥条件下长时间存活于果蔬表面;产生的胞外多糖类物质提高自身存活能力的同时,能够抑制病原菌生长;快速利用营养物质进行繁殖;农药和一些杀虫剂对其影响小;环保、无污染、不产生抗生素,且对人体无害。
微生物代谢产物主要包括抗生素、多糖类物质、抗菌蛋白和多肽等。抗生素的应用比较广泛,防治交链孢病害多使用可可链霉菌产生的多抗霉素(polyoxin),主要成分为polyoxin A和polyoxin B,其作用位点是真菌细胞壁。大部分的抗菌蛋白和大部分抗菌多肽能够抑制菌丝的生长和孢子的萌发。多糖类物质也有一定的抑菌作用,在多种微生物甚至植物体内都提取到了具有抑菌活性的几丁质酶,但其用于防治果蔬采后交链孢病害还鲜有报道;Yan Fujie等[61]的研究表明,拮抗酵母与绿脓假单胞菌产生的鼠李糖配合使用,能够增强其拮抗作用,单独使用鼠李糖使番茄腐烂程度降低30%,而鼠李糖配合拮抗酵母使用能使番茄腐烂程度降低60%。
4 结 语
交链孢属真菌及其产生的毒素严重影响着农作物的产量与质量,造成经济损失的同时也威胁着人和动物的健康。交链孢毒素的毒性虽不及黄曲霉毒素、赭曲霉毒素、呕吐毒素等毒性强烈,但也有潜在的遗传毒性和致癌性,所以仍不容小觑。目前国际上还没有针对交链孢毒素的限量标准,但EFSA应欧洲委员会的要求,已经对食品中交链孢毒素对人类健康的影响进行了相关风险评估工作,说明人们已经十分重视交链孢毒素可能引起的食品安全隐患。近年来,针对交链孢菌引起的植物病害防治研究已有一定进展,但大多是防治手段仍处于实验探索阶段。一些农用抗生素、拮抗菌、拮抗菌代谢产物以及植物提取物,在前期的研究中均表现出较好的防病效果,体现出其具有较大开发潜力,因此研究人员可进一步深入研究探索,尽早实现市场化。
[1] 吴仁锋, 汪志红. 番茄早疫病研究概述[J]. 中国植保导刊, 2009,29(3): 16-18.
[2] 裴冬丽, 洪权春, 丁锦平, 等. 番茄茎枯病病原菌鉴定[J]. 河南农业科学, 2013, 42(6): 95-97. DOI:10.15933/j.cnki.1004-3268.2013.06.016.
[3] MOTTA S D, VALENTE SOARES L M. Survey of Brazilian tomato products for alternariol, alternariol monomethyl ether, tenuazonic acid and cyclopiazonic acid[J]. Food Additives & Contaminants, 2001,18(7): 630-634. DOI:10.1080/02652030117707.
[4] TERMINIELLO L, PATRIARCA A, POSE G, et al. Occurrence of alternariol, alternariol monomethyl ether and tenuazonic acid in Argentinean tomato puree[J]. Mycotoxin Research, 2006, 22(4):236-240. DOI:10.1007/BF02946748.
[5] NOSER J, SCHNEIDER P, ROTHER M, et al. Determination of six Alternaria, toxins with UPLC-MS/MS and their occurrence in tomatoes and tomato products from the Swiss market[J]. Mycotoxin Research, 2011, 27(4): 265-271. DOI:10.1007/s12550-011-0103-x.
[6] ACKERMANN Y, CURTUI V, DIETRICH R, et al. Widespread occurrence of low levels of alternariol in apple and tomato products,as determined by comparative immunochemical assessment using monoclonal and polyclonal antibodies[J]. Journal of Agricultural and Food Chemistry, 2011, 59(12): 6360-6368. DOI:10.1021/jf201516f.
[7] HICKERT S, BERGMANN M, ERSEN S, et al. Survey of Alternaria,toxin contamination in food from the German market, using a rapid HPLC-MS/MS approach[J]. Mycotoxin Research, 2016, 32(1): 1-12.DOI:10.1007/s12550-015-0233-7.
[8] 王蒙, 姜楠, 戴莹, 等. 国内外水果真菌毒素的限量及检测方法标准分析[J]. 食品安全质量检测学报, 2016, 7(2): 459-467.
[9] EFSA panels on contaminants in the food chain (CONTAM).Scientif i c opinion on the risks for animal and public health related to the presence of alternaria toxins in feed and food[J]. EFSA Journal,2011, 9(10): 2407-2415.
[10] BARKAI-GOLAN R, PASTER N. Mouldy fruits and vegetables as a source of mycotoxins: part 1[J]. World Mycotoxin Journal, 2008, 1(2):147-159.
[11] ZHAO Kai, SHAO Bing, YANG Dajin, et al. Natural occurrence of four Alternaria mycotoxins in tomato- and citrus-based foods in China[J]. Journal of Agricultural and Food Chemistry, 2014, 63(1):343-348. DOI:10.1021/jf5052738.
[12] 谢红辉. 链格孢属部分种的分类研究现状[J]. 农业研究与应用,2012(4): 28-33.
[13] 李平. 新疆加工番茄主要真菌病害病原鉴定及早疫病防治和毒素致病机理研究[D]. 石河子: 石河子大学, 2014: 11-13.
[14] 毕阳. 果蔬采后病害原理与控制[M]. 北京: 科学出版社, 2016: 112-114.
[15] POSE G, PATRIARCA A, KYANKO V, et al. Water activity and temperature effects on mycotoxin production by Alternaria alternata on a synthetic tomato medium[J]. International Journal of Food Microbiology, 2010, 142(3): 348-353. DOI:10.1016/j.ijfoodmicro.2010.07.017.
[16] 耿锐梅, 张建萍, 余柳青. 植物病原菌毒素的种类、作用机理和应用前景[J]. 浙江农业学报, 2007, 19(5): 393-398.
[17] TSUGE T, HARIMOTO Y, AKIMITSU K, et al. Host-selective toxins produced by the plant pathogenic fungus Alternaria alternata[J]. Fems Microbiology Reviews, 2013, 37(1): 44-66. DOI:10.1111/j.1574-6976.2012.00350.x.
[18] 万佐玺, 强胜, 李扬汉. 链格孢菌寄主选择性毒素的研究现状[J]. 湖北民族学院学报(自然科学版), 2001, 19(4): 19-22.
[19] 王洪秀, 张倩, 王玲杰, 等. 链格孢菌毒素合成相关基因研究进展[J]. 中国生物工程杂志, 2015, 35(11): 92-98. DOI:10.13523/j.cb.20151113.
[20] TSUGE T, HARIMOTO Y, AKIMITSU K, et al. Host-selective toxins produced by the plant pathogenic fungus Alternaria alternata[J].FEMS Microbiology Reviews, 2013, 37(1): 44-66. DOI:10.1111/j.1574-6976.2012.00350.x.
[21] BRANDWAGT B F, KNEPPERS T J A, NIJKAMP H J J, et al.Overexpression of the tomato Asc-1 gene mediates high insensitivity to AAL toxins and fumonisin B1in tomato hairy roots and confers resistance to Alternaria alternata f. sp. lycopersici in Nicotiana umbratica plants[J]. Molecular Plant-Microbe Interactions, 2002,15(1): 35-42. DOI:10.1094/MPMI.2002.15.1.35.
[22] EGUSA M, OZAWA R, TAKABAYASHI J, et al. The jasmonate signaling pathway in tomato regulates susceptibility to a toxindependent necrotrophic pathogen[J]. Planta, 2009, 229(4): 965-976.DOI:10.1007/s00425-009-0890-x.
[23] GECHEV T S, GADJEV I Z, HILLE J. An extensive microarray analysis of AAL-toxin-induced cell death in Arabidopsis thaliana brings new insights into the complexity of programmed cell death in plants[J]. Cellular and Molecular Life Sciences, 2004, 61(10): 1185-1197.DOI:10.1007/s00018-004-4067-2.
[24] PERO R W, POSNER H, BLOIS M, et al. Toxicity of metabolites produced by the “Alternaria”[J]. Environmental Health Perspectives,1973, 4(4): 87-94. DOI:10.1289/ehp.730487.
[25] SCHRADER T J, CHERRY W, SOPER K, et al. Further examination of the effects of nitrosylation on Alternaria alternata, mycotoxin mutagenicity in vitro[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2006, 606(1/2): 61-71. DOI:10.1016/j.mrgentox.2006.02.008.
[26] LIU G T, QIAN Y Z, ZHANG P, et al. Etiological role of Alternaria alternata in human esophageal cancer[J]. Chinese Medical Journal,1992, 105(5): 394-400.
[27] STACK M E, PRIVAL M J. Mutagenicity of the Alternaria metabolites altertoxins Ⅰ, Ⅱ, and Ⅲ[J]. Applied & Environmental Microbiology, 1986, 52(4): 718-722.
[28] BOUTIN B K, PEELER J T, TWEDT R M. Effects of purified altertoxins Ⅰ, Ⅱ, and Ⅲ in the metabolic communication V79 system[J]. Journal of Toxicology & Environmental Health, 1989,26(1): 75-81. DOI:10.1080/15287398909531234.
[29] FLECK S C, BURKHARDT B, PFEIFFER E, et al. Alternaria, toxins:altertoxin Ⅱ is a much stronger mutagen and DNA strand breaking mycotoxin than alternariol and its methyl ether in cultured mammalian cells[J]. Toxicology Letters, 2012, 214(1): 27-32. DOI:10.1016/j.toxlet.2012.08.003.
[30] TANG J J. Environmental, genetic and cellular toxicity of tenuazonic acid isolated from Alternaira alternata[J]. African Journal of Biotechnology, 2008, 7(8): 29-34.
[31] LOGRIECO A, BOTTALICO A, MULÉ G, et al. Epidemiology of toxigenic fungi and their associated mycotoxins for some Mediterranean crops[J]. European Journal of Plant Pathology, 2003,109(7): 645-667.
[32] YEKELER H, BITMIŞ K, OZÇELIK N, et al. Analysis of toxic effects of Alternaria toxins on esophagus of mice by light and electron microscopy[J]. Toxicologic Pathology, 2001, 29(4): 492-497.
[33] STEELE J A, UCHYTIL T F, DURBIN R D, et al. Chloroplast coupling factor 1: a species-specific receptor for tentoxin[J].Proceedings of the National Academy of Sciences of the United States of America, 1976, 73(7): 2245-2248.
[34] STINSON E E, OSMAN S F, HEISLER E G, et al. Mycotoxin production in whole tomatoes, apples, oranges, and lemons[J]. Journal of Agricultural and Food Chemistry, 1981, 29(4): 790-792.
[35] STACK M E, MISLIVEC P B, ROACH J A, et al. Liquid chromatographic determination of tenuazonic acid and alternariol methyl ether in tomatoes and tomato products[J]. Journal Association of Off i cial Analytical Chemists, 1985, 68(4): 640-642.
[36] LÓPEZ P, VENEMA D, DE RIJK T, et al. Occurrence of Alternaria toxins in food products in the Netherlands[J]. Food Control, 2016, 60:196-204. DOI:10.1016/j.foodcont.2015.07.032.
[37] 祖庆勇. 壳寡糖诱导番茄抗交链孢菌及菌毒素提取研究[D]. 天津:天津科技大学, 2014: 42-48.
[38] 郭明娟. 番茄早疫病的发生与防治措施[J]. 农民致富之友,2016(5): 129.
[39] 孔祥佳, 郑俊峰, 林河通, 等. 热处理对果蔬贮藏品质和采后生理的影响及应用[J]. 包装与食品机械, 2011, 29(3): 34-39.
[40] FALLIK E, AHARONI Y, COPEL A, et al. Reduction of postharvest losses of Galia melon by a short hot-water rinse[J]. Plant Pathology,2000, 49(3): 333-338. DOI:10.1046/j.1365-3059.2000.00467.x.
[41] LIU J, STEVENS C, KHAN A V, et al. Application of Ultraviolet-C light on storage rots and ripening of tomatoes[J]. Journal of Food Protection, 1993, 56(10): 868-873.
[42] 荣瑞芬, 冯双庆. 不同剂量短波紫外线照射对采后番茄后熟和发病的影响[J]. 中国农业大学学报, 2001, 6(1): 68-73.
[43] BRAGHINI R, POZZI C R, AQUINO S, et al. Effects of γ-radiation on the fungus Alternaria alternata in artificially inoculated cereal samples[J]. Applied Radiation and Isotopes, 2009, 67(9): 1622-1628.DOI:10.1016/j.apradiso.2009.03.004.
[44] AZIZ N H, FARAG S, HASSANIN M A. Effect of gamma irradiation and water activity on mycotoxin production of Alternaria in tomato paste and juice[J]. Die Nahrung, 1991, 35(4): 359-362.
[45] MURPHY A M, HOLCOMBE L J, CARR J P. Characteristics of salicylic acid-induced delay in disease caused by a necrotrophic fungal pathogen in tobacco[J]. Physiological & Molecular Plant Pathology,2000, 57(2): 47-54. DOI:10.1006/pmpp.2000.0280.
[46] RYALS J, UKES S, WARD E. Systemic Acquired Resistance[J].Plant Physiology, 1994, 1(4): 179-184. DOI:10.1146/annurev.phyto.42.040803.140421.
[47] 娄予强, 叶燕萍, 申章佑, 等. 壳寡糖及低聚壳聚糖在农业上应用研究综述[J]. 科技创新导报, 2009(22): 1-2. DOI:10.16660/j.cnki.1674-098x.2009.22.023.
[48] REDDY M V B, ANGERS P, CASTAIGNE F, et al. Chitosan effects on blackmold rot and pathogenic factors produced by Alternaria alternata in postharvest tomatoes[J]. Journal of the American Society for Horticultural Science, 2000, 125(6): 742-747.
[49] WOJCIECHOWSKA E, WEINERT C H, EGERT B, et al.Chlorogenic acid, a metabolite identif i ed by untargeted metabolome analysis in resistant tomatoes, inhibits the colonization by Alternaria alternata, by inhibiting alternariol biosynthesis[J]. European Journal of Plant Pathology, 2014, 139(4): 735-747. DOI:10.1007/s10658-014-0428-3.
[50] STOMPOR-CHRZAN E. Response of damping-off fungi on the presence of plant extracts on agar substrate[J]. Bulletiln of the Polish Academy of Sciences Biological Sciences, 2001, 49(4): 404-411.
[51] 武藤真知子, 高桥久光, 石原邦, 等. 龙葵抽出物防治十字花科蔬菜黑斑病[J]. 植物病理学会刊, 2005, 14(1): 25-34.
[52] 刘畅, 任艳芳, 何俊瑜, 等. 中草药提取液对3 种柑橘病原菌的抑制作用[J]. 西南农业学报, 2011, 24(1): 132-136.
[53] 哈斯格根. 中草药提取物对番茄采后主要病原真菌的抑制作用和机理的研究[D]. 呼和浩特: 内蒙古农业大学, 2009: 17-22.DOI:10.16213/j.cnki.scjas.2011.01.020.
[54] 吴振宇, 艾启俊, 王燕, 等. 中草药提取物对链格孢菌抑制作用增效组合的研究[J]. 食品科学, 2009, 30(3): 36-38.
[55] CHEN Q R, XU S X, WU T, et al. Effect of citronella essential oil on the inhibition of postharvest Alternaria alternata in cherry tomato[J].Journal of the Science of Food & Agriculture, 2014, 94(12): 2441-2447.DOI:10.1002/jsfa.6576.
[56] XU S, YAN F, NI Z, et al. In vitro, and in vivo, control of Alternaria alternata, in cherry tomato by essential oil from Laurus nobilis of Chinese origin[J]. Journal of the Science of Food and Agriculture,2014, 94(7): 1403-1408. DOI:10.1002/jsfa.6428.
[57] LELAH Y, NEDA M. Antifungal activity of Satureja hortensis L.essential oil against alternaria citri[J]. European Journal of Experimental Biology, 2014, 4(1): 399-403.
[58] GULERRIA S, TIKU A K, GUPTA S, et al. Chemical composition,antioxidant activity and inhibitory effects of essential oil of Eucalyptus teretecornis grown in north-western Himalaya against Alternaria alternata[J]. Journal of Plant Biochemistry and Biotechnology, 2012,21(1): 44-50. DOI:10.1007/s13562-011-0073-2.
[59] CHEN Y, ZHOU T, SHENG K, et al. Effect of pyrimethanil on Cryptococcus laurentii, Rhodosporidium paludigenum, and Rhodotorula glutinis, biocontrol of Penicillium expansum, infection in pear fruit[J]. International Journal of Food Microbiology, 2013,164(2/3): 155-160. DOI:10.1016/j.ijfoodmicro.2013.04.012.
[60] WANG Y, REN X, SONG X, et al. Control of postharvest decay on cherry tomatoes by marine yeast Rhodosporidium paludigenum, and calcium chloride[J]. Journal of Applied Microbiology, 2010, 109(2):651-656.
[61] YAN Fujie, XU Shixiang, CHEN Yushu, et al. Effect of rhamnolipids on Rhodotorula glutinis biocontrol of Alternaria alternata infection in cherry tomato fruit[J]. Postharvest Biology and Technology, 2014,97(3): 32-35. DOI:10.1016/j.postharvbio.2014.05.017.
Research Progress in the Control of Alternaria Species and Its Toxin Accumulation in Tomato Fruits
WANG Yao, JIANG Dongmei, JIANG Nan, WEI Dizhe, WANG Meng*
(Risk Assessment Laboratory for Agro-Products (Beijing), Ministry of Agriculture, Beijing Research Center for Agricultural Standards and Testing, Beijing 100097, China)
Alternaria spp. is the most important pathogen causing tomato diseases. Rotten tomatoes not only bring huge fi nancial loss, but also accumulate mycotoxins in the lesion and surrounding tissues. Due to the restriction of processing technology, tomato products were also contaminated by mycotoxins, which could result in carcinogenesis, teratogenesis and mutagenesis, thereby causing a potential threat to human and animal health. This review summarized the contamination of Alternaria toxins on tomato and tomato-derived products in domestic and aboard, and the control of Alternaria and its mycotoxin, in order to provide the reference for reducing the safety risk on tomato and its products.
Alternaria; Alternaria toxins; contamination; control
10.7506/spkx1002-6630-201723044
R155.5
A
1002-6630(2017)23-0275-07
王瑶, 姜冬梅, 姜楠, 等. 番茄中交链孢菌及其产毒的防治技术研究进展[J]. 食品科学, 2017, 38(23): 275-281.
DOI:10.7506/spkx1002-6630-201723044. http://www.spkx.net.cn
WANG Yao, JIANG Dongmei, JIANG Nan, et al. Research progress in the control of Alternaria species and its toxin accumulation in tomato fruits[J]. Food Science, 2017, 38(23): 275-281. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723044. http://www.spkx.net.cn
2016-10-23
“十三五”国家重点研发计划重点专项(2016YFD0400902);
国家农产品质量安全风险评估重大专项(GJFP2017013);北京市农林科学院青年基金项目(QNJJ2015018)
王瑶(1990—),女,硕士,研究方向为农产品质量与食物安全。E-mail:wangyao900711@126.com
*通信作者:王蒙(1980—),女,副研究员,博士,研究方向为农产品质量安全与标准。E-mail:ameng-001@163.com
