小麦淀粉老化动力学及玻璃化转变温度
2017-12-11陈凤莲付大伟
赵 凯,李 君,刘 宁,陈凤莲,付大伟
(哈尔滨商业大学 食品科学与工程省级重点实验室,黑龙江 哈尔滨 150076)
小麦淀粉老化动力学及玻璃化转变温度
赵 凯,李 君,刘 宁,陈凤莲,付大伟
(哈尔滨商业大学 食品科学与工程省级重点实验室,黑龙江 哈尔滨 150076)
采用差示扫描量热法研究不同温度及储藏时间下小麦淀粉不同组分(小麦总淀粉、小麦A淀粉、小麦B淀粉)的老化动力学及最大冷冻浓缩状态下玻璃化转变温度(glass transition temperature of the maximally freezeconcentrated state,Tg’)。测定小麦淀粉各组分于-18、-5、4、22 ℃储藏3~21 d的老化度、Tg’及非冻结水含量。结果表明,不同淀粉组分在-18 ℃下储藏未发生老化,而在-5、4、22 ℃条件下储藏会发生老化,且4 ℃时的老化度最大,22 ℃时的老化度最小,-5 ℃时的老化度居两者之间;小麦B淀粉的Tg’比A淀粉的Tg’高。小麦淀粉不同组分老化动力学存在差异,小麦A淀粉的老化度较总淀粉及B淀粉大;非冻结水的含量对不同组分小麦淀粉Tg’有很大影响。
小麦淀粉;老化动力学;差示扫描量热法;玻璃化转变温度;储藏稳定性
淀粉是食品工业重要的基础原料,而淀粉的老化及玻璃化转变均与食品的加工及储藏特性密切相关。淀粉老化是部分或完全糊化淀粉分子由无序态转向有序态的过程,其中的直链淀粉分子、支链淀粉分子的侧链区域,通过氢键结合,相互靠拢,重新结合形成双螺旋晶体结构[1-3],淀粉老化会影响食品感官及加工品质,如造成质构劣化、口感粗糙、透明度下降等。有关淀粉老化的机理、影响因素、特性、应用及抑制方法,已有较多相关报道[4-8]。调控淀粉老化进程,对于淀粉类食品加工及食用品质的改良具有重要的意义。
淀粉是半结晶聚合物[9],存在以下3 种聚集状态:玻璃态、橡胶态及熔融态[10]。在3 种独立的聚集状态之间存在着温度转变区,其中玻璃化转变区域对于谷物低水分食品及谷物冷冻食品的加工与储藏具有重要理论意义及应用价值。玻璃化转变温度(glass transition temperature,Tg)是非晶态聚合物的一个重要的物理性质,会影响产品的加工及储藏性能[11-12]。在Tg测定时会涉及两种情况:一种为低水分体系(一般在20%以下)的Tg,通常采用常速差示扫描量热(differential scanning calorimetry,DSC)法或高速DSC法进行测定,测定方式取决于Tg信号是否明显,如果常速即可明确获得Tg值,则不必采用高速DSC[13-15];另一种为过量水分体系Tg的测定,在该条件下(一般在20%以上)对体系进行冷冻浓缩时,一般采用“最大冷冻浓缩状态下玻璃化转变温度(Tgof the maximally freeze-concentrated state,Tg’)”来表示,Tg’是特定的Tg,特指在过量水分含量条件下进行冷冻处理时,体系达到最大冷冻浓缩状态时对应的在此状态下,体系内的游离水都形成冰晶,视溶液组成不同,会残存少量的非冻结水。由于此时玻璃化转变信号很微弱,一般采用对热流曲线取一阶导数的方法来放大响应信号,这是业内普遍采用并被广泛认可的方法[3,17-20]。玻璃化转变属于二级相变,在冰-水相变前发生,而冰-水相变则会形成巨大的吸热峰,玻璃化转变发生在冰-水相变起始温度之前,会在一阶导数曲线上形成一个明显的信号峰,该峰值对应的温度即为Tg’。
研究小麦淀粉的老化动力学及各组分Tg’并分析其相关性,可更深入理解淀粉对谷物食品加工及储藏性能的影响,进而改进生产工艺,提高产品品质。
1 材料与方法
1.1 材料与试剂
小麦粉 青岛百乐麦食品有限公司;小麦总淀粉、小麦A淀粉、小麦B淀粉为哈尔滨商业大学食品科学与工程省级重点实验室自制;氢氧化钠、甲醇、石油醚、碘、乙醇、甲苯均为分析纯试剂。
1.2 仪器与设备
DSC4000 DSC仪 美国Perkin Elmer公司;DF-101S集热式恒温加热磁力搅拌器 郑州亚荣仪器有限公司;TDL-5-A离心机 上海安亭科学仪器厂;DHG-9420A电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;FW80-I高速万能粉碎机 天津市泰斯特仪器有限公司;SU8000扫描电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 小麦淀粉的制备
称取适量市售小麦粉加水调制成面团,静置20~30 min,加水反复搓洗,至洗出水用碘液测试不变色。提取液过300 目尼龙布,3 000 r/min离心15 min,弃上清液,去除沉淀上层少量黄色物质,将沉淀经醇洗、离心后于40 ℃烘干得小麦粗淀粉[21-22]。
称取适量小麦粗淀粉加一定量蒸馏水及甲苯(9∶1,V/V),常温搅拌12 h,然后静置12 h,去除上层蛋白,重复上述步骤直至上层甲苯无浑浊为止。然后将淀粉乳于4 000 r/min离心10 min,弃上清液,下层沉淀醇洗2 次,离心后于40 ℃烘干得小麦淀粉[23]。
1.3.2 小麦A、B淀粉的分离及纯化
小麦A、B淀粉的分离方法参照Takeda[24]与Ao Zihua[25]等的沉降法。将淀粉与水制成一定质量浓度的悬浮液,静置1 h后收集沉淀,该沉淀即为A淀粉颗粒,此过程重复8~9 次;静置20 h后再次收集沉淀,得B淀粉颗粒,此过程重复5~6 次。将分离后的A、B淀粉颗粒悬浮液分别离心、醇洗。用尼龙布过滤得淀粉,在恒温干燥箱内40 ℃烘干,得到小麦A、B淀粉。
1.3.3 颗粒形貌观察
使用S-3400N型扫描电子显微镜,将待测样品用双面胶固定在样品台上,采用离子溅射法在样品的表面喷金。实验条件为:喷金180 s,电流20 mA。
1.3.4 小麦淀粉不同组分老化动力学
将小麦淀粉与蒸馏水按1∶2(m/m)比例置于DSC仪铝盘中,密封、室温下平衡2 h。以空皿作为参比,采用10 ℃/min的升温速率,从20 ℃升温到110 ℃,测定糊化起始温度(onset temperature,To)、糊化峰值温度(peak temperature,Tp)、糊化完成温度(conclusion temperature,Tc)以及糊化焓(gelatinization enthalpy,ΔHgel)。每个样品均测试3 次,取平均值。
完全糊化的小麦淀粉各组分于-18、-5、4、22 ℃储藏3~21 d,测定其老化所形成结晶体发生熔融作用的To、Tp、Tc及老化焓(retrogradation enthalpy,ΔHret)。按式(1)计算老化度(retrogradation degree,RD)。

式中:ΔHret为老化焓/(J/g);ΔHgel为糊化焓/(J/g)。可根据Avrami方程分析淀粉老化动力学,如式(2)、(3)所示。
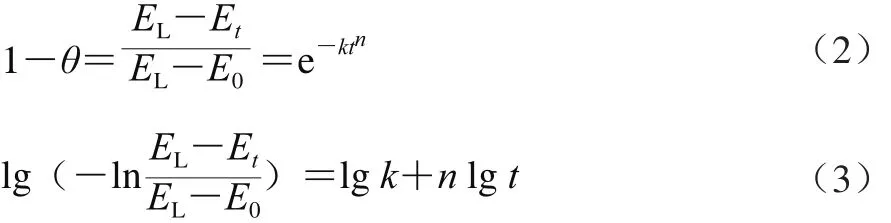
式中:E0为零时刻热焓/(J/g);Et为反应进行到t时刻的热焓/(J/g);EL为最大热焓/(J/g);θ为t时刻的结晶度/%;t是结晶时间;k是结晶速率常数;n表征成核及晶核生长方式的整数,又称Avrami指数。Avrami指数与成核的机理和生长方式有关,其数值等于生长的空间维数和成核过程的时间维数之和。淀粉老化时所形成的结晶,其成核及生长方式是同时形成且线性一维生长的,所以其Avrami指数值n=1。当Avrami指数值n=1时,得到最理想的速率常数k值(1/k为时间常数),k值由ln(EL-Et)对时间t作图所得直线的斜率来表示[26]。
1.3.5 Tg’的确定
不同组分的Tg’采用DSC法进行测定。将小麦淀粉与蒸馏水按1∶2(m/m)比例置于DSC仪铝盘中,密封、室温下平衡2 h。以空皿作为参比,样品先在20 ℃恒温1 min,然后采用10 ℃/min升温速率从20 ℃升至110 ℃使淀粉充分糊化,再以10 ℃/min速率降至-50 ℃并恒温2 min充分冻结,然后以10 ℃/min升至20 ℃。得到热流曲线,然后对其取一阶导数得Tg’[3,20],具体过程如图1所示,其中,实线为热流曲线,虚线为相应的一阶导数曲线,箭头位置峰对应的温度即为Tg’。

图1 小麦淀粉Tg’的测定示意图Fig. 1 Heat fl ow curve showing Tg’ of wheat starch
1.3.6 非冻结水含量测定
参照Schenz等[27]的方法,将淀粉与蒸馏水分别以不同比例混合置于铝皿中,密封、室温下平衡2 h。以空皿作为参比,在20 ℃恒温1 min,以5 ℃/min的升温速率,降至-50 ℃并恒温2 min,再以5 ℃/min升至30 ℃。计算峰面积焓值,而后作图,用标准曲线反推与横轴的交点代表无吸热焓值时的水分含量,即为非冻结水含量。
1.4 数据统计分析
利用SPSS 13.0软件单因素方差分析法对实验数据进行显著性分析,采用Origin 9.0软件进行绘图。
2 结果与分析
2.1 小麦淀粉不同组分颗粒形貌
从图2a可以看出小麦总淀粉由两种类型的颗粒构成:A型淀粉颗粒,直径约10~35 μm的圆盘形、扁球形(图2b);B型淀粉颗粒是直径约为2~10 μm的球形(图2c)。B型淀粉的形状并不均一,其不完整程度和边缘破损程度均较A型淀粉高,而A型淀粉颗粒表面光滑,有明显的“赤道槽”,B型淀粉颗粒则没有,这与顾正彪等[28]观察到的现象一致。由图2c可见,B型淀粉有团聚的现象,而且颗粒较大的B型淀粉与颗粒较小的各自聚集。B型淀粉在数量上明显的多于A型淀粉。

图2 小麦淀粉不同组分的颗粒形貌Fig. 2 Morphology of different wheat starch granules
2.2 小麦淀粉不同组分的糊化特性与非冻结水含量
从表1可以看出,分离后小麦B淀粉的Tp及Tc高于小麦总淀粉,而To低于小麦总淀粉及小麦A淀粉,这可能是由于小麦A淀粉的粒径(约10~35 μm)大于小麦B淀粉粒径(2~10 μm),而且A淀粉颗粒的表面有沟状的凹槽,其附近结晶度较低,易于糊化,这与朱帆等[29]对于小麦淀粉研究结果一致。小麦B淀粉颗粒较小麦总淀粉及小麦A淀粉的糊化温程Tc-To大,这与相关文献[25,30]报道的小麦B淀粉比小麦A淀粉颗粒有更大的糊化温度范围结论类似。淀粉颗粒是半晶体结构,ΔH是表征晶体结构被破坏所需的热焓值,小麦A、B淀粉的糊化焓无明显差异,但略低于总淀粉糊化焓值,说明A、B淀粉相转变时用于解开双螺旋所需的能量降低。

表1 小麦淀粉各组分糊化性质Table 1 Gelatinization properties of different wheat starches

图3 小麦淀粉不同组分非冻结水含量Fig. 3 Unfrozen water content of different wheat starches
由图3可知,小麦总淀粉的非冻结水含量高于小麦A淀粉和小麦B淀粉,同理小麦A淀粉的非冻结水量高于小麦B淀粉,由于水可作为增塑剂,增加了处于玻璃态的淀粉无定型区域的链段活动性,使其自由体积增加,导致了小麦总淀粉的Tg’比小麦A淀粉及小麦B淀粉的Tg’低。
2.3 小麦淀粉不同组分老化动力学
小麦淀粉在储藏过程中,糊化后的淀粉分子从无序结构转为有序结构,重新排列形成重结晶,其老化焓值越大则说明重结晶越多,即老化程度越严重。小麦淀粉在不同温度下储藏3、7、14、21 d后,用DSC仪对其进行测定,分析其在储藏期间的热力学性质的变化。

表2 在4 ℃下储藏不同时间小麦不同组分淀粉的DSC仪参数及老化度Table 2 DSC parameters and retrogradation degree of different wheat starches during storage at 4 ℃
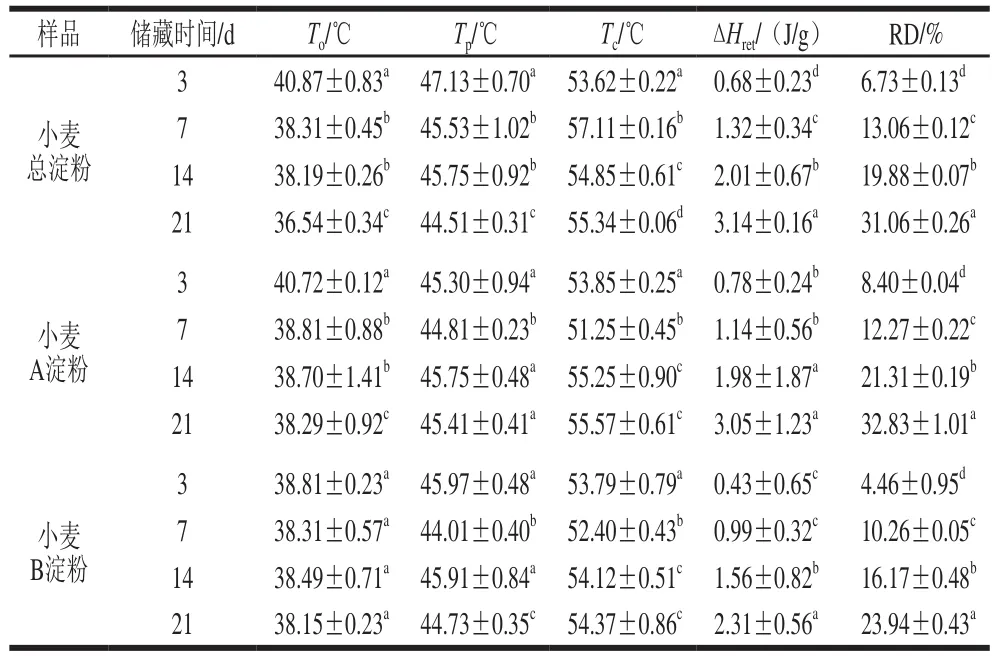
表3 在-5 ℃下储藏不同时间小麦不同组分淀粉的DSC仪参数及老化度Table 3 DSC parameters and retrogradation degree of different wheat starches during storage at −5 ℃

表4 在22 ℃下储藏不同时间小麦不同组分淀粉的DSC仪参数及老化度Table 4 DSC parameters and retrogradation degree of different wheat starches during storage at 22 ℃
从表2~4可以看出,完全糊化的小麦总淀粉、A淀粉及B淀粉在老化发生后,分子链间所形成的重结晶在受热时表现为具有较高对称性的单一吸热峰,其吸热峰To、Tp、Tc均低于相同质量浓度原淀粉糊化峰相对应的温度,老化焓也低于糊化焓。随着时间的延长,老化焓逐渐增加,老化度不断增大,说明淀粉发生的老化程度在逐渐加深。
高分子理论提及淀粉的重结晶是温度与时间的函数,包括:晶核形成、晶体生长和晶体成熟3 个步骤。结晶速率是由晶核的形成速率与晶体的成长速率一起决定的[31]。4 ℃下储藏的样品老化焓及老化速率均比其余温度下储藏的样品要大,而22 ℃下储藏的样品老化焓值最小;当在-5 ℃下储藏时,小麦淀粉样品的老化速率比4 ℃下储藏的稍慢。在22 ℃储藏时,由于小麦淀粉中的分子不断地从外界获得能量而处于一种无序的状态,使其晶核不易形成或生成的并不稳定,分子的热运动过于剧烈,即使有些分子间可以形成少量的氢键,也很容易被破坏,因此减慢了淀粉老化速率。在-18 ℃下储藏时由于温度突然下降,体系的黏度增大,链段的活动能力降低,晶体生长的速率下降,淀粉间的水分子会迅速结晶,这些晶体会阻碍淀粉分子间相互聚拢,使分子间的氢键不易结合,导致淀粉分子的微晶束很难形成,从而抑制了淀粉老化;同时,根据淀粉玻璃态结晶理论,淀粉乳只有在Tg和熔融温度Tm之间的温度时才能重结晶形成新的结晶结构。储藏温度越接近Tg,晶体的成核速率越快,但结晶成长速率越慢;储藏温度越接近Tm,晶体的成核速率越慢,但结晶成长速率越快[16]。当温度低于淀粉的Tg时,晶核是无法形成的,晶体的生长速率是零,这是淀粉在-18 ℃储藏无老化现象发生的原因。淀粉在-5 ℃储藏时由于储藏温度与Tg’相近,链段的活动能力降低,其次晶体生长速率也有所下降,老化速率则较低。老化温度在Tg’与Tm之间时,才易形成结晶,具有较高的老化速率,所以4 ℃老化速率最快。
老化现象主要是由于直链淀粉分子及支链淀粉侧链的聚集。由表2~4也可看出,随着时间的延长小麦A淀粉的老化度较总淀粉及B淀粉老化度大,可能是由于小麦A淀粉的粒径比B淀粉的粒径大,且含有较多的直链淀粉,由于直链淀粉分子的基本结构为α-1,4-D-葡聚糖,其构型为螺旋结构,在溶液中空间障碍较小,易于取向,所以易于老化;而B型淀粉中,支链淀粉的含量较多,分支点则以α-1,6糖苷键连接,其链结构呈树枝状,在溶液中空间障碍较大,不易于取向,并且由于它的分支结构作用,减弱了分子链重新缔合的紧密程度,所以难于老化[32]。
根据图4可知,由ln(EL-Et)对时间t作图所得直线的斜率,小麦淀粉的不同组分在4 ℃的老化速率常数分别为:小麦总淀粉Kz=0.075 3、小麦A淀粉KA=0.062 8、小麦B淀粉KB=0.084 2,则对应的时间常数分别:tz=1/Kz=13.28、tA=l/KA=15.92、tB=1/KB=11.88。由此可见,当储藏温度为4 ℃时小麦总淀粉的老化速率是小麦A淀粉的1.20 倍,是小麦B淀粉的0.89 倍。
小麦淀粉的不同组分在-5 ℃的老化速率常数分别为:小麦总淀粉Kz=0.049 7,小麦A淀粉KA=0.047 6,小麦B淀粉KB=0.039 9,则对应的时间常数分别:tz=1/Kz=20.12,tA=l/KA=20.01,tB=1/KB=25.06。由此可见,当储藏温度为-5 ℃时小麦总淀粉的老化速率是小麦A淀粉的1.04 倍,是小麦B淀粉的1.25 倍。
小麦淀粉不同组分在22 ℃的老化速率常数分别为:小麦总淀粉Kz=0.004 4,小麦A淀粉KA=0.006 0,小麦B淀粉KB=0.001 8,则对应的时间常数分别:tz=1/Kz=227.27,tA=l/KA=166.67,tB=1/KB=555.56。由此可见,当储藏温度为22 ℃时小麦总淀粉的老化速率是小麦A淀粉的0.73 倍,是小麦B淀粉的2.44 倍。
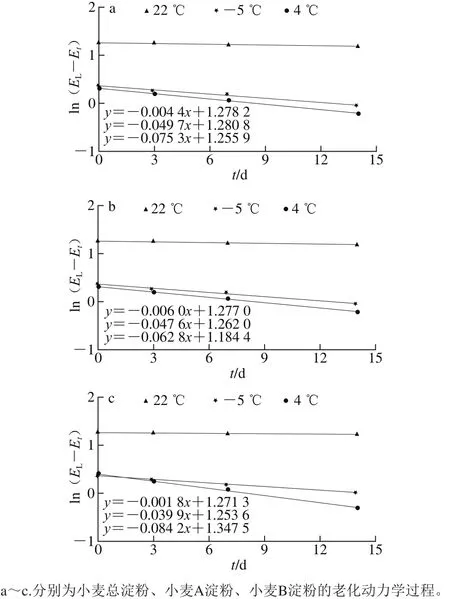
图 4 小麦淀粉不同组分的老化动力学过程Fig. 4 Retrogradation kinetics of different wheat starches
3 结 论
淀粉在玻璃态下整个分子无法运动,所以当温度低于Tg时,淀粉不再结晶,一些谷物食品在玻璃态下保藏,对于防止淀粉老化有非常明显的效果;小麦淀粉颗粒在扫描电子显微镜下观察结果表明,A淀粉的颗粒形态呈现较规则的圆形,B淀粉颗粒形态并不规则并且有明显的团聚现象;不同组分的小麦淀粉因储藏温度、时间、分子质量大小以及支链淀粉含量的不同,老化速率之间有显著差异。从本实验的研究结果可以看出,就储藏温度而言,4 ℃储藏时最易老化;A淀粉的非冻结水含量高于B淀粉,而水作为增塑剂,加强了处于玻璃态的淀粉无定型区域链段的活动性,导致了小麦B淀粉的Tg’比A淀粉的Tg’高。
[1] ATWELL W A, HOOD L F, LINEBACK D R, et al. The terminology and methodology associated with basic starch phenomena[J]. Cereal Food World, 1988, 33(3): 306-311.
[2] SLADE L, LEVINE H. Recent advances in starch retrogradation[M].New York: Gordon and Breach Science Publisher, 1987: 387-398.
[3] WANG Y J, JANE J. Correlation between glass transition temperature and starch retrogradation in the presence of sugars and maltodextrins[J]. Cereal Chemistry, 1994, 71(6): 527-531.
[4] NAKAZAWA F, NOGUCHI S, TAKAHASHI J, et al. Retrogradation of gelatinized potato starch studied by differential scanning calorimetry[J]. Agricultural and Biological Chemistry, 1985, 49(4):953-957. DOI:10.1080/00021369.1985.10866856.
[5] WADE K, TAKAHASHI K, SHIRAI K, et al. Differential thermal analysis (DTA) applied to examining gelatinization of starches in foods[J]. Journal of Food Science, 1979, 44(5): 1366-1368.DOI:10.1111/j.1365-2621.1979.tb06440.x.
[6] KARIM A A, NORZIAH M H, SEOW C C. Methods for the study of starch retrogradation[J]. Food Chemistry, 2000, 71(1): 9-36.DOI:10.1016/S0308-8146(00)00130-8.
[7] MIYAZAKI M, HUNG P V, MAEDA T, et al. Recent advances in application of modified starches for bread making[J]. Trends in Food Science & Technology, 2006, 17(11): 591-599. DOI:10.1016/j.tifs.2006.05.002.
[8] ZHANG H H, SUN B H, ZHANG S K, et al. Inhibition of wheat starch retrogradation by tea derivatives[J]. Carbohydrate Polymers,2015, 134: 413-417. DOI:10.1016/j.carbpol.2015.08.018.
[9] MIZUNO A, MITSUIKI M, MOTOKI M. Effect of crystallinity on the glass transition temperature of starch[J]. Journal of Agricultural and Food Chemistry, 1998, 46(1): 98-103. DOI:10.1021/jf970612b.
[10] 王欣, 陈庆华. 浅述玻璃化转变温度与食品成分的关系[J]. 粮油食品科技, 2004, 12(4): 52-54. DOI:10.3969/j.issn.1007-7561.2004.04.023.
[11] ZELEZNAK K J, HOSENEY R C. The glass transition in starch[J].Cereal Chemistry, 1987, 64(2): 121-124.
[12] ROOS Y H. Glass transition temperature and its relevance in food processing[J]. Annual Review of Food Science & Technology, 2010, 1:469-496. DOI:10.1146/annurev.food.102308.124139.
[13] CHUNG H J, CHANG H I, LIM S T. Physical aging of glassy normal and waxy rice starches: effect of crystallinity on glass transition and enthalpy relaxation[J]. Carbohydrate Polymers, 2004, 58(2): 101-107.DOI:10.1016/S0144-8617(03)00077-8.
[14] BHANDARI B R, HOWES T. Implication of glass transition for the drying and stability of dried foods[J]. Journal of Food Engineering,1999, 40(1/2): 71-79. DOI:10.1016/S0260-8774(99)00039-4.
[15] MADRIGAL L, SANDOVAL A J, MÜLLER A J. Effects of corn oil on glass transition temperatures of cassava starch[J]. Carbohydrate Polymers, 2011, 85(4): 875-884. DOI:10.1016/j.carbpol.2011.04.013.
[16] LEVINE H, SLADE L. A polymer physico-chemical approach to the study of commercial starch hydrolysis products (SHPs)[J].Carbohydrate Polymers, 1986, 6(3): 213-244. DOI:10.1016/0144-8617(86)90021-4.
[17] ROOS Y. Melting and glass transitions of low molecular weight carbohydrates[J]. Carbohydrate Research, 1993, 238(1): 39-48.DOI:10.1016/0008-6215(93)87004-C.
[18] LIM M H, WU H, REID D S. The effect of starch gelatinization and solute concentrations on T ’gof starch model system[J]. Journal of the Science of Food and Agriculture, 2000, 80(12): 1757-1762.
[19] TANANUWONG K, REID D S. Differential scanning calorimetry study of glass transition in frozen starch gels[J]. Journal of Agricultural and Food Chemistry, 2004, 52(13): 4308-4317. DOI:10.1021/jf049960l.
[20] SANG Y J, ALAVI S, SHI Y C. Subzero glass transition of waxy maize starch studied by differential scanning calorimetry[J]. Starch-Stärke, 2009, 61(12): 687-695. DOI:10.1002/star.200900164.
[21] 洪静, 郑学玲, 刘翀, 等. 小麦总淀粉、A-淀粉及B-淀粉的热损伤与其糊化度、糊化特性的关系[J]. 食品科学, 2014, 35(15): 38-42.DOI:10.7506/spkx1002-6630-201415008.
[22] 尚加英. 小麦A、B淀粉特性及其与小麦品质关系研究[D]. 郑州: 河南工业大学, 2011: 19-20.
[23] LI L, JIANG H X, CAMPBELL M, et al. Characterization of maize amylose-extender (ae) mutant starches. Part Ⅰ: relationship between resistant starch contents and molecular structures[J]. Carbohydrate Polymers, 2008, 74(3): 396-404. DOI:10.1016/j.carbpol.2008.03.012.
[24] TAKEDA Y, TAKEDA C, MIZUKAMI H, et al. Structures of large,medium and small starch granules of barley grain[J]. Carbohydrate Polymers, 1999, 38(2): 109-114. DOI:10.1016/S0144-8617(98)00105-2.
[25] AO Zihua, JANE J. Characterization and modeling of the A- and B-granule starches of wheat, triticale, and barley[J]. Carbohydrate Polymers, 2007, 67(1): 46-55. DOI:10.1016/j.carbpol.2006.04.013.
[26] GUO L, DU X F. Retrogradation kinetics and glass transition temperatures of Pueraria lobata starch, and its mixtures with sugars and salt[J]. Starch-Stärke, 2015, 66(9/10): 887-894.
[27] SCHENZ T W, ISRAEL B, ROSOLEN M A. Thermal analysis of water-containing systems[M]. Advances in Experimental Medicine and Biology, New York: Springer US, 1991: 199-214.
[28] 顾正彪, 王良东. 小麦A淀粉和B淀粉的比较[J]. 中国粮油学报,2004, 19(6): 27-30. DOI:10.3321/j.issn:1003-0174.2004.06.008.
[29] 朱帆, 徐广文, 丁文平. 小麦淀粉颗粒大小和糊化特性的相关性研究[J]. 中国粮油学报, 2006, 21(4): 32-34; 44. DOI:10.3321/j.issn:1003-0174.2006.04.007.
[30] ELIASSON A C, KARLSON R. Gelatinization properties of different size classes of wheat starch granules measured with differential scanning calorimetry[J]. Starch- Stärke, 1983, 35(4): 130-133.
[31] EERLINGEN R C, CROMBEZ M, DELCOUR J A. Enzyme-resistant starch. Ⅰ: quantitative and qualitative influence of incubation time and temperature of autoclaved starch on resistant starch formation[J].Cereal Chemistry, 1993, 70(3): 339-344.
[32] 赵凯. 淀粉非化学改性技术[M]. 北京: 化学工业出版社, 2009: 1.
Retrogradation Kinetics and Glass Transition Temperature of Wheat Starch
ZHAO Kai, LI Jun, LIU Ning, CHEN Fenglian, FU Dawei
(Key Laboratory for Food Science and Engineering, Harbin University of Commerce, Harbin 150076, China)
The effects of storage temperature and time on the retrogradation kinetics and Tg’ (glass transition temperature of the maximally freeze-concentrated state) of different wheat starches (normal wheat starch, wheat A-starch, and wheat B-starch) were studied by differential scanning calorimetry (DSC). Fully gelatinized wheat starches were stored at −18, −5,4 and 22 ℃ for 3–21 d respectively; retrogradation degree (RD), Tg’ and unfrozen water content of wheat starches were determined. The results showed that no retrogradation occurred for wheat starches stored at −18 ℃. The RD of wheat starch stored at 4 ℃ was greater than at −5, and 22 ℃. As indicated by DSC analysis, the Tg’ of wheat B-starch was higher than that of wheat A-starch. The results revealed that there was a signif i cant difference in retrogradation kinetics between A- and B-starch with the former having a greater RD. The unfrozen water content had a great impact on the Tg’ of wheat starch.
wheat starch; retrogradation kinetics; differential scanning calorimetry; glass transition temperature; storage stability
10.7506/spkx1002-6630-201723017
TS231
A
1002-6630(2017)23-0100-06
赵凯, 李君, 刘宁, 等. 小麦淀粉老化动力学及玻璃化转变温度[J]. 食品科学, 2017, 38(23): 100-105.
10.7506/spkx1002-6630-201723017. http://www.spkx.net.cn
ZHAO Kai, LI Jun, LIU Ning, et al. Retrogradation kinetics and glass transition temperature of wheat starch[J]. Food Science,2017, 38(23): 100-105. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723017. http://www.spkx.net.cn
2017-04-20
哈尔滨市科技创新人才项目(2014RFXXJ068)
赵凯(1974—),男,教授,博士,研究方向为淀粉化学与加工机理。E-mail:zhaok@hrbcu.edu.cn
