HIF-1α基因干扰对低氧环境下人鼻黏膜上皮细胞TGF-β1、VEGF、bFGF表达的影响及其机制
2017-12-11杨琳红张爱华范宗宪韩琳王维峰
杨琳红,张爱华,范宗宪,韩琳,王维峰
(1 佳木斯大学附属第一医院,黑龙江佳木斯154000;2 中国人民解放军第二二四医院)
HIF-1α基因干扰对低氧环境下人鼻黏膜上皮细胞TGF-β1、VEGF、bFGF表达的影响及其机制
杨琳红1,张爱华1,范宗宪1,韩琳2,王维峰1
(1 佳木斯大学附属第一医院,黑龙江佳木斯154000;2 中国人民解放军第二二四医院)
目的观察低氧诱导因子1α(HIF-1α)基因干扰对低氧环境下人鼻黏膜上皮细胞(HNEC)转化生长因子β1(TGF-β1)、血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)表达的影响,并探讨其可能的作用机制。方法体外培养HNEC,取传3代对数生长期细胞随机分为空白对照组、NC-shRNA组、HIF-shRNA组和低氧诱导组。空白对照组不予任何处理,NC-shRNA组、HIF-shRNA组分别予NC-shRNA、HIF-shRNA转染,并于转染24 h后经CoCl2化学诱导模拟低氧环境;低氧诱导组仅经CoCl2化学诱导模拟低氧环境。采用实时荧光定量PCR法和Western blotting法检测各组HIF-1α、TGF-β1、VEGF、bFGF mRNA和蛋白表达;采用Western blotting法检测PI3K/Akt信号通路相关蛋白PI3K、p-PI3K、Akt、p-Akt表达。结果与空白对照组比较,低氧诱导组HIF-1α、VEGF、TGF-β1、bFGF mRNA和蛋白表达均明显升高(P均<0.05);与NC-shRNA组比较,HIF-shRNA组上述指标mRNA和蛋白表达均明显降低(P均<0.05)。与空白对照组比较,低氧诱导组p-PI3K、p-Akt蛋白表达明显升高(P均<0.05);与NC-shRNA组比较,HIF-shRNA组p-PI3K、p-Akt蛋白表达明显降低(P均<0.05);各组PI3K、Akt蛋白表达比较P均>0.05。结论低氧诱导HIF-1α表达可促进人鼻黏膜上皮细胞TGF-β1、VEGF、bFGF表达,干扰HIF-1α基因则抑制上述因子的表达;HIF-1α对上述因子的调控机制可能与其抑制PI3K/Akt信号通路有关。
鼻黏膜上皮细胞;低氧诱导因子1α;基因干扰;血管内皮生长因子;PI3K/Akt信号通路;低氧环境
组织重塑是多数慢性炎性疾病的病理特征之一[1,2],长期炎症反应会持续损伤组织,而组织会针对持续性损伤启动自我修复机制。但这种自我修复机制属于不完全修复,会导致不可逆性组织结构异常,这也是变应性鼻炎、鼻息肉等鼻腔疾病发病的病理基础之一。感染、炎症等外界刺激均可引起局部组织耗氧增多,继而导致组织缺氧。机体为适应这种缺氧状态会激活一系列与缺氧有关的基因,以提高细胞对缺氧的适应性。低氧诱导因子1α(HIF-1α)是介导机体缺氧调控的主要转录因子之一[3]。HIF-1α具有广泛的生物学功能,如缺氧适应、炎症反应、血管新生等[4,5]。杨浩等[6]研究发现,在变应性鼻炎组织中HIF-1α表达上调,并可介导呼吸道重塑。尹文华等[7]研究认为,炎症因子可诱导人鼻黏膜上皮细胞(HNEC)大量表达HIF-1α,并促进内皮细胞增殖和血管新生。但目前对HIF-1α调节HNEC的具体机制尚不完全清楚。2015年2月~2017年2月,本研究采用短发夹RNA(shRNA)技术干扰HNEC中HIF-1α基因表达,观察其对转化生长因子β1(TGF-β1)、血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)表达的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 材料 HNEC,广州吉妮欧生物科技有限公司。绿色荧光蛋白(GFP)标记的HIF-shRNA、无义寡核苷酸阴性对照(NC-shRNA),上海吉玛制药技术有限公司设计合成。LipofectamineTM2000脂质体,美国Invitrogen公司;TRIzol,广州碧云天生物技术研究所;RT-PCR逆转录试剂盒,美国Bio-Rad公司。鼠抗人HIF-1α抗体,美国Santa Cruz公司;兔抗人TGF-β1抗体、兔抗人VEGF抗体、兔抗人bFGF抗体、鼠抗人PI3K抗体、兔抗人Akt抗体、鼠抗人p-Akt抗体、GAPDH抗体,武汉博士德生物工程有限公司;鼠抗兔IgG-辣根过氧化物酶(HRP)标记的二抗,美国Santa公司。
1.2 细胞分组处理 将HNEC接种于DEME培养基(含10% FBS、100 U/mL青霉素和100 U/mL链霉素),37 ℃、5% CO2细胞培养箱中孵育,当细胞贴壁且融合达75%时更换培养基,传代培养。取传3代对数生长期HNEC,制备细胞悬液并接种于6孔板,每孔1×104个。随机将细胞分为空白对照组、NC-shRNA组、HIF-shRNA组和低氧诱导组。空白对照组正常培养,不予任何处理;NC-shRNA组加入NC-shRNA 4 μg和LipofectamineTM2000 10 μL;HIF-shRNA组加入HIF-shRNA 4 μg和LipofectamineTM2000 10 μL;NC-shRNA组、HIF-shRNA组于转染24 h后加入100 μmol/L CoCl2溶液诱导低氧环境;低氧诱导组仅加入100 μmol/L CoCl2溶液模拟低氧环境。各组继续培养2 h后更换DEME培养液。转染48 h,取部分细胞,分别采用实时荧光定量PCR法、Western blotting法检测HIF-1α mRNA和蛋白表达。结果见表1。低氧诱导组HIF-1α mRNA和蛋白表达明显高于空白对照组,HIF-shRNA组HIF-1α mRNA和蛋白表达均明显低于NC-shRNA组(P均<0.05)。表明低氧可诱导HIF-1α表达,而干扰HIF-1α基因可抑制HIF-1α表达,该方法可用于后续实验。
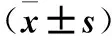
表1 各组HIF-1α mRNA和蛋白相对表达量比较
注:与空白对照组比较,*P<0.05;与NC-shRNA组比较,△P<0.05;与HIF-shRNA组比较,#P<0.05。
1.3 相关指标观察
1.3.1 TGF-β1、VEGF、bFGF mRNA和蛋白表达 ①VEGF、TGF-β1、bFGF mRNA表达:采用实时荧光定量PCR法。取各组继续培养48 h细胞,TRIzol法提取细胞总RNA,紫外分光光度计测定总RNA在260、280 nm波长处的吸光度(A)值,A260/A280为1.8~2.0,表明提取的总RNA纯度合格。按PCR逆转录试剂盒说明将总RNA逆转录为cDNA,以cDNA为模板进行PCR扩增。引物序列:VEGF上游引物:5′-AGGGCAGAATCATGAGCAAGT-3′,下游引物:5′-AGGGTCTGCATTGGATGGCA-3′;TGF-β1上游引物:5′-CTAATGGTGGAAACCCAGAAGC-3′,下游引物:
5′-TATGCGGACGAATTGTTGCTG-3′;bFGF上游引物:5′-AGTGTCTGCTAACCGTTAGCT-3′,下游引物:5′-ACTGCCCAGTTCGTTTCAGTG-3′;GAPDH上游引物:5′-CACCATTGGCAATGAGGGGTTC-3′,下游引物:5′-AGGTCTTTGCGGATGTCCACGT-3′。PCR反应体系共20 μL:上下游引物各0.2 μL,SYBR Green Ⅰ premix 12 μL,双蒸水5.6 μL,cDNA 2 μL;反应条件:95 ℃ 5 min,95 ℃ 30 s、60 ℃ 30 s共40个循环,最后72 ℃ 2 min。以GAPDH作为内参,按照2-ΔΔCt法计算目的基因相对表达量。②VEGF、TGF-β1、bFGF蛋白表达:采用Western blotting法。取各组继续培养48 h细胞,RIPA裂解,4 ℃、12 000 r/min离心10 min,提取总蛋白,BCA法进行蛋白定量。将蛋白样品与上样缓冲液混匀,100 ℃水浴5 min变性;取变性的蛋白样品50 μg,80 V电压下进行SDS-PAGE,待样品进入分离胶后改为120 V电压,至溴酚蓝跑至凝胶边缘时终止电泳;常规湿法转膜,5%脱脂牛奶封闭2 h;分别加入VEGF、TGF-β1、bFGF一抗,4 ℃孵育24 h;再加入辣根过氧化酶标记的鼠抗兔IgG二抗,37 ℃孵育2 h,PBS冲洗3次,洗膜、显影、曝光。按照ECL化学发光显影试剂盒显影,凝胶成像系统扫描,Image Lab软件分析蛋白电泳条带的灰度值。以GAPDH作为内参照,以目的蛋白电泳条带灰度值/内参蛋白电泳条带灰度值作为目的蛋白相对表达量。
1.3.2 PI3K/Akt信号通路相关蛋白表达 采用Western blotting法。一抗分别为PI3K(1∶300)、p-PI3K(1∶300)、Akt(1:200)、p-Akt(1∶200)、GAPDH(1∶100),二抗辣根过氧化酶标记的鼠抗兔IgG(1∶100),其余步骤同上。
2 结果
2.1 各组VEGF、TGF-β1、bFGF mRNA和蛋白表达比较 见表2。
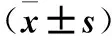
表2 各组VEGF、TGF-β1、bFGF mRNA和蛋白相对表达量比较
注:与空白对照组比较,*P<0.05;与NC-shRNA组比较,△P<0.05;与HIF-shRNA组比较,#P<0.05。
2.2 各组PI3K/Akt信号通路相关蛋白表达比较 见表3。
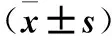
表3 各组PI3K、p-PI3K、Akt、p-Akt蛋白相对表达量比较
注:与空白对照组比较,*P<0.05;与NC-shRNA组比较,△P<0.05;与HIF-shRNA组比较,#P<0.05。
3 讨论
目前已证实,HIF-1是细胞低氧反应的核心调控因子。HIF-1由两个亚基组成,即HIF-1α、HIF-1β,HIF-1α是其活性亚基。既往研究显示,长期呼吸道的变应性炎症会引起呼吸道黏膜发生不可逆的组织结构重塑,导致局部缺氧加重[9,10]。靳春杰等[11]报道称易感个体受体变应原刺激后,导致Th2细胞活化,诱发趋化因子和细胞因子释放,肥大细胞脱颗粒和嗜酸性粒细胞聚集,气道炎症反应加重;而鼻腔局部的炎症反应又会进一步刺激HIF-1诱表达上调。Watcharasit等[12]研究亦证实,在炎性因子、低氧等因素刺激下,鼻黏膜上皮细胞能够产生HIF-1α和VEGF,促进内皮细胞增殖和血管新生。此外,HIF-1α还会诱导细胞分泌诱导型一氧化氮合酶,促进炎性组织通过血管壁进入组织,最终导致组织重塑而加重缺氧[13]。但目前对于HNEC中HIF-1α表达的调控机制,特别是其在相应信号通路中的作用鲜见报道。
生长因子如TGF-β1、VEGF、bFGF等,均与气道重塑、炎性反应等密切相关。TGF-β1是重要的细胞外基质调控因子,在组织重塑方面发挥关键作用。VEGF可增加血管壁通透性,导致炎性因子渗透入血管外间隙,加重炎症反应。bFGF参与形成细胞外基质和血管生成,在组织损伤修复、纤维化和介导炎症反应过程中起重要作用。RNA干扰技术是近年兴起的一种基因干扰技术,具有高效性、高特异性、易操作等特点,已广泛用于基因功能研究。本研究采用RNA干扰技术干扰HNEC HIF-1α基因,结果发现缺氧模拟剂CoCl2能够诱导HIF-1α表达,HIF-1α表达上调的HNEC中TGF-β1、VEGF、bFGF mRNA和蛋白表达明显升高,而干扰HIF-1α基因的HNEC中TGF-β1、VEGF、bFGF mRNA和蛋白表达明显降低。说明HIF-1α可能通过调控TGF-β1、VEGF、bFGF参与鼻黏膜细胞的炎症反应和组织重塑。
目前,关于缺氧诱导HIF-1α表达的调控机制研究较少。有学者认为,缺氧能够激活PI3K/Akt信号通路,诱导HIF-1α发生磷酸化,并调控下游靶基因的转录,提高细胞对微环境的适应性改变[14]。Wang等[15]采用LY294002(PI3K阻断剂)抑制嗜酸性粒细胞PI3K/Akt通路,细胞HIF-1α及下游靶基因VEGF表达明显减少,提示HIF-1α表达可能与PI3K/Akt信号通路有关。Li等[16]报道显示,HIF-1α活化能够诱导Akt和PI3K磷酸化,使HIF-1α降解减少和HIF-1α表达增加。此外,Akt磷酸化还能激活mTOR基因表达,从而促进VEGF转录。本研究结果显示,低氧诱导HIF-1α表达上调,可以促进p-PI3K、p-Akt蛋白表达增加,从而激活PI3K/Akt信号通路;而干扰HIF-1α表达则抑制PI3K/Akt信号通路。因此认为,HIF-1α介导的VEGF、TGF-β1、bFGF表达变化可能是通过PI3K/Akt信号通路实现的。
综上所述,低氧诱导HIF-1α表达可促进人鼻黏膜上皮细胞TGF-β1、VEGF、bFGF表达,干扰HIF-1α基因则抑制上述因子表达;HIF-1α的调控机制可能与其抑制PI3K/Akt信号通路有关。
[1] Bugdayci G, Kaymakci M, Bukan N. Matrix metalloproteinase-9 (MMP-9) in allergic nasal polyps[J]. Acta Histochem, 2010,112(1):92-95.
[2] 伯铭羽,王向东,王鸿,等.重塑相关因子在慢性鼻窦炎的表达[J].首都医科大学学报,2013,34(6):785-789.
[3] Fujita N, Markova D, Anderson DG, et al. Expression of Prolyl Hydroxylases (PHDs) is selectively controlled by HIF-1 and HIF-2 proteins in nucleus pulposus cells of the intervertebral disc: Distinct roles of PHD2 and PHD3 proteins in controlling HIF-1α activity in hypoxia[J]. J Biol Chem, 2012,287(20):16975-16986.
[4] Thiersch M, Rimann M, Panagiotopoulou V, et al. The angiogenic response to PLL-g-PEG-mediated HIF-1α plasmid DNA delivery in healthy and diabetic rats[J]. Biomaterials, 2013,34(16):4173-4182.
[5] Maschio LB, Madallozo BB, Capellasso BA, et al. Immunohistochemical investigation of the angiogenic proteins VEGF, HIF-1α and CD34 in invasive ductal carcinoma of the breast[J]. Acta Histochem, 2014,116(1):148-157.
[6] 杨浩,张阳,范芳,等.HIF-1α、MVD及EGFR表达对鼻内翻性乳头状瘤恶变的诊断意义及紫杉醇干预效果分析[J].中国免疫学杂志,2015,31(12):1683-1687.
[7] 尹文华,刘素琴,陈志凌,等.缺氧诱导因子1α与黏蛋白5在慢性鼻-鼻窦炎组织中的表达与意义[J].中国耳鼻咽喉头颈外科,2016,23(11):632-636.
[8] 中华医学会耳鼻咽喉科学分会,中华耳鼻咽喉科杂志编辑委员会.慢性鼻窦炎鼻息肉临床分型分期及内窥镜鼻窦手术疗效评定标准(1997年,海口)[J].中华耳鼻咽喉科杂志,1998,33(3):134-135.
[9] Park SJ, Kim TH, Jun YJ, et al. Chronic rhinosinusitis with polyps and without polyps is associated with increased expression of suppressors of cytokine signaling 1 and 3[J]. J Allergy Clin Immunol, 2013,131(3):772-780.
[10] Aksoy F, Yenigun A, Dogan R, et al. Investigation of the role of major respiratory viruses in the aetiology of nasal polyps using polymerase chain reaction technique[J]. J Laryngol Otol, 2014,128(4):356-359.
[11] 靳春杰,方贵龙,权伟,等.缺氧诱导因子-1α对创伤性脑损伤大鼠炎性反应和血管生成因子表达的影响[J].中华创伤杂志,2016,32(9):835-842.
[12] Watcharasit P, Suntararuks S, Visitnonthachai D, et al. β-catenin involvement in arsenite-induced VEGF expression in neuroblastoma SH-SY5Y cells[J]. Environ Toxicol, 2014,29(6):672-678.
[13] 祁蕾,苑博,傅强,等.缺氧/再复氧与脂多糖激活肠上皮细胞核转录因子-κB和低氧诱导因子-1α信号通路以及大黄素对其的干预作用[J].中华危重病急救医学,2014,26(6):409-414.
[14] Fagani F, Jiang BH. Oxygen-independent regulation of HIF-1: novel involvement of PI3K/ AKT/mTOR pathway in cancer[J]. Curr Cancer Drug Targets, 2013,13(3):245-251.
[15] Wang F, Liu S, Xi S, et al. Arsenic induces the expressions of angiogenesis-related factors through PI3K and MAPK pathways in SV-HUC-1 human uroepithelial cells[J]. Toxicol Lett, 2013,222(3):303-311.
[16] Li GQ, Zhang Y, Liu D, et al. PI3 kinase/Akt/HIF-1α pathway is associated with hypoxia-induced epithelial-mesenchymal transition in fibroblast-like synoviocytes of rheumatoid arthritis[J]. Mol Cell Biochem, 2013,372(1-2):221-231.
黑龙江省自然科学基金青年基金资助项目(QC2010076)。
王维峰(E-mail: dr_wwf@163.com)
10.3969/j.issn.1002-266X.2017.44.012
R765.2
A
1002-266X(2017)44-0042-04
2017-06-24)
