Fenton-荧光法快速测定食用油中PAEs总量的研究
2017-12-11张秦锋韩立娟杜宣利唐佳芮汪月月胡志雄张维农齐玉堂
张秦锋,韩立娟,刘 胜,杜宣利,唐佳芮,汪月月,胡志雄,3,张维农,3,齐玉堂
(1.武汉轻工大学 食品科学与工程学院,武汉 430023; 2.西安中粮工程研究设计院有限公司,西安 710082; 3.农产品加工湖北省协同创新中心,武汉430023)
Fenton-荧光法快速测定食用油中PAEs总量的研究
张秦锋1,韩立娟1,刘 胜1,杜宣利2,唐佳芮2,汪月月1,胡志雄1,3,张维农1,3,齐玉堂1
(1.武汉轻工大学 食品科学与工程学院,武汉 430023; 2.西安中粮工程研究设计院有限公司,西安 710082; 3.农产品加工湖北省协同创新中心,武汉430023)
建立了一种Fenton氧化结合荧光法快速测定食用油中邻苯二甲酸酯(PAEs)的新方法。食用油样品中的PAEs经乙腈萃取浓缩、碱性条件下水解后,利用Fenton反应生成荧光性能较强的羟基邻苯二甲酸类物质进行间接荧光定量测定。对影响衍生化效率的水解条件及Fenton反应进行了优化。结果表明:优化条件下,该方法具有较高的灵敏度,较好的线性关系(R2=0.999 2)及重复性(相对标准偏差0.35%~5.46%),检出限和定量限分别为0.05、0.15 nmol/mL,回收率在84.52%~100.13%之间。适合于食用油批量样品的PAEs总量安全初筛过程中的高通量测定。
邻苯二甲酸酯;食用油;Fenton氧化:荧光法
邻苯二甲酸酯(PAEs)是一类世界范围内无处不在的化学物质,具有较高的logKow值(大于4),较易分散于富含油脂的食物中,而食用油多使用塑料包装材料且储存期限较长[1-2],所以对于食用油中的PAEs类物质进行定量检测对保障消费者的健康具有非常重要的意义。目前,对于PAEs类物质的测定方法主要包括:高效液相色谱法(HPLC)[3],液相色谱质谱联用法(HPLC-MS)[4-5],气相色谱法(GC)[6],气相色谱质谱联用法(GC-MS)[7-9]。Holadová 等[10]利用顶空固相微萃取结合气相色谱定量检测植物油中的6种PAEs(DMP、DEP、DnBP、BBP、DEHP、DnOP),通过向食用油基质中添加甲醇促进PAEs从基质转移至聚二甲基硅氧烷萃取头,从而完成预处理净化过程,然后利用电子俘获检测器进行检测,方法在加标水平2 mL/kg下的相对标准偏差为14%~23%。Sun等[11]使用甲醇在微波辅助下萃取食用油中的PAEs,然后利用凝胶渗透色谱及C18固相萃取柱进行净化处理,最后使用GC-MS定量检测20种PAEs,方法定量限为0.78~4.51 μg/kg,回收率为93.04%~104.60%。可以看出,基于色谱类的分析方法灵敏度高、准确性好,但为了排除食品基质的干扰,通常需要进行较复杂的样品预处理过程,耗时较长,测试成本高,在需要对大批量样品进行高通量测定时,其弱势尤为明显。
Fenton反应发现于1894年,Fenton[12]报道过氧化氢能够被亚铁盐类激活从而氧化酒石酸。近年来,Fenton反应被引入PAEs物质的测定中,如李满秀等[13]利用Fenton反应将PAEs水解生成的邻苯二甲酸氧化生成含羟基的邻苯二甲酸类物质,提高其荧光效率,对环境样品中的PAEs获得较好测定效果。为了达到批量样品高通量测定的要求,本研究提出一种对于食用油中PAEs类物质进行分级筛选测定的思路,即采用高通量的光谱法进行PAEs类物质总量阈值初筛,对可疑阳性样品采用色谱法进行复核准确测定种类及含量。为此,本研究建立了一种Fenton-荧光法测定食用油中PAEs物质总量的方法,其原理在于:提取食用油中PAEs物质,首先通过碱性水解得到邻苯二甲酸(PA)并利用Fenton反应衍生化,然后采用荧光光谱定量检测得到的羟基邻苯二甲酸(HPA),最终通过计算间接得到PAEs总量。在本研究中,为了提高该方法的检测效果,对影响检测灵敏度的条件进行了优化,并在优化条件下,对5种常见食用油样品进行了PAEs总量检测、评价。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
不同种类食用油样品购于本地超市并储存于阴凉干燥处。邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二(2-乙基)己酯(DEHP)、邻苯二甲酸二异壬酯(DINP)标准品,纯度99%,购于阿拉丁生化科技股份有限公司。氢氧化钠、二水合磷酸二氢钠、十二水合磷酸氢二钠、七水合硫酸亚铁、乙二胺四乙酸二钠、盐酸、30%过氧化氢,分析纯;乙腈、己烷,色谱纯,均购于国药集团化学试剂有限公司。实验中所用水均为Milli-Q 超纯水系统净化得到的超纯水。
1.1.2 仪器与设备
TG-16台式低速离心机;F-4600荧光光谱仪,日本株式会社日立制作所。
1.2 实验方法
1.2.1 空白食用油样品及混合标准溶液的制备
向食用油样品中按料液比1∶10加入乙腈,涡旋混合2 min后于4 000 r/min离心5 min弃去上清液。重复多次直至样品中PAEs总量低于检出限,即为空白食用油样品,将其储存于磨口玻璃广口瓶中,并避光置于干燥处。将适量DMP、DBP、DEHP、DINP溶于正己烷中制备浓度为1.0 mmol/L的标准溶液,并按体积比1∶1∶1∶1将4种标准溶液混合、摇匀即得混合标准溶液,置于避光干燥处备用。
1.2.2 液液萃取食用油中的PAEs
称取1.00 g食用油样品于50 mL玻璃离心管中,加入5.0 mL乙腈涡旋混合2 min,4 000 r/min离心收集上清液,重复3次合并上清液。将所得萃取液转移至25 mL玻璃具塞比色管中并氮吹至干,加入1.0 mL乙腈溶解待测。
1.2.3 PAEs的碱性水解
向1.0 mL PAEs待测液中加入10.0 mL(0.2 mol/L)氢氧化钠溶液,涡旋混合30 s后于90℃恒温水解90 min,水解过程中间歇性振荡。水解液冷却至25℃后使用盐酸调节至pH 7.0。
1.2.4 Fenton氧化-荧光衍生化
选择EDTA螯合亚铁离子作为Fenton反应的催化剂。向水解液中依次加入7.0 mL(0.2 mol/L)磷酸盐缓冲溶液(pH=7.0),0.4 mL(5.0 mmol/L)EDTA-Fe(Ⅱ)溶液,1.0 mL 3%过氧化氢溶液,25℃反应60 min后检测荧光强度。为了优化水解及衍生化条件,分别选取氢氧化钠浓度、水解温度、水解时间、EDTA-Fe(Ⅱ)添加量、过氧化氢体积、反应时间进行单因素实验。
1.2.5 荧光光谱条件
激发波长305 nm,发射波长410 nm,光栅狭缝10 nm,光电倍增管电压600 V,扫描速率240 nm/min。
1.2.6 标准曲线
将0.75~100 μL混合标准溶液加入空白食用油样品中使得PAEs浓度为0.75~100 nmol/mL,涡旋混合5 min,然后按1.2.2~1.2.5方法处理并测定、记录相应荧光强度,绘制标准曲线。
1.2.7 方法学验证
称取1.00 g空白食用油样品于25 mL玻璃离心管中,分别加入5.0、10.0、20.0 μL混合标准溶液使得PAEs浓度为5.0、10.0、20.0 nmol/mL,涡旋混合5 min后依照1.2.2~1.2.5方法进行处理,并测定其荧光强度,每种标准溶液的不同质量浓度的添加样品重复测定3次,根据所得结果计算回收率与相对标准偏差,评价该方法的准确度与重现性。
2 结果与讨论
食用油是一类成分较为复杂的样品,不仅自身化学成分复杂,而且还可能含有营养强化成分(如甾醇、维生素E、谷维素等)、痕量污染物(如苯并芘、3-氯-1,2-丙二醇等)。为了采用该方法对食用油中PAEs进行测定,需要对样品进行预处理,以便提高检测灵敏度、减少其他物质的干扰。实验发现,采用乙腈作为萃取剂对PAEs具有较好提取、富集效果,其沸点较低、易挥干浓缩,且水溶性好,预处理后的样品可直接应用Fenton-荧光法进行测定,因此本实验选定方法1.2.2对食用油样品进行预处理。经Fenton反应处理后,测得样品溶液最大激发波长和发射波长分别为305 nm和410 nm(激发通带和发射通带均为10 nm)。
2.1 条件参数优化
PAEs的水解和Fenton氧化过程是该方法的关键步骤,为了提高该方法的灵敏度,分别对PAEs的水解条件及Fenton氧化条件进行了优化。
2.1.1 水解条件参数优化
水解需要保证所有的PAEs均转化为PA,Albro等[14]研究发现10.0 mL尿液样品(PAEs浓度大于0.5 nmol/L)在碱性条件下于(95±5)℃水解90 min后,DMP、DEP、DBP及DOP均得到完全水解,但仅60%的DEHP得到了水解,这说明具有较长烷基链的PAEs相对于具有较短烷基链的PAEs水解速率更慢,水解更困难。故本实验中采用小幅度提升氢氧化钠添加量的方式,以加快水解速率,并以具有较长烷基链、相对较难水解的DEHP作为PAEs的代表性物质对后续水解条件进行优化。
固定其他反应条件不变,分别测定水解的氢氧化钠浓度、水解温度和水解时间对最终生成HPA的荧光强度的影响,结果如图1~图3所示。
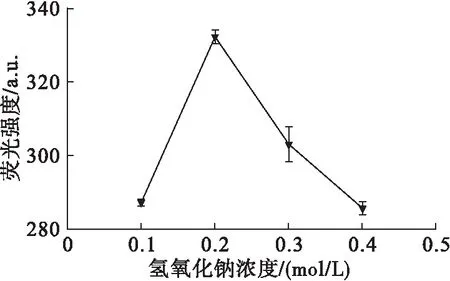
图1 氢氧化钠浓度对HPA荧光强度的影响
从图1可以看出,HPA的荧光强度随着氢氧化钠浓度的增大而升高,并在0.2 mol/L时达到最大,继续提高氢氧化钠浓度后荧光强度逐渐下降。故选取最佳氢氧化钠浓度为0.2 mol/L。
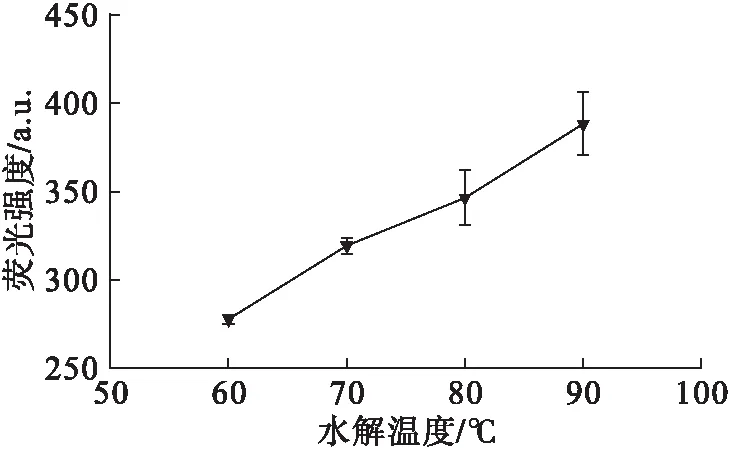
图2 水解温度对HPA荧光强度的影响
从图2可以看出,HPA的荧光强度随着水解温度的升高而增大,说明PAEs的水解速率是逐渐增大的,这与Ostrovsk等[15]的报道是一致的。但由于该反应体系是在水相中进行,过高的水解温度会加速体系中水的蒸发,故最佳水解温度选取90℃。
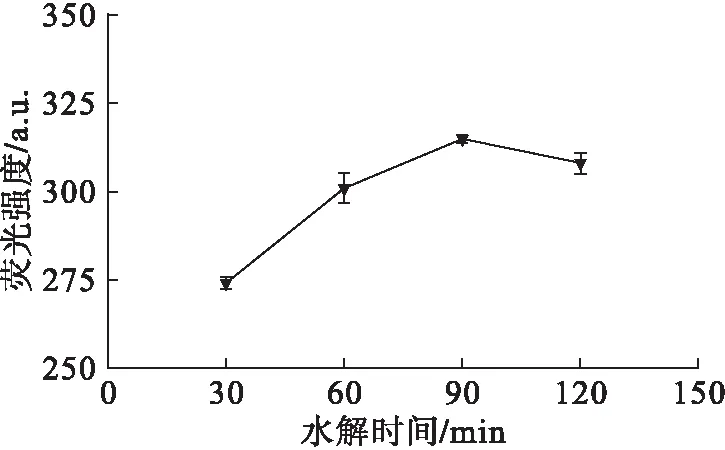
图3 水解时间对HPA荧光强度的影响
从图3可以看出,在水解温度90℃下,逐渐延长水解时间,HPA的荧光强度随着水解时间的延长逐渐增大,并在90 min时达到最大,而继续延长水解时间荧光强度保持相对稳定。这一变化趋势说明在90℃下水解90 min即可实现具有不同烷基链长度的PAEs的完全水解,故选取最佳水解时间为90 min。
2.1.2 Fenton氧化条件参数优化
如Pignatello等[16]所述,Fenton氧化反应中的EDTA-Fe(Ⅱ)添加水平、过氧化氢体积和反应时间对衍生化效果具有重要的影响,故本研究针对上述3个因素进行优化,结果分别如图4~图6所示。
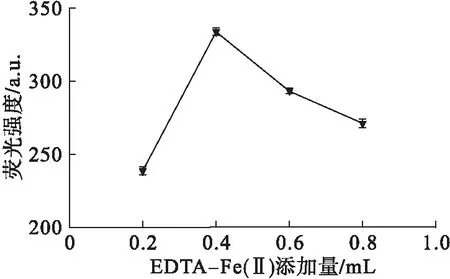
图4 EDTA-Fe(Ⅱ)添加量对HPA荧光强度的影响
从图4可以看出,亚铁离子作为Fenton氧化反应中的催化剂[17],其浓度较低时会造成整体反应速率降低,但其浓度过大时,多余的Fe2+容易转变为铁离子并产生沉淀从而影响反应的持续进行。故选取0.4 mL为最优添加量。
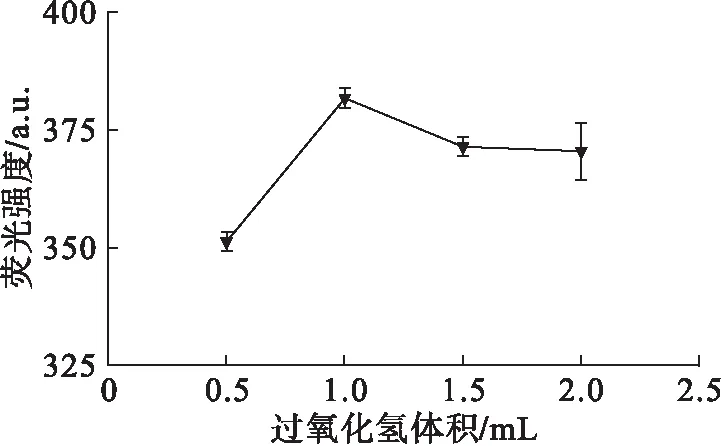
图5 过氧化氢体积对HPA荧光强度的影响
过氧化氢是反应中·OH的唯一来源,但其添加量过多时会发生多种副反应[16],产生诸如过氧自由基(·OOH)等与·OH存在竞争作用的副产物,进而影响反应的进行,引起HPA荧光强度的降低(见图5)。故选取过氧化氢体积1.0 mL。
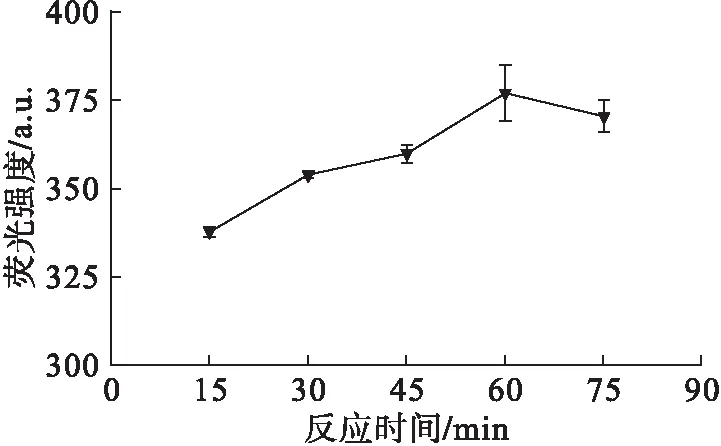
图6 反应时间对HPA荧光强度的影响
除此之外,由于·OH的寿命极短,随着反应的进行不断生成也不断被消耗,生成速率大于消耗速率,因此直至反应结束,HPA荧光强度随着·OH含量的变化呈缓慢增加趋势(见图6)。故选择60 min为最终反应时间。
2.2 分析方法特性
在优化水解和氧化条件下,按照1.2.2、1.2.3中所述方法,利用HPA荧光强度与PAEs总量的对应关系对不同浓度梯度PAEs混合标准溶液进行荧光强度定量测定,所得结果拟合得到线性回归曲线。HPA的荧光强度与PAEs总量在PAEs质量浓度范围0.75~100.00 nmol/mL内具有良好的线性关系,并且不同单一标准溶液与混合标准溶液所得到回归曲线的斜率与截距几乎一致,故最终选取相关系数最高的一条回归曲线作为定量标准曲线,见表1。

表1 PAEs总量的回归曲线,线性范围,R2,检出限及定量限
由表1可以看出,检出限和定量限分别为0.05、0.15 nmol/mL,说明本研究提出的检测方法具有良好的灵敏度而不需额外净化步骤。若待测样品中PAEs实际含量高于给出的线性范围,可以先将待测样品质量浓度稀释至线性范围内再检测。
本方法的回收率通过4种标准溶液在3个不同水平下的加标实验进行评估,结果见表2。
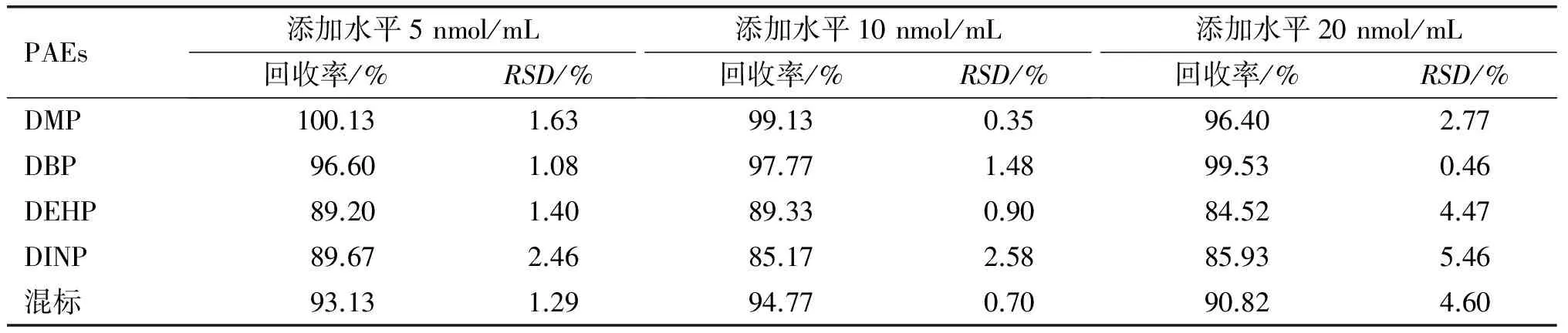
表2 PAEs总量的回收率和相对标准偏差(n=3)
从表2可以看出,回收率为84.52%~100.13%,且相对标准偏差(RSD)小于等于5.46%,最低RSD仅为0.35%,说明本方法具有良好的精密度。
2.3 样品检测
为验证本方法的实际应用性,对市售的5种食用油(生产日期为近期)中的PAEs总量进行了定量检测。对5种不同种类食用油样品按照1.2.2及1.2.3中所述方法进行碱性水解和Fenton氧化衍生化并定量检测,结果见表3。

表3 实际食用油样品中的PAEs总量检测结果
从表3可以看出,选取的5种食用油样品中的PAEs总量为9.25~20.35 nmol/mL,均未超过国家标准GB 9685—2008中对于PAEs在食品体系中的最大迁移量。食用油样品的组成复杂,但使用本研究所述的检测方法得到的基质干扰性较小,实现了实际样品中的定量检测,说明本方法适用于食用油中PAEs含量的检测,且方法的灵敏度和准确度可靠。
3 结 论
本方法通过结合一种快速并易操作的衍生化方法及高通量的荧光光谱实现对于食用油样品中复杂基质内的痕量PAEs总量阈值初筛。在本研究中,通过使用Fenton氧化反应结合荧光光谱建立了一种对食用油中PAEs总量定量检测的便捷方法。Fenton氧化反应在增强荧光性方面展现出了优秀的性能,同时荧光光谱也表现出良好的选择性和灵敏度。结果表明,Fenton-荧光法是一种有效地快速定量检测食用油中PAEs含量的方法,便于对PAEs物质的分级筛选以发现可疑样品,最终实现对PAEs暴露量进行健康风险评估。
[1] NANNI N,FISELIER K,GROB K,et al. Contamination of vegetable oils marketed in Italy by phthalic acid esters [J]. Food Control,2011,22(2):209-214.
[2] WU P,YANG D,ZHANG L,et al. Simultaneous determination of 17 phthalate esters in edible vegetable oils by GC-MS with silica/PSA-mixed solid-phase extraction [J]. J Sep Sci,2012,35(21):2932-2939.
[3] 马燕玲,陈令新,丁养军,等. 超声辅助分散液液微萃取-高效液相色谱测定水样中的4种邻苯二甲酸酯类增塑剂[J]. 色谱,2013,31(2):155-161.
[4] 徐敦明,郑向华,杨黎忠,等. 液相色谱-串联质谱法测定饮料中邻苯二甲酸二(2-乙基)己酯和邻苯二甲酸二异壬酯[J]. 分析化学,2012,40(2):304-308.
[5] 李拥军,熊文明,陈坚文,等. 固相萃取/高效液相色谱-串联质谱法测定罗非鱼中9种邻苯二甲酸酯[J]. 分析测试学报,2012,31(3):278-283.
[6] 李康雄,钟海雁,罗凡,等. 油茶籽油中邻苯二甲酸酯的气相色谱分析方法建立及应用[J]. 中国油脂,2016,41(1):56-59.
[7] 吴雪,董海峰,汤桦,等. 凝胶渗透色谱-气相色谱-质谱法测定食用油中8种邻苯二甲酸酯类增塑剂[J]. 中国油脂,2016,41(5):53-55.
[8] 曹九超,俞晔,朱云,等. 食用油中5种邻苯二甲酸酯的液液萃取-固相萃取耦合富集和气质联用的测定[J]. 中国油脂,2014,39(1):43-46.
[9] 邹柯婷,秦国富,李永波. 市售菜籽油中16种邻苯二甲酸酯类塑化剂的含量监测分析[J]. 中国油脂,2016,41(8):62-65.
[11] SUN H,YANG Y,LI H,et al. Development of multiresidue analysis for twenty phthalate esters in edible vegetable oils by microwave-assisted extraction-gel permeation chromatography-solid phase extraction-gas chromatography-tandem mass spectrometry[J]. J Agric Food Chem,2012,60(22):5532-5539.
[12] FENTON H. LXXIII.—Oxidation of tartaric acid in presence of iron[J]. J Chem Soc Trans,1894,65:899-910.
[13] 李满秀,王华燕. 荧光法测定环境样品中的邻苯二甲酸酯[J]. 分析化学,2005,33(9):1315-1317.
[14] ALBRO P W,JORDAN S,CORBETT J T,et al. Determination of total phthalate in urine by gas chromatography[J]. Anal Chem,1984,56(2):247-250.
[16] PIGNATELLO J J,OLIVEROS E,MACKAY A. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J]. Crit Rev Env Sci Tec,2006,36(1):1-84.
[17] GALLARD H,DE LAAT J. Kinetics of oxidation of chlorobenzenes and phenyl-ureas by Fe (II)/H2O2and Fe (III)/H2O2. Evidence of reduction and oxidation reactions of intermediates by Fe (II) or Fe (III)[J]. Chemosphere,2001,42(4):405-413.
ArapidapproachofFentoncoupledwithfluorescencespectrometryforthequantitativedeterminationoftotalphthalateestersinedibleoils
ZHANG Qinfeng1, HAN Lijuan1, LIU Sheng1, DU Xuanli2, TANG Jiarui2, WANG Yueyue1, HU Zhixiong1,3, ZHANG Weinong1,3, QI Yutang1
(1.College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2.Xi’an COFCO Research amp; Design Institute Co., Ltd., Xi’an 710082, China; 3.Hubei Collaborative Innovation Center for Processing of Agricultural Products, Wuhan 430023, China)
A rapid approach of Fenton oxidation coupled with fluorescence spectrometry for the quantitative determination of total phthalate esters (PAEs) in edible oils was established. PAEs in edible oils were extracted by acetonitrile and hydrolyzed in aqueous alkaline solutions. Hydroxyphthalic acids with significant fluorescence properties were produced by the Fenton reaction and analyzed by fluorescence spectrometry. The experimental parameters relating to the efficiency of the derivative reaction such as hydrolysis conditions and Fenton reaction were optimized. The results showed that under the optimal conditions, the method had the items of high sensitivity, good linearity (R2= 0.999 2), and repeatability (RSDwas in the range of 0.35%-5.46%). The limits of detection and quantity were 0.05 nmol/mL and 0.15 nmol/mL respectively, and the recoveries were in the range of 84.52%-100.13%. The approach was suitable for the high throughput determination in preliminary security screening of total PAEs in batch edible oil samples.
phthalate esters; edible oil; Fenton oxidation; fluorescence spectrometry
TS225;TS207.5
A
1003-7969(2017)11-0137-05
2017-02-26;
2017-08-18
湖北省自然科学基金项目(2014CFB885);国家自然科学基金项目(31371783);国家粮食局公益性行业科研专项(201513003);国家自然科学基金青年基金项目(31601505)
张秦锋(1992),男,在读硕士,研究方向为油脂质量检测与安全控制(E-mail)qinfeng.zhang@outlook.com;韩立娟(1986),女,讲师,研究方向为油料副产物综合利用(E-mail)hanlj.whpu@hotmail.com。张秦锋、韩立娟同为第一作者。
胡志雄,副教授(E-mail)e_huzhixiong@126.com;张维农,教授(E-mail)zhangweinong@163.com。
