糖基化及限制性酶解对大豆蛋白结构和抗氧化活性的影响
2017-12-11宋春丽陈佳鹏张新宇
宋春丽,任 健,陈佳鹏,张 新,张新宇
(齐齐哈尔大学 食品与生物工程学院,农产品加工黑龙江省普通高校重点实验室,黑龙江 齐齐哈尔161006)
糖基化及限制性酶解对大豆蛋白结构和抗氧化活性的影响
宋春丽,任 健,陈佳鹏,张 新,张新宇
(齐齐哈尔大学 食品与生物工程学院,农产品加工黑龙江省普通高校重点实验室,黑龙江 齐齐哈尔161006)
采用转谷氨酰胺酶催化大豆蛋白与壳寡糖发生糖基化反应,制备糖基化大豆蛋白,随后用胰蛋白酶对其进行限制性酶解,制得水解度为1%、5%、10%和 15%的酶解物。分析糖基化及限制性酶解对大豆蛋白的二级结构及抗氧化活性的影响。结果表明:糖基化大豆蛋白的分子发生了交联,酶解物的相对分子质量显著变小,而且分布更加广泛;糖基化大豆蛋白的结构变得无序,酶解导致大豆蛋白的无规则卷曲结构增加;两种修饰技术均能够改善大豆蛋白的抗氧化活性(DPPH自由基清除能力、还原力及亚铁离子螯合能力);糖基化及随后的酶解作用显著改变了大豆蛋白的表观黏度和黏弹特性。
大豆分离蛋白;糖基化;限制性酶解;二级结构;抗氧化活性
食品蛋白质的糖基化修饰采用的主要手段是美拉德反应,是一种有效改善蛋白质功能性质的方法。而转谷氨酰胺酶(E.C. 2.3.2.13,TGase)催化的反应,是将含氨糖基导入到蛋白质[1],制备糖基化交联蛋白质,是一种新型的蛋白质糖基化修饰技术。研究表明,该修饰技术显著改善了蛋白质的生物大分子功能性质,如蛋白质的流变性、胶凝性及乳化稳定性[2-4]。利用一些蛋白质水解酶,如胰蛋白酶的催化作用,通过断裂肽链的蛋白质肽链中Lys和Arg两个残基的羧基端肽键,改变蛋白质的肽链长度,进而改变其分子体积和结构,也能够导致蛋白质的功能性质发生显著改变[5-6]。此外,水解度对蛋白质的功能性质影响较大,如限制性酶解导致蛋白质美拉德产物的乳化活性[7]、抗氧化活性(如DPPH自由基清除能力及亚铁离子螯合能力)增强[8-9]。
转谷氨酰胺酶催化的糖基化及蛋白酶的限制性酶解对大豆蛋白的结构和功能性质的研究鲜有报道。本研究以大豆分离蛋白(SPI)及亲水性的壳寡糖为底物,通过转谷氨酰胺酶催化其发生糖基化交联反应,制备糖基化大豆蛋白(GSPI),并采用胰蛋白酶对其进行限制性酶解。分析糖基化及随后的限制性酶解对大豆蛋白的二级结构、抗氧化活性及流变性质的影响,为酶法制备功能性食品配料提供理论依据和技术支持。
1 材料与方法
1.1 实验材料
脱脂豆粉:哈尔滨市宾县禹王植物蛋白有限公司;转谷氨酰胺酶:江苏一鸣精细化工有限公司;壳寡糖(平均相对分子质量为1 kDa,脱乙酰度≥90%):浙江金壳生物化学有限公司;胰蛋白酶(酶活gt;2 500):Sigma公司。其他试剂均为分析纯。
DYY-10C型电泳仪;UV5100型紫外可见分光光度计;J-815型圆二色谱仪:日本Jasco公司;Kinexus型高级旋转流变仪:英国马尔文公司。
1.2 实验方法
1.2.1 糖基化大豆蛋白及其胰蛋白酶酶解物的制备
参照文献[4]的方法制备糖基化大豆蛋白。配制3.5%的糖基化大豆蛋白分散液(pH 7.0),在温度60℃下加入1%胰蛋白酶,滴加0.5 mol/L NaOH保持体系pH为7.0。根据pH-State法[9]计算制备水解度(DH)为1%、5%、10%和15%的酶解产物分别需要滴加的NaOH体积,反应结束后取出酶解液,立即在85℃水浴中灭酶5 min,终止反应。
1.2.2 SDS-聚丙烯凝胶电泳(SDS-PAGE)分析
采用恒压法电泳分析糖基化大豆蛋白及其酶解物的相对分子质量分布情况。浓缩胶、分离胶的质量分数分别为4%和12%,进样量10 μL,样品处于浓缩胶和分离胶的电压分别为80 V和120 V。
1.2.3 圆二色谱分析
待测样品的质量浓度为0.25 mg/mL(pH 7.0);检测波长为190~240 nm;扫描速度100 nm/min;数据间隔0.2 nm;带宽1.0 nm;反应时间0.125 s;圆二色谱(CD)数据用平均残基椭圆率表达。
1.2.4 抗氧化活性分析
根据文献[10]的方法测定大豆蛋白修饰产物的抗氧化活性。
(1)DPPH自由基清除能力的测定:取2 mL质量浓度为2 mg/mL待测样品,与2 mL质量浓度为0.04 mg/mL的DPPH无水乙醇溶液混合均匀,避光反应30 min,在517 nm处测其吸光值(Ai);2 mL无水乙醇溶液代替DPPH溶液作为空白,同上操作,测得吸光值(Aj);2 mL无水乙醇代替样品作为参比,同上操作,测得吸光值(A0)。维生素C溶液(VC,0.01%)作为阳性对照。DPPH自由基清除率=[1-(Ai-Aj)/A0] ×100%。
(2)还原力测定:取2 mL质量浓度为2 mg/mL待测样品,依次加入2 mL浓度为0.2 mol/L(pH 6.6)的磷酸盐缓冲液和1%铁氰化钾溶液,混匀,50℃水浴保温20 min后,加入2 mL 10%三氯乙酸溶液,振荡摇匀后以4 000 r/min离心10 min。取上清液2 mL,加入2 mL去离子水和0.4 mL 0.1%的三氯化铁溶液,振荡摇匀后在50℃水浴下保温10 min,在700 nm下进行比色。以VC溶液(0.01 mg/mL)作为阳性对照。
(3)羟基自由基清除能力的测定: 取2 mL质量浓度为2 mg/mL待测样品,依次加入2 mL浓度为6 mmol/L 的硫酸亚铁,6 mmol/L的双氧水,混匀后静置10 min,再加入2 mL浓度为6 mmol/L水杨酸,混匀,静置30 min,在510 nm处测定其吸光值记为Ai,当用双蒸水代替水杨酸时的吸光值记为Aj,空白对照组以双蒸水代替样品,吸光值记为A0。以VC溶液(0.01 mg/mL)作为阳性对照。羟基自由基清除率=[1-(Ai-Aj)/A0]×100%。
(4)亚铁离子螯合能力的测定:取1 mL质量浓度为2 mg/mL待测样品,依次加入2 mL浓度为100 μmol/L氯化亚铁溶液和2 mL浓度为0.5 mmol/L菲洛嗪溶液,剧烈振荡摇匀,室温下静置10 min,在563 nm处测定其吸光值为A样,以等体积去离子水取代样品溶液作为对照所测吸光值为A参。螯合率=(A样-A参)/A参×100%。
1.2.5 流变学分析
(1)静态流变特性测定:利用高级旋转流变仪测定糖基化大豆蛋白及其酶解产物的表观黏度。分散液的质量分数为4%(pH 7.0)。测试夹具为PP1/60,剪切速率为0.1~100 s-1。
(2)动态流变特性测定:上述样品在线性黏弹区内(实验测得应力振幅值为0.3%),剪切振荡频率0.1~10 Hz范围进行频率扫描,分析蛋白质分散液的储能模量(G′)和损耗模量(G″)随剪切频率的变化。
2 结果与讨论
2.1 SDS-PAGE分析
糖基化大豆蛋白及其胰蛋白酶酶解物的SDS-PAGE谱图如图1所示。
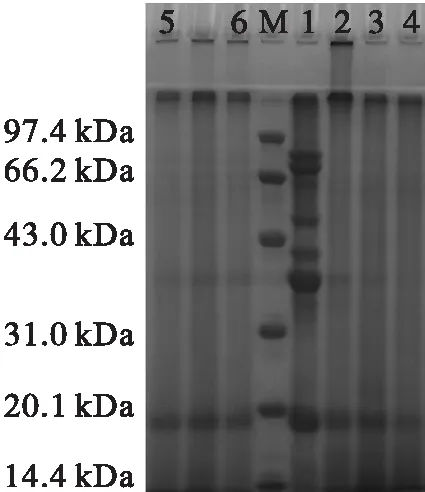
注:泳道M为标准蛋白;泳道1~6分别为大豆蛋白,糖基化大豆蛋白,DH为15%、10%、5%、1%的胰蛋白酶酶解物。
图1糖基化大豆蛋白及其胰蛋白酶酶解物的SDS-PAGE谱图
从图1可以看出,一部分糖基化大豆蛋白截留在浓缩胶处,无法进入分离胶,表明该蛋白质中含有蛋白质共聚物(泳道2)。与糖基化大豆蛋白相比,其胰蛋白酶酶解物在浓缩胶处的谱带逐渐消失;同时,随着水解度的增加,凝胶谱带下方的条带增多,DH 15%的胰蛋白酶酶解物在相对分子质量14.4 kDa附近处的条带最深(泳道3),表明低相对分子质量的肽的含量显著增多。电泳谱图的分析结果显示,胰蛋白酶的酶解显著降低了糖基化大豆蛋白的相对分子质量,同时导致其相对分子质量分布更加广泛。
2.2 圆二色谱(CD)分析
利用圆二色谱图分析糖基化大豆蛋白及其胰蛋白酶酶解产物的二级结构,包括α-螺旋、β-折叠、β-转角及无规则卷曲4种结构,结果如图2所示。
从图2可以看出,大豆蛋白在195 nm和216 nm处分别有正的摩尔椭圆率和负的摩尔椭圆率,以及在208 nm处有负的摩尔椭圆率,这表明大豆蛋白具有较多的β-折叠结构和α-螺旋结构[11]。相对于大豆蛋白,糖基化大豆蛋白在208 nm处负的摩尔椭圆率下降,表明蛋白质的α-螺旋结构减少,大豆蛋白的分子结构变得无序[4]。随后的胰蛋白酶酶解导致产物在200 nm处出现了显著的负峰,其对应为无规则卷曲结构[11]。相应地酶解产物的α-螺旋结构及β-折叠结构减少。圆二色谱分析结果表明,糖基化修饰使大豆蛋白的分子结构变得无序,随后的胰蛋白酶酶解使大豆蛋白的无规则卷曲结构显著增加,蛋白质分子二级结构更加松散。
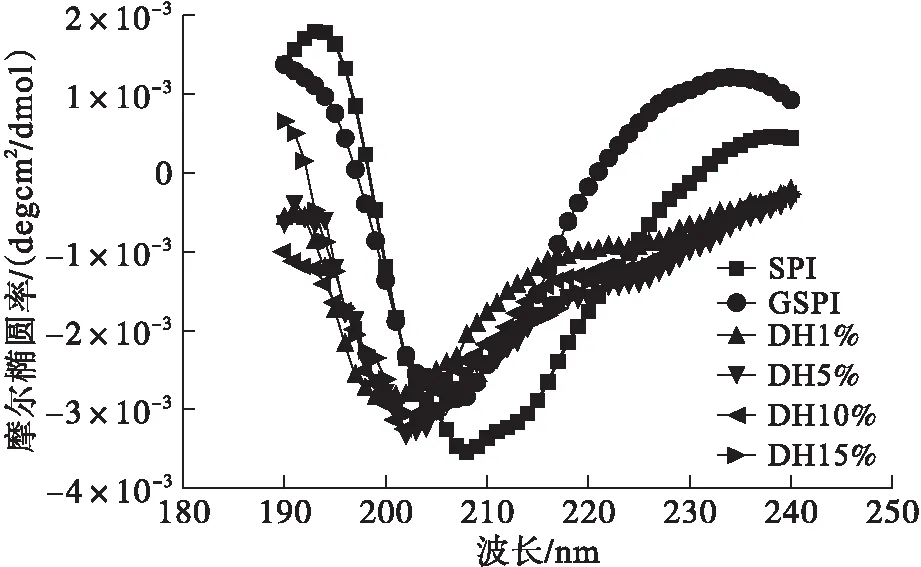
图2 糖基化大豆蛋白及其胰蛋白酶酶解物的圆二色谱图
2.3 抗氧化活性分析
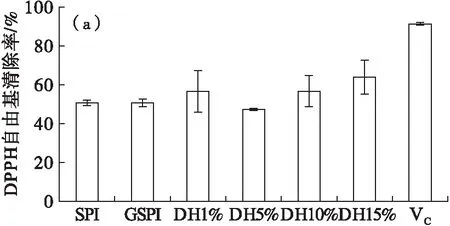
分别采用DPPH自由基清除能力、还原力、羟基自由基清除能力以及亚铁离子螯合能力表征大豆蛋白的抗氧化能力,结果如图3所示。
从图3(a)可以看出,糖基化大豆蛋白及其胰蛋白酶酶解产物的DPPH自由基清除能力较高(47.3%~63.9%);水解度为15%的糖基化大豆蛋白的DPPH自由基清除能力最高。抗氧化活性与肽段长度和肽的序列有关[12],不同水解度的糖基化大豆蛋白的肽链长度不同,因而抗氧化活性也不同。
还原剂是通过自身的还原作用提供电子从而清除自由基。还原能力越强,抗氧化活性就越强。在700 nm处的吸光值可以间接反映还原能力的大小,吸光值越大,还原能力越强[13]。从图3(b)可以看出,酶解产物的还原能力均高于大豆蛋白和糖基化大豆蛋白,这是由于酶解糖基化大豆蛋白使肽链的断裂增加了有效的氢离子,从而增强了还原能力。研究发现,酶解蛋白质导致蛋白质肽键断裂时,使具有抗氧化活性的氨基酸残基以及肽链暴露在外,进而增加了其抗氧化能力[14]。
从图3(c)可以看出,糖基化大豆蛋白的羟基自由基的清除能力低于大豆蛋白。随着水解度的增加,其胰蛋白酶酶解产物的羟基自由基清除能力增强,DH为5%的酶解产物羟基自由基清除能力达到47.2%。当水解度进一步增加,酶解产物的羟基自由基清除能力下降。可见,胰蛋白酶酶解糖基化大豆蛋白时,水解度对其羟基自由基清除能力影响较大。
从图3(d)可以看出,相对于大豆蛋白,糖基化大豆蛋白的亚铁离子螯合能力增强,其胰蛋白酶酶解物(DH 1%和DH 5%)的亚铁离子螯合能力也增强。可见,糖基化及胰蛋白酶的限制性酶解有助于提高大豆蛋白的生物利用率,从而有利于有机体对矿物质元素的吸收利用率[15]。

2.4 流变性质分析
2.4.1 表观黏度
糖基化大豆蛋白及其胰蛋白酶酶解物的表观黏度随剪切速率的变化测定结果如图4所示。
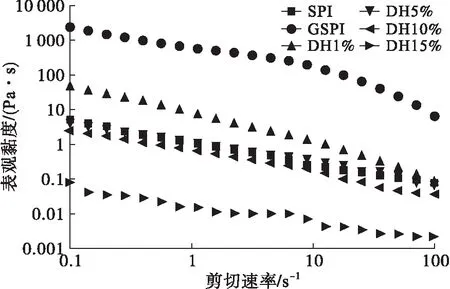
图4 糖基化大豆蛋白及其胰蛋白酶酶解物分散液的表观黏度
从图4可以看出,与大豆蛋白相比,糖基化大豆蛋白的表观黏度显著增加,酶解后,表观黏度显著下降,而且随着水解度的增加,表观黏度下降越明显。当水解度大于5%时,酶解物的表观黏度均低于大豆蛋白。此外,糖基化大豆蛋白及其胰蛋白酶酶解物都表现为非牛顿流体特性。这是因为蛋白质的分子体积会影响其表观黏度[16]。酶解会使大豆蛋白分子的相对分子质量减小和体积减小,进而蛋白质的表观黏度降低。随着剪切速率逐渐增加,蛋白质分子的体积减小,大豆蛋白及其酶解物表现出剪切稀释特性。
2.4.2 黏弹特性
振荡剪切时,糖基化大豆蛋白及其胰蛋白酶酶解物的储能模量(G′)和损耗模量(G″)在不同振荡频率时的变化如图5所示。
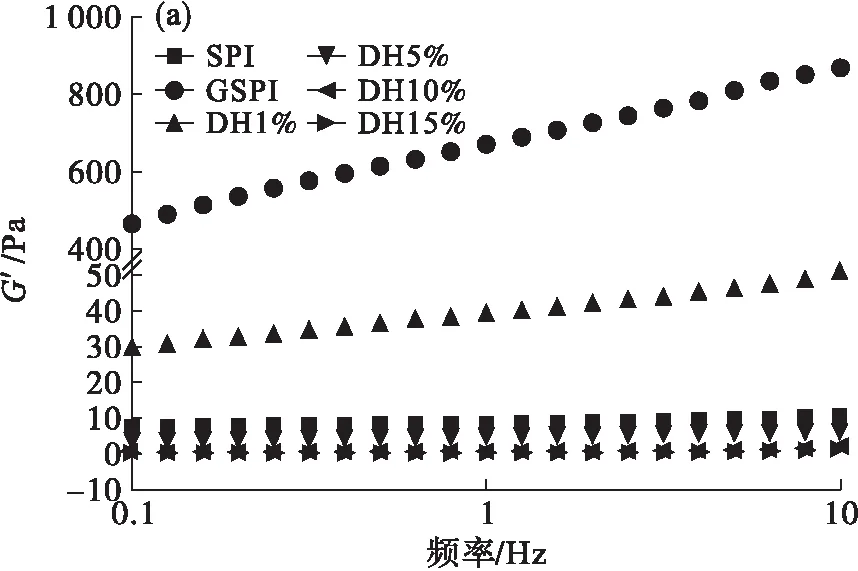
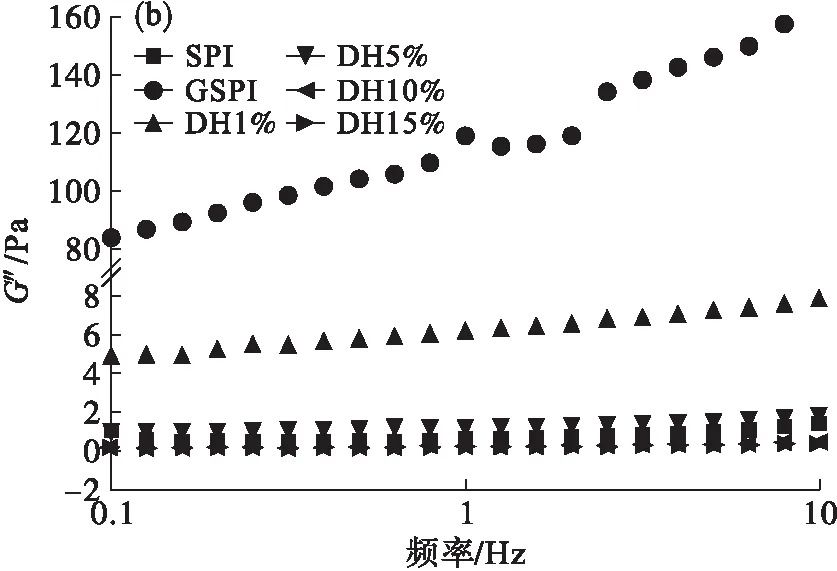
图5 糖基化大豆蛋白及其胰蛋白酶酶解物的黏弹性变化
从图5(a)可以看出,相对于大豆蛋白,糖基化大豆蛋白的G′显著增加,在频率为10 Hz时,增加了近80倍。经过胰蛋白酶酶解后,其酶解物的G′随着水解度的增加而显著降低,DH 1%酶解物的G′高于大豆蛋白的G′,其余酶解物的G′均低于大豆蛋白。从图5(b)可以看出,样品的G″的变化趋势与G′相似。同一分析样品的G′数值均高于其G″,表明所分析样品均具有类固体性质。黏弹性分析结果表明,糖基化修饰及酶解对大豆蛋白的流变性质影响较大,实际加工中可以根据需要,选择不同的蛋白质修饰手段制备具有不同流变性质的蛋白质配料。
3 结 论
转谷氨酰胺酶催化的大豆蛋白糖基化修饰及随后的胰蛋白酶的酶解作用改变了大豆蛋白的二级结构、抗氧化活性和流变性质。两种修饰作用导致大豆蛋白的二级结构更加无序;修饰作用能够改善大豆蛋白的抗氧化活性(DPPH自由基清除能力、还原力及亚铁离子螯合能力);而且两种修饰方法可以用于选择性地制备具有不同流变特性(如高/低表观黏度)的大豆蛋白产物。
[1] KIELISZEK M, MISIEWICZ A. Microbial transglutaminase and its application in the food industry. A review[J]. Folia Microbiol, 2014, 59(3): 241-250.
[2] JIANG S J, ZHAO X H. Transglutaminase-induced cross-linking and glucosamine conjugation in soybean protein isolates and its impacts on some functional properties of the products[J]. Eur Food Res Technol, 2010, 231(5): 679-689.
[3] SONG C L, ZHAO X H. Structure and property modification of an oligochitosan-glycosylated and crosslinked soybean protein generated by microbial transglutaminase[J]. Food Chem, 2014, 163(12): 114-119.
[4] FU M, ZHAO X H. Modified properties of a glycated and cross-linked soy protein isolate by transglutaminase and an oligochitosan of 5 kDa[J]. J Sci Food Agric, 2017, 97(1): 58-64.
[5] 王金水, 赵谋明, 蒲首丞,等. 胰蛋白酶水解谷朊粉的酶解产物抗氧化性研究[J]. 食品工业科技, 2005(10):93-96.
[6] 张鸣镝, 姚惠源. 胰蛋白酶水解玉米胚芽蛋白的研究[J].
中国油脂, 2006, 31(1):48-50.
[7] LI Y, ZHONG F, JI W, et al. Functional properties of Maillard reaction products of rice protein hydrolysates with mono-, oligo-and polysaccharides[J]. Food Hydrocoll, 2013, 30(1): 53-60.
[8] TANG C H, WANG X S, YANG X Q. Enzymatic hydrolysis of hemp (CannabissativaL.) protein isolate by various proteases and antioxidant properties of the resulting hydrolysates[J]. Food Chem, 2009, 114(4): 1484-1490.
[9] ADLER-NISSEN J. Limited enzymic degradation of proteins: a new approach in the industrial application of hydrolases[J]. J Chem Technol Biotechnol, 1982, 32: 138-156.
[10] ZHENG X, WANG J, LIU X, et al. Effect of hydrolysis time on the physicochemical and functional properties of corn glutelin by Protamex hydrolysis[J]. Food Chem, 2015, 172: 407-415.
[11] JOHNSON W C. Protein secondary structure and circular dichroism: a practical guide[J]. Protein Struct Funct Genet, 1990, 7(3): 205-214.
[12] 刘瑾. 酶法改善大豆分离蛋白起泡性和乳化性的研究[D]. 江苏 无锡:江南大学, 2008.
[13] 杨君丽, 魏安池, 马宇翔. 大豆球蛋白酶解物清除DPPH自由基活性的研究[J]. 粮油食品科技, 2010, 18(3):18-21.
[14] JIN T, WU Y, WANG Q. Production and characteristics of protein hydrolysates from Bombay duck (Harpodonnehereus)[J]. J Food Process Preserv, 2012, 36(1): 30-37.
[15] 李丹,赵新淮. 酪蛋白的谷氨酰胺酶水解及其产物的金属离子螯合能力[J]. 食品与发酵工业, 2010, 36(11): 21-25.
[16] BÖNISCH M P, LAUBER S, KULOZIK U. Improvement of enzymatic cross-linking of casein micelles with transglutaminase by glutathione addition[J]. Int Dairy J, 2007, 17(1): 3-11.
Effectofoligochitosanglycosylationandlimitedenzymatichydrolysisonstructureandantioxidantactivitiesofsoybeanprotein
SONG Chunli, REN Jian, CHEN Jiapeng, ZHANG Xin, ZHANG Xinyu
(Key Laboratory of Processing Agricultural Products of Heilongjiang Province, College of Food and Bioengineering,Qiqihar University, Qiqihar 161006,Heilongjiang, China)
The glycosylated soybean protein (GSPI) was first prepared by transglutaminase in the presence of oligochitosan and then hydrolyzed by trypsin to obtain the hydrolysates with hydrolysis degree of 1%, 5%, 10% and 15%. The effects of glycosylation and limited enzymatic hydrolysis on the secondary structure and antioxidant activities of soybean protein (SPI) were investigated. The results revealed the cross-linking of GSPI, while the hydrolysates exhibited significantly smaller relative molecular weight and wide distribution compared with SPI. GSPI structure became disorderly, and the enzymatic hydrolysis resulted in an increase of the random coil structure of SPI. The two modification technologies could improve the antioxidant activities of SPI (DPPH free radical scavenging activity, reducing power and Fe2+-chelating activity). The two modification methods significantly changed the apparent viscosity and viscoelastic characteristics of SPI.
soybean protein isolate; glycosylation; limited enzymatic hydrolysis; secondary structure; antioxidant activity
Q51;TQ201
A
1003-7969(2017)11-0065-05
2017-02-28;
2017-07-26
国家自然科学基金资助项目(31401639);黑龙江省本科高等学校青年创新人才支持计划(UNPYSCT-2015094)
宋春丽(1980),女,副教授,博士,研究方向为蛋白质化学(E-mail)songchunlilily@sina.com。
