亲水作用色谱-蒸发光散射法测定核桃乳中糖醇含量及其热稳定性研究
2017-12-11李露露余佳浩张连富
李露露,余佳浩,张连富,3
(1.食品科学与技术国家重点实验室,江苏 无锡214122; 2.江南大学 食品学院,江苏 无锡214122; 3.国家功能食品工程技术研究中心,江苏 无锡214122)
检测分析
亲水作用色谱-蒸发光散射法测定核桃乳中糖醇含量及其热稳定性研究
李露露1,2,余佳浩1,2,张连富1,2,3
(1.食品科学与技术国家重点实验室,江苏 无锡214122; 2.江南大学 食品学院,江苏 无锡214122; 3.国家功能食品工程技术研究中心,江苏 无锡214122)
建立了亲水作用色谱-蒸发光散射法同时测定核桃乳中木糖醇、赤藓糖醇、山梨糖醇、麦芽糖醇的含量,并研究了在121℃下,pH和加热时间对4种糖醇热稳定性的影响。结果表明:赤藓糖醇和木糖醇在0.08~1.25 mg/mL范围内线性良好,山梨糖醇和麦芽糖醇在0.05~1.45 mg/mL范围内线性良好,精密度RSDlt;3.5%(n=6),加标回收率为96.9%~103.1%;木糖醇、赤藓糖醇、山梨糖醇和麦芽糖醇在121℃加热条件下稳定性较好,加热残留率为83.03%~99.72%,4种糖醇的热稳定性随pH的增加而提高,随加热时间的延长而降低,且赤藓糖醇、麦芽糖醇、木糖醇的热稳定性要优于山梨糖醇。
亲水作用色谱;蒸发光散射检测器;糖醇;热稳定性
核桃乳是深受大众喜欢的营养型饮料,富含蛋白质、维生素B、尼克酸和多种微量元素。目前,核桃乳常用甜味剂为蔗糖,但蔗糖过多摄入易患肥胖症、心血管疾病、糖尿病等,因此研发无糖核桃乳已成为当今研究的热点。糖醇是多元酮糖或醛糖的羰基被还原成羟基的衍生物,在甜味特性方面接近蔗糖,有一定的甜度且热值较低,摄入后不消耗胰岛素,因此在很多方面可部分或完全替代蔗糖。除此之外,糖醇还具有较多的生理功能,如预防和治疗肥胖[1-2]、促进钙的吸收[3]、改善肠道功能[2]、预防龋齿[4]等。因此,本研究以糖醇替代蔗糖应用于核桃乳中,但核桃乳制备过程中的热、pH等会影响其含量,进而影响产品品质,所以需要对其含量进行测定。
目前检测糖醇常用的方法有高效液相色谱法[5-11]、液相色谱-质谱法[12]、气相色谱法[13-17]、气相色谱-质谱法[18]、分光光度法[19]、毛细管电泳法[20]等。但气相色谱法、毛细管电泳法、分光光度法需要经过衍生化,方法烦琐,且增加误差。质谱法对仪器要求高,且花费费用较大。本文采用高效液相色谱-蒸发光散射法测定核桃乳中糖醇含量,虽然已有文献报道使用此法,但其他文献中多用糖柱和氨基柱,使用亲水作用色谱柱的报道较少,该法具有可进行梯度洗脱、样品处理简单、分离时间短、基线稳定、分离效果佳、结果准确等优点。在此基础上,本文研究了在121℃下,不同pH和加热时间对核桃乳中木糖醇、赤藓糖醇、山梨糖醇、麦芽糖醇稳定性的影响,为糖醇在核桃乳的工业应用中合理选择灭菌时间、提高核桃乳质量提供依据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
超纯水:自制;木糖醇(gt;99.0%)、山梨糖醇(99.0%)、麦芽糖醇(gt;99.0%)、赤藓糖醇(gt;99.0%):美国Sigma公司;阿克苏185核桃:无锡欧尚超市购入;三氯乙酸、碳酸钠:分析纯;乙腈:色谱纯;单硬脂酸甘油酯、蔗糖脂肪酸甘油酯、卡拉胶、阿拉伯胶:丹尼斯克有限公司。
1.1.2 仪器与设备
2695型高效液相色谱仪:美国Waters公司;UM-3000蒸发光散射检测器;KQ-500DE型数控超声波清洗器;CR21N冷冻离心机:日本HITACHI公司;AH-2010型均质机;FE-20K pH计:瑞士Mettler Toledo公司;胶体磨;HR1724型打浆机;AG245型电子分析天平:瑞士Mettler Toledo公司;Smart-S30实验室纯水系统;DSX-280B手提式压力蒸汽灭菌器。
1.2 试验方法
1.2.1 溶液配制
1.2.1.1 标准储备溶液的配制
精确称取赤藓糖醇、山梨糖醇、麦芽糖醇、木糖醇各1.000 0 g,用70%乙腈水溶液溶解并定容至100 mL,分别配制成10 mg/mL的溶液。取上述溶液,用10 mL容量瓶稀释成0.5 mg/mL的单标溶液。
1.2.1.2 混合标准溶液的配制
准确称取赤藓糖醇、山梨糖醇、麦芽糖醇、木糖醇各1.000 0 g,用70%乙腈水溶液溶解并定容至100 mL,配制成10 mg/mL的糖醇混合储备液。用70%乙腈水溶液稀释成质量浓度为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的混合标准溶液。
1.2.1.3 三氯乙酸溶液的配制[22]
称取10 g三氯乙酸,加超纯水溶解并定容至100 mL,配制成0.1 g/mL的溶液。
1.2.1.4 碳酸钠溶液的配制[22]
称取2.12 g碳酸钠,加超纯水溶解并定容至100 mL,配制成21.2 mg/mL的溶液。
1.2.2 核桃乳的制备
将核桃仁用4%碳酸钠、10%氢氧化钙混合溶液煮沸3 min去皮,自来水反复冲洗多次。按照 1∶6 的料水比进行打浆和胶磨,用100目网筛过滤得到滤液,加入糖醇、乳化剂、增稠剂和1%柠檬酸,用2%碳酸钠调节pH,80 MPa均质3次,装罐,在121℃灭菌一定时间。
1.2.3 糖醇含量的测定
1.2.3.1 样品前处理[22]
取核桃乳200 g,在密闭的容器中混匀,称取2.500 0 g样品于25 mL容量瓶中,用移液管移取17.5 mL超纯水混匀,放在超声波清洗器中超声30 min,每隔5 min混匀1次。超声结束后,加入2.5 mL 三氯乙酸溶液,摇匀后室温放置30 min,8 000×g离心20 min,用滤纸过滤。取滤液850 μL,加入150 μL碳酸钠溶液混匀,加入2.33 mL 乙腈溶液,经0.22 μm微孔滤器过滤,滤液待上机分析。
1.2.3.2 亲水作用色谱-蒸发光散射法测定条件
TOSOH Amide-80色谱柱(2.0 mm×15 cm,3 μm);柱温26℃;进样量20 μL;蒸发管温度50℃;载气流速2.5 L/min,流动相梯度洗脱条件如表1所示。

表1 梯度洗脱程序
1.2.4 核桃乳中糖醇热稳定性分析
将核桃乳调制成pH 6.0、6.5、7.0、7.5、8.0、8.5,在121℃分别加热10、15、20、25、30 min,依照上述方法测定木糖醇、山梨糖醇、麦芽糖醇、赤藓糖醇在加热过程中的质量浓度变化,按照如下公式求得加热残留率,分析核桃乳中木糖醇、山梨糖醇、麦芽糖醇、赤藓糖醇残留率随加热时间和pH变化的趋势。计算结果以独立重复3次结果的平均值表示,结果保留小数点后两位。
式中:C1为加热核桃乳中木糖醇、麦芽糖醇、山梨糖醇、赤藓糖醇的质量浓度,mg/mL;C2为未加热核桃乳中木糖醇、麦芽糖醇、山梨糖醇、赤藓糖醇的质量浓度,mg/mL。
2 结果与分析
2.1 混合标准溶液的分离效果
本试验采用糖醇常用流动相乙腈和水进行分离,但在试验中发现等度的流动相无法分离4种糖醇,经过摸索,发现表1的梯度洗脱程序可以完成4种糖醇的完全分离,分离情况见图1。
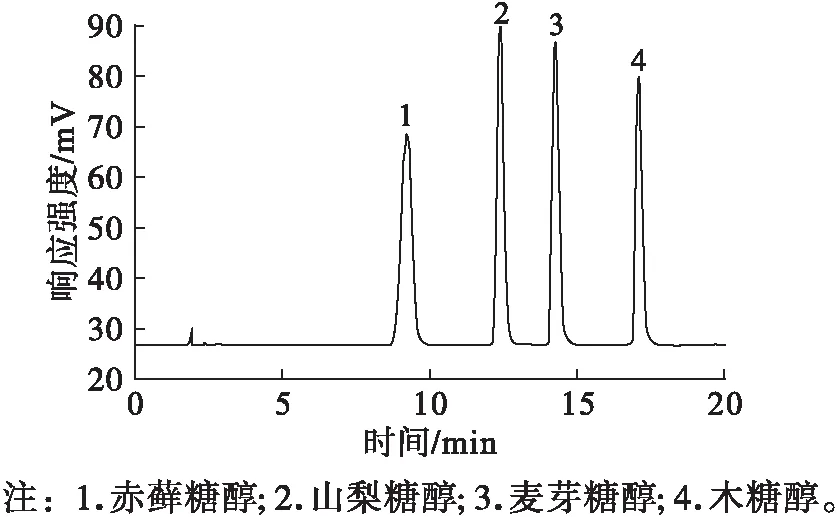
图1 混合标准溶液的色谱图
2.2 色谱条件的优化
2.2.1 蒸发管温度的确定
以信噪比为考核指标,采用1.2.3.2色谱条件,保持其他色谱条件恒定,考察蒸发管温度对色谱分离效果的影响,结果如图2所示。

图2 糖醇信噪比随蒸发管温度的变化
由图2可知,50℃时4种糖醇的信噪比均最高,最终选择蒸发管温度为50℃。
2.2.2 载气流速的确定
以信噪比为考核指标,采用1.2.3.2色谱条件,保持其他色谱条件恒定,考察载气流速对色谱分离效果的影响,结果见图3所示。
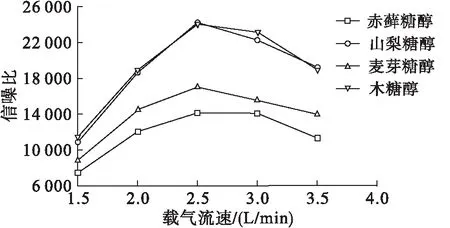
图3 糖醇信噪比随载气流速的变化
由图3可知,载气流速为2.5 L/min时4种糖醇的信噪比均最高,最终选择载气流速为2.5 L/min。
2.3 方法的验证
2.3.1 标准回归方程、线性范围、相关系数、检出限
将1.2.1.2中的混合标准溶液,在1.2.3.2的色谱条件下进机检测,将峰面积对数(Y)和质量浓度对数(X)进行线性回归,得到标准回归方程、相关系数、线性范围、检出限,结果见表2。
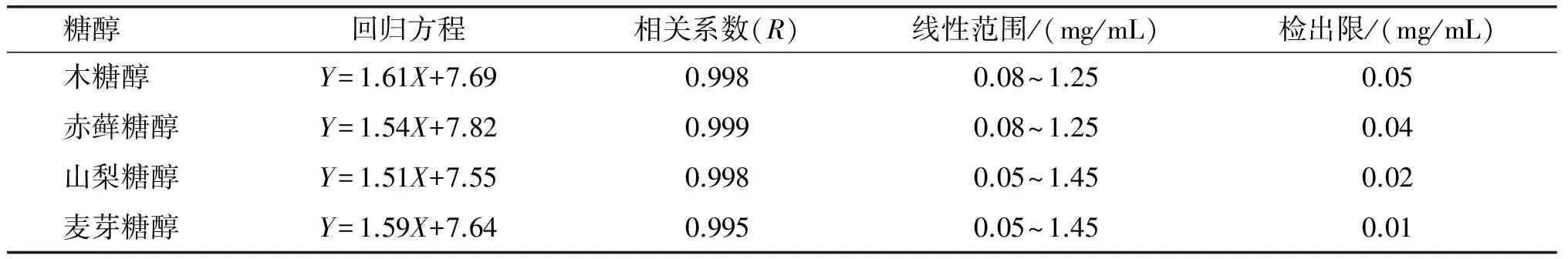
表2 4种糖醇的标准回归方程、相关系数、线性范围及最低检出限
由表2可知,木糖醇和赤藓糖醇在0.08~1.25 mg/mL范围内线性良好,山梨糖醇和麦芽糖醇在0.05~1.45 mg/mL范围内线性良好,将标准溶液不断稀释至信噪比为3,此时的质量浓度为该糖醇的检出限。
2.3.2 精密度试验
将质量浓度为0.3 mg/mL的混合标准溶液重复进样6次,用峰面积计算精密度,结果见表3。由表3可知,RSD在1.65%~3.50%(n=6)之间,精密度良好。
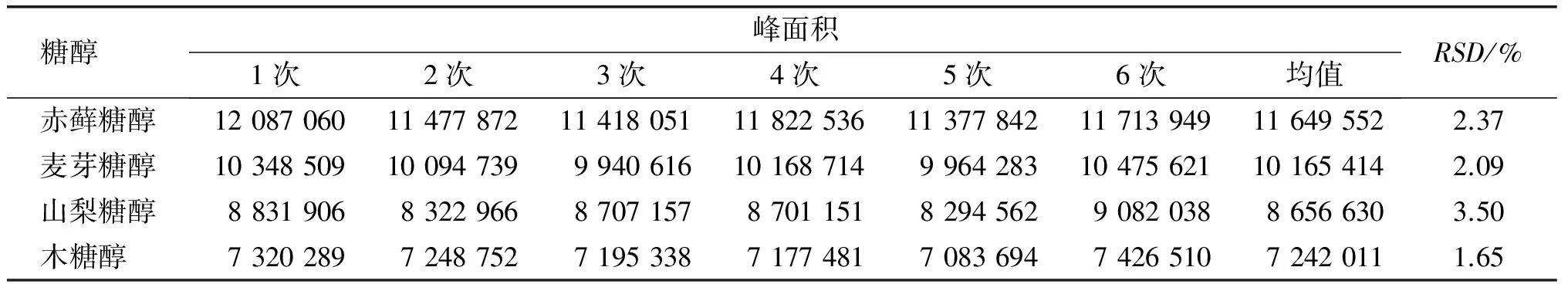
表3 精密度试验结果
2.3.3 回收率试验
向核桃乳中添加一定量的木糖醇、赤藓糖醇、山梨糖醇和麦芽糖醇进行加标回收试验,每种糖醇2个水平,结果见表4。
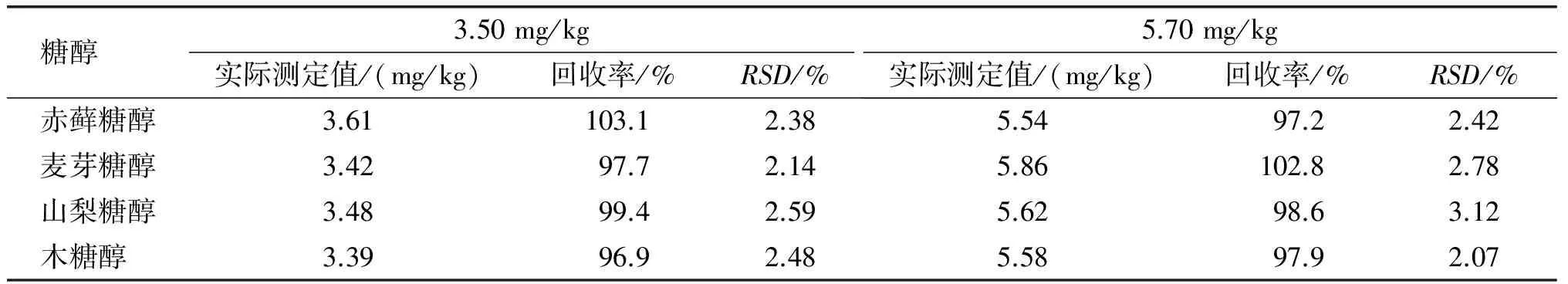
表4 样品加标回收率
由表4可知,样品加标回收率为96.9%~103.1%,RSD2.07%~3.12%(n=3)。
2.4 糖醇热稳定性测定
木糖醇、山梨糖醇、麦芽糖醇、赤藓糖醇的热稳定性测定结果见图4。
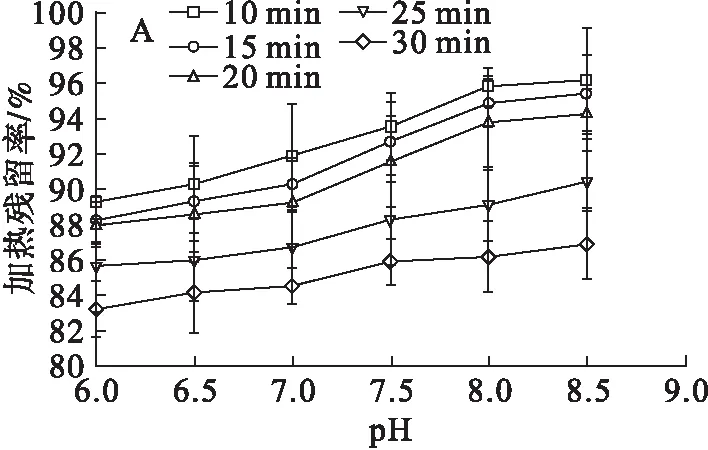
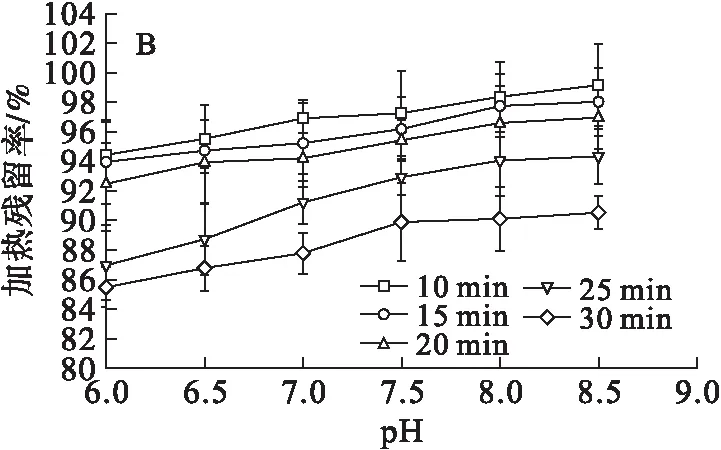
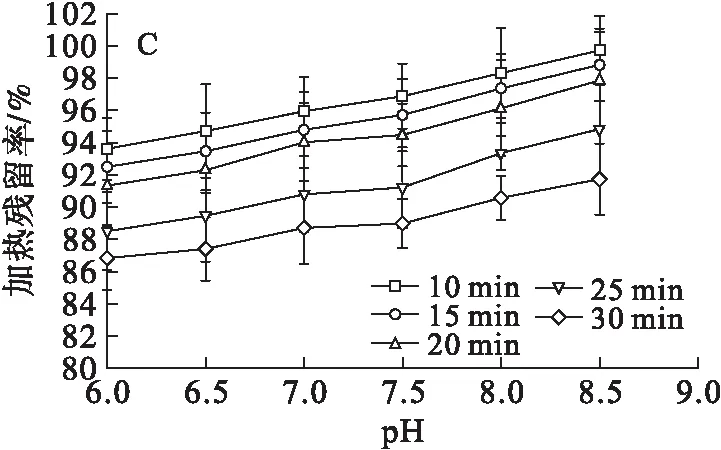
由图4可知,木糖醇、山梨糖醇、麦芽糖醇、赤藓糖醇在pH 6.0~8.5范围内随pH的增大而热稳定性逐渐增强,随加热时间的延长而热稳定性逐渐降低,木糖醇、麦芽糖醇、赤藓糖醇热稳定性优于山梨糖醇。木糖醇、山梨糖醇、麦芽糖醇、赤藓糖醇随pH的增大热稳定性逐渐增强的原因可能为柠檬酸催化糖醇热分解,而加入的碳酸钠中和部分柠檬酸,且生成的柠檬酸钠会中和糖醇二次降解产生的酸而起到提高糖醇热稳定性的作用[23]。赤藓糖醇加热残留率为85.17%~99.16%,麦芽糖醇加热残留率为 86.83%~99.72%,木糖醇加热残留率为87.32%~99.50%,山梨糖醇的加热残留率为83.03%~96.06%。木糖醇、山梨糖醇、麦芽糖醇、赤藓糖醇加热10~20 min热降解速率明显低于20~30 min的热降解速率。
从热稳定性的角度考虑,与山梨糖醇相比,木糖醇、赤藓糖醇、麦芽糖醇更适合应用于核桃乳中。木糖醇、山梨糖醇、赤藓糖醇、麦芽糖醇均适用于碱性核桃乳中,适宜的灭菌时间为10~20 min。
3 结 论
采用亲水作用色谱-蒸发光散射法同时测定了核桃乳中赤藓糖醇、山梨糖醇、麦芽糖醇和木糖醇的含量。结果表明,该方法能有效实现核桃乳中4种糖醇的测定,并且其前处理简便、灵敏度高、分离效果佳、准确度高、精密度好。同时,通过分析糖醇在121℃加热条件下,pH和加热时间对其稳定性的影响,结果发现山梨糖醇、木糖醇、麦芽糖醇、赤藓糖醇具有较高的热稳定性,其中木糖醇、赤藓糖醇、麦芽糖醇较山梨糖醇更适合应用于核桃乳中。
[1] 王星云,王成福. 麦芽糖醇的功能特性与应用[J]. 中国食品添加剂,2009,17(1): 152-155.
[2] 王蕊. 功能性甜味剂木糖醇及在食品加工中的应用[J]. 江苏食品与发酵,2008,16(2):18-20.
[3] 王凯,高群玉. 糖醇食品健康营养新概念[J]. 粮油食品科技,2010,18(1):42-46.
[4] THABUIS C,CHENG C Y,WANG X,et al. Effects of maltitol and xylitol chewing-gums on parameters involved in dental caries development[J]. Eur J Paediatr Dent,2013,14(4): 303-308.
[5] 马立田,王式箴. 高效液相色谱法测定低热量食品中的葡萄糖、果糖、蔗糖、麦芽糖醇和山梨糖醇的研究[J]. 食品与发酵工业,1998,24(4):12-17.
[6] 李黎,刘玉峰,唐华澄,等. 高效液相色谱法测定食品中的糖醇[J]. 食品科学,2007,28(6):278-280.
[7] 陈树东,林晓佳,林森煜,等. 高效液相色谱法同时检测胶基糖果中的7种糖醇[J]. 食品安全质量检测学报,2016,13(5):1908-1914.
[8] 刘琳,郝鹏飞,张丽,等. 高效液相色谱法测定葡萄酒中多种糖醇[J]. 食品研究与开发,2016,37(13):147-150.
[9] 权静,吴永宏. 高效液相色谱法测定发酵液中的赤藓糖醇[J]. 安徽农业科学,2008,36(30):13005-13010.
[10] 林慧,颜春荣,徐春祥,等. HPLC-ELSD法同时测定食品中的10种糖和糖醇[J]. 食品科学,2013,34(12):286-291.
[11] 黄蕊,吴光斌,陈发河. 高效液相色谱法测定水果中常见的4种糖和糖醇[J]. 集美大学学报(自然科学版),2014,19(3):179-184.
[12] 马书民,王明泰,韩大川,等. 液相色谱串联质谱法测定食品中甘乳糖醇、麦芽糖、木糖醇、山梨糖醇[J]. 中国食品添加剂,2011,23(50):206-210.
[13] 张雅珩,周围,李斌. 衍生化毛细管气相色谱法同时测定无糖食品中的多种糖醇类甜味剂[J]. 分析化学,2013,41(6):911-916.
[14] 李铁林,吴昌贤,张燕霞. 糖和糖醇的气相色谱分析研究Ⅱ.糖腈乙酰酯衍生物气相色谱分析的改进[J]. 分析化学,1982,10(5):272-276.
[15] 陈晨,朱建良,欧阳平凯. 稀水溶液中糖和糖醇的气相色谱分析[J]. 南京化工大学学报(自然科学版),1997,19(2):80-82.
[16] 曹玉林,束天锋,刘艳玲,等. 牛奶中三种糖醇类甜味剂的气相色谱测定及前处理方法研究[J]. 食品工业科技,2015,36(10):69-72.
[17] 高国琰,董贵章. 气相色谱法尿半乳糖醇及其他糖醇的测定[J]. 中国医科大学学报,1995,24(3):247-249.
[18] 周洪斌,熊治渝,余杨,等. 醋酸酐衍生-气相色谱-质谱联用测定葡萄酒中的糖醇[J]. 色谱,2013,31(8):786-790.
[19] 梁振明. 分光光度法测定山梨醇含量[J]. 中国食品添加剂,2007,27(1):184-185.
[20] 穆广芬. 高效毛细管电泳在食品及药品分析中的应用[D]. 山东 烟台:烟台大学,2012.
[21] 邓月影,翟金萍,郎爱东. 亲水作用色谱在中药极性成分分析中应用进展[J]. 中药材,2012,35(3):499-502.
[22] 唐治玉,傅博强,盛灵慧,等. 高效液相色谱-蒸发光散射法测定食品中糖醇含量的研究[J]. 食品工业科技,2016,20(7):78-89.
[23] 张义明. 还原糖和无机盐对蔗糖热稳定性的影响研究[J]. 贵州工学院学报,1995,24(2):42-45.
DeterminationofsugaralcoholsinwalnutmilkbyHILIC-ELSDanditsthermalstability
LI Lulu1,2,YU Jiahao1,2,ZHANG Lianfu1,2,3
(1.State Key Laboratory of Food Science and Technology, Wuxi 214122, Jiangsu, China; 2.School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China; 3.National Engineering Research Center for Functional Food, Wuxi 214122, Jiangsu, China)
The contents of xylitol, erythritol, sorbitol and maltol in walnut milk were determined by HILIC-ELSD, and the effects of pH and heating time on the thermal stability of the four kinds of sugar alcohols at 121℃ were investigated.The results showed that the linear range of erythritol and xylitol was 0.08-1.25 mg/mL, the linear range of sorbitol and maltol was 0.05-1.45 mg/mL, theRSDwas lower than 3.5% (n=6), and the recoveries were 96.9%-103.1%. The stabilities of xylitol, erythritol, sorbitol and maltol were good at 121℃, and heating retention rates were 83.03%-99.72%. The stabilities of the four sugar alcohols increased with the increase of pH, decreased with heating time prolonging, and the thermal stabilities of erythritol, maltol and xylitol were better than that of sorbitol.
HILIC;ELSD;sugar alcohol; thermal stability
O657.7;TS27
A
1003-7969(2017)11-0132-05
2017-01-06;
2017-06-14
高等学校博士学科点专项科研基金(2013009110008);中央高校基本科研业务费专项资金(JUSRP51501)
李露露(1991),女,硕士,研究方向为食品科学与工程(E-mail)1163785793@qq.com。
张连富,教授,博士(E-mail)lianfu@jiangnan.edu.cn。
