壳聚糖甘油二酯微乳液的制备、表征及稳定性研究
2017-12-11汪慧超薛秀恒
钱 宇,汪慧超,薛秀恒
(安徽农业大学 茶与食品科技学院,安徽省农产品加工工程实验室,合肥230036)
油脂化学
壳聚糖甘油二酯微乳液的制备、表征及稳定性研究
钱 宇,汪慧超,薛秀恒
(安徽农业大学 茶与食品科技学院,安徽省农产品加工工程实验室,合肥230036)
以壳聚糖为壁材制备壳聚糖甘油二酯微乳液,在单因素试验基础上,采用响应面试验优化制备条件,并对壳聚糖甘油二酯微乳液的表面性质与温度稳定性、贮藏稳定性、氧化稳定性进行了研究。结果表明,壳聚糖甘油二酯微乳液最佳制备工艺条件为:壳聚糖质量浓度3.44 mg/mL,三聚磷酸钠(TPP)质量浓度1.5 mg/mL,壳聚糖与1,3-甘油二酯乳脂质量比1∶2.79,壳聚糖溶液与TPP溶液体积比2∶1。在最佳制备工艺条件下,所制备的壳聚糖甘油二酯微乳液包埋率为66.53%,粒子分布均匀,粒径可达93.7 nm;壳聚糖甘油二酯微乳液有明显的壳核结构;壳聚糖甘油二酯微乳液在20~70 ℃的范围内有相对较好的稳定性,最佳贮藏温度为4℃,且包被很好地延缓了1,3-甘油二酯乳脂的氧化。
壳聚糖;甘油二酯;微乳液;温度稳定性;贮藏稳定性;氧化稳定性
甘油二酯具有两种不同的异构体,分别是 1,2-甘油二酯和1,3-甘油二酯。在普通油脂的生理代谢中,主要以1,2-甘油二酯的形式存在。现有研究显示,1,3-甘油二酯具有一定的功能性,主要体现在降低血脂、缓解糖尿病、降低食欲等方面。在美国,1,3-甘油二酯作为食品材料已经通过FDA的许可,在日本,1,3-甘油二酯也被允许作为烹调用油进行食用[1-5]。
但是甘油二酯极易被氧化,存放过程中容易使其活性降低。因此,利用包被、微胶囊、微乳化等技术对其进行处理,可以避免活性下降,提高其生物利用价值[6-8]。目前,可用作微乳液包被的壁材有很多种,其中壳聚糖是自然界唯一带阳离子的天然活性多糖,来源丰富、天然无毒、生物相容性好,与其他合成高分子材料有着不可比拟的优势。且壳聚糖与人体细胞有良好的亲和性,无排斥反应[9-13]。
本研究采用带正电荷的壳聚糖为壁材,对 1,3-甘油二酯乳脂进行包被处理,并对所制备的壳聚糖甘油二酯微乳液的表面性质与温度稳定性、贮藏稳定性、氧化稳定性进行了研究,以期为甘油二酯的深加工奠定基础。
1 材料与方法
1.1 试验材料
低相对分子质量壳聚糖,浙江金壳药业有限公司;乙酸(分析纯);吐温-80(分析纯);三聚磷酸钠(TPP);二氯甲烷(分析纯);1,3-甘油二酯乳脂,实验室自制;正己烷(色谱纯),异丙醇(色谱纯),亚甲基蓝。
JA2103电子天平;DF-101S型集热式恒温加热磁力搅拌器;HH-S恒温水浴锅;HG303-3恒温培养箱;1525系列高效液相色谱仪,美国Waters公司;2414示差折光检测器,美国Waters公司;Zeta电位及纳米粒度测定仪,英国Malvern公司;OXITEST油脂氧化分析仪,意大利VELP公司。
1.2 试验方法
1.2.1 壳聚糖甘油二酯微乳液的制备
参照Calvo等[14]和Hosseini等[15]制备壳聚糖纳米粒的方法并做改进,利用离子交联原理结合O/W 乳液的方法制备壳聚糖甘油二酯微乳液。称取一定量的壳聚糖(CS),用1%醋酸溶液在20 ℃条件下过夜搅拌,得壳聚糖溶液,向其中加入1%吐温-80(HLB 15.9),60 ℃加热2 h。称取一定量的1,3-甘油二酯乳脂(DG),溶于2 mL二氯甲烷,得油相,将其缓慢逐滴加到水相的CS溶液中,20℃温和搅拌30 min,得O/W乳液。再向其中逐滴加入TPP溶液,于20 ℃温和搅拌30 min,即得壳聚糖甘油二酯微乳液。
1.2.2 壳聚糖甘油二酯微乳液的质量评价
1.2.2.1 包埋率的测定
通过高效液相色谱法测定甘油二酯乳脂的含量[16]。
表面油的提取:取制备好的壳聚糖甘油二酯微乳液,加入正己烷-异丙醇(15∶1),反复萃取后合并有机相并定容,用高效液相色谱测定甘油二酯乳脂含量。
总油的提取:将制备好的壳聚糖甘油二酯微乳液乳液在超声波细胞破碎仪中破乳后,加入正己烷-异丙醇(15∶1),反复萃取后合并有机相并定容,用高效液相色谱测定甘油二酯乳脂含量。
包埋率按下式计算:
1.2.2.2 粒径及表面电位的测定
通过Zeta电位及纳米粒度测定仪测定。
1.2.3 透射电镜观察
将壳聚糖溶液与壳聚糖甘油二酯微乳液分别滴加到铜网上,用1%磷钨酸负染色,室温下自然干燥,然后置于透射电镜仪上观察。
1.2.4 稳定性试验
1.2.4.1 温度稳定性
将壳聚糖甘油二酯微乳液置于20、30、40、50、60、70、80、90 ℃的环境中,分别加热30 min,室温静置12 h,测定甘油二酯乳脂含量,计算包埋率。
1.2.4.2 贮藏稳定性
将壳聚糖甘油二酯微乳液置于不同的贮藏温度(4、25、37 ℃),30 d内每隔5 d测定甘油二酯乳脂含量,计算包埋率。
1.2.4.3 氧化稳定性
使用油脂氧化分析仪对壳聚糖甘油二酯微乳液及1,3-甘油二酯乳脂进行分析。压力为0.6 MPa、温度为110℃,观察二者的氧化稳定性。
2 结果与分析
2.1 单因素试验
2.1.1 壳聚糖质量浓度的确定
在TPP质量浓度1.5 mg/mL、CS与DG质量比1∶2、CS溶液与TPP溶液体积比2∶1的条件下,研究壳聚糖质量浓度对微乳液包埋率及粒径的影响,结果如图1所示。
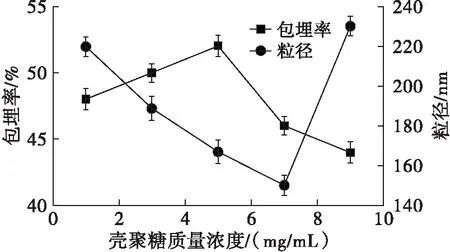
图1 壳聚糖质量浓度对包埋率及粒径的影响
从图1可以看出,随着壳聚糖质量浓度的增加,微乳液的包埋率先增加后减小,而粒径则先减小后增加。在壳聚糖质量浓度为5 mg/mL时,微乳液的包埋率达到最大值。而壳聚糖质量浓度为7 mg/mL时,微乳液粒径达到最小值,但与壳聚糖质量浓度为5 mg/mL时的粒径相差不大。因此,选择最佳壳聚糖质量浓度为5 mg/mL。
2.1.2 TPP质量浓度的确定
在壳聚糖质量浓度5 mg/mL、CS与DG质量比1∶2、CS溶液与TPP溶液体积比2∶1的条件下,研究TPP质量浓度对微乳液包埋率及粒径的影响,结果如图2所示。
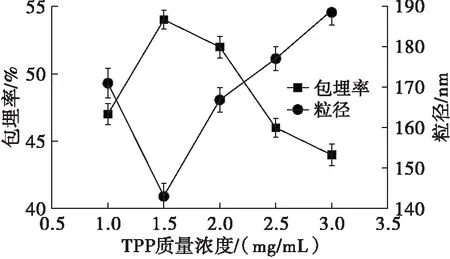
图2 TPP质量浓度对包埋率及粒径的影响
从图2可以看出,随着TPP质量浓度的增加,微乳液的包埋率先增加后减小,而粒径则先减小后增加,在TPP质量浓度为1.5 mg/mL时,微乳液的包埋率达到最大值,粒径达到最小值。因此,选择最佳TPP质量浓度为1.5 mg/mL。
2.1.3 CS与DG质量比的确定
在壳聚糖质量浓度5 mg/mL、TPP质量浓度1.5 mg/mL、CS溶液与TPP溶液体积比2∶1的条件下,研究CS与DG质量比对微乳液包埋率及粒径的影响,结果如图3所示。
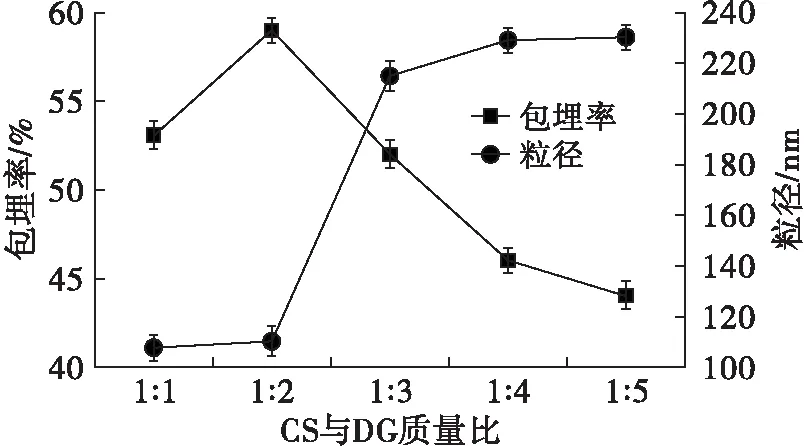
图3 CS与DG质量比对包埋率及粒径的影响
从图3可以看出,随着CS与DG质量比的增加,微乳液的包埋率呈先增加后减小的趋势,在CS与DG质量比为1∶2时,微乳液的包埋率达到最大值。而随着CS与DG质量比的继续增加,微乳液的粒径逐渐增加,在CS与DG的质量比为1∶1及1∶2时,微乳液的粒径都较小。因此,选择最佳CS与DG质量比为1∶2。
2.1.4 CS溶液与TPP溶液体积比的确定
在壳聚糖质量浓度5 mg/mL、TPP质量浓度1.5 mg/mL、CS与DG质量比1∶2的条件下,研究CS溶液与TPP溶液体积比对微乳液包埋率及粒径的影响,结果如图4所示。
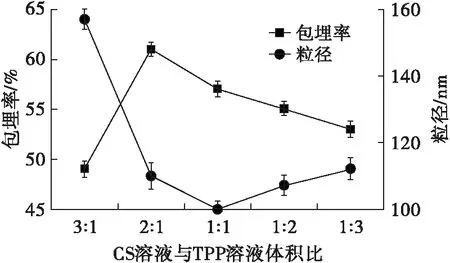
图4 CS溶液与TPP溶液体积比对包埋率及粒径的影响
从图4可以看出,随着CS溶液与TPP溶液体积比的增加,微乳液的包埋率呈先增加后减小的趋势,在CS溶液与TPP溶液体积比为2∶1时,微乳液的包埋率达到最大值。随着CS溶液与TPP溶液体积比的增加,微乳液的粒径则呈先减小后增加的趋势,在体积比为1∶1时,微乳液粒径达最小值,但较2∶1时粒径相差不大。因此,最佳CS溶液与TPP溶液体积比为2∶1。
2.2 响应面优化试验
固定TPP质量浓度为1.5 mg/mL,以壳聚糖质量浓度(A)、CS与DG质量比(B)、CS溶液与TPP溶液体积比(C)为自变量,壳聚糖甘油二酯微乳液的包埋率(Y)为指标,利用响应面分析法优化制备工艺。响应面试验因素水平编码见表1,响应面试验设计及结果见表2。

表1 响应面试验因素水平编码
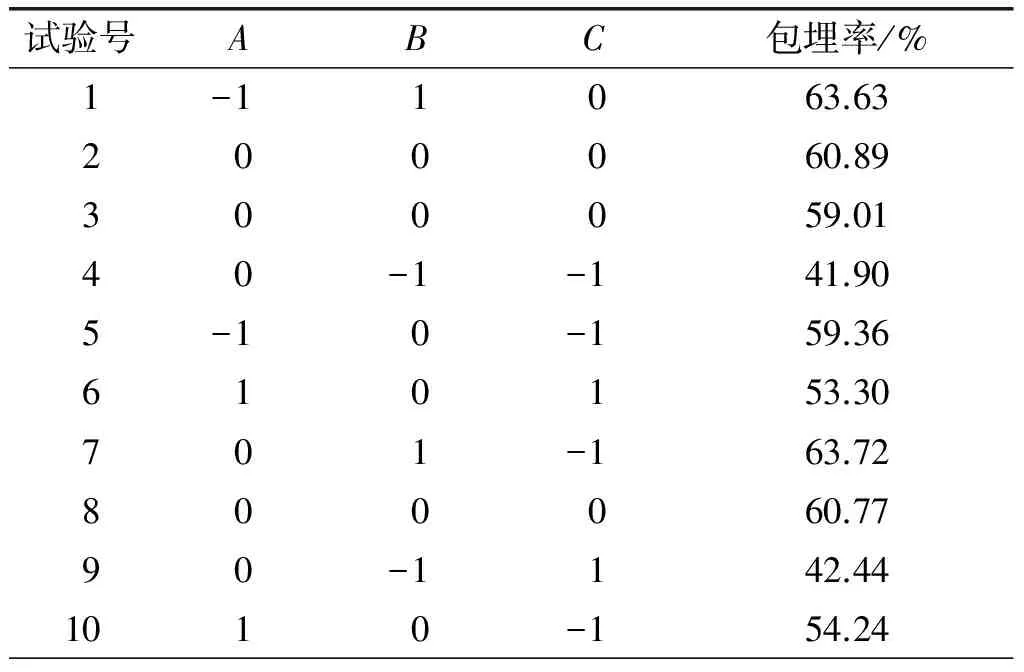
表2 响应面试验设计及结果
续表2
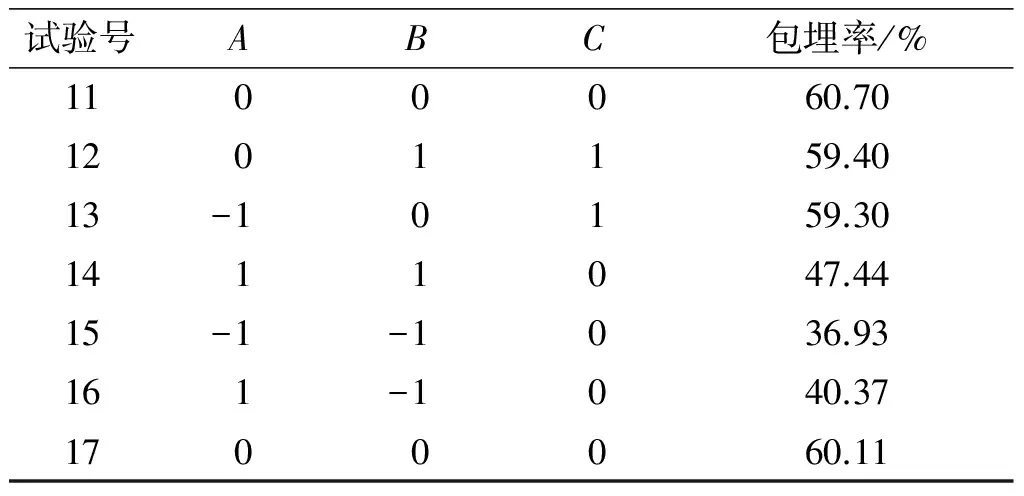
试验号ABC包埋率/%1100060.701201159.4013-10159.301411047.4415-1-1036.93161-1040.371700060.11
对表2数据进行分析,得到响应面回归方程:Y=60.30-2.98A+9.07B-0.60C-4.91AB-0.22AC-1.21BC-4.26A2-8.94B2+0.51C2。
对回归方程进行方差分析,结果见表3。
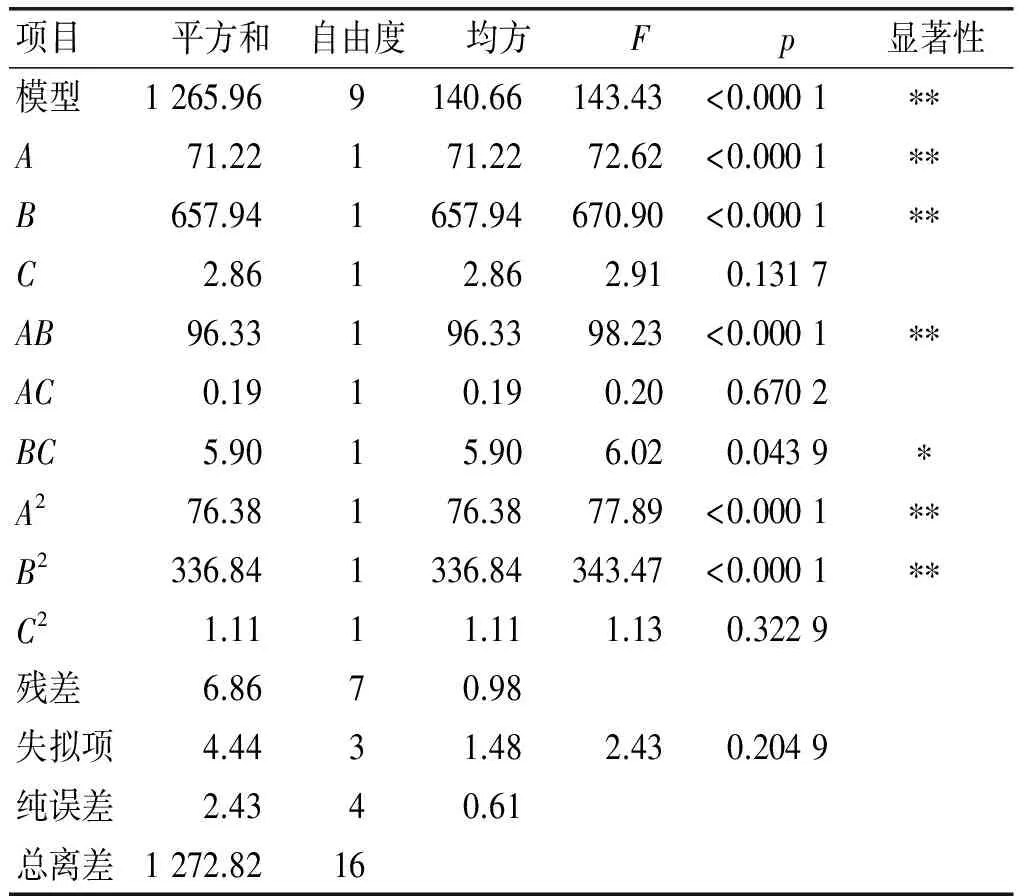
表3 回归方程方差分析
注:**plt;0.01,表示差异极显著;*plt;0.05,表示差异显著。
从表3可以看出,模型的plt;0.000 1,说明该模型极显著,失拟项p=0.204 9gt;0.05,不显著,说明该模型能很好地拟合试验的真实情况,可以用于该工艺优化。壳聚糖质量浓度和CS与DG质量比两个因素对微乳液的包埋率影响都极显著,另外壳聚糖质量浓度及CS与DG质量比的交互作用对微乳液的包埋率影响极显著,CS与DG质量比及CS溶液与TPP溶液体积比的交互作用对微乳液的包埋率影响显著。
2.3 最佳工艺条件的确定及验证
根据模型,壳聚糖甘油二酯微乳液的最佳制备工艺条件为:壳聚糖质量浓度3.44 mg/mL,TPP质量浓度1.5 mg/mL,壳聚糖与1,3-甘油二酯乳脂的质量比1∶2.79,壳聚糖溶液与TPP溶液体积比2∶1。采用上述条件制备壳聚糖甘油二酯微乳液,经过3次重复试验,制得微乳液包埋率为66.53%。因此,基于响应面法得到的工艺条件是可行的,有实用价值。
2.4 壳聚糖甘油二酯微乳液的表面电位
通过Zeta电位及纳米粒度测定仪对壳聚糖甘油二酯微乳液进行测定,结果见表4。
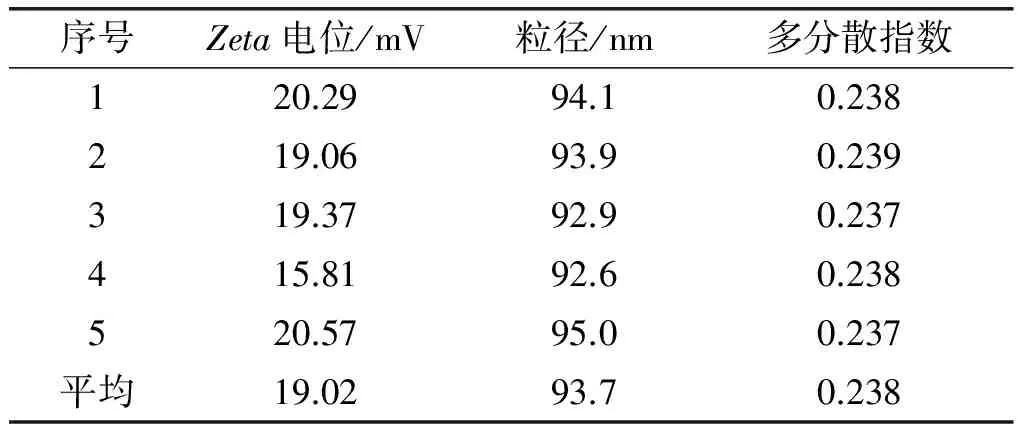
表4 壳聚糖甘油二酯微乳液的Zeta电位及纳米粒度
从表4可以看出,壳聚糖甘油二酯微乳液的Zeta电位为19.02 mV,粒径为93.7 nm。壳聚糖是自然界唯一带阳离子的天然活性多糖,可以看出壳聚糖包被的甘油二酯微乳液带正电荷,与人体细胞具有良好的亲和性。
2.5 壳聚糖甘油二酯微乳液的透射电镜观察(见图5)

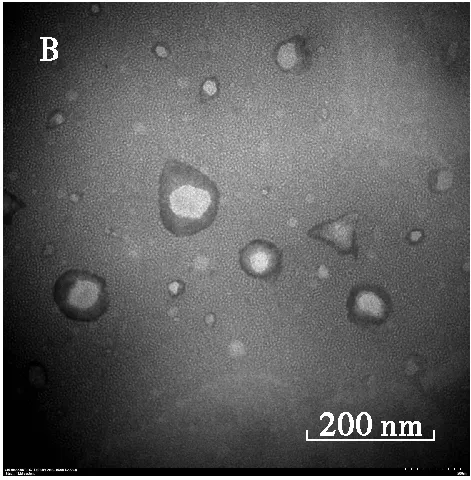
图5 空载的壳聚糖溶液(A)及壳聚糖甘油二酯微乳液(B)的透射电镜图
从图5可以看出,壳聚糖甘油二酯微乳液形状并不是规则的球型,空载的壳聚糖溶液平均粒径50 nm 左右,壳聚糖甘油二酯微乳液的粒径增加至100 nm左右,且有明显的壳核结构,表明形成壳聚糖甘油二酯微乳液。
2.6 壳聚糖甘油二酯微乳液的稳定性
2.6.1 温度稳定性(见图6)
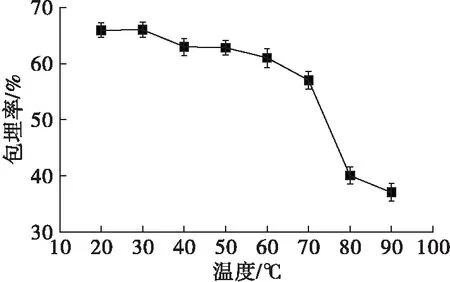
图6 壳聚糖甘油二酯微乳液在不同温度处理后包埋率的变化
从图6可以看出,随着温度的升高,包埋率呈降低趋势。且80℃处理使其较之前低温处理的包埋率有明显的下降,可见壳聚糖甘油二酯微乳液在20~70℃的范围内有相对较好的稳定性。
2.6.2 贮藏稳定性(见图7)
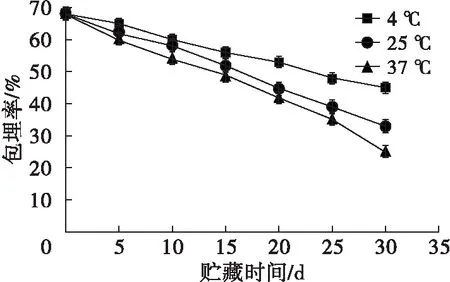
图7 壳聚糖甘油二酯微乳液在不同贮藏条件下包埋率的变化
从图7可以看出,随着贮藏时间的延长,贮藏温度越高,包埋率下降速率越快。37℃条件下的下降情况最为明显,25℃次之,4℃的下降速率相对比较平缓。这说明微乳液的贮藏受环境温度影响较大,温度越高,微乳液粒子的壁越容易被损坏。因此,4℃的低温条件更利于壳聚糖甘油二酯微乳液的贮藏。
2.6.3 氧化稳定性(见图8)
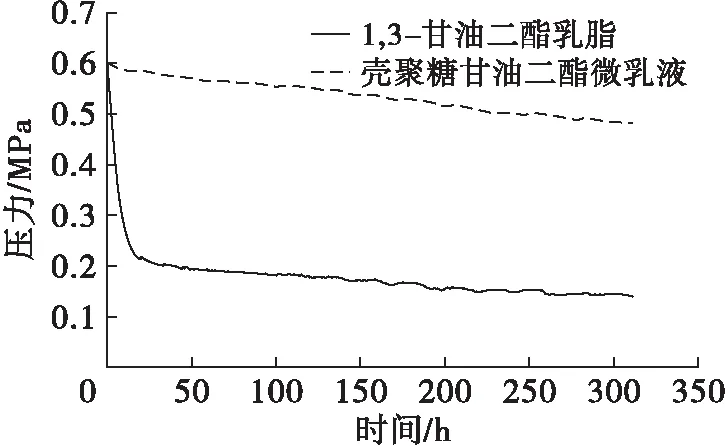
图8 1,3-甘油二酯乳脂及壳聚糖甘油二酯微乳液的氧化曲线
从图8可以看出,单纯改性的1,3-甘油二酯乳脂氧化速度很快,从开始至10 h左右急剧氧化,在30 h左右氧压降至0.225 MPa,后趋于稳定。而壳聚糖甘油二酯微乳液氧化速度非常缓慢,氧化稳定性较高。因此,壳聚糖甘油二酯微乳液能有效减缓1,3-甘油二酯乳脂的氧化。
3 结 论
壳聚糖甘油二酯微乳液最佳制备工艺条件为:壳聚糖质量浓度3.44 mg/mL,TPP质量浓度1.5 mg/mL,CS与DG质量比1∶2.79,CS溶液与TPP溶液体积比2∶1。在最佳制备工艺条件下,所制备的微乳液包埋率为66.53%,粒子分布均匀,粒径可达93.7 nm。壳聚糖甘油二酯微乳液有明显的壳核结构。微乳液在20~70℃的范围内有相对较好的稳定性,最佳贮藏温度为4℃,且包被很好地延缓了1,3-甘油二酯乳脂的氧化。
[1] KIMURA H, BURDOCK G A. Chronic study of diacylglycerol oil in rats [J]. Food Chem Toxicol,2001, 39(4): 317-329.
[2] TAGUCHI H, WATANABE H,ONIZAWA K, et al. Double-blind controlled study on the effects of dietary diacylglycerol on postprandial serum and chylomicron triacylglyc-erol responses in healthy humans[J]. J Am Coll Nutr,2000, 19(7): 789-796.
[3] MURASE T, AOKI M, TOKIMITSU I. Supplementation withα-linolenic acid-rich diacylglycerol suppresses fatty liver formation accompanied by an up-regulation ofβ-oxidation in Zucker fatty rats[J]. Biochim Biophys Acta (BBA)-Mol Cell Biol Lipids,2005, 1733(2): 224-231.
[4] 陈琼, 杨雪, 赵金利, 等. 酶法制备甘油二酯与甘油三酯的结晶特性研究[J]. 中国油脂, 2015, 40(11): 48-53.
[5] 郭永利, 刘炎峻, 孙兆敏, 等. 酶法催化制备1-十八烷氧基-2-DHA-3-油酸烷氧基甘油二酯[J]. 中国油脂, 2016, 41(3): 21-25.
[6] GARTI N, YAGHMUR A, LESSER M E, et al. Improve oil solubilization in oil/water food grade microemulsions in the presence of polyols and ethanol[J]. J Agric Food Chem, 2001, 49(5): 2552-2562.
[7] LAM A C, SCHECHTER R S. A study of diffusion and electrical conduction in microemulsions Ⅱ[J]. J Colloid Interf Sci, 1987,120(1): 42-55.
[8] FULLER C J. Relative bioavailability ofβ-carotene from supplement sources[J]. Nutr Res, 2001, 21(9): 1209-1215.
[9] 柴平海, 张文清,金鑫荣.甲壳素/壳聚糖开发和研究的新动向[J]. 化学通报, 1999(7): 8-11.
[10] 董炎明,阮永红,丘蔚碧,等. 甲壳素/壳聚糖及其衍生物在食品工业中的应用[J]. 食品科技, 2000(5): 28-31.
[11] 张丽, 宋益民, 张学成. 壳聚糖载药微球的制备及应用研究进展[J]. 海洋科学, 2009, 33(4): 81-85.
[12] YAMADA T, ONISHI H, MACHIDA Y. In vitro and in vivo evaluation of sustained release chitosan-coated ketoprofen micropaticles[J]. Yakugaku Zasshi, 2001, 121(3): 239-244.
[13] GIUNCHEDI P, GENTA I, CONTI B, et al. Preparation and characterization of ampicillin loaded methylpyrrolidinone chitosan and chitosan microspheres[J]. Biomaterials, 1998, 19(1/3): 157-160.
[15] HOSSEINI S F, ZANDI M, REZAEI M, et al. Two-step method for encapsulation of oregano essential oil in chitosan nanoparticles: preparation, characterization and in vitro release study[J]. Carbohydr Polym, 2013, 95(1): 50-56.
[16] 周思, 王志耕, 梅林, 等. 乳脂中1,3-甘油二酯检测方法的研究[J]. 中国油脂, 2011, 36(7): 67-70.
Preparation,characterizationandstabilityofchitosandiglyceridemicroemulsion
QIAN Yu, WANG Huichao, XUE Xiuheng
(Anhui Agricultural Products Processing Engineering Laboratory, College of Tea and Food Science and Technology, Anhui Agricultural University, Hefei 230036, China)
The chitosan diglyceride microemulsion was prepared with chitosan as wall material,and the preparation conditions were optimized through single factor experiment and response surface methodology. The surface properties and temperature stability, storage stability and oxidation stability of chitosan diglyceride microemulsion were studied. The results showed that the optimal preparation conditions of chitosan diglyceride microemulsion were obtained as follows: mass concentrations of chitosan and sodium tripolyphosphate were 3.44 mg/mL and 1.5 mg/mL respectively, mass ratio of chitosan to 1,3-diacylglyceride cream 1∶2.79 and volume ratio of chitosan solution to sodium tripolyphosphate solution 2∶1. Under the optimal conditions, the embedding rate was 66.53%, the particle distribution was uniform and the size was 93.7 nm. Chitosan diglyceride microemulsion had obvious core-shell structure. Besides, it had relatively good stability at 20-70 ℃, the best storage temperature was 4 ℃ and the coating could obviously delay the oxidation of 1,3-diacylglyceride cream.
chitosan; diglyceride; microemulsion; temperature stability; storage stability; oxidation stability
TS252.5;O636.1
A
1003-7969(2017)11-0028-05
2017-01-03;
2017-06-20
钱 宇(1994),女,在读硕士,研究方向为食品科学(E-mail)614122694@qq.com。
薛秀恒,副教授,博士(E-mail)xuexiuheng@126.com。
