不同抗生素对小鼠结肠吲哚胺2,3-二氧化酶及树突状细胞表达的影响
2017-12-08周丹丹
杨 雁,赵 丽,周丹丹,张 燕
(四川大学华西医院消化内科,四川 成都 610041)
不同抗生素对小鼠结肠吲哚胺2,3-二氧化酶及树突状细胞表达的影响
杨 雁,赵 丽,周丹丹,张 燕
(四川大学华西医院消化内科,四川 成都 610041)
目的探讨口服抗生素改变小鼠肠道菌群结构,检测吲哚胺2,3-二氧化酶(IDO)及树突状细胞(DC)在小鼠肠道黏膜中的表达情况。方法将Babl/c小鼠分成对照组,甲硝唑组和庆大霉素组各5只,分别灌胃生理盐水、甲硝唑和庆大霉素共7日。第8日在无菌环境中处死小鼠并收集小鼠结肠。使用WesternBlot法检测小鼠肠道IDO的表达,流式细胞术检测肠道DC的表型,免疫荧光法检测肠道IDO和CD11c阳性细胞的数量。结果甲硝唑组小鼠结肠IDO表达低于对照组(P= 0.003)和庆大霉素组(P= 0.010)。各组CD40、CD80、CCR7、CD103表达差异无统计学意义(P> 0.05)。甲硝唑组CD86表达高于对照组(P= 0.003),庆大霉素组CD86表达与对照组差异无统计学意义(P= 0.107)。免疫荧光显示甲硝唑组CD11c和IDO双阳性细胞比例较对照组低(P= 0.004),庆大霉素组与对照组差异无统计学意义(P= 0.908)。结论不同抗生素口服后对小鼠结肠黏膜IDO及DC的表达影响不同。
肠道菌群;吲哚胺2,3-二氧化酶;树突状细胞;甲硝唑;庆大霉素
肠道菌群结构稳定是维持肠道免疫功能正常的重要条件,肠菌紊乱可能会导致多种疾病的发生。人类肠道中存在着大量微生物,并且种类繁多[1]。这些微生物参与肠道免疫系统的建立,一方面肠内正常的共生菌可以被机体识别形成免疫耐受避免过度的炎症反应,另一方面肠道内的细菌可以通过促进调节型T细胞(regulator-T cell,Treg)分化发挥免疫调节作用[2]。Treg是调节肠道免疫耐受功能的主要细胞。树突状细胞(dendritic cell,DC)及其产生的吲哚胺2,3-二氧化酶(indoleamine 2,3-diozygenase,IDO)是刺激Treg分化的重要通路[3]。IDO是色氨酸代谢为犬尿氨酸过程中的限速酶,除了促进Treg分化外,IDO还可以促进Th1细胞、B细胞、NK细胞凋亡。IDO发挥免疫调节作用主要依赖于消耗环境中的必需氨基酸色氨酸,进而抑制淋巴细胞或微生物的增殖;另外色氨酸经IDO代谢产生的多种代谢产物可介导T细胞的死亡[4]。IDO主要由抗原提呈细胞产生,DC是IDO的重要来源。2016年5~12月作者探讨使用抗生素7天后改变肠道菌群组成后肠道IDO以及DC功能的改变,现报道如下。
1 材料与方法
1.1实验动物15只6~8周龄雌性Balb/c小鼠,购于成都达硕实验动物中心,分成对照组、甲硝唑组和庆大霉素组各5只。
1.2造模灌胃给药(0.2 ml/只),对照组给予生理盐水,每日两次;甲硝唑组给予甲硝唑60 mg/kg,每日两次;庆大霉素组给予庆大霉素注射液45 mg/kg,每日早上灌胃一次,下午用生理盐水0.2 ml代替。共造模7日。于实验第8天在无菌环境中脱颈处死小鼠,取小鼠结肠组织。
1.3WesternBlot测肠道IDO表达提取小鼠结肠全蛋白,测定蛋白浓度。配置SDS-PAGE凝胶,电泳、转膜、曝光,使用Quality One 4.6.2分析条带灰度值,计算各样本IDO/GAPDH的比值。
1.4流式细胞仪检测肠道DC细胞使用胶原酶Ⅳ0.6 mg/ml,Dnase 50μg/ml消化小鼠结肠得到单个细胞悬液。避光分两管孵育流式抗体CD11cPE、CD86 PE-cy7、CD40 APC、CD80 FITC和CCR7 APC、CD103 FITC。设置同型对照,PI标记死细胞。检测DC细胞相对数量和细胞表型。
1.5免疫荧光取小鼠结肠常规石蜡包埋切片。4 ℃孵育IDO一抗(兔抗鼠,1∶40),CD11c一抗(豚鼠抗鼠,1∶40)过夜,然后加入二抗工作液(山羊抗兔,1∶200,山羊抗豚鼠,1∶400)孵育,DAPI染核。使用全自动正置荧光显微镜400倍镜下拍片,Zen软件进行图像分析。计数CD11c(绿色)阳性细胞数和CD11c、IDO(红色)双阳性细胞数,并计算双阳性细胞数占CD11c阳性细胞数的比值。
1.6统计学方法使用SPSS 22.0软件进行统计分析。计量资料以均数±标准差表示,组间比较采用方差分析及LSD-t法,若方差不齐,采用独立样本的非参数检验。P< 0.05为差异有统计学意义。
2 结果
2.1肠道IDO的表达WesternBlot检测显示三组IDO表达水平差异有统计学意义(F=8.337,P= 0.007)。其中甲硝唑组结肠IDO(0.27±0.08)表达低于对照组(0.93±0.33,t=3.863,P= 0.003)和庆大霉素组(0.84±0.25,t=-3.160,P= 0.010)。对照组和庆大霉素组IDO表达差异无统计学意义(t=1.331,P= 0.606),见图1。

图1 Western Blot法检测各组小鼠结肠IDO的表达情况
2.2肠道DC细胞数量和表型各组DC细胞相对数量比较差异无统计学意义(P= 0.159),见表1。比较CD11c阳性细胞中各表型的比例,各组CD40、CD80、CCR7、CD103差异无统计学意义(P> 0.05),三组CD86表达差异有统计学意义(F=6.777,P= 0.011)。甲硝唑组CD86阳性率高于对照组(t=-3.680,P= 0.003),但与庆大霉素组相比差异无统计学意义(t=1.936,P= 0.077)。庆大霉素组CD86阳性率与对照组差异无统计学意义(t=-1.744,P= 0.107),见图2。
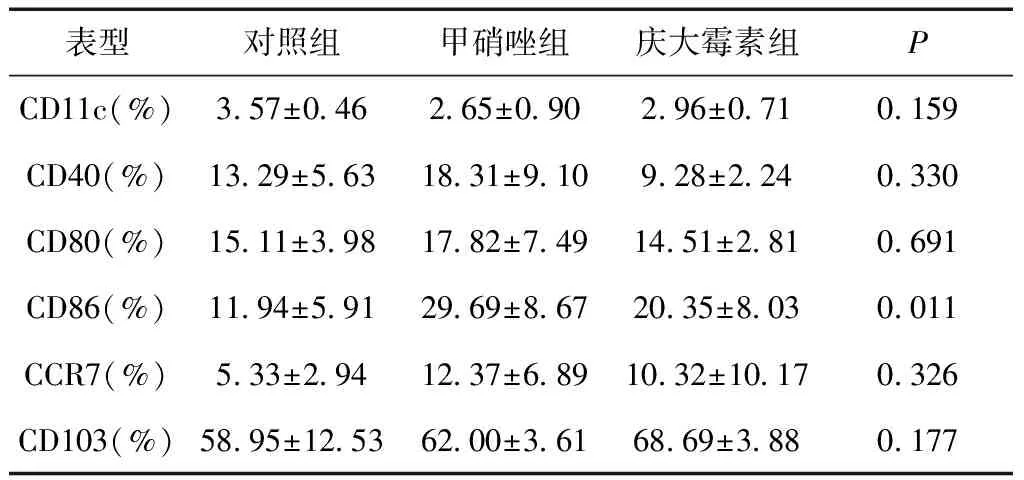
表1 各组DC细胞表型*
*CD11c为CD11c阳性细胞数与细胞总数的百分比,余表型百分数为各表型阳性细胞数与CD11c阳性细胞数的比值
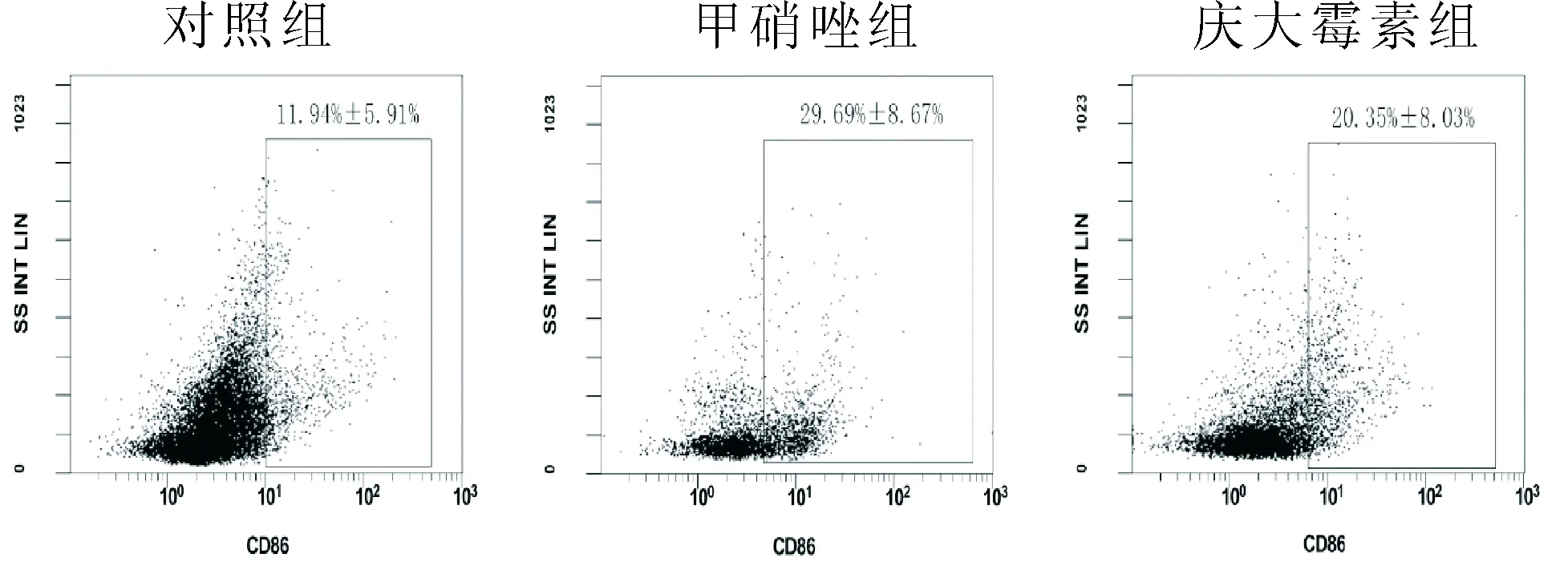
图2 各组CD86阳性率
2.3免疫荧光IDO在结肠上皮层、固有层中均有表达。三组IDO阳性细胞数量不同(F=8.135,P= 0.006)。甲硝唑组肠道CD11c+IDO双阳性细胞数占CD11c阳性细胞数[(27.19±16.27)%]比例最低,明显低于对照组[(63.97±10.36)%,t=3.550,P= 0.004]和庆大霉素组[(62.75±20.80)%,t=-3.423,P= 0.005]。庆大霉素组与对照组差异无统计学意义(t=0.117,P= 0.908),见图3。

图3 结肠组织免疫荧光(Х400) 蓝色为DAPI显示细胞核,绿色为CD11c,红色为IDO,第三列中绿色箭头指示CD11c和IDO双阳性的细胞。
3 讨论
人体的肠道菌群构成在一段时间内是稳定的,抗生素可以影响肠菌构成。肠道菌群结构改变可以影响机体的免疫功能,其中机制尚不十分清楚。
甲硝唑是一种硝基咪唑类抗生素,主要作用于原虫、厌氧菌。研究显示服用甲硝唑后可以改变肠道菌群组成。Marie-agnes等[5]向健康大鼠的饮水中加入甲硝唑(1 mg/ml)一周后,发现大鼠结肠粘膜及粪便中的肠杆菌和双歧杆菌数量明显增加。C57BL/6小鼠接受甲硝唑处理后乳杆菌属、双歧杆菌属数量增加[6]。而Ivan等在猕猴的研究中发现肠道中的乳杆菌可以抑制IDO1,应用益生菌制剂VSL#3(含有4种乳杆菌、3种双歧杆菌和1种链球菌)后IDO的表达降低[7]。人免疫缺陷病毒(HIV)感染患者IDO的表达量常增加[8],使用包含乳杆菌属、双歧杆菌属、链球菌属的益生菌制剂治疗6个月后,HIV患者肠道中IDOmRNA表达量下降[9]。单独应用约氏乳酸菌可以直接降低大鼠IDO的表达及活性[10]。以上结果提示服用甲硝唑后肠道内肠杆菌、乳杆菌数量增加将会导致肠道IDO降低。
庆大霉素是一种氨基糖苷类抗生素,主要作用于革兰氏阴性杆菌,如大肠杆菌、产气杆菌、奇异变形杆菌和革兰氏阳性菌中的金黄色葡萄球菌。在婴儿中同时使用庆大霉素和氨苄西林后肠道中变形菌门数量增加,放线菌门(包括双歧杆菌)、乳杆菌数量下降[11]。庆大霉素可以使组织中产生过氧化氢、超氧阴离子等造成氧化应激,而过氧化氢可以抑制IDO的活性[10]。因此在庆大霉素组中肠道IDO水平没有变化可能是综合作用的结果。
非炎症时期肠道中的DC主要为非成熟DC,低表达MHC-Ⅱ和CD40、CD80、CD86的共刺激分子,在受到炎症刺激后,DC高表达MHC-Ⅱ、CD40、CD80、CD86转变为成熟DC,并迁徙至T细胞富集区域或淋巴结,刺激T细胞分化,分泌TNF-α等因子[12]促进免疫反应。Li等[13]使用头孢曲松造成肠道菌群紊乱后肠道中DC细胞中MHC-II、CD40、CD80、CD86表达下降。DC细胞是通过不同的模式识别受体如Toll样受体、NOD样受体等识别不同的病原体[14]。不同的抗生素处理后肠道菌群与不同的模式识别受体作用,可能导致了DC表型的差异。我们的研究显示经甲硝唑处理后小鼠结肠黏膜CD86升高而IDO水平降低,目前尚未见相关报道,具体机制尚不清楚。但有一种新型的IDO特效抑制剂INCB024360在体外抑制DC表达IDO后却伴有CD86增加,而CD40,CD80,CD83水平没有明显改变[15]。
本研究具有一定的局限性,未能对甲硝唑及庆大霉素导致的菌群改变做进一步的分析,因此无法具体分析肠道菌群失调与IDO及DC细胞表达的直接联系。综上,我们的研究显示经口服甲硝唑处理后小鼠结肠IDO表达下降,CD86表达增高,结肠黏膜中CD11c和IDO双阳性细胞比例较低。口服庆大霉素处理后小鼠结肠黏膜中IDO和CD86表达与对照组无统计学差异,提示不同抗生素口服后对小鼠结肠黏膜IDO及DC的表达影响不同。
[1] Rajilic-Stojanovic M,de Vos WM.The first 1000 cultured species of the human gastrointestinal microbiota[J].FEMS Microbiol Rev,2014,38(5):996-1047.
[2] Furusawa Y,Obata Y,Hase K.Commensal microbiota regulates T cell fate decision in the gut[J].Semin Immunopathol,2015,37(1):17-25.
[3] Xie FT,Cao JS,Zhao J,et al.IDO expressing dendritic cells suppress allograft rejection of small bowel transplantation in mice by expansion of Foxp3+ regulatory T cells[J].Transpl Immunol,2015,33(2):69-77.
[4] Platten M,Wick W,Van den Eynde BJ.Tryptophan catabolism in cancer:Beyond IDO and tryptophan depletion[J].Cancer Res,2012,72(21):5435-5440.
[5] Pelissier MA,Vasquez N,Balamurugan R,et al.Metronidazole effects on microbiota and mucus layer thickness in the rat gut[J].FEMS Microbiol Ecol,2010,73:601-610.
[6] Ferreira RBR,Gill N,Willing BP,et al.The intestinal microbiota plays a role in Salmonella-induced colitis independent of pathogen colonization[J].PloS one,2011,6(5):e20338.
[7] Vujkovic-Cvijin I,Swainson LA,Chu SN,et al.Gut-resident Lactobacillus abundanceassociates with IDO1 inhibition and Th17 dynamics in SIV-infected macaques[J].Cell Rep,2015,13(8):1589-1597.
[8] Bipath P,Levay PF,Viljoen M.The kynurenine pathy activities in a sub-Saharan HIV/AIDS population[J].BMC infect Dis,2015,15(1):346.
[9] Scagnolari C,Corano Scheri G,Selvaggi C,et al.Probiotics differently sffect gut-associated lymphoid tissue indolamine-2,3-dioxygenase mRNA and cerebrospinal fluid neopterin levels in antiretroviral-treated HIV-1 infected patients:A pilot study[J].Int J Mol Sci,2016,17(10):E1639.
[10]Valladares R,Bojilova L,Potts AH,et al.Lactobacillus johnsonii inhibits indoleamine 2,3-dioxygenase and alters tryptophan metabolite levels in biobreeding rats[J].FASEB J,2013,27(4):1711-1720.
[11]Fouhy F,Guinane CM,Hussey S,et al.High-throughput sequencing reveals the incomplete,short-term recovery of infant gut microbiota following parenteral antibiotic treatment with ampicillin and gentamicin[J].Antimicro Agents Chemother,2012,56(11):5811-5820.
[12]夏金华,夏建川,谢丽燕,等.丹参酮ⅡA对树突状细胞表型的影响及对功能的调控[J].中国免疫学杂志,2017,33(3):374-377.
[13]Li M,Li W,Wen S,et al.Effects of ceftriaxone-induced intestinal dysbacteriosis on dendritic cells of small intestine in mice[J].Microbiol Immunol,2013,57(8):561-568.
[14]盛康亮,张玲玲,魏伟.树突状细胞参与免疫调节的相关受体及其介导的信号转导通路研究进展[J].细胞与分子免疫学杂志,2013,29(9):997-1000.
[15]Liu X,Shin N,Koblish HK,et al.Selective inhibition of IDO1 effectively regulates mediators of antitumor immunity[J].Blood,2010,115(17):3520-3530.
Effectsofalteredintestinalmicrobiotaonintestinalindoleamine2,3-dixoygenaseanddendriticcellsinmice
YANGYan,ZHAOLi,ZHOUDan-dan,ZHANGYan
(DepartmentofGastrointestinal,WestChinaHospital,Chengdu610041,China)
ZHANGYan
ObjectiveTo investigate the expression of intestinal indoleamine 2,3-dixogenase (IDO) and dendritic cells by oral antibiotics to alter the mice intestinal microbiota.MethodsBabl/c mice were randomly divided into control,metronidazole and gentamycin groups,5 mice in each group.The mice were given normal saline,metronidazole and gentamycin,respectivelly by gavage for 7 days.On the 8 th day,all mice were sacrificed in sterile enviroement and the colons were collected to measure the expression of IDO by using western blot.DC phenotype was analyzed by flow cytometry.Immunofluorescence was used to assess the number of IDO and CD11c double positive cells in the colons.ResultsThe IDO expression was much lower in the metronidazole group than that in the control goup (P= 0.003) and gentamycin group (P= 0.010).There was no significant difference in the expressions of CD40,CD80,CCR7 and CD103 (P> 0.05) among the three groups.The expression of CD86 was higher in the metronidazole group than that in the control group (P= 0.0003) while not elevated in the gentamycin group (P=0.107).By immunofluorenscence,the number of CD11cand IDO double positive cells in the metronidazole group was lower than that in the control group (P= 0.004) while no difference was found between the gentamycin group and the control group (P=0.908).ConclusionOral different biotics may have different influence on the expression of IDO and DC in mice colon.
Intstinal microbiota;IDO;DC;Metronidazole;Gentamicin
张 燕
四川省科技厅科研基金资助项目(编号:2014 SZ0002-12)
R392.12
A
1672-6170(2017)06-0041-03
2017-03-21;
2017-05-23)
