腰椎间盘退行性改变患者ADAMTS-7表达及其机制研究
2017-12-08姜棚菲马张稳张民泽邓亚军
姜棚菲,马张稳,张民泽,邓亚军
(延安大学附属医院骨科,陕西 延安 716000)
腰椎间盘退行性改变患者ADAMTS-7表达及其机制研究
姜棚菲,马张稳,张民泽,邓亚军
(延安大学附属医院骨科,陕西 延安 716000)
目的探讨新型金属蛋白酶(ADAMTS-7)在腰椎间盘退行性改变患者中表达情况,并探讨其作用机制。方法2014年3月至2016年2月我院手术切除腰椎间盘突出症患者退变的椎间盘组织40例(依据后外层纤维破裂与否分为破裂组及未破裂组)及同期腰椎骨折患者正常腰椎间盘组织20例(对照组),采用半定量RT-PCR及免疫组织化学技术对不同髓核组织中肿瘤坏死因子(TNF-α)、ADAMTS-7进行定性定量检测。结果TNF-α表达量随腰椎间盘退变程度加重而增加,ADAMTS-7蛋白在对照组腰椎间盘髓核组织呈现弱阳性表达,在未破裂组及破裂组椎间盘髓核组织中分别呈阳性表达及强阳性表达;3组ADAMTS-7蛋白表达量、mRNA表达量及TNF-α mRNA表达量由高到低排序为破裂组>未破裂组>对照组(P< 0.05)。结论ADAMTS-7及TNF-α在腰椎间盘退行性改变患者髓核组织中存在高表达现象,并且退变程度越重其表达量越多,而作用机制可能与7 ADAMTS-7及TNF-α在腰椎间盘退行性病变中表达呈正反馈通路加速其病程进展有关。
腰椎间盘;退行性改变;ADAMTS-7;TNF-α;机制
腰椎间盘属于人体重要组成部分,主要位于脊柱两椎体之间,并由髓核、纤维环及软骨终板组成,近年来腰椎间盘突出症已成为中老年人中较为常见脊柱退行性疾病之一[1]。临床将腰椎间盘突出症定义为椎间盘纤维环破裂后,突入到椎管内的髓核、残留纤维环及覆盖在其表面的后韧带压迫邻近神经根而产生的临床综合征,对患者身心健康造成严重影响[2]。目前临床对其发病机制尚未完全明确,早期学者研究指出在长期不良机械负荷下,当施加在椎间盘压力超过椎间盘自身膨胀力时,会引发髓核破裂出血,表明机械应力损伤在椎间盘突出症病理过程中发挥重要作用[3];而随着临床对本病病理研究的逐渐深入,细胞因子、炎性介质等在椎间盘突出症中的作用的研究日益广泛,近期有研究报告指出ADAMTS-7可能参与腰椎间盘退行性改变疾病演变过程中[4],但尚未完全明确,为此笔者展开临床对照研究,现报道如下。
1 资料与方法
1.1一般资料2014年3月至2016年2月我院手术切除腰椎间盘突出症患者退变的椎间盘组织40例(依据后外层纤维破裂与否分为破裂组及未破裂组)及同期20例腰椎骨折患者正常腰椎间盘组织(对照组)。纳入标准:①符合腰椎间盘突出症相关诊断标准;②入院后经MRI诊断确诊;③纳入研究前无慢性腰背痛史;④符合赫尔辛基宣言,自愿签署相关知情同意书;⑤首次确诊为腰椎间盘突出症。排除标准:①合并恶性肿瘤;②妊娠期及哺乳期妇女;③合并急慢性炎症性疾病;④合并自身免疫性疾病或结缔组织疾病;⑤对本研究依从性不好。所有标本在采集前均已告知,患者及其家属知情并自愿签署知情同意书,本院伦理委员会批准同意。其中破裂组18例,男12例,女6例,年龄25~60岁[(45.18±6.25)岁],椎间盘节段:L3-4、L4-5、L5-S1各3、10、5例;未破裂组22例,男14例,女8例,年龄27~58岁[(46.31±6.58)岁],椎间盘节段:L3-4、L4-5、L5-S1各5、12、5例;对照组20例,男15例,女5例,年龄24~58岁[(44.98±6.52)岁],椎间盘节段:L3-4、L4-5、L5-S1各5、10、5例。三组基线资料比较差异均无统计学意义(P> 0.05);具有可比性。
1.2方法石蜡切片HE染色:①石蜡切片制作:将采集的髓核组织制成标本,采用4%的甲醛固定液将其固定10 h,固定后的组织块在脱水前必须采用流水液将其固定液清洗干净,脱水硬化后,将组织块由无水酒精中取出,并放入二甲苯及无水酒精等量混合溶剂中1 h左右,随后包埋,并修整蜡块,展片的同时将其粘好,最后烘干待用;②切片HE染色:脱蜡处理后,对切片进行染色处理,染色成功后取出切片以盖玻片盖住,将封好的切片放置于恒温箱中干燥处理。ADAMTS-7 mRNA表达量测定:①RNA提取:从-70 ℃超低温冰箱中取出腰椎间盘髓核组织标本80 mg放在研钵内,将组织块放置于研钵中,加入少量液氮,迅速研磨,待组织变软,再加入少量液氮研磨,重复3次将组织加入Trizol后,室温下静置5 min使其完全裂解,并将其放入-70 ℃低温处保存,常规离心去除沉淀后,并经过纯化最终待用;②RNA浓度测定,定量取RNA样品2 μL,采用紫外分光光度计Q5000对RNA在260 nm下的吸光度进行定量,并最终采用RT-PCR检测RNA。ADAMTS-7蛋白质表达量测定:①烤片将切片置于60 ℃烤箱中3 h,脱蜡入水,放入1%甲醇双氧水,室温10 min后,蒸馏水洗1次,于切片上滴加抗原修复液,室温放置10 min,在切片上滴定正常山羊血清封闭液,室温20 min后,将多余液体甩出去,随后在切片上滴加生物素化第二抗体,室温20 min;切片上滴加辣根酶标记链酶卵白素工作液,直至DAB显色,苏木素染色1 min后,用自来水冲洗干净,采用中性树脂封片,每次实验采用PBS代替第一抗体做阴性对照;②结果判断:ADAMTS-7蛋白在免疫组织化学检测中,细胞浆着色呈棕黄色者为阳性细胞,深棕黄色表明强阳性表达,深棕黄色为弱阳性表达,而无着色为阴性表达。
1.3观察指标与检测判定①人体腰椎间盘髓核组织TNF-α、ADAMTS-7表达情况。②髓核组织中ADAMTS-7蛋白表达量比较。③髓核组织中TNF-α、ADAMTS-7 mRNA表达量比较。
1.4统计学方法采用SPSS 19.0统计学软件对数据进行分析和处理。计量资料以均数±标准差表示,组间比较采用t检验;计数资料比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1人体腰椎间盘髓核组织TNF-α、ADAMTS-7表达情况对照组髓核细胞多为单个髓核细胞(图1a),未破裂组髓核细胞轻度聚集,呈现双核形态(图1b),破裂组髓核细胞高度聚集,呈多核形态,细胞聚集,成纤维细胞增多,纤维化明显,并且随着腰椎间盘退变程度加重,TNF-α表达量随之增加(图1c)。ADAMTS-7在对照组腰椎间盘髓核组织髓核组织呈现弱阳性表达(图2a);ADAMTS-7蛋白在未破裂组及破裂组椎间盘髓核组织中分别呈现阳性表达及强阳性表达(图2b,2c)。
2.2三组髓核组织中ADAMTS-7蛋白表达量比较
三组ADAMTS-7蛋白表达量由高到低排序为破裂组>未破裂组>对照组(P< 0.05),见表1。
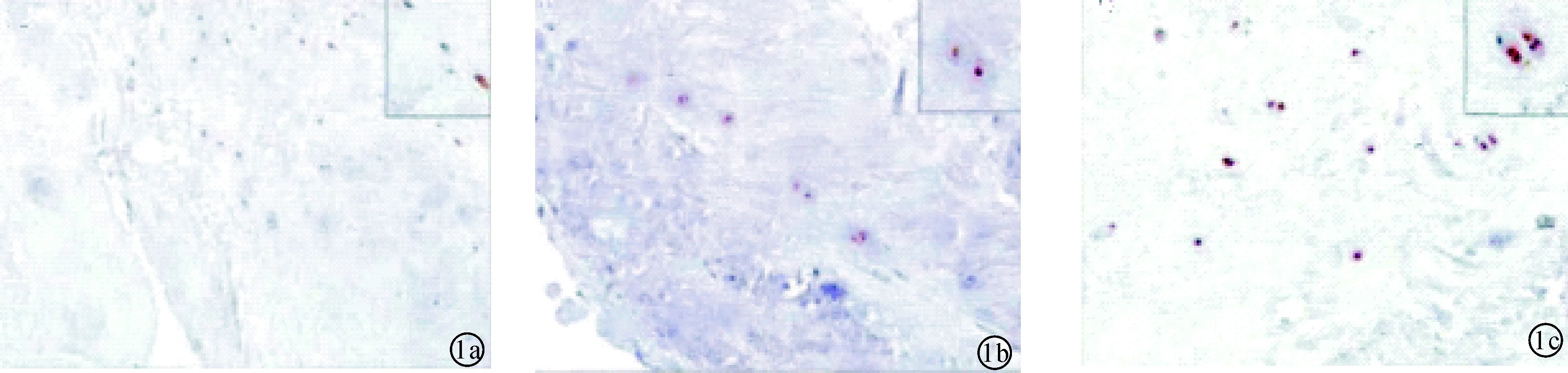
图1 髓核组织TNF-α表达 a:对照组;b:未破裂组;c:破裂组
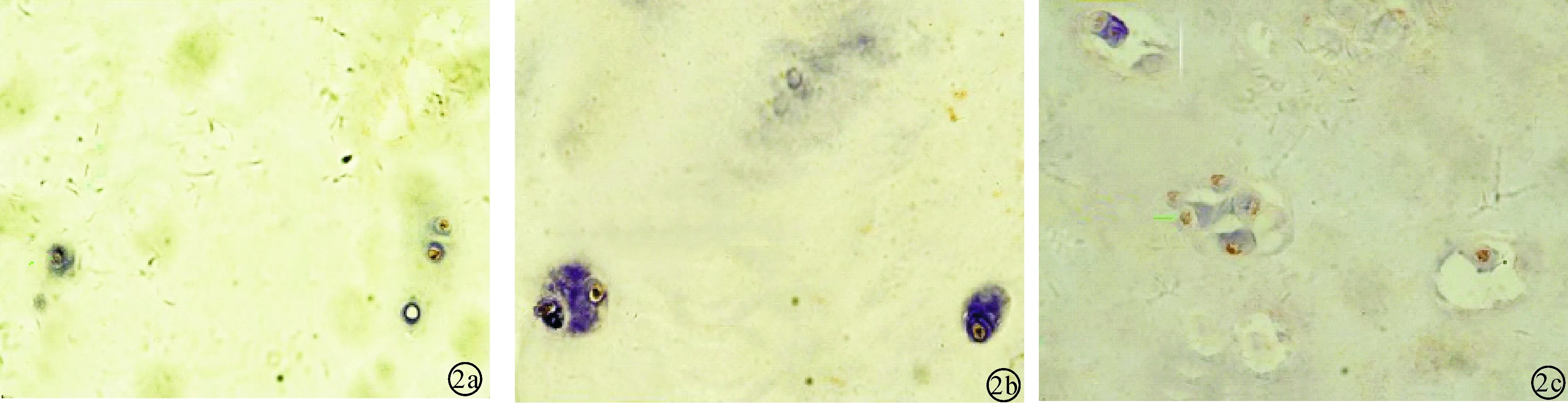
图2 髓核组织ADAMTS-7表达 a:对照组;b:未破裂组;c:破裂组

组别ADAMTS⁃7蛋白表达量对照组(n=20)028±010破裂组(n=18)066±030未破裂组(n=22)051±021
2.3三组髓核组织中TNF-α、ADAMTS-7mRNA表达量比较破裂组TNF-α、ADAMTS-7 mRNA表达量高于未破裂组及对照组,而未破裂组TNF-α、ADAMTS-7 mRNA表达量高于对照组(P< 0.05),见表2。

表2 三组TNF-α、ADAMTS-7 mRNA表达量比较
3 讨论
腰椎间盘是一种位于相邻两腰椎椎体之间的纤维软骨盘,现代医学研究表明椎间盘退变过程较为复杂,其不仅表现在形态学上的变化,并伴随着椎间盘组织学及生化性质的系统性变化,而一旦椎间盘退变时,其基质降解会随之增加,使得髓核突出而压迫脊神经根或脊髓,最终会引起椎间盘源性腰背部疼痛及相应的神经根的病变[5]。腰椎间盘生理性退变与患者年龄、椎间盘营养供应减少、自身免疫、炎性间质、细胞因子等有关,而近期相关指出ADAMTS-7在腰椎间盘突出症疾病发生及进展中发挥着重要作用[6]。
ADAMTS-7是一种含有Ⅰ型血小板结合蛋白基序解聚蛋白样金属蛋白酶,早期研究就证实了其在哺乳动物及无脊椎动物的体内广泛存在[7],其与解聚蛋白样金属蛋白酶ADAMs及基质金属蛋白水解酶等属于家属蛋白酶家族成员,其中蛋白多糖聚酶ADAMTS-7被认为参与椎间盘退变过程,由于髓核一半成分为聚集蛋白聚糖,而蛋白聚糖的降解可引起髓核的退变,因而临床考虑其可能参与腰椎间盘退行性病变过程中[8]。笔者于本文展开临床对照性研究,本研究结果显示,随着腰椎间盘退变程度加重,TNF-α表达量随之增加,ADAMTS-7蛋白在对照组腰椎间盘髓核组织呈现弱阳性表达,而其在未破裂组及破裂组椎间盘髓核组织中分别呈阳性表达及强阳性表达。研究结果还显示,三组ADAMTS-7蛋白表达量、mRNA表达量及TNF-α mRNA表达量由高到低排序:破裂组>未破裂组>对照组,初步证实了ADAMTS-7在腰椎间盘退行性病变患者中存在高表达现象,并且随着腰椎间盘退行性病变患者疾病严重程度加重,其ADAMTS-7及TNF-α表达量随着增加,与既往文献报告相符[9]。由于ADAMTS是髓核细胞退变过程中的一类重要关键酶,很长时间内,ADAMTS与髓核退变关系成为临床研究热点,而早期研究中主要发现了ADAMTS-4、ADAMTS-5在髓核组织中呈明显高表达现象[10],而有关ADAMTS-7在腰椎间盘退行性病变患者中的相关性研究较少;国外学者动物实验研究指出ADAMTS-7的高表达可引起幼鼠短趾畸形和软骨骨化障碍,并且当其高表达时可加速关节软骨破坏及骨性关节病程进展[11,12];而本研究结果证实了ADAMTS-7及TNF-α在腰椎间盘退行性病变过程中起到重要作用,与另一骨性关节炎模型试验得出的ADAMTS-7可上调TNF-α的表达及活性,而TNF-α可通过NF-κB信号通路诱导ADAMTS-7表达,并证实在软骨退变和骨性关节炎病程进展中ADAMTS-7与TNF-α共同促进正反馈回路的观点相符[13]。
综上所述,ADAMTS-7与TNF-α在腰椎间盘退行性病变过程中发挥重要作用,ADAMTS-7促进腰椎间盘退行性病变进展的可能机制与TNF-α通过NF-κB信号通路诱导ADAMTS-7表达有关。
[1] 殷相姣,宫赫,王丽珍,等.椎间盘退行性变的影响因素及其相关形态结构变化的研究进展[J].生物医学工程与临床,2016,26(1):112-117.
[2] 张海青,蒋大海.腰椎间盘退行性病变诊断中CT与MRI的应用价值[J].中国现代医生,2016,54(19):101-103.
[3] 褚相乐,马景旭,邱雪玲,等.DTI在腰椎间盘退行性改变中的应用初探[J].放射学实践,2016,31(1):81-85.
[4] SS Wang,WZhang,YQ Zhang,等.IL-17 A enhances ADAMTS-7 expression through regulation of TNF-α in human nucleus pulposus cells[J].Journal of Molecular Histology,2015,46(6):475.
[5] 董视师,李景峰,周逸驰,等.腰椎间盘退变:组织工程修复及生物力学评价[J].中国组织工程研究,2015,19(37):6024-6030.
[6] Lin EA,Liu CJ.The emerging roles of ADAMTS-7 and ADAMTS-12 matrix metalloproteinases[J].Open Access Rheumatology:Research and Reviews,2009,1(1):121-131.
[7] 王利,王宪,孔炜.新型金属蛋白酶ADAMTS家族的研究进展[J].生理科学进展,2008,39(1):49-52.
[8] 魏凡华,张玉颖,于修平.基质金属蛋白酶ADAMTS的研究进展[J].中国细胞生物学学报,2014,26(8):1186-1192.
[9] 李俊杰,梁舒涵,彭奇,等.椎间盘退行性变的信号转导机制研究进展[J].山东医药,2015,29(48):90-92.
[10]史东,董富强,董金波,等.ADAMTS-4、ADAMTS-5在骨关节炎患者滑膜中的表达及意义[J].现代预防医学,2015,42(6):1061-1064.
[11]Stanton H,Melrose J,Little CB,et al.Proteoglycan degradation by the ADAMTS family of proteinases[J].BiochimicaetBiophysicaActa (BBA)-Molecular Basis of Disease,2011,1812(12):1616-1629.
[12]殷浩,贺学军,易惠军,等.CT表现与临床定位体征不相符的腰椎间盘突出症MSCT重建图像分析[J].实用医院临床杂志,2014,11(1):86-88.
[13]Lai Y,Bai X,Zhao Y,et al.ADAMTS-7 forms a positive feedback loop with TNF-αin the pathogenesis of osteoarthritis[J].Annals of the Rheumatic Diseases,2014,73(8):1575-84.
ExpressionofADAMTS-7anditsmechanisminpatientswithdegenerativechangesinlumbarintervertebraldisc
JIANGPeng-fei,MAZhang-wen,ZHANGMin-ze,DENGYa-jun
(DepartmentofOrthopedics,AffiliatedHospital,Yan’anUniversity,Yan’an716000,China)
ObjectiveTo investigate the expression of new type metalloproteinase (ADAMTS-7) in patients with degenerative lumbar disc and explore its mechanism.MethodsThe degenerative lumbar disc tissue samples from 40 patients with lumbar disc herniation undergoing the surgical resection of the degenerative disc tissue in our hospital from March 2014 to February 2016 were collected.The samples were divided into the rupture group and the non-rupture group based on whether the posterior outer fiber ruptured or not.At the same time,normal lumber disc tissue samples from 20 patients with lumbar vertebrae fractures were also collected as the control group.Qualitative and quantitative detection of tumor necrosis factor α (TNF-α) and ADAMTS-7 were performed by using semi-quantitative RT-PCR and immunohistochemistry.ResultsThe expression levels of TNF-α was increased with the degree of degeneration of lumbar intervertebral disc.ADAMTS-7 protein was shown weakly positive expression in the nucleus pulposus of the lumbar intervertebral disc in the control group while it was positive and strongly positive expression in the nucleus pulposus of the rupture group and the non-rupture group.The expression levels of ADAMTS-7 protein,mRNA and TNF-α in the three groups ranged from high to low:the rupture group > the non-rupture group > the control group (P< 0.05).ConclusionThere are high expressions of ADAMTS-7 and TNF-α in the nucleus pulposus of patients with degenerative changes in lumbar intervertebral disc.The more serious degeneration is,the higher expression level is.The mechanism may be related to the expressions of ADAMTS-7 and TNF-α as the positive feedback pathways,which can accelerate the disease progression of the degenerative lesions in lumbar intervertebral disc.
Lumbar intervertebral disc;Degenerative changes;ADAMTS-7;TNF-α;Mechanism
陕西省自然科学基金资助项目(编号:2012 JM741203)
R681.5+3
A
1672-6170(2017)06-0101-04
2017-03-21;
2017-05-23)
