原电池电动势法测定热力学函数实验改进
2017-12-07王泰森殷悦王奇张海鹏戴杰俞意哲邓琳陈红钟爱国
王泰森,殷悦,王奇,张海鹏,戴杰,俞意哲,邓琳 玥 ,陈红,钟爱国
(台州学院医药化工学院, 浙江 台州 318000)
原电池电动势法测定热力学函数实验改进
王泰森,殷悦,王奇,张海鹏,戴杰,俞意哲,邓琳 玥 ,陈红,钟爱国*
(台州学院医药化工学院, 浙江 台州 318000)
常规电动势法测定热力学函数存在电动势的温度系数不稳定,仍至无法估计或修正等问题。使用改进型盐桥,在20~50°C温度范围内,对比测定了两支参比电极(氯化银和甘汞电极)组成的原电池的电动势。结果表明,其温度系数为正(2.22×10-4V ℃-1),反应的热力学函数变化值 ΔrGm(298 K)、ΔrSm(298 K) 和ΔrHm(298K) 分别为 -52.87 kJ·mol-1、-67.14 J·K-1·mol-1、-69.98 kJ·mol-1。与热力学函数理论值相比,其相对误差分别为3.7%、-2.4% 和 -2.5%。满足基础物理化学实验教学要求。
电动势法;热力学函数;温度系数;恒温装置
用电动势温度系数法(简称温度系数法)比用热化学法求取化学反应的热力学函数变化值更精准。它既有测试方法简单、测试灵敏度高等优点,又兼具重现性好和可信度高等特点。它对本科大学生学习、掌握并获取氧化还原体系的许多热力学参数,如物理化学平衡常数、溶液电解质离子活度系数、有机分子的酸碱离解常数、固体分子的溶解度、配合物结合常数以及某些重要的热力学函数改变量均具有不可或缺的作用。我们在台州学院医药化工学院开设这个电化学实验已经有20余年的历史。医药化工学院强调学院教学科研的融通与共生。一方面,科研是教学可持续发展的保证,只有不断进行科学研究,关注前沿,才能保证教学的高水平。另一方面,教学能够为科研提供宽厚的专业基础,并引发科研的灵感与动力。学院通过科研与教学的融合,构建了以“早期引导—长期培养—定期评估”为特点的化学类本科生科研基本素质协同培养体系。学院强调“学科建设与本科教学融通”,努力塑造“以教学为中心”的组织文化、创新教学动力机制,推动教师、特别是高水平教师群体对本科教学的全面投入。近年,通过“自上而下”与“自下而上”双向推动方式推进教学建设。“自上而下”,学院通过开设教学公开课、示范课,不断建设、强化爱生重教的氛围,培养教师群体对从事一线教学工作的“荣誉感”。“自下而上”,指学院充分发挥学生群体的作用,通过学生评价等形式,以学生自主性评价触动并强化教师群体的教学“荣誉感”。学院自筹 300多万元用于化工中试车间、药物制剂 GMP实训室等校内中试基地建设,其中制药化工实验教学示范中心被列为省重点实验教学示范中心建设点。新创建了台州市国家生物医药科技兴贸创新基地生物医药试验检测公共服务平台、台州市绿色医药化工服务平台、工业废弃物全链循环综合利用工程中心等服务平台,积极开展社会服务工作。不断推进“台州市国家生物医药科技兴贸创新基地生物医药试验检测公共服务平台”建设进程,提高为企业产品研发所需要的分析测试、检测验证、标准研制、运行保障和技术咨询等项目的服务质量;拓宽专业中试基地的学科涵盖领域,建立医药化工学院示范性校内中试基地;校企共建产品研发中心,组建产学研联合体,为学生提供校企联合指导毕业论文的工作平台,引导学生的毕业论文要结合工程实践来选题,鼓励学生主动参与企业技术创新、工程开发项目及教师产学研应用性科研项目,构建多层次的工程实践综合教学体系。工业废弃物全链循环综合利用工程中心承担了多项化工制药专业的拓展实验课程项目,真正实现了科研反哺教学。为达到本专业的人才培养目标,要求学生通过学习化学及相关学科的基础知识、基本理论和基本技能,初步具备运用化学及相关学科的基本理论和技术方法进行科学研究、教育教学和技术(产品)开发的能力。因此,我们按照“3+0.5+0.5”计划编制本专业的人才培养方案,做好人才培养模式的顶层设计,形成了“123”的人才培养模式,即:“一个平台,两个模块,三个阶段”。“一个平台”指的是前两年的“通识+专业基础”平台课程体系;“两个模块”第三年的“化学教育模块”与“应用化学模块”两个方向的选修课程体系;“三个阶段”指的是本专业的人才培养必须要经历“平台课程”、“模块课程”和“专业实践(第四年)”三个不同阶段的分级课程与专业技能训练,以满足学生就业需求所必需的知识与技能。根据学校办学定位和社会对“落地人才”的需求,专业能力的培养主要是通过专业理论知识体系(包括“专业基础课”、“专业模块课”和“专业选修课”)、专业实验训练体系(包含专业课程实验训练体系和专业综合实验实践课程体系)及专业技能实训体系(专业见习、专业实习和职业技能训练等)的实施来实现。同时结合学生的专业方向选择的意愿,指导学生合理选择公共选修课程,引导学生提早进入教师的科研项目实践,鼓励学生积极参与各级大学生创新创业训练项目的申报及校、省级科技竞赛,以培养动手能力强、综合素质高的应用型人才。其开设的系列实验教学改革即为一有益的尝试。
1 实验部分
大多数物理化学实验教材选用氯化银和甘汞电极两支参比电极,通过KCl饱和溶液U型管盐桥组成原电池,作为测反应热力学函数变化值对象[1-3]:

其反应的热力学函数的改变量 ΔrGm、ΔrHm、ΔrSm, 可通过测定该可逆电池的电动势 E, 实验中只要测得多个温度下的电动势,就可以求出温度系数,进而代入公式(3)-(5),计算出反应的热力学函数变化值。

但式 (2) 的测量实验过程中,如果选择原电池反应(1)式作为我们测定热函数对象,则出现问题,该(1)电池法使用的甘汞参比电极和氯化银参比电极,其电极电势均随温度变化而变化,且其函数关系远较电极反应的能斯特方程描述的复杂。
林清枝等[4]自制一种Ag/AgCl参比电极, 经近三届 200余名本科生实验表明, 通过“电镀”法制得的Ag/AgCl电极的精度较高, 稳定性和重现性较好。赵会玲等[5]针对甘汞电极损耗较多及实验数据时有不稳定等问题,用改进的原电池(饱和甘汞电极)来做实验,其热力学函数值在实验教学误差范围内。聂雪等[6]设计了新型铜/硫酸铜||银/硝酸银原电池。使用新型的铜-银电池测定的电动势值较大,且新型电池的电动势随本体温度的变化值与物化教材用的原电池电动势随环境温度变化值相当,相对误差较小,所得实验结果的准确性较高。张德生等[7]通过测量原电池电动势的方法,测量不同温度下的锌电极与铜电极的电极电势,用软件做实验数据的线性回归处理,所得Cu电极与Zn电极的电极电势与温度的直线关系。刘茹等[8]认为,虽则Nerst方程能反映出温度T 和电动势E 之间的关系,但却未考虑到环境温度 T 对物质分子活度及标准电动势的影响,所以温度T对原电池电动势E的影响将比Nerst方程显示出来的要复杂的多,为此他们设计并测量了锌-铜电池的电动势与温度之间的关系,建立了锌-铜原电池电动势与温度之间的一元高次数学方程。张燕等[9]针对电解型Ag/AgCl参比电极寿命有限的特点,自制了对电极性能影响小、且液接电位甚微的盐桥。该新型盐桥内参比液为饱和的 KCl溶液和 AgCl 固体, 再加入一定数量的琼脂体, 经过多孔性陶瓷片与测试溶液相接触,他们试验了该参比电极性能。以上改进侧重于电极和盐桥的改进,但人们很少关注到环境温度对原电池电动势测量的影响[4]。针对上述问题,我们将难于保温的外盐桥去掉,直接将两只参比电极插在饱和的KCl溶液里面一起恒温。设计了如下原电池:

将Ag-AgCl电极、饱和甘汞电极插入装有饱和氯化钾溶液的小烧杯中即成。用电势差计测量不同温度时上述电池的电动势。电池用超级恒温槽恒温。本文优化了该电化学实验参数和实验条件,对比改进前(后)该原电池(6)电动势随温度的变化值(见图1)。经多批次实验,取得了阶段性成果。

图1 电动势法测定热力学函数 (a)改进前; (b)改进后Fig.1 Electromotive force method for the determination of thermodynamic function
2 结果与讨论
2.1 电极的选择
文献[5]选择Cu/CuSO4(Zn/ZnSO4) 电极组装原电池,其优点在于该电池电势值本身就比较大,温度波动对其电池电动势测量影响比较小。缺点是两电极在使用时候,每一次均要电镀。我们选择饱和甘汞电极和氯化银参比电极,缺点是电动势较小,优点是它们的电化学性能稳定。
2.2 电解液浓度的选择
对电池反应 (1) 和反应 (6) 而言, 反应为:
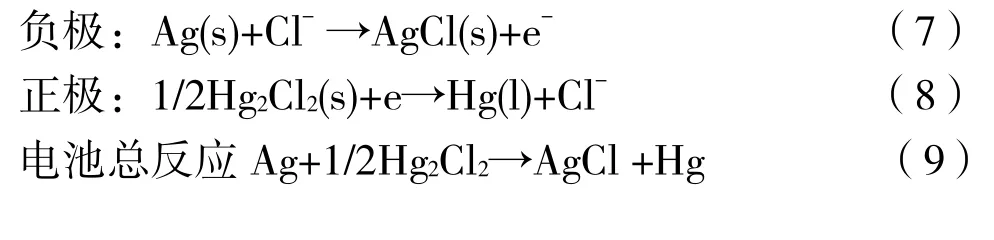
两个电极的电极电势分别列为如下4个等式:
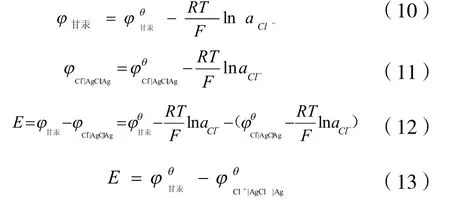
根据上述 4个电池反应能斯特(Nerst)方程(11-13),该原电池反应的电动势值与介质KCl的浓度无关。为方便起见,我们选则饱和的KCl溶液做介质。
2.3 测定温度的选择
两参比电极电动势与温度存在如下经验关系[3],

对式 (14) 和式 (15) 进行温度求偏导,可知在25℃时,负极Ag(s)/AgCl(s) 参比电极的温度系数约为 -7.61×10-4V•℃-1, 正极 Hg2Cl2(s)/Hg(l) 的温度系数约为 -5.40×10-4V•℃-1, 该电池电动势温度系数约为 2.21×10-4V•℃-1。我们经过多次实验探索后发现,架设在两个小烧杯上面的盐桥,在很大程度上影响了实验的结果,导致实验数据参差不齐,重现性差(见图2中的黑点数据)。
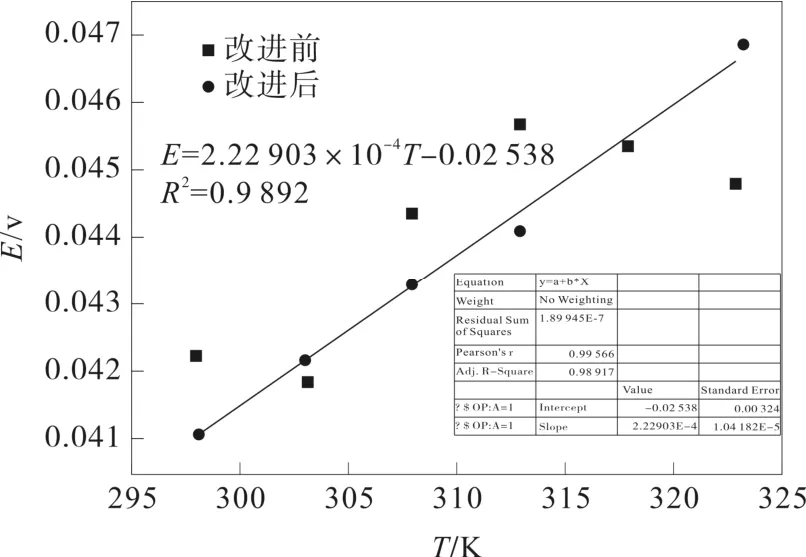
图2 改进前(后)电动势随温度变化关系图Fig.2 The relationship between E vs T
从图2中黑点数据看出,改进前的原电池,在20~50 ℃温度范围内,其电池电势测量值虽然也处在40~45 mV之间,但是其温度系数波动较大,有时候为正,有时候为负。原因可能是,测量过程很难即刻寻找到其平衡位点,酿成被测的原电池电路中多多少少会产生极化现象(即电流不等于零),形成系统误差:当外加电压值比电动势大时,被测的原电池等同于电解池,阴阳两极的极化后果将使反应原电池的电动势增大;当外电压小于电动势时,原电池放电产生极化,将使反应原电池的电动势减少。上述极化现象将使两电极的界面态产生改变,纵使线路断开后也是复原很难,致使原电池的电动势E测量值不能稳定。还由于我们的实验次数有限,误差也会较大。原盐桥测量实验中,我们每组数据都只进行了3次实验测定,产生的测量误差较大。若这些数据在平均值附近晃动,偏差低于±0.5 mV时候,则可认为已基本达平衡,可取后3个数的平均值作为该电池的电动势E。如果用盐桥消除液接电势而未能完全消除,数据偏差则将宽至1-2 mV。
改进后的原电池装置,电池电势测量值(红色曲线)在40~45 mV之间,且呈单调上升,曲线斜率(温度系数) 2.22×10-4V•℃-1,与理论值温度系数(2.20×10-4V•℃-1)符合的较好。对电池总反应 (7)式,查参考文献得:Hg(l)、Ag+(aq)、Cl-(aq)、AgCl(s)、Hg2Cl2(s) 各自的的标准生成焓变、标准生成自由能变及标准熵、标准摩尔反应能变Δ、标准摩尔吉布斯能变、标准摩尔熵变,结果如表 2所示。反应的热力学函数变化值 ΔrGm(298 K)=-52.87 kJ•mol-1、K)=-67.14 J和(298 K)=-69.98。与理论值相比,其相对误差分别为3.7%、-2.4% 和-2.5%,完全满足大学物理化学实验误差不超过 ± 5% 的要求。

表1 电化学反应的热力学函数变化值a) (298.15 K)Table 1 The change of thermodynamic function of electrochemical reaction (298.15 K)
3 结论
(1) 在20℃~50℃ 范围内,对氯化银和甘汞电极两参比电极组成的原电池电动势进行了测量。与改进前的测量值不稳定相比,改进后电池的电动势值稳定在40~45 mV之间,其温度系数为正值 (回归方程E=2.22903×10-4T-0.02538,R2=0.989);
(2) 用改进后电动势法确定电池反应热力学函数简单易行。如果实验仪器有足够精密度,实验操作足够准确,电动势测得的数据相比其他方法较准确。改进后的盐桥恒温效果较好,其热力学函数变化值 ΔrGm(298 K)、ΔrSm(298 K)、ΔrHm(298 K)的相对误差分别为3.7 %, -2.4 % 和 -2.5 %,不超过 ± 5 % , 达到了物化实验教学要求。
[1]复旦大学. 物理化学实验[M]第三版. 北京: 高等教育出版社, 2004.
[2]孙尔康, 徐维清,邱金恒,等.物理化学实验[M].南京:南京大学出版社, 1998.
[3]傅献彩编. 物理化学 (第三版,下册) , 北京:高等教育出版社, 1980,73.
[4]林清枝. 电动势与温度关系实验的改进[J].大学化学,1989,4(1):47-48.
[5]赵会玲,宋江闯,熊焰. “原电池电动势的测定”实验的几点改进[J], 广州化工, 2015,43(9):196-197.
[6]聂 雪,屈景年,曾荣英,刘玲. 电动势法测定化学反应的热力学函数实验的改进[J], 衡阳师范学院学报, 2013, 34(3:):48-51.
[7]张德生, 苏 英. 电极电势与温度关系式的测量[J], 安庆师范学院学报 (自然科学版), 2002, 8(1):76-80.
[8]刘茹,蔡邦宏,刘月华,胡珠霞,彭常活. 锌-铜原电池电动势与温度数学模型的建立[J], 嘉应学院学报(自然科学版), 2015,33(2):54-56.
[9] 张燕, 宋玉苏, 王源升. 电解型Ag/AgCl参比探头的制备及性能研究[[J],材料保护,2007,40(11):59-62.
Improvement on the Experiment of Measuring the Thermodynamic Function by the Electromotive Force Method
WANG Tai-seng, YING Yue, WANG Qi, ZHANG Hai-peng, DAI Jie, YU Yi-zhe,DENG Lin-yue, CHEN Hong, ZHONG Ai-guo*
(School of Medicine and Chemical Engineering, Taizhou University, Zhejiang Taizhou 318000, China)
Aiming at the problem that the temperature coefficient of electromotive force is not stable and can not be estimated or modified in measuring the thermodynamic function by the conventional electromotive force method,improved salt bridges were used to determine the electromotive force of the primary battery composed of silver chloride reference electrode and calomel electrode at 20~50°C. The results show that the temperature coefficient is positive (2.22×10-4V•°C-1), thermodynamic function change values of the reaction ΔrGm(298 K), ΔrSm(298 K) and ΔrHm(298K) are -52.87 kJ·mol-1,-67.14 J·K-1mol-1, -69.98 kJ·mol-1, respectively. Compared with the theoretical values, the relative errors are 3.7%, -2.4% and -2.5%, respectively.
Electromotive force method; Thermodynamic function; Temperature coefficient; Constant temperature
TQ 013
A
1671-0460(2017)11-2254-04
台州学院校级教学改革项目资助(基于“一体化双语三层次”的高素质涉外医化人才培养的实验教学模式创新与实践)。
2017-03-21
王泰森(1994-),男,黑龙江省哈尔滨市人。
钟爱国(1964-),男,教授,硕士,从事物理化学工作。E-mail:xg2268@163.com。
