奇台黑碱土可培养细菌的分离及抑制黑色素合成活性菌株的筛选
2017-12-06付建红杨新平仲晓燕张婉昕
付建红, 杨新平,谢 芹,仲晓燕,张婉昕,甘 甜
(1.新疆师范大学 生命科学学院 新疆特殊环境物种多样性应用与调控重点实验室,新疆 乌鲁木齐 830054;2.新疆农业科学院 微生物应用研究所,新疆 乌鲁木齐 830011)
奇台黑碱土可培养细菌的分离及抑制黑色素合成活性菌株的筛选
付建红1, 杨新平2,谢 芹1,仲晓燕1,张婉昕1,甘 甜1
(1.新疆师范大学 生命科学学院 新疆特殊环境物种多样性应用与调控重点实验室,新疆 乌鲁木齐 830054;2.新疆农业科学院 微生物应用研究所,新疆 乌鲁木齐 830011)
黑碱土也称为碱化盐土,形成原因十分复杂,改良也很困难,但是这种高盐环境为嗜盐碱菌、耐盐碱菌的研究提供了得天独厚的条件。本研究中,笔者采用平板稀释法从新疆奇台黑碱土中分离获得95个细菌菌株,通过建立的用比基尼链霉菌CPCC200555为鉴定菌的黑色素生物合成抑制剂筛选模型,从分离菌株的285个次级代谢产物样品中筛选出21株细菌,其代谢产物对黑色素合成有较强的抑制活性,其中,15株细菌代谢物对蘑菇酪氨酸酶也有明显的抑制活性。本研究为筛选用作美白化妆品的添加剂和治疗皮肤黑色素瘤药物的黑色素生物合成抑制剂奠定科学基础。
耐盐碱菌;分离;黑色素合成抑制剂;蘑菇酪氨酸酶抑制剂
新疆地处欧亚大陆腹地,降雨量稀少,蒸发强烈,是我国最为干旱、土壤盐碱化分布面积最广、盐碱化类型最多以及土壤积盐最重的地区。因此被称为“世界盐碱土的博物馆”[1]。
目前,盐碱化程度比较严重的黑碱土在新疆的分布面积还没有精确的统计,但就奇台县坎尔孜乡西三村新疆农科院奇台试验站附近零星分布的黑碱土来说,已经发现其对作物危害很大,一般作物几乎不能在此生长。这种独特的生态环境为耐盐碱微生物的生长繁殖创造了有利条件,长期的选择压力使这些微生物演化形成适应环境胁迫的机制,能产生特殊性质的生物活性物质。
人体局部黑色素沉着如痣、雀斑,影响人的美观及身心健康,严重的如黑色素瘤还危及生命。因此,筛选黑色素生物合成抑制剂用作化妆品及药品有着良好的前景。目前,为了从微生物中寻找新的黑色素合成抑制剂,已先后从霉菌和链霉菌中分离到一些有效物质,但是为数不多。Imae等[2]报道:在利用指示菌比基尼链霉菌NRRL B-1049筛选黑色素生物合成抑制剂过程中,分别从链霉菌StreptomycescalvusNo.N924-1和StreptomycesclaviferNo.N924-2的发酵液中分离出新的化合物BMY-28565和BMY-28566。Komiyama等[3]从Streptomycessp. OH-3984的发酵液中分离出了新的黑色素生物合成抑制剂 OH-3984K1 和K2。Takamatsu等[4]研究了OH-3948K1和K2的理化特性和结构。Lee等[5-6]从木霉Trichodermaharzianum的发酵液中分离出了新的黑色素合成抑制剂MR566A 和MR566B,并对其分类、发酵、分离、生物学特性和理化特性、结构式鉴定进行了研究。郑榕等[7]从棘孢小单孢福建亚种No.80-A18(Micromonosporaechinosporasubsp.fujianensis)的发酵液中提取黑色素生物合成抑制剂MA-18,经过纯化和理化性质鉴别,根据元素分析、EI-MS 和13C核磁共振(NMR)的结果,确定了其分子式。目前,已报道的具有抑制黑色素合成功能的菌株都不是极端微生物菌株,从盐碱土的细菌资源中获得具有抑制黑色素生物合成活性的耐盐碱菌株尚未见报道。
本研究中,笔者应用产生黑色素的链霉菌为指示菌,通过分离的耐盐碱细菌产生的次生代谢产物直接抑制其产生黑色素的方法筛选黑色素生物合成抑制剂,同时检测其对酪氨酸酶的抑制活性,以探究黑色素合成抑制剂的抑制机理和抑制剂的结构鉴定。
1 材料与方法
1.1 实验指示菌及样品来源
比基尼链霉菌CPCC200555由中国医学科学院医药生物技术研究所菌种中心提供。
供试土壤为2014年10月采自奇台县坎尔孜乡西三村新疆农科院奇台试验站附近的土壤样品。分别在有少量植被和无植被的地带采集地表和地下20 cm土层的土壤样品,去除根系、石块等杂物,将土壤样品装入牛皮纸袋中带回实验室,保存于4 ℃冰箱中。
1.2 培养基
1.2.1 富集培养基
1)改良CM培养基(g/L):酪蛋白5 ,酵母粉10,NaCl 50,胰蛋白胨 5,KCl 2,柠檬酸三钠3,MgSO4·7H2O 20;pH 7.5。
2)改良LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 50;pH 7.0。
3)Horikoshi培养基(g/L):葡萄糖 10,蛋白胨 5,酵母浸出物 5,K2HPO41,MgSO4·7H2O 0.2,Na2CO310,NaCl 50;pH 9.0。
1.2.2 分离培养基
1)GW1培养基(g/L):干酪素0.3,甘露醇1,NaCl 100,NaHCO32,CaCO30.2,(NH4)2SO42,KNO32,K2HPO41,MgSO4·7H2O 2,FeSO40.01,琼脂20;另加微量盐溶液1 mL。
2)改良ISP5培养基(g/L):酵母浸出物5,K2HPO41,甘油1,KNO35,L-天门冬酰胺1,NaCl 100,琼脂12;pH 7.0~7.4。
3)改良CM培养基(g/L):酪蛋白5,酵母粉10,NaCl 50,胰蛋白胨5,KCl 2,柠檬酸三钠3,MgSO4·7H2O 20,琼脂18;pH 7.5。
4)Horikoshi培养基(g/L):葡萄糖 10,蛋白胨 5,酵母浸出物 5,K2HPO41,MgSO4·7H2O0.2,Na2CO310,NaCl 50,琼脂18;pH 9.0。
细菌种子培养和发酵培养用的培养基同富集培养基。
1.2.3 Papavizas′ VDYA固体培养基
V-8蔬菜汁液20 mL,葡萄糖 2 g/L,酵母提取物 2 g/L,CaCO31 g/L,琼脂20 g/L;pH 7.2。
1.2.4 ISP7琼脂培养基
蛋白胨 10 g/L,牛肉膏 3 g/L,NaCl 5 g/L,细菌-酵母提取物 2 g/L,酪氨酸 5 g/L,琼脂 20 g/L;pH 7.6。
1.3 试剂与仪器
丁基羟基茴香醚(BHA,AR)、二甲基亚砜(AR)、曲酸(AR)、L-多巴(AR)、蘑菇酪氨酸酶(BR),Sigma-Aldrich公司;乙酸乙酯、丙酮、NaH2PO4、Na2HPO4·12H2O等均为市售国产分析纯。
FA2204N型电子天平,上海菁华仪器有限公司;BXM-30R型立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;SW-LF-1FD型超净工作台,苏州苏洁净化设备有限公司;ZWY-211B型恒温培养振荡器,上海智城分析仪器制造有限公司;RE-2000A型旋转蒸发器,上海亚荣生化仪器厂;SHB-Ш型循环水式多用真空泵,郑州长城科工贸有限公司;BG-80型隔水式培养箱,上海博迅实业有限公司医疗设备厂;GL-20GH型离心机,上海安亭科学仪器厂;UV-2800H型紫外-可见分光光度计,上海尤尼柯仪器有限公司。
1.4 黑碱土中细菌的分离纯化
分别称取采集的土样5 g置于100 mL不同的富集培养基中,在28 ℃、160 r/min振荡培养2~3 d进行耐盐碱微生物的富集。然后将富集的菌悬液采用稀释平板分离法涂布于不同的分离培养基平板上,37 ℃培养3~15 d,待菌落长出后,根据菌落大小、形态和颜色进行初步筛选,再经反复划线分离纯化后,接种于斜面培养基4 ℃冷藏保存备用。
1.5 细菌发酵及其次生代谢产物的提取分离
将分离到的细菌接种于种子培养基中,37 ℃、160 r/min振荡培养24 h。以1%(体积分数)接种量转接于发酵培养基中,于37 ℃、160 r/min振荡培养48~72 h。
获得的细菌发酵液于4 ℃、6 000 r/min离心20 min,分别收集上清液和菌体沉淀。
1)上清液:加等体积乙酸乙酯萃取,共萃取3次,合并萃取液后减压浓缩,用少量的5%二甲基亚砜溶液溶解得样品Ⅰ,4 ℃冷藏备用;
2)菌体:用等体积的60%丙酮水溶液悬浮菌体沉淀,超声波破碎细胞,再浸提5 h,低温离心。上清液中加等体积乙酸乙酯萃取2次,分别收集乙酸乙酯萃取相(样品Ⅱ)和丙酮溶液萃取相(样品Ⅲ),经减压蒸馏得浸膏状物质,加少量二甲基亚砜溶解,4 ℃冷藏备用。
1.6 细菌次生代谢产物对比基尼链霉菌黑色素合成的抑制活性
参照文献[8-10]将比基尼链霉菌CPCC200555接种到Papavizas′VDYA平板上,28 ℃培养2周,制备孢子悬液。将链霉菌孢子悬液定量加入到ISP7琼脂平板上,用玻璃棒刮匀。干燥后,将不同的细菌代谢产物样品浸泡过的、直径6 mm纸碟放置在平板上,28 ℃培养4 d后,从平板背面观察测量黑色素抑制圈,以1 000 μg/mL丁基羟基茴香醚为黑色素合成抑制剂的阳性对照。
1.7 细菌次生代谢产物对蘑菇酪氨酸酶的抑制活性
以L-多巴为底物,参照文献[11-12]报道的方法进行酪氨酸酶活性的抑制率测定。用含5%二甲基亚砜的磷酸盐缓冲液配制一定浓度的细菌代谢提取物溶液。按表1精确吸取代谢物溶液、pH 6.8磷酸盐缓冲溶液和浓度为1.0 mmol/L的L-多巴溶液,充分混合,于30 ℃下水浴10 min后,加入酪氨酸酶溶液(150 U/mL) ,再水浴反应15 min,迅速转移至比色皿中,在475 nm处测定各反应液吸光度值,按式(1)计算抑制率。阳性对照以曲酸代替细菌代谢物,空白对照为含5%二甲基亚砜磷酸盐缓冲液。
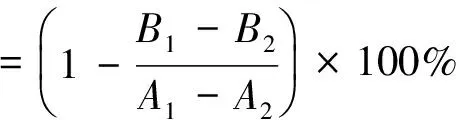
(1)
式中:A1为酪氨酸酶催化氧化L-多巴溶液产生黑色素的吸光度值;A2为L-多巴溶液的吸光度值;B1为酪氨酸酶活性受代谢物抑制后溶液的吸光度值;B2为代谢物的吸光度值。

表1 反应液组成
2 结果与讨论
2.1 黑碱土中细菌的分离纯化
从奇台采集黑碱土样品4份,分别用3种富集培养基和4种分离培养基,采用稀释平板涂布法分离细菌。最终从本次采集的样品中分离到95株纯培养物,结果如表2和3所示。

表2 不同富集培养基分离菌株的结果
从表2可出:不同富集培养基的分离效果不同,改良CM富集培养基(1号)和LB培养基(2号)分离到的菌落较多,而Horikoshi培养基(3号)上菌落形成单位少,说明土壤样品中可培养细菌以耐盐菌为主,耐碱菌相对较少。

表3 不同分离培养基分离菌株的结果
从表3可以看出:改良CM分离培养基(3号)分离到的菌落数量要远远多于其他分离培养基,占细菌总数的61%。可见,改良CM培养基的分离效果最好,且分离到的菌株大多为耐盐细菌。
从各土样的分离结果看,无植被的地下20 cm土层中可培养细菌最丰富(占32.6%~33.7%),而有少量植被的地表土层中细菌数量最少(占16.8%~17.9%)。这可能与土壤中盐分分布格局有关,土层越深,含盐量越低,则细菌数量越多。
2.2 细菌次生代谢产物对比基尼链霉菌合成黑色素的抑制
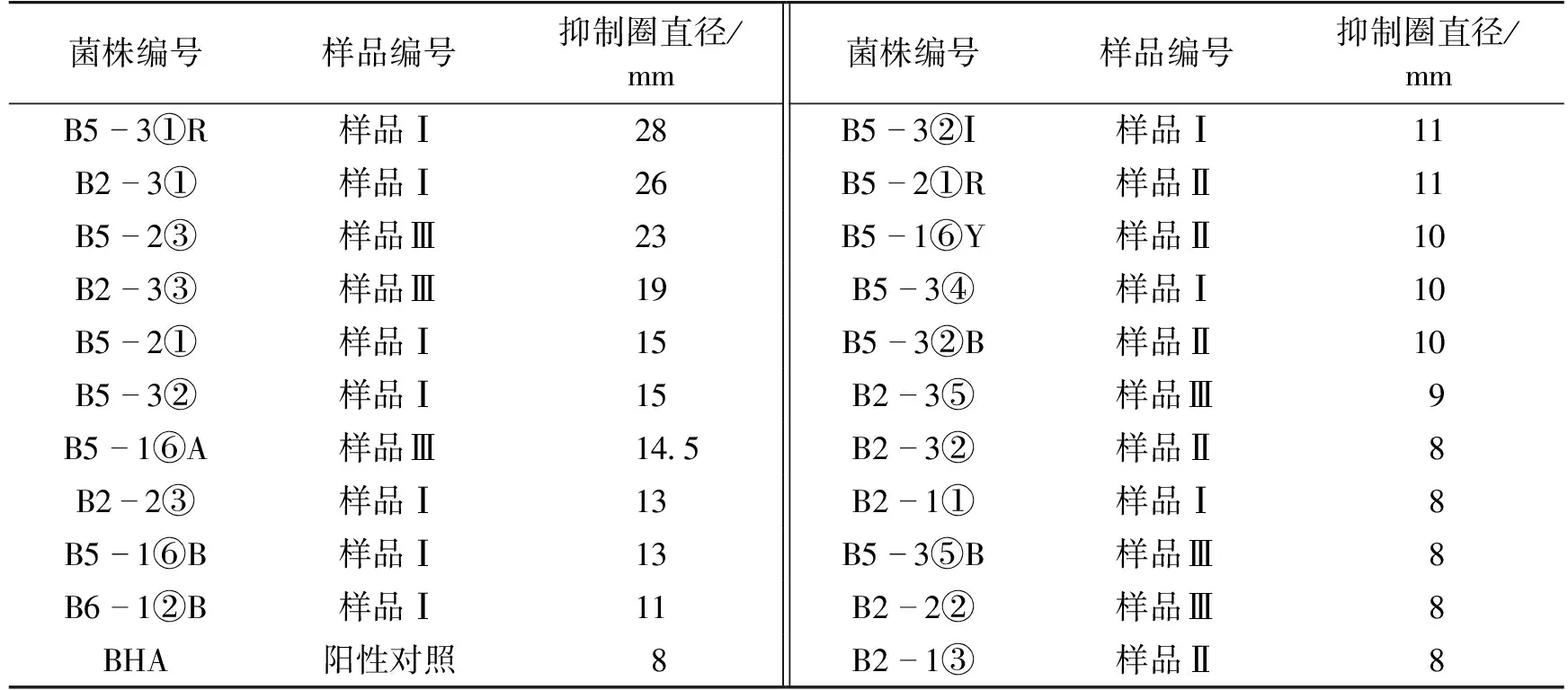
将待筛选的95株细菌接种于发酵培养基,摇瓶发酵后按照胞外和胞内产物以及提取方式的不同,共获得285个次级代谢产物样品,这些样品分别用比基尼链霉菌筛选模型进行筛选。通过比较抑制圈直径的大小,从中选得21株抑制圈直径较大的黑色素生物合成抑制剂产生菌株。图1显示了在ISP7琼脂培养基上,筛选出的阳性菌株产生的次生代谢产物抑制比基尼链霉菌CPCC200555形成黑色素的情况。表4为黑碱土中筛选得到的菌株产黑色素生物合成抑制剂的情况。
从表4可以看出:21株具有黑色素生物合成抑制活性的菌株耐盐能力不同,其中8株菌是从2号分离培养基分离出来的,能耐受100 g/L NaCl,属于中度耐盐菌;12株菌是从3号分离培养基分离出来的,能耐受50 g/L NaCl,属于轻度耐盐菌。还有1株菌B6 -1②B是从4号分离培养基分离出来的,既能耐受50 g/L NaCl,又能在pH 9.0的环境下生长,属于耐盐碱菌。

图1 阳性菌株产生的次生代谢物抑制比基尼链霉菌形成黑色素抑制圈Fig.1 The resulting zone of inhibition of melanin formation of Streptomyces bikiniensis from thepositive strain for the metabolites
菌株编号样品编号抑制圈直径/mm菌株编号样品编号抑制圈直径/mmB53①R样品Ⅰ28B53②Ⅰ样品Ⅰ11B23①样品Ⅰ26B52①R样品Ⅱ11B52③样品Ⅲ23B51⑥Y样品Ⅱ10B23③样品Ⅲ19B53④样品Ⅰ10B52①样品Ⅰ15B53②B样品Ⅱ10B53②样品Ⅰ15B23⑤样品Ⅲ9B51⑥A样品Ⅲ145B23②样品Ⅱ8B22③样品Ⅰ13B21①样品Ⅰ8B51⑥B样品Ⅰ13B53⑤B样品Ⅲ8B61②B样品Ⅰ11B22②样品Ⅲ8BHA阳性对照8B21③样品Ⅱ8
2.3细菌次生代谢产物对蘑菇酪氨酸酶的抑制活性
酪氨酸酶是黑色素生物合成的主要限速酶,黑色素合成量与酪氨酸酶的活性呈正相关,其活力可控制黑色素生成量,抑制酪氨酸酶活性可减少黑色素生成。一般情况下,能强烈抑制酪氨酸酶的物质也能抑制比基尼链霉菌的黑色素形成。应用蘑菇酪氨酸酶法筛选对比基尼链霉菌的黑色素形成和蘑菇酪氨酸酶都有抑制作用的抑制剂,为进一步探究黑色素合成抑制剂的抑制机理、鉴定其化学结构以及开发其应用价值提供理论依据。
参照文献[11-12]报道的方法,在475 nm处测定各反应液的吸光度值,计算细菌代谢产物对蘑菇酪氨酸酶活性的抑制率。实验结果发现,抑制比基尼链霉菌黑色素生物合成的21株活性菌株中有15株细菌的代谢产物也能抑制酪氨酸酶的活性,表现为能强烈抑制酪氨酸酶活性的代谢产物也能很强地抑制比基尼链霉菌的黑色素形成,如菌株B2-3①样品Ⅰ(95.9%)、菌株B5-3①R样品Ⅰ(92.98%)和菌株B5-2 ③样品Ⅲ(92.86%)。此外,抑制率达70%以上的菌株有B6-1②B样品Ⅰ(80.59%)、菌株B2-3②样品Ⅱ(86.7%)、菌株B5 -1⑥B样品Ⅰ(72.6%)、菌株B5-2①R样品Ⅱ(82.49%)、菌株B5-3②样品Ⅰ(86.43%)、菌株B2-2②样品Ⅲ(73.1%)、菌株B2-3③样品Ⅲ(87.68%)、菌株5-1⑥A样品Ⅲ(80.05%)。
在实验过程中,我们发现有8株细菌的代谢产物对比基尼链霉菌的黑色素有抑制作用,但对蘑菇酪氨酸酶却没有抑制作用,推测它们可能是缩肽类抗生素,通过抑制酪氨酸酶的产生抑制黑色素形成,而对酪氨酸酶的酶催化反应无影响[5,13]。这类物质可能抑制了某种激素,通过有关的信号通路下调酶基因的表达,从而间接抑制酪氨酸酶的含量[14]。
3 结论
1)本研究通过稀释平板法从新疆奇台黑碱土中分离获得95株耐盐碱细菌。
2)采用比基尼链霉菌筛选模型,从耐盐碱细菌中筛选出的21株细菌可产生对黑色素合成有抑制活性的代谢物质,进一步研究其对蘑菇酪氨酸酶活性的影响,发现15株细菌的代谢产物对蘑菇酪氨酸酶和比基尼链霉菌的黑色素形成都有抑制作用。
本研究筛选出的黑色素合成抑制剂能否抑制小鼠B16黑色素瘤细胞的黑色素合成,能否从细菌发酵产物中寻找到能有效祛除及减轻皮肤局部色素沉着且毒性较低的化合物,作为造福于人类的治疗新药和美容佳品值得进一步研究。
[1] 邵华伟,孙九胜,胡伟,等.新疆盐碱地分布特点和成因及改良利用技术研究进展[J].黑龙江农业科学,2014(11):160-164.
[2] IMAE K,KAMACHI H,YAMASHITA H,et al.Synthesis,stereochemistry,and biological properties of the depigmenting agents,melanostatin,feldamycin and analogs[J].J Antibiot,1991,44(1):76-85.
[3] KOMIYAMA K,TAKAMATSU S,TAKAHASHI Y,et al.New inhibitors of melanogenesis,OH-3948 K1 and K2:I.taxonomy,fermentation,isolation and biological characteristics[J].J Antibiot,1993,46(10):1520-1525.
[4] TAKAMATSU S,RHO M,HAYAHSI M,et al.New inhibitors of melanogenesis,OH-3948 K1 and K2:II.physico-chemical properties and structural elucidation[J].J Antibiot,1993,46(10):1526-1529.
[5] LEE C H,KOSHINO M,CHUNG M C,et al.MR304A,a new melanin synthesis inhibitor produced byTrichodermaharzianum[J].J Antibiot,1995,48(10):1168-1170.
[6] LEE C H,KOSHINO H,CHUNG M C,,et al.MR566A and MR566B,new melanin synthesis inhibitors produced byTrichodermaharzianum:II.physico-chemical properties and structural elucidation[J].J Antibiot,1997,50(6):474-478.
[7] 郑榕,林永珠,陈磊,等.黑色素生物合成抑制剂MA-18化学结构和生物学活性的研究[J].中国抗生素杂志,1997,22(1):8-11.
[8] TOMITA K.用比基尼链霉菌筛选黑色素生物合成抑制剂的一种新方法[J].国外医药抗生素分册,l992,13(3):167-169.
[9] 田敏,刘瑜,俞朵,等.微生物来源的黑色素生物合成抑制剂H7264的研究[J].中国抗生素杂志,2002,27(2):84-86.
[10] 张礼萍,龚炳永.黑素生物合成抑制剂的研究[J].国外医药抗生素分册,1998,19(2):83-86.
[11] 龚盛昭,杨卓如,张木全微波辅助提取牡丹皮中的酪氨酸酶抑制剂[J].精细化工,2007,24(8):766-768.
[12] 李红艳,刘艳杰,王倩,等.红花中酪氨酸酶抑制成分的快速筛选和分析[J].现代药物与临床,2013,28(2):170-174.
[13] TAKAHASHI S,HASHIMOTO R,HAMANO K,et al.Melanoxazal,new melanin biosynthesis inhibitor discovered by using the larval haemolymph of the silkworm,Bombyxmori:production,isolation,structural elucidation,and biological properties[J].J Antibiot,1996,49(6):513-518.
[14] 刘圆圆,刘振辉,张士璀.黑色素生物合成和黑色素抑制剂[J].鲁东大学学报(自然科学版),2016,32(3):236-242.
(责任编辑 荀志金)
Isolationofculturablebacteriafromsaline-alkalisoilinQitaiandscreeningofstrainsofinhibitingmelaninbiosynthesis
FU Jianhong1,YANG Xinping2,XIE Qin1,ZHONG Xiaoyan1,ZHANG Wanxin1,GAN Tian1
(1.Key Laboratory of Species Diversity Application and Control in Xinjiang,College of Life Science,Xinjiang Normal University,Urumqi 830054,China; 2.Applied Microbiology Institute,Xinjiang Academy of Agricultural Sciences,Urumqi 830011,China)
Black alkali soil is called alkalized solonchak.The soil-farming process is very complex and the soil improvement is very difficult.However,black alkli soil provides a unique condition to study of haloalkalophilic bacteria and haloalkalo-resistant bacteria.Using dilution-plate method,95 bacteria strains were isolated and purified from the black alkali soil collected in Qitai,Xinjiang.In total 285 secondary metabolites of 95 strains were screened for their melanin formation inhibition,withStreptomycesbikiniensisCPCC200555(a melanin-producer) as a screening model.Metabolites of 21 strains strongly inhibited melanin formation inS.bikiniensisCPCC200555.The metabolites of the 15 strains among the above strains showed inhibitory activity against mushroom tyrosinase.Our findings provide references for exploring melanin synthesis inhibitors with potential use in cosmetics and drug.
haloalkaloresistant bacteria; isolation; melanin synthesis inhibitors; mushroom tyrosinase inhibitors
10.3969/j.issn.1672-3678.2017.06.011
2017-09-27
国家自然科学基金(31260213)
付建红(1970—),女,河南平舆人,博士,教授,研究方向:特殊环境微生物多样性及其代谢产物活性,E-mail:fjh_719@163.com
Q936
A
1672-3678(2017)06-0074-06
