木质纤维素生物炼制的研究进展
2017-12-06林海龙
林海龙
(国投生物科技投资有限公司,北京 100034)
木质纤维素生物炼制的研究进展
林海龙
(国投生物科技投资有限公司,北京 100034)
木质纤维素是一种广泛存在的可再生生物质资源,主要由纤维素、半纤维素和木质素组成。如何更有效地综合利用木质纤维素是当前面临的世界性难题。本文中,笔者梳理了木质纤维素生物化学法转化生产以燃料乙醇为代表的生物基产品,特别是转化过程中关键技术环节的研究现状及难点,深入探讨了木质素的生物转化利用趋势,并综述了合成生物学在这些领域的研究趋势和最新成果。本文力图描绘出木质纤维素生物炼制研究全景,为后续研究提供潜在思路。
木质纤维素;生物炼制;燃料乙醇;木质素生物降解
木质纤维素是植物细胞壁的主要成分,包含了纤维素、半纤维素和木质素三大组分。地球上每年通过光合作用产生的木质纤维素类生物质高达1 000亿t以上,然而只有少数部分被人类所利用。美国每年可收集利用的木质纤维素类生物质高达13亿t,中国也有8亿t左右[1],这些生物质的有效利用必将减少化石资源的开采。目前,以化石资源为主要的能源利用形式导致了一系列的社会问题,如环境污染、能源危机等。因此,世界各国都在加大力度开发木质纤维素这一可再生资源,以缓解能源危机、环境污染等问题,达到可持续发展的目标。
木质纤维素的转化利用可分为热化学法和生物化学法。热化学法包括高温分解(pyrolysis)、高温液化(liquefaction)和气化(gasification)等。高温分解在300~1 000 ℃、无氧条件下进行[2],其产物主要为合成气(CO、CO2、 CH4和H2等)、生物油(bio-oil)以及生物碳(bio-char)。另外,根据木质纤维素热裂解反应的变化,其产物也明显不同。当木质纤维素快速高温分解时,主要产物为生物油,而慢速高温分解的主要产物为生物碳。木质纤维素的高温液化是将物料在含有较多水分的条件下,在250~370 ℃将生物质转变为生物油[3];而气化则是在900~1 200 ℃条件下,将生物质裂解为CO、CO2、H2O、H2和CH4等,同时有副产物焦油和焦炭等的生成[4]。生物化学法的一般流程是预处理破坏植物细胞壁的紧密结构,酶水解将木质纤维素中的纤维素和半纤维素降解为可被微生物发酵的糖,最后通过微生物发酵生产各种生物基产品,如燃料乙醇、丁醇等(图1)[5-6]。相比而言,生物化学法反应条件温和,预处理温度在60~220 ℃,酶水解温度50 ℃左右,发酵温度20~60 ℃。本文中,笔者主要介绍木质纤维素的生物化学法转化利用生产以燃料乙醇为代表的生物基产品。

图1 木质纤维素生物炼制生产燃料乙醇的工艺流程Fig.1 Schematic diagram of biorefinery for converting lignocellulosic biomass to bio-ethanol
1 燃料乙醇
燃料乙醇可用来部分代替汽油,缓解石油危机。目前,燃料乙醇主要与汽油以一定比例混合使用(通常乙醇添加比例为10%),形成新型混合燃料(E10汽油)。燃料乙醇取代甲基叔丁基醚添加到汽油中,减少对地下水和空气的污染,可提高汽油的辛烷值,增强汽油的抗爆性能。另外,乙醇的氧含量高达34.7%,因此,乙醇与汽油的混用一定程度上解决了汽油在油缸内燃烧供氧不足的问题,从而使汽油燃烧更加充分,减少CO和其他有害气体的生成,降低对环境的污染。目前,美国是燃料乙醇的最大生产国(原料主要为玉米),年产量4 500万t左右[7];巴西是第二大燃料乙醇生产国(原料为甘蔗),年产量2 150万t左右[7];中国是第三大燃料乙醇生产国(原料为玉米、木薯和小麦等),年产量为250万t左右[7]。
相比已规模化生产的玉米乙醇,木质纤维素乙醇目前还处于规模化生产的起始阶段。欧美有几家公司已经建立了较大规模的木质纤维素乙醇生产厂进行试运行。这些公司包括:在美国堪萨斯建立的以玉米秸秆为原料年产7.5万t乙醇的Abengoa公司、在意大利Crescentino建立的以草为原料年产4.0万t乙醇的Beta Renewables公司、在美国爱荷华州建立的以玉米秸秆为原料年产9.0万t乙醇的DuPont公司、在美国爱荷华州建立的以玉米秸秆为原料年产6.0万t乙醇的POET/DSM公司、在巴西建立的以甘蔗渣为原料年产3.2万t乙醇的Raizen公司以及年产6.5万t乙醇的Granbio公司等[8]。
2 木质纤维素转化为可发酵糖
木质纤维素原料来源广泛、价格低廉且能被来源于微生物的水解酶类降解。木质纤维素的这些特点为微生物发酵法大规模产糖提供了可能,进而为系统生产种类多样的生物基产品提供了丰富的原料。这些生物基化学品包括大宗化学品(如乙醇)、精细化学品(如酶制剂、手性化合物)、食品元素(如维生素、抗氧化剂)以及药品(如天然产物)等[9]。从生物质中获取发酵糖,然后糖通过微生物发酵生产各种产品的技术路线也被称为 “糖平台”技术。“糖平台”技术主要包括预处理和酶水解生产可发酵糖的过程。
2.1 预处理方法
木质纤维素的预处理过程是将木质纤维素转化为可发酵糖的关键步骤。木质纤维素中的半纤维素包裹着纤维素,并与木质素交织形成复杂的木质素碳水化合物复合体(lignin carbohydrates complex)。木质纤维素复杂的结构使得纤维素酶很难与直接纤维素接触,从而导致纤维素生物降解效率低下。同时,纤维素的高聚合度和高结晶度等特点也影响了纤维素的生物降解[6]。因此,预处理是实现木质纤维素高效转化利用的至关重要一步。目前常用的预处理方法包括:物理法、化学法、物理化学法和生物法等[10]。
物理法预处理主要是通过物理的方式破坏生物质的细胞壁结构,使纤维素暴露出来,从而提高纤维素的可及性。物理法预处理包括研磨粉碎、β-射线和微波等。机械预挤压处理方法是物理法中最常用的一种预处理方法,这种预处理方法在较高温度下(>300 ℃)对生物质进行机械剪切研磨,能够有效地破坏生物质细胞结构,扰乱纤维素的结晶区,从而提高纤维素的酶解效率[11]。这种预处理方法主要缺点是能耗高,因而在工业化应用过程中的前景有限。
与物理法预处理不同,化学法预处理主要是通过化学反应切断木质素碳水化合物复合体中的化学键,破坏或去除生物质中的半纤维素或者木质素,从而提高纤维素的酶促反应可及性,以提高酶解效率[12]。化学法预处理主要包括稀酸预处理、碱预处理、有机溶剂预处理和湿式氧化预处理等,其中,稀酸预处理主要是将半纤维素在预处理过程中水解为单糖,从而把半纤维素从纤维素表面剥离,使纤维素暴露出来便于生物降解[13]。这种预处理方法成本低,操作较为简单,但预处理过程中会导致糖的降解以及抑制物(如酚类、糠醛和呋喃等)的生成。同时,稀酸对设备具有腐蚀性,增加了设备的运行及维护成本[14-16]。碱预处理的应用也较为广泛,该方法能有效切断木质素与碳水化合物之间的化学键,从而打散木质纤维素结构。同时,碱还能溶解、去除部分木质素,从而提高木质纤维素的酶解转化效率。然而,该方法常常需要大量的水对预处理后的底物进行冲洗除盐、脱毒,导致下游处理成本大大提高,不利于工业化应用[14]。
由于物理法和化学法各有优点,吸收这两种方法优点的物理化学法预处理逐渐受到广泛关注[17]。物理化学法预处理主要是在高温高压的条件下,破坏木质纤维素不同组分之间的连接,同时可去除部分木质素或者半纤维素[18-20]。物理化学法有蒸汽爆破法、氨纤维膨胀法(AFEX)等[17]。其中,蒸汽爆破预处理方法应用较为广泛,该法主要是利用蒸汽作为介质,进入植物细胞内部,在压力瞬间释放的作用下破碎细胞壁结构。另外,在高温高压的作用下,催化剂(H2SO4和SO2)的存在能显著提高蒸汽爆破的预处理效果,达到较好的半纤维素去除率以及糖回收率[18]。和酸催化预处理类似,蒸汽爆破预处理过程中也会产生大量抑制物,这些抑制物对后续酶解发酵产生较为强烈的抑制影响。蒸汽爆破预处理的相关技术难题仍有待进一步解决[21-22]。AFEX采用的氨气呈弱碱性,因此具有碱预处理的一些特征,但由于是弱碱,从而避免了过多副反应的发生,产生的抑制物较少[23]。另外,氨的挥发性使得氨气回收利用较为方便,残留在木质纤维素中的氨还能作为后续微生物发酵的氮源[24]。
生物法预处理对木质纤维素也具有较好的预处理效果。该预处理方法主要利用白腐菌、软腐菌等微生物选择性地对木质纤维素中的木质素进行降解。然而,由于生物降解反应速率过慢,该预处理方法所需时间较长(长达数周),因此较难在工业化生产中得到广泛应用[10,25]。目前,稀酸预处理、蒸汽爆破预处理和AFEX预处理都已经实现了中试规模以上的放大测试。
此外,近年来还出现了一些较为新颖的预处理方式,如co-solvent enhanced lignocellulosic fractionation(CELF)预处理[26-27]、sulfite pretreatment to overcome recalcitrance of lignocellulose(SPORL)预处理[28-30]、对甲苯磺酸预处理技术以及flowthrough预处理[31]等。美国加州大学河滨分校的Wyman教授课题组开发的CELF预处理技术主要利用低沸点的四氢呋喃作为溶剂,分离木质纤维素的3种组分(纤维素、半纤维素和木质素),所得预处理底物纤维素含量高,更容易被纤维素酶催化水解、大大降低了酶用量[32]。美国农业部Zhu课题组开发的SPORL预处理结合了稀酸预处理和磺化预处理的特点,以亚硫酸盐为反应剂,在酸性条件(pH 2~4)及较高温度(160~180 ℃)下进行预处理[28-30],该预处理方式适用于处理结构较为致密的软木以及硬木,且可利用传统制浆造纸产业的设备作为反应器。最近,该课题组还利用对甲苯磺酸(pTsOH)作为水溶性助溶剂,有效分离了纤维素、半纤维素和木质素,大大提高了所得纤维素的可及性,提高了纤维素酶催化水解效率。该预处理技术所采用的pTsOH可重复利用,预处理温度较低(<80 ℃),时间较短(<60 min),并且无需添加任何其他催化剂,因而具有较好的应用前景[33-34]。
2.2 酶水解
木质纤维素酶水解的主要目标是将其中的纤维素和半纤维素水解为可发酵单糖。纤维素是由葡萄糖通过β-1,4糖苷键连接起来的聚合物。半纤维素则是由几种不同类型的单糖构成的多聚体,这些单糖主要为木糖、阿拉伯糖、葡萄糖和半乳糖等,其中最多的是木糖。水解纤维素的酶主要包含3种核心酶:纤维二糖水解酶(CBH)、内切葡聚糖酶(EG)和β-葡萄糖苷酶(βG)[35-36]。内切葡聚糖酶在低结晶区纤维素链的中间随机地进行切割,产生还原末端和非还原末端的纤维素链。纤维二糖水解酶CBH I 和 CBH II通过其自身的吸附结构域吸附在纤维素链上,分别从还原末端和非还原末端对纤维素链进行水解,产生纤维二糖。β-葡萄糖苷酶水解纤维二糖,产生葡萄糖。半纤维素的水解主要依靠内切木聚糖酶、外切木聚糖酶、木糖苷酶和内切甘露聚糖酶等[35]。不同的纤维素酶和半纤维素酶通过相互协同作用提高木质纤维素的降解转化效率。Gao等[37]研究了水解AFEX预处理玉米秸秆的最优酶配比,发现CBHI+CBHII+EG的含量在最优的酶配比中占了77.4%,说明纤维二糖水解酶和内切葡聚糖酶在水解木质纤维素中至关重要的作用。
影响木质纤维素酶水解效率的因素很多,包括底物的孔隙率、酶所能接触到的底物面积、纤维素的结晶度和聚合度、木质素的含量以及酶的活力等[6]。其中,木质素主要通过疏水作用和静电作用与纤维素酶进行无效吸附,从而阻碍酶与底物的高效接触、降低酶的水解效率[38]。另外,预处理产生的抑制物,特别是木质素衍生出的酚类物质,对酶活有较大的抑制[39]。酶水解的产物(单糖和寡糖)对木质纤维素的酶水解也具有强烈的抑制作用[16]。这些因素都或多或少地限制了木质纤维素酶水解的效率。
2.3 木质纤维素制糖的瓶颈
2.3.1 高底物浓度酶水解的低糖转化率
高底物浓度酶水解是实现木质纤维素生物炼制工业化的必要条件。然而,纤维素和半纤维素的转化率(糖转化率)随着酶水解底物浓度的提高而直线下降,导致高底物浓度下糖转化率偏低[40]。造成这种现象的可能原因包括:1)水含量下降。木质纤维素底物浓度提高造成了反应体系中水含量的下降。水是纤维素和半纤维素酶水解的底物之一,同时也是酶的溶剂,在酶水解过程中非常重要。水含量的下降、物料黏度的提高在一定程度上影响了酶水解的效果。2)木质素含量的提高。木质纤维素底物浓度的提高导致了木质素含量的提高,而木质素是影响酶水解的一大负面因素。3)抑制物浓度的提高。木质纤维素预处理产生的抑制物随着木质纤维素底物进入酶水解,木质纤维素浓度的提高必然引起抑制物浓度的提高。即使是产生抑制物较少的AFEX预处理方法,酶的水解效率也会明显受到预处理抑制物的影响[41]。4)传质问题。高底物浓度酶水解往往伴随一段时间的物料高黏度特性,从而引起传质问题[42]。5)产物的反馈抑制。高底物浓度酶解产生高产物浓度(高糖浓度),从而造成对酶反应的强烈反馈抑制。Kristensen等[40]研究了限制高底物浓度酶水解糖转化率的因素,发现随着底物浓度的提高,酶在底物上的吸附减少是造成糖转化率下降的重要原因。Jin 等[43]通过同步糖化共发酵法(SSCF)将酶水解与微生物发酵在同一个反应器中同时进行,SSCF过程虽然降低了酶水解产物糖对酶反应的抑制作用,但仍然呈现糖转化率随底物浓度的提高而下降的现象。进一步研究发现,除存在预处理抑制物的抑制效应外,发酵产物乙醇的不断积累也是造成糖转化率显著下降的重要因素。因此,及时将抑制物和产物乙醇移除后,在高底物浓度下也获得了较高的糖转化率。
2.3.2 高纤维素酶用量
高纤维素酶用量导致酶使用成本居高不下是制约木质纤维素生物炼制产业化发展的另一需要解决的关键问题。据估算,木质纤维素乙醇的生产成本中,酶的成本占15.7%[44]。为此,人们在改进预处理方法[45]、酶配方[37]以及酶回收利用[46]等方面做了大量工作。最近,Sousa等[45]在AFEX预处理基础上发明了萃取氨(EA)预处理技术。该技术移除了大约45%的木质素,并将纤维素I型转变为纤维素III型,从而大大提高了酶解效率、降低了60%的酶用量。诺维信公司在其第三代纤维素酶Cellic Ctec 3中添加了多糖单加氧酶(GH61),大大提高了木质纤维素的降解效率。Jin等[46-47]利用纤维素酶在酶水解残留固体上的吸附特性,高效快速回收纤维素酶并将酶用量减少40%。近年来,合成生物学与系统生物学技术的飞速发展,也为新纤维素酶的挖掘、新纤维素降解体系的构建、分子酶机器的构建提供了技术支撑。
2.3.2.1 新纤维素酶的挖掘和纤维素降解体系的重构
自然界一些特殊环境,比如动物瘤胃、昆虫肠道以及人迹罕至的原始森林、沼泽地区等,这些环境中的微生物能快速降解木质纤维素。这些环境及微生物的多样性为新纤维素酶的挖掘提供了丰富的酶源[48-49]。由于特定环境下的微生物在长期进化中形成了高度的生存依赖关系[50],因此,群落中主要产纤维素酶菌株的纯培养相对较为困难。近年来,宏基因组、宏转录组及宏蛋白组技术的快速发展可以直接读取原始环境中微生物群落的基因组、转录组和蛋白组信息,为鉴定纤维素酶基因、研究酶表达水平、调取新纤维素酶基因、表达纯化异源蛋白、研究降解机理奠定基础[48,51]。例如,美国能源部等多家研究机构直接从白蚁肠道中提取总DNA和总RNA,建立了宏基因库,通过测序发现其中存在着多达数百种的纤维素、半纤维素水解相关的基因[52-53]。因此,组学工具的大规模应用显著增强了人们对纤维素酶的筛选和应用。另外,系统生物学和合成生物学的基因组、代谢组、流量组以及计算模拟技术也为微生物群落研究提供了丰富的工具[50]。
目前,从自然界中筛选高效降解纤维素的微生物群落,鉴定其群落结构,研究混菌发酵动力学,解析其高效降解转化的机理,进而模拟构建类似系统或者通过改造进一步强化其功能等[54-56],为建立新的纤维素降解体系提供了新思路。
2.3.2.2 分子酶机器的构建
自然界中的生物质降解过程是多种木质纤维素酶系协同作用完成的[57]。不同种类的酶、不同的酶组分之间在降解木质纤维素过程中具有协同作用,即复合酶组分的降解效率会明显高于单个酶解效率的总和。因此,控制酶系中酶的组成、比例和活力,增强协同作用,是提高酶解效率的有效手段[57-58]。纤维小体(cellulosome)是一种能高效降解结晶纤维素和非结晶纤维素的天然多酶复合体,活力是里氏木霉纤维素酶活力的50倍[58]。目前在多种细菌和真菌中均发现了纤维小体。纤维小体的主体结构是支架蛋白(scaffoldin),纤维素酶通过锚定域特异性地与支架蛋白上的黏附域结合。随着测序及蛋白解析技术的发展,基因组测序和脚手架蛋白、纤维小体组分序列信息的披露使得人工设计纤维小体成为可能[57,59]。目前已经有多种设计型的纤维小体实现了体外构建。纤维小体各种配比的纤维素酶组分也可以被有效组装到骨架蛋白上。构建的设计型纤维小体的总纤维素酶活优于单组分纤维素酶[59-62]。目前,设计型纤维小体的体内组装研究进展相对缓慢,嵌合型纤维小体还无法高效地异源表达。随着合成生物学与系统生物学在微生物蛋白分泌表达研究上的深入,这一问题最终将会获得突破[58,63]。
3 木质纤维素发酵
3.1 酶解发酵工艺
木质纤维素转化为燃料乙醇或其他生物基产品主要步骤有:预处理、酶水解、发酵以及纤维素酶和半纤维素酶的发酵生产(图1)。将酶解发酵各个步骤分开在独立的反应器中进行,为分步酶解发酵工艺(SHF);将酶水解和发酵整合在同一个反应器进行,为同步酶解发酵工艺或同步糖化发酵工艺(SSF);葡萄糖和木糖共发酵情况则被称为同步糖化共发酵(SSCF)。发酵产酶、酶解和发酵3个涉及生物反应的步骤全整合在一个反应器中进行,为统合生物加工(CBP)(图2)[64]。SSF和SSCF将酶解产物糖及时消耗移除,降低了糖对酶的反馈抑制,同时也减少了染菌机会。由于微生物菌株的生长温度与酶解的最佳温度(50 ℃)不同,导致SSF/SSCF一般在30~35 ℃下进行,酶解效率受限[65]。CBP的研究主要集中在酵母体系和梭菌体系。在酵母中表达纤维素酶,或者改造梭菌(如Clostridiumthermocellum)使其既能高效降解木质纤维素,同时还能高效生产乙醇[66]。由于CBP消除了外加酶的需求,同时结合了SSCF的优势,其成本大大降低,被誉为生产木质纤维素乙醇的终极技术。但由于CBP体系过于复杂,目前还没有菌株能达到CBP工业化的要求。
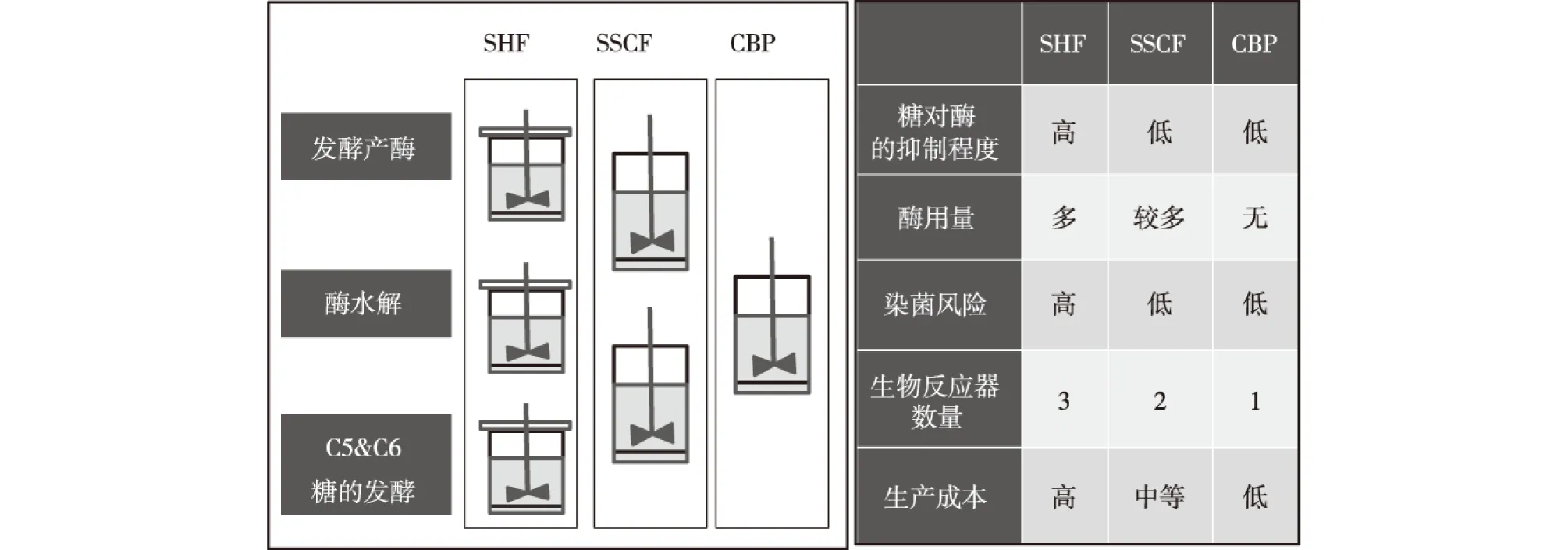
图2 不同酶解发酵工艺的对比Fig.2 Comparison of different processes for enzymatic hydrolysis and fermentation
3.2 木质纤维素水解液发酵存在的问题
木质纤维素在酶水解后产生了主要含有葡萄糖和木糖的水解液。水解液通过微生物发酵可生产乙醇。由于传统的酿酒酵母不能利用木糖,因此,科学家们通过基因工程改造将木糖代谢途径导入酵母中,使得酿酒酵母具有发酵木糖的能力。目前所知的木糖代谢途径主要有木糖还原酶-木糖醇脱氢酶途径和木糖异构酶途径。将这两个途径导入酿酒酵母而获得成功的代表菌种有美国普度大学的Saccharomycescerevisiae424A(LNH-ST) (导入了木糖还原酶-木糖醇脱氢酶途径)[67]和荷兰代尔夫特理工大学的SaccharomycescerevisiaeRWB 218(导入了木糖异构酶途径)[68]。但即使拥有木糖代谢能力的酿酒酵母也通常先利用葡萄糖,葡萄糖利用完后再利用木糖,即糖代谢物阻遏效应(carbon catabolite repression)。酿酒酵母没有专门的木糖转运蛋白,木糖转运入酿酒酵母细胞内需要依靠葡萄糖转运体系。而葡萄糖转运蛋白对葡萄糖的亲和力要大于对木糖的亲和力,从而导致有葡萄糖存在的情况下木糖极少被转运入细胞内[69]。这也是木糖晚于葡萄糖利用的一个原因。
木质纤维素高浓度水解液中的高浓度抑制物对后期酵母发酵极为不利,特别是对木糖发酵的抑制更为明显[70]。基因工程改造后的酵母在乙醇厌氧发酵条件下,由于还原力或能量供应的不平衡,不能在木糖上生长[71-72]。在利用木质纤维素水解液发酵过程中,酵母先发酵利用葡萄糖,待葡萄糖消耗完之后才能利用木糖。因此,发酵木糖时不仅受预处理抑制物的抑制,同时还受发酵前期积累乙醇的影响,使木糖发酵速率大大下降[70]。另外,由于木糖发酵时酵母停止生长,细胞活力下降,菌体死亡,木糖利用速率会随之降低,从而导致整体发酵速率下降。为解决葡萄糖先于木糖发酵带来的问题,Jin 等[73]发明了两步法SSCF工艺:在SSCF中,先加入半纤维素酶将半纤维素水解释放出木糖,进而进行木糖发酵,随后再加入纤维素酶,水解纤维素释放出葡萄糖并进行葡萄糖发酵。SSCF工艺技术使得木糖先于葡萄糖发酵,避免了葡萄糖发酵造成的产物抑制。SSCF工艺同时利用发酵开始时的营养丰富和微氧环境,大大提升了木糖的发酵效率。
近年来,随着基因工程菌的不断改进以及预处理和发酵策略的优化,木糖的利用率及乙醇产率有了很大的提高。Demeke等[74]构建的酿酒酵母GS1.11-26在小麦秸秆和干草的水解液中发酵,乙醇的最终产率达到0.48 g/g(以混合糖计),是最大理论产率的94%。Zhu等[75]使用重组酵母SyBE005对于稀酸预处理的玉米秸秆(不去除抑制剂)进行SSCF,最终乙醇质量浓度达47.2 g/L,产率65.5%。Fujii等[76]利用重组酿酒酵母MA-R4对桉树水解液进行发酵,发酵72 h得到乙醇53.5 g/L,产率82.8%。Qureshi等[77]利用重组酿酒酵母DQ1对干酸法预处理并生物脱毒后的玉米秸秆进行SSCF,最终乙醇质量浓度达71.4 g/L,产率80.3%。Zhu等[78]对玉米秸秆进行氨水预处理,用重组酵母SyBE005进行SSCF,分批补料发酵,最终乙醇质量浓度为68.8 g/L,产率79.8%,木糖利用率89%。为了提高木糖利用率,提高木糖转运效率是有效手段之一。Gonçalves等[79]研究了己糖转运蛋白基因过表达的重组酵母菌株对木糖摄取的影响,获得的重组酵母菌株DLG-K1T7在完全合成培养基中发酵72 h,木糖利用率为85%,乙醇的最终产率为0.38 g/g。此外,利用两种不同功能的菌株共培养也显示出其独特的优势。Zhang等[80]利用可降解纤维素的重组酿酒酵母BY4743和可降解木聚糖的重组巴斯德毕赤酵母GS115共培养,进行葡萄糖/木糖共发酵,在不添加水解酶情况下,发酵预处理小麦秸秆80 h后乙醇质量浓度达32.6 g/L,达到理论产率的82.6%。Zhu等[81]通过木糖利用酿酒酵母CGMCC NO.6634和抑制物耐受酵母CGMCC No.2757共培养发酵玉米秸秆干酸预处理后的水解物(不除去抑制物),通过SSCF发酵120 h,最终乙醇质量浓度达70.2 g/L,产率89.0%。
3.3 合成生物学和系统生物学促进木质纤维素乙醇的发展
预处理过程中产生的抑制物(如糠醛、羟甲基糠醛和乙酸等)和高浓度的产物如乙醇等对微生物的发酵产生了负面影响[82],从而使以木糖为代表的戊糖发酵受到抑制。因此,实现木质纤维素的高效炼制需要使微生物既能同步高效发酵己糖和戊糖,又能提升对水解抑制物和发酵产物的耐受能力。
由于微生物在糖利用和抗逆性方面涉及基因、蛋白、调控因子和应激行为等多个层面,很难通过简单的基因工程或代谢工程改造实现微生物发酵性能的完美提升[83]。基于代谢工程的适应性进化工程可使微生物迅速获得优异表型,但是存在基因靶点不清楚、负突变干扰等问题[84-85]。多组学技术的发展为进化工程打开了全新视角,也为反向代谢工程提供了可靠的靶点[82]。另外,系统生物学和合成生物学提升了人们对于微生物生理、代谢过程的综合认识,了解了代谢途径之间相互作用及其调控网络的复杂性。利用复杂代谢网络的精确计算机模拟,可以通过改变最少的基因,来获得最优化生长或者在特定条件下生产某一产品的能力[86]。系统地整合微生物组学数据、基因表达谱、蛋白质组学以及代谢组学的全新策略,使研究者对细胞代谢的研究更加深入,从而可对菌株进行理性设计。合成生物学提供的新工具可以将广泛的遗传多样性引入到同一个微生物宿主中,再结合选育、高通量筛选技术、适应性进化,从而完成一系列遗传改造,实现优化生物过程工程的目标[87-88]。因此,合成生物学和系统生物学为构建利用木质纤维素水解液发酵高效菌株提供了系统性的技术支撑。
4 木质素的生物降解转化
木质纤维素生物炼制过程中的纤维素和半纤维素降解转化后,残留的木质素常进行燃烧产热发电。近几年来,木质素的生物转化利用也引起了领域内的普遍关注。木质素是一种复杂的酚类聚合物,其在自然界中的降解是一个缓慢的过程,基本都是由氧气参与的氧化反应[89-91]。木质素的降解过程中,一些好氧真菌和好氧细菌起着至关重要的作用[50]。可以降解木质素的真菌属于担子菌(如白腐真菌的Phanerochaetechrysosporium和褐腐真菌的Postiaplacenta,Gloeophyllumtrabeum)、子囊菌以及半知菌(如软腐真菌的Daldiniaconcentric)[89-90,50,92]。
白腐真菌可以分泌多种胞外木质素酶(如木质素过氧化物酶和锰过氧化物酶) 深度降解木质素,白腐真菌相比褐腐真菌和软腐真菌具有较强的降解木质素能力,部分白腐真菌(如Trametesversicolor) 无选择性地降解木质纤维素中的木质素、纤维素和半纤维素,有些白腐真菌先选择性地降解利用木质素,然后再降解利用纤维素和半纤维素,还有一部分白腐真菌 (如Phellinusnigrolimitatus) 只降解利用木质素[89,93]。在木质素被白腐真菌降解的过程中,木质素单体的丙酸侧链和芳香环被氧化切断,芳香环上的甲基也被脱去[92]。褐腐真菌主要降解木质纤维素中的纤维素和半纤维素,对木质素的修饰只局限于去甲基化、部分氧化及降低木质素的聚合度。褐腐真菌对木质素的这些修饰主要通过铁和氧化还原中介物进行芬顿反应[94]。一些软腐真菌,如Daldiniaconcentrica,可以深度降解木质素,但降解效率低于白腐真菌[89-90]。另外,白腐真菌不能降解愈创木基木质素[89]。
细菌中,属于放线菌的链霉菌属具有部分降解木质素的能力[89],这些细菌能分泌木质素降解酶,如胞外过氧化物酶、过氧化氢酶和苯酚氧化酶[89,95-96],将木质素降解为水溶性的可被酸沉淀的木质素片段[97],其中有Cɑ—Cβ键的切断、去甲基化和Cα的氧化[89]。其他细菌的木质素降解能力比链霉菌弱,只能通过胞内酶降解低分子量的木质素,其中以假单胞菌(Pseudomonas)降解能力最强[89,98]。另外,红球菌属(Rhodococcus)、诺卡氏菌属(Nocardia)、鞘脂菌属(Sphingobium)、芽孢杆菌属(Bacillum)、无色菌属(Achromobacter)、贪铜菌属(Cupriavidus)和平革菌属(Phanerochaete)也被发现具有降解芳香族化合物的能力[50]。
木质素降解酶(通常为胞外酶)主要包括木质素过氧化物酶、锰过氧化物酶以及漆酶[90,99]。木质素过氧化物酶和锰过氧化物酶是亚铁血红素过氧化物酶,具有高的氧化还原电势,而漆酶是含铜的氧化酶,氧化还原电势较低[99]。木质素过氧化物酶的底物特异性差,能与不同种类的木质素化合物反应。锰过氧化物酶主要氧化酚类底物,而不能与非酚类的木质素化合物反应。在没有脂肪酸存在的情况下,锰过氧化物酶也能氧化非酚类木质素化合物[100]。漆酶在没有中介物的情况下只氧化酚类化合物。在中介物 (如2,2’-azinobis (3-e t h y l b e n z t h i a z o l i n e-5-sulphonate) 和1-hydroxybenzotriazole) 存在时,漆酶也能氧化难降解的非酚类化合物[89,101]。白腐真菌的次级代谢产物藜芦基醇能加强木质素过氧化物酶的反应[102]。木质素过氧化物酶作用于木质素时,产生正离子自由基,从而引发各种各样的反应,例如Cɑ—Cβ键的切断和开环反应。锰过氧化物酶和漆酶作用于木质素时产生含苯氧基的自由基,引起诸如Cɑ—Cβ键的切断、去甲基化、烷基-苯基断裂和Cɑ氧化等反应[103]。白腐真菌能分泌木质素过氧化物酶、锰过氧化物酶以及漆酶[90]。但木质素高效降解菌P.chrysosporium却不能分泌漆酶[91]。
木质素降解菌或木质素降解酶可用于生物法去除原料中的木质素[104-105]。另外,木质素降解微生物还可用于转化木质素生产燃料和化学品[50,98,106-107]。比如,Sainsbury 等[106]改造了RhodococcusjostiiRHA1,使其能从木质素中制取香草醛。Lin 等[108]系统改造了Pseudomonasputida,使其能高效降解木质素生产生物塑料PHA。
5 展望
燃料乙醇是木质纤维素生物炼制最容易产业化的大宗产品之一。虽然目前的低油价对木质纤维素燃料乙醇的发展造成了一定的冲击,美国能源部在不久前依然宣布继续资助2007年成立的四大生物能源研究中心。2017年9月,国家发改委、国家能源局、财政部等十五部门联合印发了《关于扩大生物燃料乙醇生产和推广使用车用乙醇汽油的实施方案》,该方案为推进纤维素乙醇在2025年实现规模化生产提供了政策支撑。这些均显示了世界主要经济体对木质纤维素生物炼制的信心。我国目前年产7~9亿t农作物秸秆,其中有一半以上不能被综合利用,甚至被直接焚烧在农田里,造成了严重的环境污染。因此,木质纤维素的生物炼制对于提高生物质的综合利用,以及保护环境、保障能源安全和人类社会的可持续发展等具有重要意义。
[1] 石元春.中国生物质原料资源[J].中国工程科学,2011,13(2):16-23.
[2] ROY P,DIAS G.Prospects for pyrolysis technologies in the bioenergy sector:a review[J].Renew Sustainable Energy Rev,2017,77:59-69.
[3] LI C,ASTON J E,LACEY J A,et al.Impact of feedstock quality and variation on biochemical and thermochemical conversion[J].Renew Sustainable Energy Rev,2016,65:525-536.
[4] RICHARDSON Y,BLIN J,JULBE A.A short overview on purification and conditioning of syngas produced by biomass gasification:catalytic strategies,process intensification and new concepts[J].Prog Energy Combust Sci,2012,38:765-781.
[5] NIGAM P S,SINGH A.Production of liquid biofuels from renewable resources[J].Prog Energy Combust Sci,2011,37:52-68.
[6] LYND L R,WEIMER P J,VAN ZYL W H,et al.Microbial cellulose utilization:fundamentals and biotechnology[J].Microbiol Mol Biol Rev,2002,66:506-577.
[7] 郭孝孝,罗虎,邓立康.全球燃料乙醇行业进展[J].当代化工,2016,45(9):2244-2248.
[8] LYND L R,LIANG X,BIDDY M J,et al.Cellulosic ethanol:status and innovation[J].Curr Opin Biotechnol,2017,45:202-211.
[9] HONG K K,NIELSEN J.Metabolic engineering ofSaccharomycescerevisiae:a key cell factory platform for future biorefineries[J].Cell Mol Life Sci,2012,69:2671-2690.
[10] AGBOR V B,CICEK N,SPARLING R,et al.Biomass pretreatment:fundamentals toward application[J].Biotechnol Adv,2011,29:675-685.
[11] ALVIRA P,TOMS-PEJE,BALLESTEROS M J,et al.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:a review[J].Bioresour Technol,2010,101:4851-4861.
[12] CARA C,MOYA M,BALLESTEROS I,et al.Influence of solid loading on enzymatic hydrolysis of steam exploded or liquid hot water pretreated olive tree biomass[J].Process Biochem,2007,42:1003-1009.
[13] KARIMI K,TAHERZADEH M J.A critical review on analysis in pretreatment of lignocelluloses:degree of polymerization,adsorption/desorption,and accessibility[J].Bioresour Technol,2016,203:348-356.
[14] HAYES D J.An examination of biorefining processes,catalysts and challenges[J].Catal Today,2009,145:138-151.
[15] JÖNSSON L J,MARTN C.Pretreatment of lignocellulose:formation of inhibitory by-products and strategies for minimizing their effects[J].Bioresour Technol,2016,199:103-112.
[16] QING Q,YANG B,WYMAN C E.Xylooligomers are strong inhibitors of cellulose hydrolysis by enzymes[J].Bioresour Technol,2010,101:9624-9630.
[17] TADESSE H,LUQUE R.Advances on biomass pretreatment using ionic liquids:an overview[J].Energy Environ Sci,2011,4:3913-3929.
[18] KANG Y,BANSAL P,REALFF M J,et al.SO2-catalyzed steam explosion:the effects of different severity on digestibility,accessibility,and crystallinity of lignocellulosic biomass[J].Biotechnol Prog,2013,29:909-916.
[19] LI J,GELLERSTEDT G,TOVEN K.Steam explosion lignins; their extraction,structure and potential as feedstock for biodiesel and chemicals[J].Bioresour Technol,2009,100:2556-2561.
[20] SHEN F,SADDLER J N,LIU R,et al.Evaluation of steam pretreatment on sweet sorghum bagasse for enzymatic hydrolysis and bioethanol production[J].Carbohydr Polym,2011,86:1542-1548.
[21] CANTARELLA M,CANTARELLA L,ALBERTO GALLIFUOCO A S,et al.Effect of inhibitors released during steam-explosion treatment of poplar wood on subsequent enzymatic hydrolysis and SSF[J].Biotechnol Prog,2004,20:200-206.
[22] LI H,CHEN H.Detoxification of steam-exploded corn straw produced by an industrial-scale reactor[J].Process Biochem,2008,43:1447-1451.
[23] CHUNDAWAT S P S,VISMEH R,SHARMA L N,et al.Multifaceted characterization of cell wall decomposition products formed during ammonia fiber expansion (AFEX) and dilute acid based pretreatments[J].Bioresour Technol,2010,101:8429-8438.
[24] LAU M W,BALS B D,CHUNDAWAT S P S,et al.An integrated paradigm for cellulosic biorefineries:utilization of lignocellulosic biomass as self-sufficient feedstocks for fuel,food precursors and saccharolytic enzyme production[J].Energy Environ Sci,2012,5:7100-7110.
[25] AGBOR V B,CICEK N,SPARLING R,et al.Biomass pretreatment:fundamentals toward application[J].Biotechnol Adv,2011,29:675-685.
[26] NGUYEN T Y,CAI C M,KUMAR R,et al.Co-solvent pretreatment reduces costly enzyme requirements for high sugar and ethanol yields from lignocellulosic biomass[J].ChemSusChem,2015,8:1716-1725.
[27] NGUYEN T Y,CAI C M,OSMAN O,et al.CELF pretreatment of corn stover boosts ethanol titers and yields from high solids SSF with low enzyme loadings[J].Green Chem,2016,18:1581-1589.
[28] LI X,LUO X,LI K,et al.Effects of SPORL and dilute acid pretreatment on substrate morphology,cell physical and chemical wall structures,and subsequent enzymatic hydrolysis of lodgepole pine[J].Appl Biochem Biotechnol,2012,168:1556-1567.
[29] WANG G S,PAN X J,ZHU J Y,et al.Sulfite pretreatment to overcome recalcitrance of lignocellulose (SPORL) for robust enzymatic saccharification of hardwoods[J].Biotechnol Prog,2009,25:1086-1093.
[30] ZHANG D S,YANG Q,ZHU J Y,et al.Sulfite (SPORL) pretreatment of switchgrass for enzymatic saccharification[J].Bioresour Technol,2013,129:127-134.
[31] ZHANG L,PU Y,CORT J R,et al.Revealing the molecular structural transformation of hardwood and softwood in dilute acid flowthrough pretreatment[J].ACS Sustainable Chem Eng,2016,4:6618-6628.
[32] ALIZADEH H,TEYMOURI F,GILBERT T I,et al.Pretreatment of switchgrass by ammonia fiber explosion (AFEX)[J].Appl Biochem Biotechnol,2005,121:1133-1141.
[33] BIAN H,CHEN L,GLEISNER R,et al.Producing wood-based nanomaterials by rapid fractionation of wood at 80 ℃ using a recyclable acid hydrotrope[J].Green Chem,2017,19:3370-3379.
[34] CHEN L,DOU J,MA Q,LI N,et al.Rapid and near-complete dissolution of wood lignin at≤ 80 ℃ by a recyclable acid hydrotrope[J].Sci Adv,2017,3(9):e1701735.
[35] TAHERZADEH M J,KARIMI K.Enzyme-based hydrolysis processes for ethanol from lignocellulosic materials:a review[J].BioResources,2007,2:707-738.
[36] KHARE S K,PANDEY A,LARROCHE C.Current perspectives in enzymatic saccharification of lignocellulosic biomass[J].Biochem Eng J,2015,102:38-44.
[37] GAO D,CHUNDAWAT S P S,KRISHNAN C,et al.Mixture optimization of six core glycosyl hydrolases for maximizing saccharification of ammonia fiber expansion (AFEX) pretreated corn stover[J].Bioresour Technol,2010,101:2770-2781.
[38] LI X,ZHENG Y.Lignin-enzyme interaction:mechanism,mitigation approach,modeling,and research prospects[J].Biotechnol Adv,2017,35:466-489.
[39] OLIVA-TARAVILLA A,TOMAS-PEJO E,DEMUEZ M,et al.Phenols and lignin:key players in reducing enzymatic hydrolysis yields of steam-pretreated biomass in presence of laccase[J].J Biotechnol,2016,218:94-101.
[40] KRISTENSEN J B,FELBY C,JØRGENSEN H.Yield-determining factors in high-solids enzymatic hydrolysis of lignocellulose[J].Biotechnol Biofuels,2009,2:11.
[41] HUMPULA J F,UPPUGUNDLA N,VISMEH R,et al.Probing the nature of AFEX-pretreated corn stover derived decomposition products that inhibit cellulase activity[J].Bioresour Technol,2014,152:38-45.
[42] HODGE D B,KARIM M N,SCHELL D J,et al.Soluble and insoluble solids contributions to high-solids enzymatic hydrolysis of lignocellulose[J].Bioresour Technol,2008,99:8940-8948.
[43] JIN M,SARKS C,BALS B D,et al.Toward high solids loading process for lignocellulosic biofuel production at a low cost[J].Biotechnol Bioeng,2017,114:980-989.
[44] HUMBIRD D,DAVIS R,TAO L,et al.Process design and economics for biochemical conversion of lignocellulosic biomass to ethanol:dilute-acid pretreatment and enzymatic hydrolysis of corn stover [R/OL].[2017-08-22].https://www.nrel.gov/docs/fy11osti/47764.pdf.
[45] SOUSA L D C,JIN M,CHUNDAWAT S P S,et al.Next-generation ammonia pretreatment enhances cellulosic biofuel production[J].Energy Environ Sci,2016,9:1215-1223.
[46] JIN M,GUNAWAN C,UPPUGUNDLA N,et al.A novel integrated biological process for cellulosic ethanol production featuring high ethanol productivity,enzyme recycling,and yeast cells reuse[J].Energy Environ Sci,2012,5:7168-7175.
[47] JIN M,SOUSA L D C,SCHWARTZ C,et al.Toward lower cost cellulosic biofuel production using ammonia based pretreatment technologies[J].Green Chem,2016,18:957-966.
[48] LIU G,QIN Y,LI Z,et al.Development of highly efficient,low-cost lignocellulolytic enzyme systems in the post-genomic era[J].Biotechnol Adv,2013,31:962-975.
[49] MEWIS K,TAUPP M,HALLAM S J.A high throughput screen for biomining cellulase activity from metagenomic libraries[J].J Vis Exp,2011(48):489-495.
[50] XIE S,SYRENNE R,SUN S,et al.Exploration of natural biomass utilization systems (NBUS) for advanced biofuel:from systems biology to synthetic design[J].Curr Opin Biotechnol,2014,27:195-203.
[51] ILMBERGER N,STREIT W R.Screening for cellulase encoding clones in metagenomic libraries[J].Methods Mol Biol,2017,1539:205-217.
[52] NIMCHUA T,THONGARAM T,UENGWETWANIT T,et al.Metagenomic analysis of novel lignocellulose-degrading enzymes from higher termite guts inhabiting microbes[J].J Microbiol Biotechnol,2012,22:462-469.
[53] RASHAMUSE K,TENDAI W S,MATHIBA K,et al.Metagenomic mining of glycoside hydrolases from the hindgut bacterial symbionts of a termite (Trinervitermestrinervoides) and the characterization of a multimodular beta-1,4-xylanase(GH11)[J].Biotechnol Appl Biochem,2017,64:174-186.
[54] WANG C,DONG D,WANG H,MUELLER K,et al.Metagenomic analysis of microbial consortia enriched from compost:new insights into the role ofActinobacteriain lignocellulose decomposition[J].Biotechnol Biofuels,2016,9:22.
[55] ZHU N,YANG J,JI L,et al.Metagenomic and metaproteomic analyses of a corn stover-adapted microbial consortium EMSD5 reveal its taxonomic and enzymatic basis for degrading lignocellulose[J].Biotechnol Biofuels,2016,9:243.
[56] LIANG J,LIN Y,LI T,et al.Microbial consortium OEM1 cultivation for higher lignocellulose degradation and chlorophenol removal[J].RSC Adv,2017,7:39011-39017.
[57] STERN J,KAHN A,VAZANA Y,et al.Significance of relative position of cellulases in designer cellulosomes for optimized cellulolysis[J].PloS ONE,2015,10(5):e0127326.
[58] BAYER E A.Cellulosomes and designer cellulosomes:why toy with Nature?[J].Environ Microbiol Rep,2017,9(1):14-15.
[59] VAZANA Y,MORAÏS S,BARAK Y,et al.Designer cellulosomes for enhanced hydrolysis of cellulosic substrates[J].Methods Enzymol,2012,510:429-452.
[60] HENDRIX J,FRIED D,BARAK Y,et al.Conformational dynamics in designer cellulosomes studied by single-pair fret with Mfd-pie[J].Biophys J,2013,104:19a.
[61] MORAIS S,MORAG E,BARAK Y,et al.Deconstruction of lignocellulose into soluble sugars by native and designer cellulosomes[J].MBio,2012,3(6):214104.
[62] ARFI Y,SHAMSHOUM M,ROGACHEV I,et al.Integration of bacterial lytic polysaccharide monooxygenases into designer cellulosomes promotes enhanced cellulose degradation[J].Proc Natl Acad Sci USA,2014,111:9109-9114.
[63] TANAKA T,KONDO A.Cell-surface display of enzymes by the yeastSaccharomycescerevisiaefor synthetic biology[J].FEMS Yeast Res,2015,15(1):1-9.
[64] LYND L R.Overview and evaluation of fuel ethanol from cellulosic biomass:technology,economics,the environment,and policy[J].Annu Rev Energy Environ,1996,21:403-465.
[65] JIN M,SARKS C,GUNAWAN C,et al.Phenotypic selection of a wildSaccharomycescerevisiaestrain for simultaneous saccharification and co-fermentation of AFEX (TM) pretreated corn stover[J].Biotechnol Biofuels,2013,6:108.
[66] OLSON D G,MCBRIDE J E,JOE SHAW A,et al.Recent progress in consolidated bioprocessing[J].Curr Opin Biotechnol,2012,23:396-405.
[67] SEDLAK M,HO N W Y.Production of ethanol from cellulosic biomass hydrolysates using genetically engineeredSaccharomycesyeast capable of cofermenting glucose and xylose[J].Appl Biochem Biotechnol,2004,113:403-416.
[68] KUYPER M,TOIRKENS M J,DIDERICH J A,et al.Evolutionary engineering of mixed sugar utilization by a xylose fermentingSaccharomycescerevisiaestrain[J].FEMS Yeast Res,2005,5(10):925-934.
[69] BERTILSSON M,ANDERSSON J,LIDEN G.Modeling simultaneous glucose and xylose uptake inSaccharomycescerevisiaefrom kinetics and gene expression of sugar transporters[J].Bioprocess Biosyst Eng,2008,31:369-377.
[70] JIN M,BALAN V,GUNAWAN C,et al.Quantitatively understanding reduced xylose fermentation performance in AFEX TM treated corn stover hydrolysate usingSaccharomycescerevisiae424A (LNH-ST) andEscherichiacoliKO11[J].Bioresour Technol,2012,111:294-300.
[71] KUYPER M,WINKLER A A,DIJKEN J P,et al.Minimal metabolic engineering ofSaccharomycescerevisiaefor efficient anaerobic xylose fermentation:a proof of principle[J].FEMS Yeast Res,2004,4(6):655-664.
[72] KUYPER M,HARTOG M M P,TOIRKENS M J,et al.Metabolic engineering of a xylose-isomerase-expressingSaccharomycescerevisiaestrain for rapid anaerobic xylose fermentation[J].FEMS Yeast Res,2005,5(4/5):399-409.
[73] JIN M,LAU M W,BALAN V,et al.Two-step SSCF to convert AFEX-treated switchgrass to ethanol using commercial enzymes andSaccharomycescerevisiae424A(LNH-ST)[J].Bioresour Technol,2010,101:8171-8178.
[74] DEMEKE M M,DIETZ H,LI Y,et al.Development of a D-xylose fermenting and inhibitor tolerant industrialSaccharomycescerevisiaestrain with high performance in lignocellulose hydrolysates using metabolic and evolutionary engineering[J].Biotechnol Biofuels,2013,6:89.
[75] ZHU J Q,QIN L,LI W C,et al.Simultaneous saccharification and co-fermentation of dry diluted acid pretreated corn stover at high dry matter loading:overcoming the inhibitors by non-tolerant yeast[J].Bioresour Technol,2015,198:39-46.
[76] FUJII T,MURAKAMI K,ENDO T,et al.Bench-scale bioethanol production from eucalyptus by high solid saccharification and glucose/xylose fermentation method[J].Bioprocess Biosyst Eng,2014,37:749-754.
[77] QURESHI A S,ZHANG J,BAO J.High ethanol fermentation performance of the dry dilute acid pretreated corn stover by an evolutionarily adaptedSaccharomycescerevisiaestrain[J].Bioresour Technol,2015,189:399-404.
[78] ZHU J Q,QIN L,LI B Z,et al.Simultaneous saccharification and co-fermentation of aqueous ammonia pretreated corn stover with an engineeredSaccharomycescerevisiaeSyBE005[J].Bioresour Technol,2014,169:9-18.
[79] GONCALVES D L,MATSUSHIKA A,BELISA B,et al.Xylose and xylose/glucose co-fermentation by recombinantSaccharomycescerevisiaestrains expressing individual hexose transporters[J].Enzyme Microb Technol,2014,63:13-20.
[80] ZHANG Y,WANG C,WANG L,et al.Direct bioethanol production from wheat straw using xylose/glucose co-fermentation by co-culture of two recombinant yeasts[J].J Ind Microbiol Biotechnol,2017,44:453-464.
[81] ZHU J Q,LI X,QIN L,et al.In situ detoxification of dry dilute acid pretreated corn stover by co-culture of xylose-utilizing and inhibitor-tolerantSaccharomycescerevisiaeincreases ethanol production[J].Bioresour Technol,2016,218:380-387.
[82] DOS SANTOS S C,SA-CORREIA I.Yeast toxicogenomics:lessons from a eukaryotic cell model and cell factory[J].Curr Opin Biotechnol,2015,33:183-191.
[83] FU Y,CHEN L,ZHANG W.Regulatory mechanisms related to biofuel tolerance in producing microbes[J].J Appl Microbiol,2016,121:320-332.
[84] DRAGOSITS M,MATTANOVICH D.Adaptive laboratory evolution:principles and applications for biotechnology[J].Microb Cell Fact,2013,12(1):64.
[85] FARWICK A,BRUDER S,SCHADEWEG V,et al.Engineering of yeast hexose transporters to transport D-xylose without inhibition by D-glucose[J].Proc Natl Acad Sci USA,2014,111(14):5159-5164.
[86] KING Z A,LLOYD C J,FEIST A M,et al.Next-generation genome-scale models for metabolic engineering[J].Curr Opin Biotechnol,2015,35:23-29.
[87] BASSALO M C,LIU R,GILL R T.Directed evolution and synthetic biology applications to microbial systems[J].Curr Opin Biotechnol,2016,39:126-133.
[88] GHIM C M,KIM T,MITCHELL R J,et al.Synthetic biology for biofuels:building designer microbes from the scratch[J].Biotechnol Bioprocess Eng,2010,15:11-21.
[89] ERIKSSON K E L,BLANCHETTE R A,ANDER P.Biodegradation of lignin[M]// Microbial and enzymatic degradation of wood and wood components.Springer Series in Wood Science.Berlin:Springer-Verlag,1990.
[90] REID I D.Biodegradation of lignin[J].Can J Bot,1995,73:1011-1018.
[91] KIRK T K,FARRELL R L.Enzymatic "combustion":the microbial degradation of lignin[J].Annu Rev Microbiol,1987,41(1):465-505.
[92] GEIB S M,FILLEY T R,HATCHER P G,et al.Lignin degradation in wood-feeding insects[J].Proc Natl Acad Sci USA,2008,105:12932-12937.
[93] BLANCHETTE R A.Degradation of the lignocellulose complex in wood[J].Can J Bot,1995,73:999-1010.
[94] WONG D W.Structure and action mechanism of ligninolytic enzymes[J].Appl Biochem Biotechnol,2009,157:174-209.
[95] GODDEN B,BALL A S,HELVENSTEIN P,et al.Towards elucidation of the lignin degradation pathway in actinomycetes[J].J Gen Microbiol,1992,138:2441-2448.
[96] ZIMMERMAN W,UMEZAWA T,BRODA P,et al.Degradation of a non-phenolic arylglycerolβ-aryl ether byStreptomycescyaneus[J].FEBS Lett,1988,239:5-7.
[97] SUTHERLAND J B,CRAWFORD D L,POMETTO III A L.Metabolism of cinnamic,p-coumaric,and ferulic acids byStreptomycessetonii[J].Can J Microbiol,1983,29:1253-1257.
[98] NIKEL P I,MARTíNEZ-GARCA E,DE LORENZO V.Biotechnological domestication of pseudomonads using synthetic biology[J].Nat Rev Microbiol,2014,12:368-379.
[100] KIRK T K,CULLEN D.Enzymology and molecular genetics of wood degradation by white-rot fungi[M]//YOUNG R A,AKHTAR M.Environmentally friendly technologies for the pulp and paper industry.New York:John Wiley & Sons,Inc.,1998:273-307.
[101] BOURBONNAIS R,PAICE M G.Oxidation of non-phenolic substrates:an expanded role for laccase in lignin biodegradation[J].FEBS Lett,1990,267:99-102.
[102] HAMMEL K E,JENSEN K,MOZUCH M D,et al.Ligninolysis by a purified lignin peroxidase[J].J Biol Chem,1993,268:12274-12281.
[103] TUOR U,WARIISHI H,SCHOEMAKER H E,et al.Oxidation of phenolic arylglycerolβ-aryl ether lignin model compounds by manganese peroxidase fromPhanerochaetechrysosporium:oxidative cleavage of anα-carbonyl model compound[J].Biochemistry,1992,31:4986-4995.
[104] WANG F Q,XIE H,CHEN W,et al.Biological pretreatment of corn stover with ligninolytic enzyme for high efficient enzymatic hydrolysis[J].Bioresour Technol,2013,144:572-578.
[105] SONG L,MA F,ZENG Y,et al.The promoting effects of manganese on biological pretreatment withIrpexlacteusand enzymatic hydrolysis of corn stover[J].Bioresour Technol,2013,135:9-92.
[106] SAINSBURY P D,HARDIMAN E M,AHMAD M,et al.Breaking down lignin to high-value chemicals:the conversion of lignocellulose to vanillin in a gene deletion mutant ofRhodococcusjostiiRHA1[J].ACS Chem Biol,2013,8:2151-2156.
[107] POBLETE-CASTRO I,BECKER J,DOHNT K,et al.Industrial biotechnology ofPseudomonasputidaand related species[J].Appl Microbol Biotechnol,2012,93:2279-2290.
[108] LIN L,CHENG Y B,PU Y Q,et al.Systems biology-guided biodesign of consolidated lignin conversion[J].Green Chem,2016,18:5536-5547.
(责任编辑 荀志金)
Researchprogressinbiorefineryoflignocellulosicbiomass
LIN Hailong
(SDIC Biotechnology Investment Co. Ltd.,Beijing 100034,China)
Lignocellulose is an abundant and renewable biomass that is mainly composed of cellulose,hemicellulose and lignin.The utilization of lignocellulosic biomass has attracted worldwide attention.This article reviews the biochemical route of lignocellulosic biomass refinery for bioproducts production (using bio-ethanol as an example) and the remaining challenges.This article also discussed the bioconversion of lignin,which is economically critical for a biorefinery.The application of synthetic biology technologies in biorefinery field is also reviewed aiming to give insights into aspects of biorefinery research and provide suggestions for future research.
lignocellulosic biomass; fuel ethanol; biorefinery; lignin biodegradation
10.3969/j.issn.1672-3678.2017.06.007
2017-08-23
林海龙(1976—),男,福建福州人,博士,高级工程师,研究方向:燃料乙醇,E-mail:linhailong@sdic.com.cn
TQ9;X71
A
1672-3678(2017)06-0044-11
