miR-199a-3p对Eca109和KYSE450细胞周期和迁移的影响*
2017-12-06刘襄艳侯桂琴张幸丽师莹莹鲁照明
刘襄艳,侯桂琴,高 盼,凡 丞,张幸丽,师莹莹,鲁照明
miR-199a-3p对Eca109和KYSE450细胞周期和迁移的影响*
刘襄艳,侯桂琴,高 盼,凡 丞,张幸丽,师莹莹,鲁照明#
miR-199a-3p;食管鳞癌;细胞周期;细胞迁移;Eca109;KYSE450
目的:观察miR-199a-3p对食管鳞癌细胞周期及迁移能力的影响,并探讨其分子机制。方法常规培养Eca109和KYSE450细胞,分别转染miR-199a-3p mimics及miR-199a-3p mimics negative control(阴性对照)。采用qRT-PCR法检测3组细胞中miR-199a-3p的表达水平,并用流式细胞术及划痕实验分别检测细胞周期及细胞迁移能力,用Western blot检测细胞中mTORC2信号通路相关蛋白[mTOR、Rictor、PI3K、p-Akt(T308)、p-Akt(S473)]的表达。结果与阴性对照相比,转染miR-199a-3p mimics后,Eca109和KYSE450细胞中miR-199a-3p表达量增加; G1期细胞增多,细胞相对迁移率降低,mTOR和Rictor蛋白的表达水平降低,而PI3K、p-Akt(T308)和p-Akt(S473)蛋白的表达水平升高(P均<0.05)。结论miR-199a-3p可能通过调控mTORC2信号通路来影响食管鳞癌细胞周期进程及细胞迁移。
microRNA是一类长度约为22 nt的非编码RNA(ncRNA),其分布广泛且功能几乎涉及与肿瘤相关的所有过程,包括增殖、分化、凋亡、转移、血管生成、 免疫应答等[1]。microRNA的作用机制较为单一,其通过完全或部分互补的原则结合到靶基因mRNA 3’端非翻译区,以降解或抑制mRNA翻译的方式调控靶基因的表达。microRNA-199a-3p(miR-199a-3p)是众多microRNA中的一种,已有研究[2-4]观察了其在肝癌、卵巢癌、骨肉瘤中的作用,但其在食管癌中的研究很少。mTOR是雷帕霉素的靶分子,是一种丝氨酸/苏氨酸激酶,根据与其结合的物质不同,在体内主要以两种复合物的形式存在,即mTORC1和mTORC2。mTOR与Raptor等蛋白构成mTORC1,与Rictor等蛋白构成mTORC2,不同形式的mTOR产生的生理作用不同[5]。有报道[2]显示,miR-199a-3p对mTOR具有靶向调控作用,但具体调控机制仍不清楚。因此,该研究拟以食管鳞癌细胞为研究对象,探讨miR-199a-3p对食管鳞癌细胞周期和迁移能力的影响,并探讨其对mTORC2信号通路的影响,为进一步探讨miR-199a-3p在食管鳞癌发生中的作用提供实验基础。
1 材料与方法
1.1细胞株与主要试剂Eca109细胞购自中国科学院上海生物所细胞库,KYSE450细胞由中国医学科学院肿瘤医院惠赠。RPMI 1640培养基和胎牛血清购自以色列BI公司,细胞周期检测试剂盒购自北京索莱宝科技有限公司,抗体PI3K(#13666)、p-Akt(S473)(#4060)、p-Akt(T308)(#13038)、mTOR(#2983)、Rictor(#2114)及GAPDH(#5174)均购自美国CST公司,RNA反转录试剂盒及qRT-PCR试剂盒均购自大连宝生物工程有限公司,转染试剂siRNA-MateTM购自上海吉玛制药技术有限公司,miR-199a-3p mimics序列、miR-199a-3p mimics negative control序列以及U6内参引物序列也由大连宝生物工程有限公司设计合成。
1.2细胞培养及转染Eca109和KYSE450细胞加入含体积分数10%胎牛血清、100 U/mL青霉素和0.1 g/L链霉素的RPMI 1640培养液,置于37 ℃、体积分数5%CO2培养箱中培养。将处于对数生长期的Eca109和KYSE450细胞分别接种于6孔板(5×105个/孔),待细胞汇合度达到30%~50%时,按照siRNA-MateTM说明书转染miR-199a-3p mimics或miR-199a-3p mimics negative control(阴性对照),并于转染6 h后在荧光显微镜下观察转染效率,同时以未转染细胞作为空白对照。
1.3qRT-PCR分别提取转染miR-199a-3p mimics、miR-199a-3p mimics negative control 48 h及未转染细胞总RNA,反转录成cDNA。miR-199a-3p引物序列为上游5’-GCCGAACAGTAGTCTGCACAT-3’,下游5’-TATGGTTTTGACGACTGTGTGAT-3’;U6引物序列为上游5’-CTCGCTTCGGCAGCACA-3’,下游5’-AACGCTTCACGAATTTGCGT-3’。qRT-PCR反应体系为20 μL,其中SYBR®Premix Ex Taq®(TliRNaseH Plus)10 μL,上、下游引物各0.8 μL,cDNA模板2 μL,dH2O 6.4 μL。扩增条件:95 ℃预变性30 s;95 ℃ 5 s,62 ℃ 30 s,40个循环。按2-ΔΔCt计算miR-199a-3p的相对表达量。实验重复3次。
1.4细胞周期检测收集转染miR-199a-3p mimics及miR-199a-3p mimics negative control 48 h的Eca109和KYSE450细胞,用PBS洗2遍后加入体积分数70%预冷乙醇固定,混匀后4 ℃保存至少24 h。测定前1 000 r/min离心5 min以除去固定液,用PBS洗3遍后重悬细胞并加入适量RNaseA,37 ℃水浴30 min,之后加入适量的PI染液,混匀,4 ℃避光30 min。最后用流式细胞仪检测G1期、S期、G2期细胞比例。实验重复3次。
1.5划痕实验收集转染miR-199a-3p mimics及miR-199a-3p mimics negative control 24 h的Eca109和KYSE450细胞,分别用10 μL的枪头垂直划痕;弃去培养基,并用PBS洗3遍,之后加入无血清培养基,分别于0、24 h置于倒置显微镜下拍照,并记录划痕宽度。应用Image J图像处理软件对划痕宽度进行分析,以阴性对照组作为标准控制组,计算相对迁移率。迁移距离=0 h宽度-24 h宽度;相对迁移率(%)=迁移距离/阴性对照组平均迁移距离×100%。实验重复3次。
1.6Westernblot收集转染miR-199a-3p mimics及miR-199a-3p mimics negative control 48 h及未转染细胞的Eca109和KYSE450细胞并分别提取总蛋白,Western blot检测mTORC2信号通路相关蛋白表达水平。蛋白上样量为20 μg。mTOR、Rictor、 PI3K、p-Akt(T308)、p-Akt(S473)和GAPDH一抗的稀释比例均为11 000,二抗的稀释比例均为110 000。电泳后用湿转仪将蛋白转移到NC膜上,转膜条件为300 mA,2 h;将NC膜用50 g/L脱脂牛奶封闭,置于摇床上轻摇2 h;加一抗4 ℃过夜;PBS洗3遍,加入二抗置于摇床上轻摇2 h;PBS洗3遍后将ECL发光液加在NC膜上,于暗室进行曝光。实验结果采用Image J图像处理软件进行灰度分析。以目的蛋白与GAPDH灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.7统计学处理用SPSS 21.0进行统计学处理。采用单因素方差分析比较未转染组、阴性对照组及转染miR-199a-3p mimics组食管癌细胞miR-199a-3p的相对表达量及mTORC2信号通路相关蛋白表达的差异,两两比较采用SNK-q检验;采用两独立样本的t检验比较阴性对照组及转染miR-199a-3p mimics组食管癌细胞周期分布和相对迁移率的差异,检验水准α=0.05。
2 结果
2.1转染miR-199a-3pmimics对食管鳞癌细胞中miR-199a-3p表达的影响Eca109和KYSE450细胞在转染miR-199a-3p mimics及其阴性对照6 h后,在荧光显微镜下均可看到较强的绿色荧光;转染48 h后qRT-PCR检测结果显示,与其他2组相比,转染miR-199a-3p mimics组中miR-199a-3p的表达升高,而阴性对照组则没有明显变化,见表1。
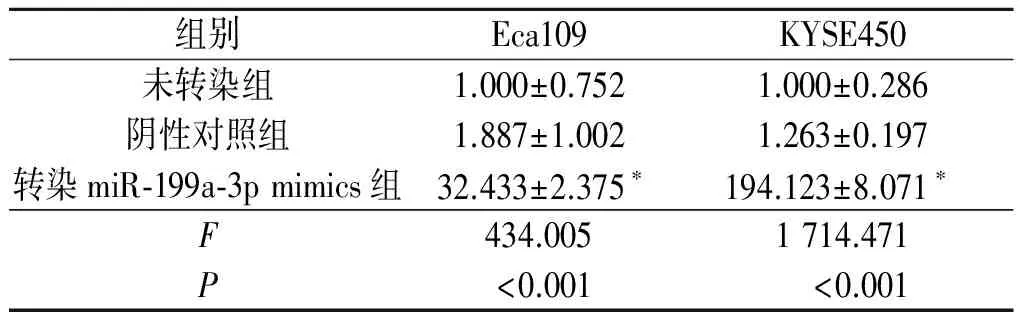
表1 各组细胞中miR-199a-3p的相对表达量(n=3)
*:与其他2组比较,P<0.001。
2.2转染miR-199a-3pmimics对食管鳞癌细胞周期的影响流式细胞术检测结果显示,与阴性对照组相比,转染miR-199a-3p mimics 的Eca109和KYSE450细胞中G1期细胞比例升高,S期细胞比例降低,见表2、3。
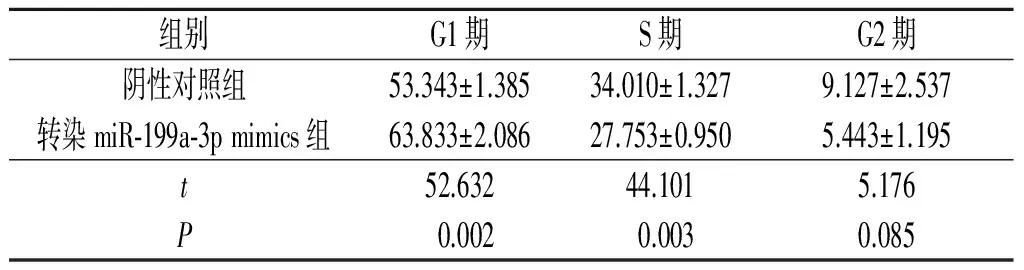
表2 Eca109不同分组细胞周期分布情况(n=3) %
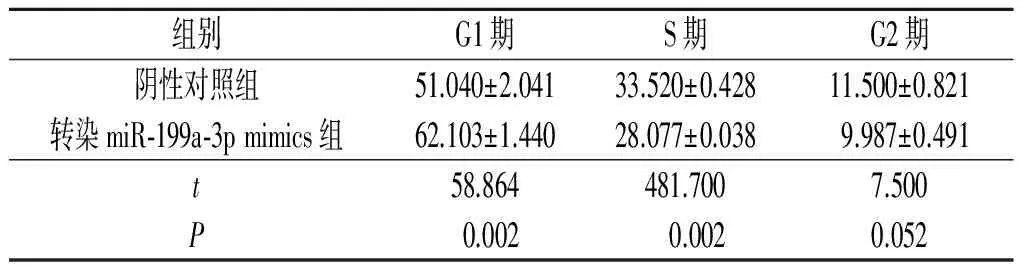
表3 KYSE450不同分组细胞周期分布情况(n=3) %
2.3转染miR-199a-3pmimics对食管鳞癌细胞迁移能力的影响Eca109和KYSE450细胞中转染miR-199a-3p mimics的细胞相对迁移率低于阴性对照组,见表4。
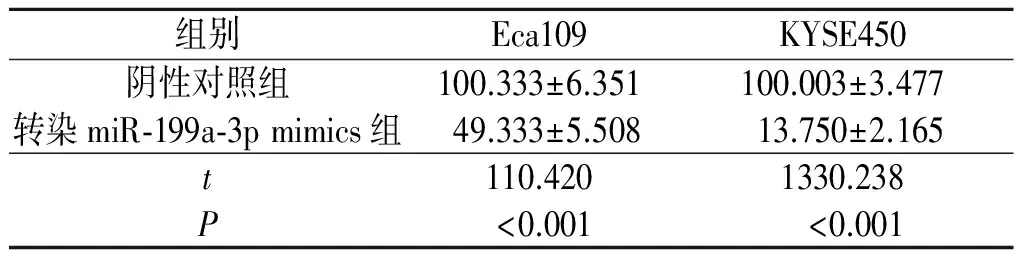
表4 各组细胞的相对迁移率(n=3) %
2.4转染miR-199a-3pmimics对食管鳞癌细胞mTORC2信号通路相关蛋白表达的影响Western blot结果证实,与未转染组及阴性对照组相比,转染miR-199a-3p mimics的Eca109和KYSE450细胞中mTOR和Rictor蛋白的表达水平降低,而p-Akt(T308)、p-Akt(S473)和PI3K的表达水平升高(图1,表5、6)。
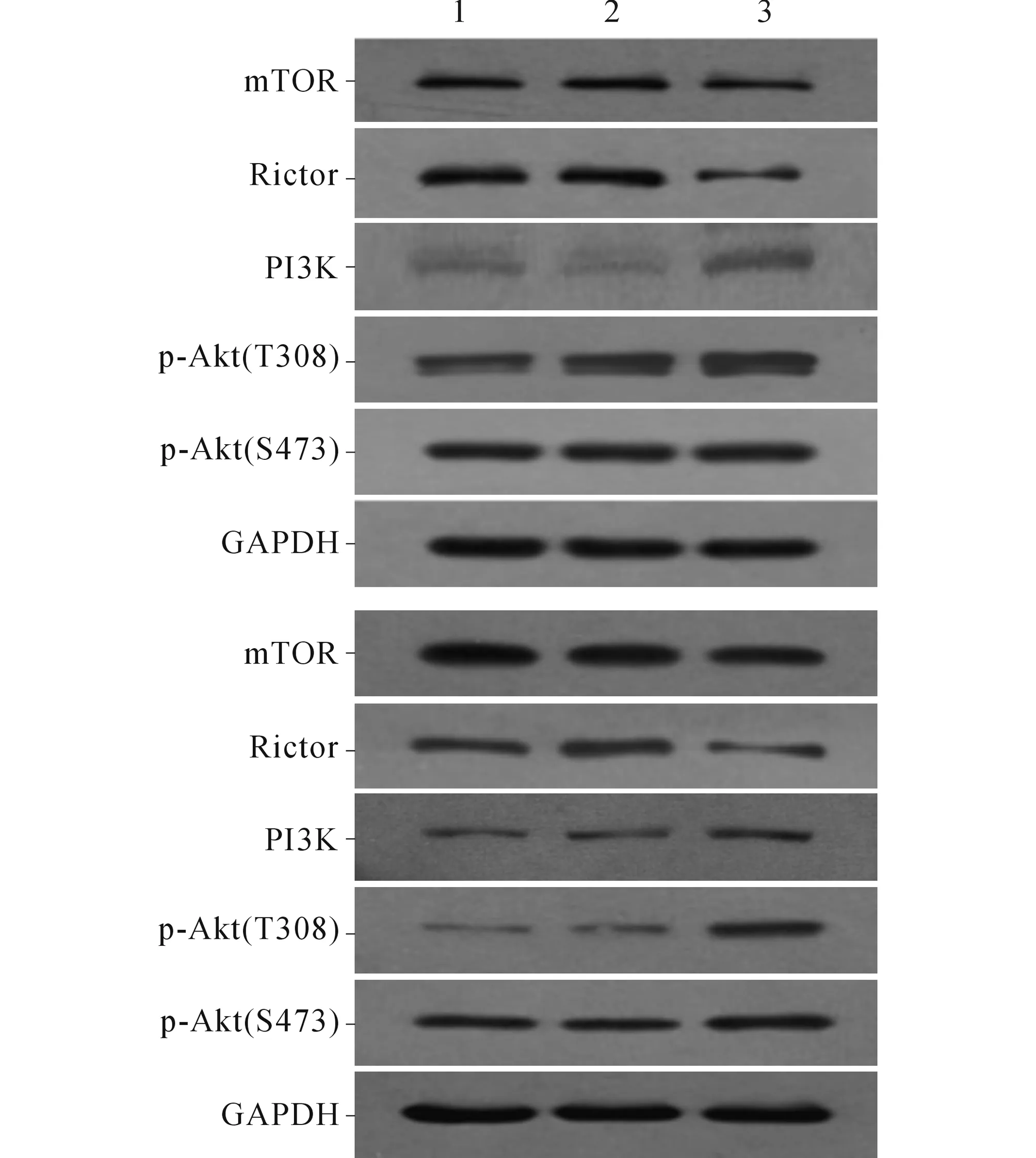
上图:Eca109;下图:KYSE450。图1 miR-199a-3p mimics转染对Eca109和KYSE450细胞mTORC2信号通路相关蛋白表达的影响

组别mTORRictorp⁃Akt(S473)PI3Kp⁃Akt(T308)未转染组0.763±0.0120.923±0.0490.807±0.0290.673±0.0740.620±0.160阴性对照组0.783±0.0210.927±0.1000.850±0.0440.693±0.0960.850±0.137转染miR⁃199a⁃3pmimics组0.613±0.025∗0.390±0.072∗1.067±0.076∗1.103±0.083∗1.147±0.110∗F64.75048.60620.62624.54211.098P<0.001<0.0010.0020.0010.010
*:与其他2组比较,P<0.01。
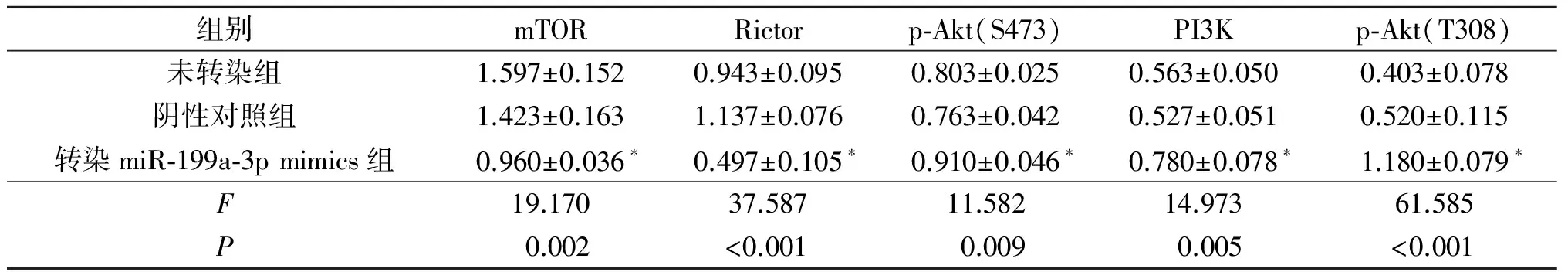
表6 KYSE450各组细胞中相关蛋白表达的比较(n=3)
*:与其他2组比较,P<0.05。
3 讨论
研究[6-7]发现,在哺乳动物基因组中,只有不到2%的转录产物具有蛋白编码功能,其余98%均为ncRNA,其中microRNA是由较长的初级转录物经过一系列核酸酶剪切加工而得到的长度较短的一类ncRNA。近几年的功能学研究[8]表明,microRNA既可以作为促癌基因参与肿瘤的发生和发展,也可作为抑癌基因控制恶性肿瘤的形成。Wang等[9]研究发现miR-199a-3p可以调节体细胞的细胞重构,其过表达可以通过阻滞细胞周期来抑制细胞的增殖。此外,肝癌中miR-199a-3p不仅可以影响细胞周期进程,而且可以调节细胞的侵袭能力[2]。作者的研究结果也证实,在两种食管鳞癌细胞中miR-199a-3p过表达均可影响食管鳞癌细胞的周期进程,并将细胞阻滞于G1期,同时对细胞迁移也有明显的抑制作用。
研究[10]发现,与肿瘤发生密切相关的多种生理过程如细胞生长增殖、细胞周期调控、细胞迁移等都受到mTOR信号通路的调控,许多肿瘤都伴有mTOR信号通路的异常。其中mTORC2信号通路可以有效调节细胞的迁移能力[11-12]。Fornari等[2]在肝癌中证实miR-199a-3p对mTOR具有靶向调节作用,但其对mTORC2信号通路具体的调节作用还不清楚。该研究结果证实,miR-199a-3p能抑制mTORC2信号通路中mTOR和Rictor蛋白的表达,因此在食管鳞癌中miR-199a-3p或许可以通过调节mTORC2信号通路进而影响食管鳞癌细胞周期进程及细胞迁移能力。但是在实验中还发现,miR-199a-3p促进了PI3K、p-Akt(S473)和p-Akt(T308)蛋白的表达,这可能因为miR-199a-3p在对mTORC2调控的同时使PI3K-Akt信号通路负反馈激活,而Akt的激活会促进癌细胞的存活、增殖和生长,这一点与mTOR抑制剂对Akt产生的负反馈作用类似,也因此可能导致癌细胞对mTOR抑制剂产生耐药性,这也是mTOR抑制剂用于临床治疗肿瘤时出现的一个违背人们意愿的结果[13-14]。miR-199a-3p对Akt的激活或许会减弱其对食管鳞癌细胞周期和迁移的作用,若能与Akt通路抑制剂联用或许会有更好的效果,作者在这方面的研究正在进行中。该研究探讨了miR-199a-3p在食管鳞癌细胞中的作用及作用机制,为进一步探讨食管鳞癌分子发生发展机制及寻找分子治疗靶点和治疗方法提供了实验基础和理论依据。
[1] 任昊天,张巍.miRNA在癌症的诊断与治疗中的研究进展[J].中国社区医师(医学专业),2012,14(32):7
[2] FORNARI F,MILAZZO M,CHIECO P,et al.MiR-199a-3p regulates mTOR and c-Met to influence the doxorubicin sensitivity of human hepatocarcinoma cells[J].Cancer Res,2010,70(12):5184
[3] KINOSE Y,SAWADA K,NAKAMURA K,et al.The hypoxia-related microRNA miR-199a-3p displays tumor suppressor functions in ovarian carcinoma[J].Oncotarget,2015,6(13):11342
[4] ZHANG L,LYER AK,YANG X,et al.Polymeric nanoparticle-based delivery of microRNA-199a-3p inhibits proliferation and growth of osteosarcoma cells[J].Int J Nanomedicine,2015,10:2913
[5] 陆建国,俞松.mTOR信号通路与肿瘤研究进展[J].现代医药卫生,2015,31(2):199
[6] ENCODE Project Consortium,BIRNEY E, STAMATOYANNOPOULOS JA,et al.Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project[J].Nature,2007,447(7146):799
[7] WANG Z,LI X.The role of noncoding RNA in hepatocellular carcinoma[J].Gland Surg,2013,2(1):25
[8] 王兰,袁芳芳,吕晓慧,等.miRNA与肿瘤性疾病相关研究进展[J].畜牧与饲料科学,2014,35(9):33
[9] WANG J,HE Q,HAN C,et al.p53-facilitated miR-199a-3p regulates somatic cell reprogramming[J].Stem Cells,2012,30(7):1405
[10]潘智,张令强,蒋继志,等.mTOR的研究进展[J].细胞生物学杂志,2006,28(3):395
[11]ZHANG X,WANG X,XU T,et al.Targeting of mTORC2 may have advantages over selective targeting of mTORC1 in the treatment of malignant pheochromocytoma[J].Tumour Biol,2015,36(7):5273
[12]AGARWAL NK,CHEN CH,CHO H,et al.Rictor regulates cell migration by suppressing RhoGDI2[J].Oncogene,2013,32(20):2521
[13]O′REILLY KE,ROJO F,SHE QB,et al.mTOR inhibition induces upstream receptor tyrosine kinase signaling and activates Akt[J].Cancer Res,2006,66(3):1500
[14]WANG X,YUE P,KIM YA,et al.Enhancing mammalian target of rapamycin(mTOR)-targeted cancer therapy by preventing mTOR/raptor inhibition-initiated,mTOR/rictor-independent Akt activation[J].Cancer Res,2008,68(18):7409
(2016-12-03收稿 责任编辑徐春燕)
Effects of miR-199a-3p on cell cycle and migration of Eca109 and KYSE450 cells
LIUXiangyan,HOUGuiqin,GAOPan,FANCheng,ZHANGXingli,SHIYingying,LUZhaoming
SchoolofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450001
miR-199a-3p; esophageal squamous cell carcinoma; cell cycle; cell migration;Eca109;KYSE450
Aim: To study the effects and molecular mechanism of miR-199a-3p on cell cycle and migration in esophageal squamous cell carcinoma.MethodsmiR-199a-3p mimics and miR-199a-3p mimics negative control were transfected into Eca109 and KYSE450 cells,and the expression level of miR-199a-3p in cells was detected by qRT-PCR.The cell cycle and migration were investigated by flow cytometry and wound healing assay, and the mTORC2 signaling pathway-related proteins such as mTOR,Rictor,PI3K,p-Akt(T308), and p-Akt(S473) were detected by Western blot.ResultsThe expression of miR-199a-3p was significantly increased in two cell lines after transfected with miR-199a-3p mimics(P<0.001). The results of cell cycle and wound healing assay showed that in cells transfected with miR-199a-3p mimics,the percentage of G1 phase cells was higher and the rate of cell migration was lower compared with those transfected with miR-199a-3p mimics negative control(P<0.05).Western blot results confirmed that the expression levels of mTOR and Rictor were obviously reduced, while those of PI3K,p-Akt(T308) and p-Akt(S473) were obviously increased in cells transfected with miR-199a-3p mimics than those transfected with miR-199a-3p mimics negative control(P<0.05).ConclusionmiR-199a-3p may affect the cell cycle and migration of esophageal squamous cell carcinoma cells through regulating the mTORC2 signaling pathway.
10.13705/j.issn.1671-6825.2017.06.002
*国家自然科学基金资助项目 30901778;河南省基础与前沿技术研究计划项目 162300410122
郑州大学药学院 郑州 450001
#通信作者,男,1966年11月生,博士,副教授,研究方向:肿瘤细胞分子生物学,E-mail:lzm310@zzu.edu.cn
R735.1
