姜黄素抑制多药耐药肝癌细胞HepG2/ADM的增殖及其机制研究*
2017-12-05耿燕娜尹元元武毅君张文鑫
耿燕娜,尹元元,武毅君,张文鑫
(1.河南大学淮河医院药学部,河南开封 475000;2.河南大学药学院,河南开封 475000; 3.河南中医药大学第一附属医院,郑州 450000)
姜黄素抑制多药耐药肝癌细胞HepG2/ADM的增殖及其机制研究*
耿燕娜1,尹元元1,武毅君2,张文鑫3△
(1.河南大学淮河医院药学部,河南开封 475000;2.河南大学药学院,河南开封 475000; 3.河南中医药大学第一附属医院,郑州 450000)
姜黄素;多药耐药;P-糖蛋白;HepG2/ADM细胞
GengYanna1,YinYuanyuan1,WuYijun2,ZhangWenxin3△
多药耐药(MDR)是指对一种药物具有耐药性的同时,对其他结构不同、作用靶点不同的药物也具有耐药性。MDR通常是导致抗感染药物治疗和抗肿瘤化疗失败的重要原因。通常来说,细菌的MDR主要与内酰胺酶的变异有关,而肿瘤细胞的MDR通常与细胞膜上过度表达外排抗肿瘤药物的蛋白有关,如:MDR基因mdr-1编码的P-糖蛋白(P-gp)过度表达是其重要原因之一,P-gp能够将亲脂类化疗药物泵出细胞外,从而产生耐药特性[1]。
肝癌是严重威胁人类健康的恶性肿瘤之一,由于我国是乙型肝炎病毒(HBV)的高发区,因此,受肝癌威胁也最大,约占全球肝癌病死率的50%。尽管,治疗肝癌的手段有了很大的提高,但由于MDR的存在,使得其化疗的疗效不尽如人意,因此寻找新的治疗策略逆转肝癌的MDR就显得极其重要。
姜黄素(Curcumin)是从姜科植物姜黄中提取的一种酚类化合物,具有显著的抗炎[2]、抗氧化[3]、抗缺血[4]、抗纤维化[5]、抗肿瘤[6]等生物活性。故本实验用阿霉素(ADM)处理肝癌细胞株HepG2制备耐药细胞株HepG2/ADM,用姜黄素处理该细胞,观察其对该细胞的杀伤作用,并探讨其抗耐药的机制。
1 材料与方法
1.1试剂 HepG2肝癌细胞株购置中科院上海生科院细胞资源中心;姜黄素购自美国Sigma公司,纯度大于96%,并用二甲基亚砜(DMSO)溶解,等量分装,并-20 ℃保存备用;ADM购自深圳万乐药业有限公司,用双蒸水稀释保存。RPMI-1640培养液、0.25%胰酶和胎牛血清购自美国Gibco公司;CCK-8试剂盒购自上海生博生物医药科技有限公司;反转录-聚合酶链反应(RT-PCR)试剂盒购自大连宝生生物工程有限公司,mdr-1引物由美国Invitrogen公司设计并合成。P-gp单克隆抗体购自美国Santa Cruz公司,内参抗体β-actin购自博鳌森生物有限公司。

表1 姜黄素对肝癌HepG2/ADM细胞增殖的抑制作用
*:P<0.01,与空白对照组或DMSO组比较;△:P<0.05,与同组内24 h比较
1.2方法
1.2.1细胞培养和HepG2/ADM的制备 HepG2肝癌细胞贴壁生长于含有10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的RPMI-1640培养液中,置于37 ℃、5% CO2的饱和湿度的培养箱中培养。耐药细胞株的建立采用AMD大剂量冲击和剂量递增相结合的方法诱导产生,具体做法:测定AMD对HepG2细胞的最低耐受浓度,用终浓度为1 mg/L的AMD与细胞共培养24 h,存活细胞用含最低AMD耐受浓度的培养液共培养7~10 d,待细胞稳定后传代,再次用含1 mg/L的AMD的培养液共培养24 h,存活细胞接种于含较高浓度的AMD中,以此类推,直至HepG2细胞在含1 mg/L的AMD下稳定生长和传代,即建立耐药菌株HepG2/ADM[7]。
1.2.2CCK-8试剂检测姜黄素对HepG2/ADM细胞的杀伤作用 将处于对数生长期的HepG2/ADM细胞以1×104/孔接种于96孔板中,培养12 h细胞贴壁后,将不同浓度的姜黄素(5、10、20、40 mol/L)加入HepG2/ADM培养体系中,继续培养24、48、72 h。在培养相应时间点后加入10 μL的CCK-8试剂,37 ℃孵育2 h,于酶标仪上490 nm处比色。根据公式计算细胞活力:细胞活力(%)=A490处理组/A490自然生长组×100%。
1.2.3R-123外排实验 将处于对数生长期的处理的HepG/ADM细胞以2×104/L接种于24孔板内,每孔终体积为1 mL。培养24 h后,弃上清液,加入R-123至终浓度为5 mg/ L,然后加入姜黄素(20 mol/L),联合继续培养0、0.5、1、2 h后,收集上清用流式细胞仪上检测(激发波长560 nm,发射波长 540~660 nm)R-123激发的荧光强度值表示细胞内R-123浓度。
1.2.4RT-PCR 收集培养的各组HepG2/ADM细胞,磷酸盐缓冲液(PBS)充分洗涤后,参照Trizol试剂盒说明书提取细胞总RNA,用RT-PCR检测各组细胞中mdr-1基因的表达量。mdr-1上游引物:5′-GTA CCC ATC ATT GCA ATA GC-3′;下游引物:5′-CAA ACT TCT GCT CCT GAG TC-3′,扩增产物大小为167 bp。内参GAPDH上游引物:5′-CGG AGT CAA CGG ATT TGG TCG TAT-3′;下游引物:5′-AGC CTT CTC CAT GGT GGT GAA GAC-3′,扩增产物大小为228 bp。扩增条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸5 min,35个循环;72 ℃ 延伸 7 min。扩增产物于1.5%琼脂糖凝胶进行电泳,凝胶成像扫描。用Quantity One灰度分析软件进行吸光度值计算。以目的基因mdr-1条带灰度值与内参GAPDH条带灰度值的比值作为mdr-1 mRNA的表达量,并重复3次。
1.2.5Western blot 收集各组细胞提取总蛋白,并测定蛋白的浓度为(2.12±0.24)mg/mL。取蛋白样品20 μL,经过SDS-PAGE电泳后,将蛋白电转移至聚偏二氟乙烯(PVDF)膜,以5%脱脂奶粉TBST液封闭后,加入P-gp抗体4℃孵育过夜,洗涤后加入辣根过氧化物酶(HRP)标记的二抗室温孵育1 h后,ECL底物化学发光显色后曝光显影。通过Chemi DocXRS化学发光成像系统,进行曝光分析,然后计算其比值表示结果,即:相对吸光度=目的蛋白P-gp吸光度/ β-actin 蛋白吸光度。

2 结 果
2.1姜黄素抑制HepG2/ADM细胞的增殖 与空白对照组和DMSO组比较,当姜黄素浓度为5、10 mol/L作用24 h时,对HepG2/ADM细胞的增殖活力无明显影响(P>0.05);而当姜黄素浓度增加至20、40 mol/L时,其对肝癌细胞的增殖活力有明显的抑制作用,呈剂量-依赖性(P<0.05)。进一步发现,随着作用时间的逐渐延长,不同浓度的姜黄素对HepG2/ADM细胞的增殖活力都有显著的抑制作用,呈时间-依赖性(P<0.05)。见表1。
2.2姜黄素对肝癌HepG2/ADM内R-123浓度的影响 流式细胞结果如图1显示:与空白对照组和DMSO组比较,当姜黄素浓度为5、10 mol/L时,在每一个时间点,姜黄素对HepG2/ADM细胞内的R-123的外排无明显抑制作用,而当浓度增加至20、40 mol/L时,在每一个时间点,姜黄素都能够明显地抑制细胞内R-123的外排,即:增加了细胞内ADM的药物浓度。

*:P<0.05,与空白对照组或DMSO组比较
图1姜黄素对肝癌HepG2/ADM内R-123浓度的影响
2.3姜黄素抑制了耐药肝癌HepG2/ADM细胞内mdr-1 mRNA及其编码的P-gp的表达 PCR和Western blot结果显示,与空白对照组或DMSO组比较,当姜黄素浓度为10 μmol/L时,HepG2/ADM细胞内mdr-1 mRNA及其编码的P-gp的表达水平无明显差异(P>0.05);当姜黄素浓度增加至20 μmol/L时,mdr-1 mRNA和P-gp水平表达的相对OD值都有显著降低,差异有统计学意义(P<0.01),具有浓度依赖性(图2A和C)。进一步结果还显示,当姜黄素浓度为20 μmol/L时,随着药物作用时间的延长,HepG2/ADM 胞内mdr-1 mRNA和P-gp水平的相对OD值都逐渐降低,差异有统计学意义(P<0.01),呈时间依赖性(见图2B和D)。
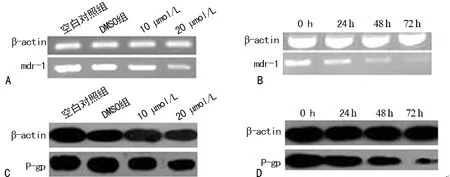
A:不同浓度的姜黄素对耐药肝癌HepG2/ADM细胞内mdr-1 mRNA表达水平的影响;B:20 μmol/L 的姜黄素作用不同时间后对耐药肝癌HepG2/ADM细胞内mdr-1 mRNA表达水平的影响;C:不同浓度的姜黄素对耐药肝癌HepG2/ADM细胞内P-gp蛋白表达水平的影响;D:20 μmol/L 的姜黄素作用不同时间后对耐药肝癌HepG2/ADM细胞内P-gp蛋白表达水平的影响
图2姜黄素对耐药肝癌HepG2/ADM细胞内mdr-1 mRNA和P-gp蛋白表达的影响和比较
3 讨 论
MDR不仅是肿瘤治疗过程中常见的问题之一,也是其面临的巨大挑战。耐药的肿瘤细胞能够有效地从细胞内部防止抗瘤药物的积聚,从而降低肿瘤细胞对抗瘤药物的敏感度[8]。MDR形成的原因多样,如P-gp的过度表达[1],上游通路(NF-kappB和PI3K)活性的异常等[9]。其中,mdr-1基因及其编码的P-gp在多种恶性肿瘤细胞中的过度表达是形成MDR的重要机制,也是肿瘤患者化疗效果差、预后差、复发率高的重要原因。
肝癌是消化系统最为常见的恶性肿瘤之一,因P-gp高表达引发MDR从而导致肝癌病死率居高不下,因此寻找有效的MDR逆转剂一直是肝癌防治研究的热点。 目前越来越多的研究表明,许多植物提取物,如:绿茶[10]、白藜芦醇[11]等,因其广泛的药理特性和低毒性,在肝癌的治疗和预防中有广阔的应用前景,但这些提取物对MDR的肝癌的治疗作用及其机制却鲜有研究。
姜黄素是一种多酚类植物提取物,因其良好的抗突变和抗癌作用,使其成为一种很有应用前景的抗癌药物。本研究利用姜黄素处理MDR的肝癌细胞株HepG2/ADM,观察姜黄素对该细胞株的增殖作用的影响,并探讨其机制。研究表明,姜黄素能够明显地抑制耐药肝癌细胞的增殖,且这种抑制作用呈明显的浓度-时间依赖性(P<0.01)。流式细胞术检测了姜黄素对R-123的影响,结果发现姜黄素也能够明显抑制细胞内R-123的外排,也就是说姜黄素可以明显增加细胞内ADM的药物浓度,使其增强抗肝癌的作用。进一步的研究结果表明,姜黄素能够明显抑制与MDR密切相关的mdr-1 mRNA及其编码的P-gp的表达水平,也呈浓度-时间依赖性。
总之,本研究显示姜黄素能够逆转人肝癌耐药细胞株HepG2/ADM的耐药作用,其机制可能与抑制mdr-1及其编码的P-gp的表达有关系,这或为治疗耐药肝癌指出了新的方向,也提供了一定理论依据,但其逆转耐药的确切机制仍有待深入研究。
[1]Liu Z,Duan ZJ,Chang JY,et al.Sinomenine sensitizes multidrug-resistant colon cancer cells (Caco-2) to doxorubicin by downregulation of MDR-1 expression[J].PLoS One,2014,9(6):98560.
[2]Machova Urdzikova L,Karova K,Ruzicka J,et al.The anti-inflammatory compound curcumin enhances locomotor and sensory recovery after spinal cord injury in rats by immunomodulation[J].Int J Mol Sci,2015,17(1):E49.
[3]Xiong ZE,Dong WG,Wang BY,et al.Curcumin attenuates chronic ethanol-induced liver injury by inhibition of oxidative stress via mitogen-activated protein kinase/nuclear factor E2-related factor 2 pathway in mice[J].Pharmacogn Mag,2015,11(44):707-715.
[4]Shah FA,Gim SA,Sung JH,et al.Identification of proteins regulated by curcumin in cerebral ischemia[J].J Surg Res,2016,201(1):141-148.
[5]Liu PY.Curcumin:another potential translational candidate for anti-fibrosis on heart failure?[J].Acta Cardiol Sin,2014,30(5):483-484.
[6]Pan Z,Chen C,Zhou Y,et al.Synthesis and cytotoxic evaluation of monocarbonyl analogs of curcumin as potential anti-tumor agents[J].Drug Dev Res,2016,77(1):43-49.
[7]Zhai BJ,Shao ZY,Zhao CL,et al.Development of characterization of multidrug resistant human hepatocarcinoma cell line in nude mice[J].World J Gastroenterol,2006,12(41):6614-6619.
[8]Fletcher JI,Haber M,Henderson MJ,et al.ABC transporter in cancer:more than just drug efflux pumps[J].Nat Rev Cancer,2010,10(2):147-156.
[9]Fey SJ,Wrzesinski K.Determination of drug toxicity using 3D spheroids constructed from an immortal human hepatocyte cell line[J].Toxicol Sci,2012,127(2):403-411.
[10]Zhang Y,Duan W,Owusu L,et al.Epigallocatechin-3-gallate induces the apoptosis of hepatocellular carcinoma LM6 cells but not non-cancerous liver cells[J].Int J Mol Med,2015,35(1):117-124.
[11]Lombardi G,Vannini S,Blasi F,et al.In vitro safety/protection assessment of resveratrol and pterostilbene in a human hepatoma cell line (HepG2)[J].Nat Prod Commun,2015,10(8):1403-1408.
StudyoneffectofcurcuminininhibitingproliferationofmultidrugresistantlivercancerHepG2/ADMcellsanditsmechanism*
(1.DepartmentofPharmacy,HuaiheHospital,HenanUniversity,Kaifeng,Henan,475000;2.CollegeofPharmacy,HenanUniversity,Kaifeng,Henan,475000;3.FirstAffiliatedHospital,HenanUniversityofTraditionalChineseMedicine,Zhengzhou,Henan450000,China)
ObjectiveTo observe the inhibitory effect of curcumin on the proliferation of multidrug resistance liver cancer line HepG2/ADM cells and to explore its mechanisms.MethodsHepG2/ADM cells were prepared and cultured in vitro,and treated by different concentrations (5,10,20,40 μmol/L) of curcumin for 24,48,72 h respectively.The effect of curcumin on proliferation of HepG2/ADM cells was measured by CCK-8 reagent;the concentration of intracellular rhodamine-123(Rh-123) and adriamycin (ADM) were determined by flow cytometry;the level change of intracellular mdr-1 mRNA in each group was determined by RT-PCR,the P-gp protein level was detected by Western blot.ResultsCompared with the blank control and DMSO group,curucmin had more obvious inhibitory effect on HepG2/ADM cells proliferation (P<0.05),and could more remarkably inhibit the intracellular Rh-123 excretion(P<0.05).The RT-PCR and Western blot results showed that curcumin more significantly decrease the mdr-1 mRNA and P-gp protein levels in dose-time dependent manner (P<0.05).ConclusionCurcumin could significantly inhibit the proliferation of multidrug-resistant HepG2/ADM cells,and its mechanism may be related with inhibiting mdr-1 gene expression and its encoded P-gp protein level,which are closely related with MDR.
curcumin;multidrug-resistance;P-gp;HepG2/ADM cells
目的观察姜黄素对多药耐药(MDR)的肝癌细胞株HepG2/ADM细胞增殖的抑制作用及其机制。方法制备、培养HepG2/ADM细胞,然后用不同浓度的姜黄素(5、10、20、40 mol/L)处理该细胞24、48、72 h。采用CCK-8试剂检测姜黄素对HepG2/ADM细胞的增殖活力的影响。流式细胞仪检测细胞内罗丹明123(R-123)的浓度和阿霉素(ADM)的浓度;反转录-聚合酶链反应(RT-PCR)检测各组细胞内mdr-1 mRNA的水平变化;用Western blot检测细胞内P-糖蛋白(P-gp)水平的变化。结果与空白对照组和DMSO组相比,姜黄素对HepG2/ADM细胞增殖的抑制作用更加明显(P<0.05);更能够明显抑制细胞内Rh123的外排(P<0.05);RT-PCR和Western blot结果分别显示,姜黄素对HepG2/ADM细胞内的mdr-1 mRNA和P-gp水平更有明显的降低(P<0.05),且呈浓度-时间依赖性(P<0.05)。结论姜黄素可以显著抑制多药耐药HepG2/ADM细胞的增殖,其机制可能与抑制和MDR密切相关的mdr-1基因及其编码的P-gp水平有关。
R962
A
1671-8348(2017)31-4329-03
10.3969/j.issn.1671-8348.2017.31.003
河南省医学科技公关计划项目(201404035)。
耿燕娜(1983-),副主任药师,硕士,研究方向为中药药理与临床药学。△
,E-mail:zhangwenxin1983@163.com。
2017-03-20
2017-06-08)
