心血管疾病运动康复新机制:microRNA的调控
2017-11-27吴德琳刘宇娜郑思道
吴德琳,刘宇娜,郑思道
·理论探索·
心血管疾病运动康复新机制:microRNA的调控
吴德琳,刘宇娜,郑思道
血液循环系统健康是心血管疾病和全因死亡率的强有力预测因素,适当的运动康复是防治心血管疾病有效和经济措施之一。MicroRNAs(miRNAs、miRs)是一类内源性非编码RNA,可在转录后水平调控基因表达。目前研究显示miR-1、miR-214、miR-19b、miR-30e、miR-29、miR-455、miR-30c、miR-222等介导运动对心脏的保护作用,miR-146a、miR-30e、miR-23b、miR-130a、miR-16、miR-21、miR-24、miR-92a、miR-126、miR-143/145、miR-155、miR-221/222等介导运动对血管的保护作用。miRNA介导运动保护心血管的作用主要表现为以下3个特点:心血管运动康复与miRNA相关、运动方式不同miRNA表达不同、miRNA是心血管运动康复与其他多种干预措施的共同靶点。以上结果提示miRNAs是心血管运动康复的重要作用机制,也是其他多种干预措施的靶点,提示心血管运动康复可以作为治疗处方应用于临床。
心脏康复;血管康复;运动训练;microRNA
血液循环系统健康是心血管疾病和全因死亡率的强有力预测因素,其健康程度与心血管疾病风险呈负相关[1]。适当的运动是防治心血管疾病的有效和经济措施之一,其对心脏的刺激属于生理性,不引起细胞死亡、纤维化和心脏功能下降,因而有别于病理性心脏重构[2-3]。运动康复对心血管的保护作用与运动形式、强度、周期等有关,主要体现在对心率、心脏功能和结构的调整,如通过6个月的适度训练可以使未曾受训者的静息心率、次极量运动心率降低(5~20)min,并增加20%左右的每搏量,同时轻度增加心腔容量和心壁厚度[1]。确定心血管最适宜的运动形式、强度、周期等是目前研究的方向之一,而通过对具体机制进行研究,发现新干预机制和作用靶点,不仅能够阐释心血管康复的微观机制,还将会对心脏病的药物治疗产生明显推动作用[2,4]。
MicroRNAs(miRNAs、miRs)是一类内源性非编码RNA,通过降解mRNA或抑制转录等方式在转录后水平调控基因表达,从而影响包括增殖、分化、代谢在内的多种病理生理过程[5-6]。组织和血液中的miRNA表达水平可以通过运动训练被调节,并且运动方式不同,调节的miRNA也不同[5-7]。本研究综述心血管运动康复过程中由miRNA介导的作用机制。
1 心血管运动康复的miRNA机制
运动防治心血管疾病的作用涉及包括miRNA在内的多种调控机制,多个miRNA介导心肌细胞、血管平滑肌细胞和内皮细胞的生理作用,部分miRNA也参与对心血管疾病的调控[8-10]。运动诱导心肌生理性肥大及细胞更新,能够通过改善内皮祖细胞的增殖、迁徙、分化能力促进内皮细胞更新和血管生成,上述细胞的适应性改变与包括miRNA在内的细胞信号通路激活有关(见表1)[4]。

表1 运动防治心血管疾病的作用机制
2 心脏运动康复的miRNA机制
2.1 心肌肥厚 适当运动能够促进心脏生理性结构改变、抑制心脏病理性重构发生,相关作用与运动上调miR-222表达的作用有关:miR-222上调后抑制靶基因p27、HIPK1/2、HMBOX1等,从而调控细胞增殖和心肌肥大,最后调控心脏表型[11]。有氧运动能够诱导心脏生理性肥厚,在此过程中小鼠心肌组织miR-30c表达升高、结缔组织生长因子(CTGF)蛋白表达下调,两者组成的信号通路介导了运动改善心室顺应性的作用[12]。miR-350表达上调诱导的靶基因JNK表达减少介导了运动诱导的心肌肥厚,这一过程中可能同时存在拮抗机制:miR-1表达下降诱导的休克蛋白70表达升高对运动诱导的心肌重构具有抑制作用[13-14]。
2.2 心肌纤维化 经运动训练的心肌梗死大鼠,梗死边缘区及远离梗死部位的心肌miRNA表达呈现出相似规律:miR-29a、miR-29b表达上调,通过细胞外基质蛋白介导,这两个miRNA下调胶原蛋白1a1和3a1,抑制心肌细胞外基质重构[15]。心肌外泌体中含有的miR-29b、miR-455等可在运动的诱导下降低靶基因基质金属蛋白酶9表达水平,抑制糖尿病性心脏病的心肌纤维化[16]。对健康大鼠进行的研究显示,运动训练可以提高心肌miR-29c表达水平,也能够下调靶基因胶原蛋白1a1和3a1表达,改善左室顺应性[17]。中等强度运动对心脏并无不理想影响,但长期高强度运动能够上调大鼠心房转化生长因子β1(TGF-β1)/miR-21信号通路,存在诱导纤维化、促发房颤的危险[18]。而另一研究显示,心衰病人一次性力竭运动后血清miR-21、miR-378、miR-940表达显著升高,但这些miRNA的变化与心脏功能及运动耐力等未呈现出强相关性,其意义仍需要进一步探索[19]。
2.3 心肌凋亡 运动训练引起主动脉缩窄所致心力衰竭大鼠心肌组织中多个miRNA表达水平发生变化,其中涉及对细胞凋亡的调控[20]。有研究显示,中等强度游泳负荷能够上调小鼠心肌miR-30b、miR-499表达水平,通过抑制下游蛋白Drp-1表达最终显示出对心肌凋亡的抑制作用[21-22]。此外,运动诱导生理性肥大的心肌中miR-19b、miR-30e表达上调,均通过对靶基因Bcl-2的调控抑制细胞凋亡,从而保护心脏[23]。
2.4 心肌离子通路 长跑运动员常出现窦性心动过缓,严重时需要置入起搏装置,这一现象的发生机制并非因为自主神经系统活性改变,而是源于窦房结内源性电生理的重构:运动诱导的心动过缓在阻断自主神经后仍持续存在,可能与运动上调miR-1、下调Tbx3的作用有关,在这两个调节因子作用下离子通道HCN4表达下调,进而引起窦房结细胞起搏电流减少、促发心动过缓[24]。然而miR-1、Tbx3和HCN4之间的调控关系尚需要进一步研究。冠状动脉前降支结扎所致心肌梗死大鼠心肌组织中miR-1表达下调、miR-214表达上调,通过适当的运动训练可以使这两个miRNA的表达恢复至生理状态水平,同时相应靶基因钠/钙交换体1、肌浆网钙泵2a的表达水平可恢复正常,提示运动训练可以通过调控miRNA及其靶基因保护缺血性心脏[25]。
2.5 心脏功能 长期中等强度耐力运动心肌组织中miR-1、miR-133a表达下调,但急性运动、长期高强度耐力训练常导致两者表达上调[12,26-28]。有研究显示,循环miR-1与心脏短缩率呈负相关,而循环miR-133a则与室间隔厚度呈正相关[29]。与心肌组织相反,耐力运动引起腓肠肌组织中miR-133a及肌细胞增强因子2 mRNA表达上调,增强肌肉运动能力[30]。可以推测运动训练加速心源性miR-133a转移至外周组织,既减少其对心脏的刺激作用,又提高外周组织对运动的适应能力。另有研究证实,对于动脉缩窄诱导心衰小鼠,运动可以通过抑制miR-350表达上调JNK水平、改善心脏射血分数[31]。前述对miR-350的研究提示其在心肌重构过程中具有重要作用,可能是心血管康复的靶miRNA[13-14,31]。
基于前述证据可以看出,适度运动训练通过调控miRNA及其靶基因对生理及病理状态下的心脏、血管具有多种保护作用(见表2)。
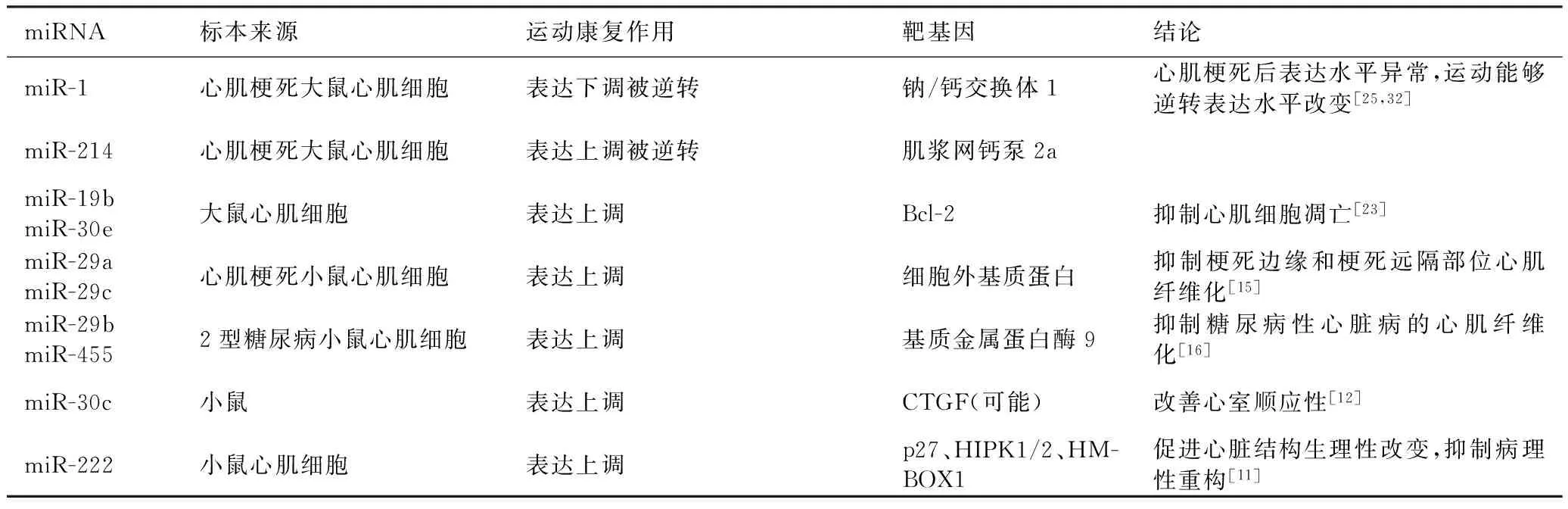
表2 运动调控心脏重构的miRNA机制
3 血管运动康复的miRNA机制
对于高脂饮食诱导的动脉粥样硬化炎症反应,运动与辛伐他汀具有相似的抑制作用,可能与两者上调miR-146a及下调下游靶基因肿瘤坏死因子受体6有关[33]。其他如miR-30e、miR-23b、miR-130a可能分别通过Jak-STAT、p53、胞吞作用等调控单核细胞功能,从而调节血管动脉硬化过程[34]。更早的一个研究提示,外周单核细胞中有多达34种miRNA的表达可以被运动训练改变,涉及对TGF-β、MAPK等12条信号通路,其中6种miRNA(126、130a、151-5p、1225-5p、181-b、939)的改变同样存在于中性粒细胞内[35]。此外,miR-27、miR-143也通过对血管紧张素的调节扩张血管、抑制纤维化[3]。运动训练对高血压引起的血管损伤也有调节作用,涉及多个miRNA及血管内皮相关靶基因(见表3)[36]。
4 总 结
运动训练本身作为生活方式调整的内容之一,副作用极少,可以成为一种强效治疗处方应用[6]。不仅需要关注运动对心脏、血管重构的宏观影响,还应探索相关细胞、分子层面的作用机制,以发现用于防治心脏重构、心力衰竭病理过程的新靶点[1]。由前述内容可以发现多种miRNA介导了运动对心脏、血管的保护作用,并主要表现为以下3个特点。
4.1 心血管运动康复与miRNA相关 心血管运动康复涉及对心肌肥厚、心肌纤维化、心肌凋亡、心肌离子通路、心脏功能等心脏重构的调节,也包括对血管、微循环的调节。目前研究显示miR-1、miR-214、miR-19b、miR-30e、miR-29a、miR-29c、miR-29b、miR-455、miR-30c、miR-222等介导运动对心脏的保护作用,miR-146a、miR-30e、miR-23b、miR-130a、miR-16、miR-21、miR-24、miR-92a、miR-126、miR-143/145、miR-155、miR-221/222等介导运动对血管的保护作用。鉴于心血管重构的复杂性、miRNA及其靶基因的多样性,推测会有越来越多miRNA及其靶基因被发现与心血管康复有关。
4.2 运动方式不同miRNA表达不同 循环miR-21在健康成年男性一次性力竭运动后表达不变,而在耐力训练后表达水平下调[37]。对参加马拉松赛事的运动员研究也显示,循环miR-21表达水平在比赛前后无明显变化[29]。另外对长期训练运动员的研究表明,循环miR-21表达水平在耐力训练后表达上调、在力量训练后表达下调,前者是后者的1.56倍[38]。上述研究提示,对miR-21研究的结论差异可能与运动方式不同有关:一次性力竭运动对miR-21表达无影响,而长期运动诱导miR-21表达改变,改变方向与运动方式有关。需要注意到运动方式不同对心脏的重构也不同,可能是相关miRNA表达差异的原因之一:有氧运动主要引起心脏扩张,而阻抗训练主要引起心脏肥厚[3]。此外,有氧运动下调心脏血管紧张素Ⅱ水平、上调血管紧张素(1-7)水平,而阻抗训练对心脏血管紧张素表达无明显影响,提示有氧运动能够减轻血管紧张素对心脏的不利影响[39]。
4.3 miRNA是心血管运动康复与其他多种干预措施的共同靶点miRNA不仅介导心血管运动康复对心血管的保护作用,也介导药物、表观遗传学干预等的治疗作用,显示其在生理和病理状态下具有核心调控作用[40-41]。因此,通过合理的干预方式组合,应该能够达到治疗取效最大化:既发挥各种干预措施优势和特色,又可减少或避免相应措施不足或副作用。
综合目前研究表明,miRNA是心血管运动康复的重要作用机制,并且运动方式不同起介导作用的miRNA不同,同时miRNA也是其他多种干预措施的靶点,提示心血管运动康复应当作为治疗处方应用于临床。
[1] Wilson MG,Ellison GM,Cable NT.Basic science behind the cardiovascular benefits of exercise[J].Heart,2015,101(10):758-765.
[2] Bei Y,Zhou Q,Sun Q,et al.Exercise as a platform for pharmacotherapy development in cardiac diseases[J].Current Pharmaceutical Design,2015,21(30):4409-4416.
[3] Fernandes T,Soci UP,Oliveira EM.Eccentric and concentric cardiac hypertrophy induced by exercise training: microRNAs and molecular determinants[J].Braz J Med Biol Res,2011,44(9):836-847.
[4] Tao L,Bei Y,Zhang H,et al.Exercise for the heart: signaling pathways[J].Oncotarget,2015,6(25):20773-20784.
[5] Xu T,Liu Q,Yao J,et al.Circulating microRNAs in response to exercise[J].Scand J Med Sci Sports,2015,25(2):e149-e154.
[6] Hill JA.Braking bad hypertrophy[J].N Engl J Med,2015,372(22):2160-2162.
[7] Altana V,Geretto M,Pulliero A.MicroRNAs and physical activity[J].Microrna,2015,4(2):74-85.
[8] Shi L,Liao J,Liu B,et al.Mechanisms and therapeutic potential of microRNAs in hypertension[J].Drug Discov Today,2015,20(10):1188-1204.
[9] Schuler G,Adams V,Goto Y.Role of exercise in the prevention of cardiovascular disease: results,mechanisms,and new perspectives[J].Eur Heart J,2013,34(24):1790-1799.
[10] Flowers E,Won GY,Fukuoka Y.MicroRNAs associated with exercise and diet: a systematic review[J].Physiol Genomics,2015,47(1):1-11.
[11] Liu X,Xiao J,Zhu H,et al.miR-222 Is Necessary for exercise-induced cardiac growth and protects against pathological Cardiac Remodeling[J].Cell Metabolism,2015,21(4):584-595.
[12] 贾明学,张国海,李艳,等.微小RNA 30c增加有氧运动训练小鼠心室顺应性的研究[J].体育科学,2013,33(9):70-76.
[13] 翟帅,陈佩林.运动心脏重塑过程中miRNA-350/JNK信号通路的动态变化[J].体育科学,2014,34(5):9-14.
[14] 马志勇,赵永才.运动对小鼠心肌miRNA-1及热休克蛋白的影响[J].唐山师范学院学报,2015(2):96-98.
[15] Melo SF,Fernandes T,Barauna VG,et al.Expression of microRNA-29 and collagen in cardiac muscle after swimming training in myocardial-infarcted rats[J].Cell Physiol Biochem ,2014,33(3):657-669.
[16] Chaturvedi P,Kalani A,Medina I,et al.Cardiosome mediated regulation of MMP9 in diabetic heart: role of mir29b and mir455 in exercise[J].Journal of Cellular and Molecular Medicine,2015,19(9):2153-2161.
[17] Soci UPR,Fernandes T,Hashimoto NY,et al.MicroRNAs 29 are involved in the improvement of ventricular compliance promoted by aerobic exercise training in rats[J].Physiological Genomics,2011,43(11):665-673.
[18] 王世强,常芸,马晓雯,等.不同强度耐力运动对大鼠心房TGF-β1/miR-21信号途径的影响[J].体育科学,2015(11):30-37.
[19] Xu T,Zhou Q,Che L,et al.Circulating miR-21,miR-378,and miR-940 increase in response to an acute exhaustive exercise in chronic heart failure patients[J].Oncotarget,2016,7(11):12414-12425.
[20] Souza RW,Fernandez GJ,Cunha JP,et al.Regulation of cardiac microRNAs induced by aerobic exercise training during heart failure[J].Am J Physiol Heart Circ Physiol,2015,309(10):H1629-H1641.
[21] 赵永才,郑兵.运动训练对心肌线粒体途径miR-30-p53-Drp-1凋亡通路的影响[J].中国运动医学杂志,2015(2):128-133.
[22] 赵永才.运动训练对小鼠心肌线粒体miR-499-CaN-Drp-1凋亡通路的影响[J].中国应用生理学杂志,2015,31(3):259-263.
[23] Ramasamy S,Velmurugan G,Shanmugha Rajan K,et al.MiRNAs with apoptosis regulating potential are differentially expressed in chronic exercise-induced physiologically hypertrophied hearts[J].PLoS One,2015,10(3):e0121401.
[24] D'Souza A,Bucchi A,Johnsen AB,et al.Exercise training reduces resting heart rate via downregulation of the funny channel HCN4[J].Nat Commun,2014,5:3775.
[25] Melo SF,Barauna VG,Neves VJ,et al.Exercise training restores the cardiac microRNA-1 and -214 levels regulating Ca2+handling after myocardial infarction[J].BMC Cardiovasc Disord,2015,15(1):166.
[26] 赵永才.运动对C57BL/6小鼠心肌miRNA的影响及其在心脏肥大中的调节作用[J].体育科学,2012,32(6):62-68.
[27] Clauss S,Wakili R,Hildebrand B,et al.MicroRNAs as biomarkers for acute atrial remodeling in marathon runners (the miRathon study a substudy of the munich marathon study) [J].PLoS One,2016,11(2):e0148599.
[28] Gomes CP,Oliveira GP,Madrid B,et al.Circulating miR-1,miR-133a,and miR-206 levels are increased after a half-marathon run[J].Biomarkers,2014,19(7):585-589.
[29] Mooren FC,Viereck J,Kruger K,et al.Circulating microRNAs as potential biomarkers of aerobic exercise capacity[J].Am J Physiol Heart Circ Physiol,2014,306(4):H557-H563.
[30] 张嘉伟,任文君.有氧训练大鼠腓肠肌组织微小RNA-133a和肌细胞增强因子2的表达[J].中国组织工程研究,2012,16(20):3730-3734.
[31] 陈炜,陈佩林,邓玉强.游泳对心衰模型小鼠左心室miRNA-350/JNK通路的影响[J].北京体育大学学报,2014(5):77-83.
[32] Melo SF,Barauna VG,Junior MA, et al.Resistance training regulates cardiac function through modulation of miRNA-214[J].Int J Mol Sci,2015,16(4):6855-6867.
[33] Wu XD,Zeng K,Liu WL,et al.Effect of aerobic exercise on miRNA-TLR4 signaling in atherosclerosis[J].Int J Sports Med,2014,35(4):344-350.
[34] Radom-Aizik S,Zaldivar FP,Haddad F,et al.Impact of brief exercise on circulating monocyte gene and microRNA expression: implications for atherosclerotic vascular disease[J].Brain Behav Immun,2014,39:121-129.
[35] Radom-Aizik S,Zaldivar F,Leu SY,et al.Effects of exercise on microRNA expression in young males peripheral blood mononuclear cells[J].Clin Transl Sci,2012,5(1):32-38.
[36] Neves VJ,Fernandes T,Roque FR,et al.Exercise training in hypertension:role of microRNAs[J].World J Cardiol,2014,6(8):713-727.
[37] Nielsen S,Akerstrom T,Rinnov A,et al.The miRNA plasma signature in response to acute aerobic exercise and endurance Training[J].PLoS One,2014,9(2):e87308.
[38] Wardle SL,Bailey ME,Kilikevicius A,et al.Plasma microRNA levels differ between endurance and strength athletes[J].PLoS One,2015,10(4):e0122107.
[39] Fernandes T,Hashimoto NY,Magalhaes FC,et al.Aerobic Exercise training-induced left ventricular hypertrophy involves regulatory microRNAs,decreased angiotensin-converting enzyme-angiotensin Ⅱ,and synergistic regulation of angiotensin-converting enzyme 2-angiotensin (1-7) [J].Hypertension,2011,58(2):182-189.
[40] Peng L,Zhong X.Epigenetic regulation of drug metabolism and transport[J].Acta Pharm Sin B,2015,5(2):106-112.
[41] Kamps JA,Krenning G.Micromanaging cardiac regeneration: Targeted delivery of microRNAs for cardiac repair and regeneration[J].World J Cardiol ,2016,8(2):163-179.
2016-07-27)
(本文编辑 王雅洁)
The Mechanisms of microRNA-induced Cardiovascular Protection in Exercise Rehabilitation
Wu Delin,Liu Yu’na,Zheng Sidao
Beijing Hospital of Integrated Traditional Chinese and Western Medicine, Beijing 100039,China
Zheng Sidao
Cardiovascular status is one of the strongest predictors of both cardiovascular diseases death and all-cause death.Exercise training (ET) has been proved to be an effective and economical strategy to overcome the cardiovascular deleterious effects.microRNAs (miRNAs or miRs) are a class of small, noncoding RNAs which regulate gene expression at post-transcriptional level.Current studies have revealed that many miRNAs induce the protective effects of ET by regulating structures and functions of heart and blood vessel.For example, miR-1, miR-214, miR-19b, miR-30e, miR-29, miR-455, miR-30c, and miR-222 are involved in ET-related heart protection, miR-146a, miR-30e, miR-23b, miR-130a, miR-16, miR-21, miR-24, miR-92a, miR-126, miR-143/145, miR-155, and miR-221/222 take park in ET-related vessel protection.What is more, besides ET, many other intervention strategies can also regulate miRNAs level.So, it is obviously that miRNAs underline a new protective mechanism for cardiovascular health, and ET should be used as a special drug in medical practice.
cardiac rehabilitation;vascular rehabilitation;exercise training;microRNAs
R54 R256.2
A
10.3969/j.issn.1672-1349.2017.21.039
1672-1349(2017)21-2786-04
北京市优秀人才培养资助青年骨干个人项目(No.2014000057592G296)
北京市中西医结合医院(北京100039)
郑思道,E-mail:zhengsidao@yahoo.com
信息:吴德琳,刘宇娜,郑思道.心血管疾病运动康复新机制:microRNA的调控[J].中西医结合心脑血管病杂志,2017,15(21):2786-2789.
