血管内皮细胞m iR-126、m iR-155与高血压病血瘀证的相关性研究
2017-11-24尹莲花许艺惠黄守清
尹莲花,许艺惠,郑 彦,黄守清
(福建中医药大学附属第二人民医院,福建 福州 350003)
血管内皮细胞m iR-126、m iR-155与高血压病血瘀证的相关性研究
尹莲花,许艺惠,郑 彦,黄守清
(福建中医药大学附属第二人民医院,福建 福州 350003)
目的 探讨血管内皮细胞中m iR-126、m iR-155的表达与高血压病血瘀证的相关性及其可能的病理作用机制。 方法 募集60例高血压病血瘀证患者(血瘀证组)、60例高血压病非血瘀证患者(非血瘀证组)、60例健康人群(健康组)作为研究对象,采集3组空腹静脉血,比较3组血液中miR-126、miR-155的表达和VCAM-1、TM的含量。 结果 与健康组比较,非血瘀证组和血瘀证组m iR-126、m iR-155的表达明显降低(P<0.01),VCAM-1、TM含量明显升高(P<0.01);与非血瘀证组比较,血瘀证组m iR-126、m iR-155表达和 VCAM-1、TM含量明显升高(P<0.05)。 结论 m iR-126、m iR-155可能参与高血压病非血瘀证向血瘀证发展的过程,其作用机制可能为通过上调VCAM-1的表达介导ECs的炎症反应;TM可作为高血压病血瘀证的微观辨证指标。
高血压病;血瘀证;miR-126;miR-155;血管细胞粘附分子-1;血栓调节蛋白
众多学者认为,血瘀证在高血压的发生、发展和演变过程中扮演重要角色,血管内皮细胞功能障碍是血瘀证发病的病理基础,微小RNA(microRNAs,miRNAs)参与血管内皮系统功能的调节[1]。 研究发现,血管细胞粘附分子-1(vascular cell adhesion protein,VCAM-1)在高血压及血瘀证中呈高表达[2],而 miR-126、miR-155 可直接或间接调控内皮细胞(endothelial cells,ECs)中 VCAM-1 的表达[3-4]。血栓调节蛋白(thrombomodulin,TM)被认为是反映血管内皮细胞损伤的有效指标[5]。本研究拟通过病例对照分析,从内皮细胞炎症损伤的角度,分析miR-126、miR-155的表达与高血压病血瘀证的相关性,探讨其可能的作用机制,即这种相关性是否与miR-126、miR-155调控VCAM-1的表达、进而介导ECs的炎症反应有关,并进一步明确TM是否可以作为高血压病形成血瘀证的微观辨证指标。
1 临床资料
1.1 西医诊断标准 高血压病的诊断和分级标准参照《中国高血压防治指南 2010》[6]。
1.2 中医辨证标准 参照2011年中国中西医结合学会活血化瘀专业委员会修订的《血瘀证中西医结合诊断标准》[7]中血瘀证制定。
1.3 纳入标准 ① 符合上述诊断及辨证标准;②年龄18~65岁;③ 签署知情同意书。
1.4 排除标准 ① 继发性高血压患者;② 合并冠心病、脑卒中等心脑血管疾病,肝肾疾病或造血系统等严重原发性疾病者;③ 检测前2周内服用过阿司匹林、华法林、皮质醇激素、儿茶酚胺、噻氯匹定、波立维、肝素或活血化瘀类的中药,以及其他可能影响凝血或纤溶的药物;④ 精神病患者;⑤ 妊娠期或哺乳期妇女;⑥ 合并单纯急性疾病(如急性阑尾炎等)或外伤患者;⑦ 恶性肿瘤患者。
1.5 一般资料 选择2014年1月—2014年12月于我院体检中心体检的高血压患者120例,根据中医辨证分为血瘀证组和非血瘀组各60例。血瘀证组中男32例,女28例,平均年龄(41.81±7.37)岁,平均收缩压(165.23±14.68)mmHg,平均舒张压(102.36±7.96)mmHg;非血瘀证组中男 31例,女29例,平均年龄(42.15±8.21)岁,平均收缩压(164.89±12.53) mmHg,平均舒张压(104.82±8.26) mmHg。 2组在血压上比较,差异无统计学意义(P>0.05),具有可比性。另选同一时段于中心体检的健康人群60例为健康组,男30例,女30例,平均年龄(40.86±7.35)岁,平均收缩压(120.53±10.63) mmHg,平均舒张压(78.95±9.86)mmHg。3组在性别、年龄上比较,无显著性差异(P>0.05),具有可比性。
2 方 法
2.1 主要试剂和仪器 mirVanaTMmiRNA I solation K it(美国 Ambion 公司);miScript Reverse Transcription Kit(德国 Qiagen 公司);miScript SYBR Green PCR Kit(德国 Qiagen公司);VCAM-1检测试剂盒(美国R&D公司);TM检测试剂盒(福州迈新生物技术开发有限公司);miRNA引物(广州市锐博生物科技有限公司);Biophotometer plus紫外分光光度计(德国 Eppendorf公司);Real-Time PCR 仪(美国ABI公司);Multiskan MK3型全自动酶标仪(芬兰Thermo公司)。
2.2 miR-126、miR-155的检测
2.2.1 总RNA提取及质量鉴定 取空腹血浆400 μL,使用mirVanaTMmiRNA I solation K it提取血清总RNA,总RNA完整性由1%琼脂糖凝胶电泳鉴定,经紫外分光光度计测定光密度,计算D260 nm/D280 nm和D260 nm/D230 nm,两者分别表示RNA的浓度和纯度。
2.2.2 RT-PCR检测 使用miScript Reverse Transcription Kit将 1μg RNA逆转录为 cDNA,在 PCR反应前,将cDNA用无RNase的水进行1∶10稀释。使用miScript SYBR Green PCR Kit在ABI 3700 Real-Time PCR 系统(Applied Biosystems)进行PCR反应。
miRNA引物为厂家提供的miScrit通用引物和miRNA特异性引物。miRNA特异性引物用Primer Express软件v2.0版(Applied Biosystems)进行设计。miRNA序列由miRbase数据库获得,选用U6 snRNA(GenBankEntrez:M14486)作为内参。miR-126 引物序列:5’-UCGU ACCGUGAGUAAUAAUGCG-3’(has-miR-126-3p MIMAT0000445,最佳退火温度58.8 ℃ ,205 bp)。 miR-155 引 物 序 列 :5’-UUAAUGCUAAUCGUGAU AGGGGU-3’ (has-miR-155-5p MIMAT0000646,最佳退火温度58.3℃,181 bp)。
2.3 VCAM-1检测 抽取受试者肘静脉血5 mL,注入10 mL肝素抗凝,3500 r/m离心3 min,取上清液,-70℃冰箱冻存待测。使用双抗夹心ELISA法和全自动酶标仪检测血清VCAM-1的表达水平,操作过程严格按照试剂说明书进行。
2.4 TM检测 抽取受试者肘静脉血1.8 mL置于0.2 mL 0.109 mmol/L枸橼酸钠抗凝剂抗凝分离血浆。使用双抗夹心ELISA法和全自动酶标仪检测,操作步骤严格按照试剂说明书进行。测定450 nm波长的吸光度并对比标准曲线,可测定TM的含量。2.5 统计学方法 采用SPSS 20.0统计软件进行数据分析。符合正态分布且方差齐的计量资料以(x±s)表示,采用单因素方差分析;计数资料采用χ2检验。
3 结 果
3.1 3组血浆中miR-126、miR-155的表达水平比较 见表1。
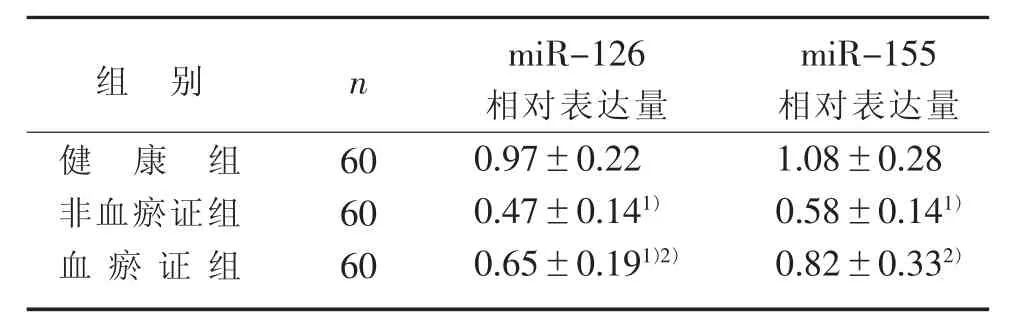
表1 3 组血浆中 m iR-126、m iR-155 表达比较(x±s)
3.2 3组血浆中VCAM-1、TM含量比较 见表2。
4 讨 论
4.1 miR-126可以抑制血栓形成,并促进血栓机化,同时增强内皮祖细胞促血栓再通的作用[8]。miR-126还能抑制VCAM-1的表达,减少白细胞粘附于内皮细胞,从而减轻血管炎症[9]。本研究中血瘀组和非血瘀组的miR-126表达水平均低于健康组,其原因可能是miR-126的下降导致血管内代谢发生紊乱,并进一步激活血小板和内皮细胞;血瘀证组miR-126的表达水平明显高于非血瘀证组,这表明miR-126可能参与了非血瘀证向血瘀证发展的过程。

表2 3组血浆中 VCAM-1、TM 含量比较(x±s)
4.2 研究发现:过表达miR-155可明显抑制巨噬细胞对氧化性低密度脂蛋白的结合和摄取,从而抑制巨噬泡沫细胞的形成,提示miR-155可能参与了动脉硬化的形成过程[10]。冠心病患者血浆中miR-155的表达水平明显低于非冠心病患者,并且其表达随着病情的加重而下降[11]。本研究中健康组miR-155的表达水平高于血瘀证组和非血瘀证组,这与既往研究结果一致;但血瘀证组miR-155的表达水平高于非血瘀证组,这与其他研究结果有异,一方面可能由于疾病的差异性导致结果差异,另一方面考虑高血压病非血瘀证向血瘀证发展的过程中,血管内皮细胞的损伤日益加重,炎症因子的释放逐渐增加,从而导致miR-155在血浆中的表达增加。
4.3 VCAM-1是miR-126直接或间接的靶基因,VCAM-1表达水平的升高与高血压及血瘀证血管内皮功能损伤的相关性已被众多研究证实[12-15]。研究显示,miR-126可通过上调内皮细胞VCAM-1的表达参与血管炎症反应[3]。本研究中血瘀证组和非血瘀证组VCAM-1的表达水平均高于健康组,且血瘀证组明显高于非血瘀证组,提示VCAM-1作为血瘀证血管内皮功能异常的标志,正是miR-126调控高血压病血瘀证的机制靶点。
4.4 TM是高血压病血瘀证的微观辨证指标 TM存在于除脑血管外的所有ECs中,被认为是反映血管内皮细胞损伤的最佳指标之一[12]。本研究中血瘀证组和非血瘀证组的血浆TM水平均高于健康组,且血瘀证组高于非血瘀证组,该结果与既往研究报道相符[16],提示TM可作为高血压形成血瘀证的微观辨证指标。
[1] 黄守清,许艺惠,尹莲花.血管内皮细胞miRNAs与高血压病血瘀证的相关性研究进展[J].医学综述,2016,22(11):2085-2088.
[2] 曲华,郭明,柴华,等.冠心丹参滴丸对慢性稳定型心绞痛血瘀证患者血瘀证计分及血清相关黏附因子水平的影响[J].中医杂志,2017,58(5):394-397.
[3] XU Q,LUAN T,FU S,et al.Effects of pitavastatin on the expression of VCAM-1 and its target gene miR-126 in cultured human umbilical vein endothelial cells [J].Cardiovasc Ther,2014,32(5):193-197.
[4] 郑华峰,陶晶,张斌,等.MicroRNA-155在高糖诱导人血管内皮细胞中的表达及功能研究[J].临床心血管病杂志,2016,33(4):392-397.
[5] 吴金花,张海丽,付梅.H型高血压患者血管内皮损伤与炎症反应的相关性研究[J].武警后勤学院学报(医学版),2015,24(8):631-633.
[6] 中国高血压防治指南修订委员会.中国高血压防治指南2010[S].中华心血管病杂志,2011,39(7):579-616.
[7] 中国中西医结合学会活血化瘀专业委员会.血瘀证中西医结合诊疗共识[S].中国中西医结合杂志,2011,31(6):839-844.
[8] 孟庆友.miR-126靶向PIK3R2调控内皮祖细胞及在静脉血栓再通中的作用研究[D].苏州:苏州大学,2014.
[9] 张新焕.动脉硬化关键信号分子相关的血清microRNA在亚临床甲减病人中表达谱初探[D].济南:山东大学,2014.
[10]王兴波,曹运长.miR-155在动脉粥样硬化中的研究进展[J].临床与病理杂志,2015,35(12):2185-2190.
[11]李文琴.血小板miR-146a及miR-155表达水平在急性冠脉综合征中的意义[D].昆明:昆明医科大学,2015.
[12] 黄为民,刘时彦,张润慧,等.高盐饮食对大鼠血浆AngⅡ、CGRP、ICAM-1、VCAM-1和 P-S的表达的影响[J].昆明医科大学学报,2015,36(11):8-11.
[13]张静,王光允,张秀梅,等.妊娠高血压疾病与血管细胞粘附因子相关性的研究[J].临床和实验医学杂志,2015,14(15):1267-1269.
[14] ZHANG H G,GUO W,GU H F,et al.Correlation of VCAM-1 expression in serum,cord blood,and placental tissue with gestational hypertension associated with fetal growth restriction in women from Xingtai Hebei,China [J].Genet Mol Res,2016,15(3):10.4238 /gmr.15038274.
[15] DE LA SIERRA A,LARROUSSE M,OLIVERAS A,et al.Abnormalities of vascular function in resistant hypertension [J].Blood Press,2015,21(2):104-109.
[16]林建著,许艺惠,黄守清.畅脉乐胶囊对血瘀型高血压病患者血管内皮细胞分泌血栓调节蛋白的影响[J].福建中医药,2015,46(5):47-49.
R544.1
A
1000-338X(2017)05-0004-02
2017-03-08
福建省自然科学基金资助项目(2014J01344)
尹莲花(1984—),女,从事健康管理及慢性病防治研究。
黄守清(1966—),男,副主任医师。 E-mail:hsqtj@163.com
