燕麦麸皮β-葡聚糖的提取优化研究
2017-11-24蔡天革侯倩倩唐凤德
蔡天革,侯倩倩,唐凤德
(1.辽宁大学 生命科学院,辽宁 沈阳 110036; 2.辽宁大学 商学院,辽宁 沈阳 110036)
燕麦麸皮β-葡聚糖的提取优化研究
蔡天革1,侯倩倩1,唐凤德2*
(1.辽宁大学 生命科学院,辽宁 沈阳 110036; 2.辽宁大学 商学院,辽宁 沈阳 110036)
燕麦中的可溶性膳食纤维的主要成分为β-葡聚糖,其许多功能的实现都要依赖于β-葡聚糖.实验以燕麦麸皮为材料,以水为溶剂提取其中β-葡聚糖,用刚果红分光光度法测量各提取条件下燕麦麸皮β-葡聚糖的得率.通过单因素实验以及正交实验确定燕麦麸皮β-葡聚糖提取得率最高的条件组合.结果表明:实验中各因素对燕麦麸皮β-葡聚糖的提取率都有一定影响,影响顺序依次为提取液pH>料液比>反应温度>提取时间.提取β-葡聚糖的最佳条件为:提取时间100 min,料液体积比1∶20,提取液pH 10,反应温度10 ℃,在此提取条件中β-葡聚糖的得率为4.31%.
β-葡聚糖;刚果红法;正交实验
0 引言
燕麦属禾本科燕麦属一年生植物,在加拿大,美国,中国等地均有分布.燕麦一般分为皮燕麦和裸燕麦两种类型,我国的燕麦以裸燕麦居多.燕麦作为粮食作物,其中含有丰富的蛋白质、淀粉、脂肪、膳食纤维、矿物质等[1],而且其中多种营养物质的含量都高于其他谷类作物.在燕麦加工中,由于籽粒软,麸皮与胚乳不易分离,麸皮中含有一定的胚乳并且含有高比例的蛋白质和膳食纤维[2].燕麦膳食纤维[3-4]由木质素和多糖化合物组成,其多糖化合物又由β-葡聚糖,果胶等组成,具有降低胆固醇和低密度脂蛋白的功能.有关研究表明燕麦膳食纤维的多种功能主要是由β-葡聚糖实现的[5-6].
谷类中的β-葡聚糖[7-8]主要存在于麸皮及胚乳细胞壁中.燕麦中β-葡聚糖的含量远远高于如大麦、小麦等其他谷类作物.β-葡聚糖是一种非淀粉类的多糖,具有良好的水溶性,吸水性,能清除体内自由基,具有降血脂[9-10]、抗衰老[11]、清肠道[12]等功能,而且β-葡聚糖溶液具有一定粘性[13],在食品中可以起到增稠的作用,因此β-葡聚糖在医药,化妆品以及食品产业中有广泛地应用.
近年来越来越多的人投入到β-葡聚糖的研究中.因此探究出β-葡聚糖提取最简单、最佳的方法和条件,使得有关研究更快捷的进行,变得至关重要.本实验以燕麦麸皮为原材料,探究刚果红分光光度法[14]提取燕麦β-葡聚糖,各因素对燕麦麸皮β-葡聚糖得率的影响,以及此方法中β-葡聚糖得率最大的条件,为后续β-葡聚糖降血糖[10]、抑菌[15]等生理功能的研究提供一种简单快速高效的β-葡聚糖的提取方法.
1 实验材料与方法
1.1 材料与仪器
燕麦:白燕2号 吉林省白城农科院提供;
β-葡聚糖标准品 Sigma公司;
刚果红,磷酸氢二钠,磷酸二氢钠,碳酸氢钠,氢氧化钠,过硫酸铵等,均为分析纯;
旋转式往复式水浴恒温振荡器,上海四瑞仪器有限公司;
JW-3021高速冷冻离心机,安徽嘉文仪器装备有限公司;
UV-2700紫外可见分光光度计,岛津企业管理(中国)有限公司;
标准型pH计,赛多利斯科学仪器(北京)有限公司.
1.2 方法
1.2.1 刚果红分光光度法[16]测量燕麦麸皮β-葡聚糖含量的标准曲线的绘制
取六组试管,分别标组号1-6,除标号1组外,其余每组3支作为平行试管.将β-葡聚糖标准溶液稀释为等梯度的5个浓度分别取1.0 mL加入2-6号试管中,1号试管中加入等量的蒸馏水.在上述试管中分别加入4.0 mL的刚果红溶液摇匀,室温下准确反应10 min,于545 nm波长下测定吸光度,以1号试管中的反应液作空白对照调零.
1.2.2 燕麦麸皮β-葡聚糖得率的测定
采用刚果红分光光度法测定β-葡聚糖浓度,其得率计算公式:
得率(%)=100 m/M
式中:m为测定的燕麦麸皮中β-葡聚糖的质量,g;M为燕麦麸皮质量.
1.2.3 单因素实验
选择提取液pH,料液比(V),提取时间,反应温度为影响因素[17],研究各影响因素的不同水平对燕麦麸皮β-葡聚糖得率的影响.
1.2.3.1 提取液pH对燕麦麸皮β-葡聚糖得率的影响
选择提取温度为50 ℃,料液比(V)为1∶15,提取时间90 min,反应温度为15 ℃,研究pH为 7、8、9、10、11 时对燕麦麸皮β-葡聚糖得率的影响.
1.2.3.2 料液比对燕麦麸皮β-葡聚糖得率的影响
选择提取温度为50 ℃,提取时间为90 min,提取液pH为7.0,反应温度15 ℃,研究了料液比(V)为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35时对燕麦麸皮β-葡聚糖得率的影响.
1.2.3.3 提取时间对燕麦麸皮β-葡聚糖得率的影响
选择料液比(V)为1∶15,提取液pH为7.0,反应温度15 ℃,研究提取时间为60、70、80、90、100、110、120 min时对燕麦麸皮β-葡聚糖得率的影响.
1.2.3.4 反应温度对燕麦麸皮β-葡聚糖得率的影响
选择提取时间90 min,料液比(V)为1∶15,提取液pH为7.0,研究反应温度为12、16、20、24 ℃时对燕麦麸皮β-葡聚糖得率的影响.
1.2.4 正交实验设计
在提取液pH,料液比(V),提取时间,反应温度4个单因素实验的基础上选择三个对燕麦麸皮β-葡聚糖得率影响相对较大的因素各取3个水平,进行L9(34)正交实验,实验因素与实验水平编码如表1.
1.2.5 燕麦 β-葡聚糖
燕麦麸皮于烘箱中105 ℃烘2h,加入提取溶剂,恒温水浴振荡浸提一定时间.提取液以4 000 r/ min 离心20 min后收集上清,加入2倍体积的过硫酸铵溶液4 000 r/ min离心20 min.反复提取三次后定容10 mL.吸取0.1 mL提取的β-葡聚糖溶液,依次加入1.9 mL的蒸馏水,4.0 mL的刚果红,一定温度下准确作用10 min.以2.0 mL蒸馏水作空白,在545nm波长下测定反应液吸光度,根据β-葡聚糖标准曲线以及得率计算公式即可得知样品中β-葡聚糖的含量.
1.3 统计分析
采取Excel 2003对单因素实验进行分析,采用SPSS21.0对正交实验进行分析.
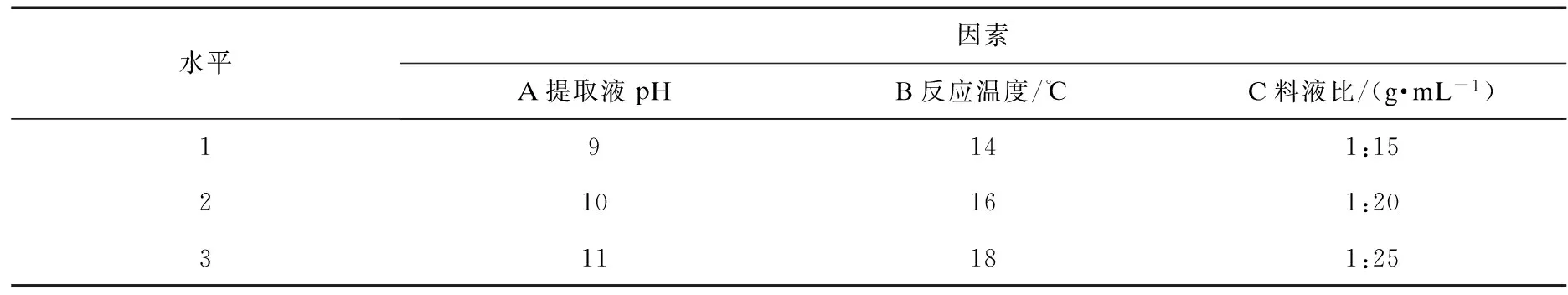
表1 正交实验因素与水平编码表
2 结果与分析
2.1 燕麦β-葡聚糖含量的标准曲线
以β-葡聚糖质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,结果如图1.

图1 刚果红法测量β-葡聚糖的标准曲线
2.2 影响燕麦麸皮β-葡聚糖得率的单因素实验
2.2.1 pH值
β-葡聚糖作为可溶性纤维的一种可溶于弱酸性和弱碱性的溶液中,而且在不同的溶液中β-葡聚糖的溶解度不同.由图2可知随着pH的升高燕麦麸皮β-葡聚糖的得率增加,在pH 10的溶液中其提取率达到最大,pH大于10以后燕麦麸皮β-葡聚糖的提取率下降.β-葡聚糖在弱酸和弱碱溶液中会发生水解,在一定的时间与pH范围内,时间与pH的增加与水解过程成正比.实验提取过程中β-葡聚糖的析出与水解是同时进行的.所以pH 10本实验中燕麦麸皮β-葡聚糖得率最大时的pH值.
2.2.2 料液比
由图3可知随着料液比的增加β-葡聚糖的得率也在增加,在1∶20时达到最大;料液比(V)超过1∶20 以后得率反而降低.根据固液萃取基本理论,增大溶剂量有利于溶质的析出和扩散.但当溶质的析出达到一个动态平衡时通过加大溶剂的量来提高溶质的析出量意义不大.

图2 提取液pH对燕麦麸皮β-葡聚糖得率的影响

图3 料液比对β-葡聚糖的率的影响
2.2.3 提取时间
由图4可知随着提取时间的增加,燕麦麸皮β-葡聚糖的得率增加,在提取时间为100 min时得率达到最大,提取时间超过100 min时得率又降低.因为随着时间的增加燕麦麸皮β-葡聚糖的浸出更加充分而时间过长导致浸出的β-葡聚糖被重新吸附从而导致得率下降[17].而已经析出的β-葡聚糖长时间处于高温的碱溶液中反而会发生水解.
2.2.4 反应温度
反应温度指刚果红与燕麦麸皮β-葡聚糖反应时的温度.对β-葡聚糖的提取率没有直接影响,它影响了反应液的吸光度使得测量时的数值偏低[16],由图4可知随着反应温度的升高燕麦麸皮β-葡聚糖的得率降低.本实验中16 ℃是燕麦麸皮β-葡聚糖得率最大的反应温度.
2.3 影响燕麦麸皮β-葡聚糖得率的正交实验
由单因素实验结果可知,在上述因素中提取液pH、固液比 、反应温度 、对燕麦麸皮β-葡聚糖得率的影响相对较大,因此对这三个因素进行正交实验,结果如表2,表3.
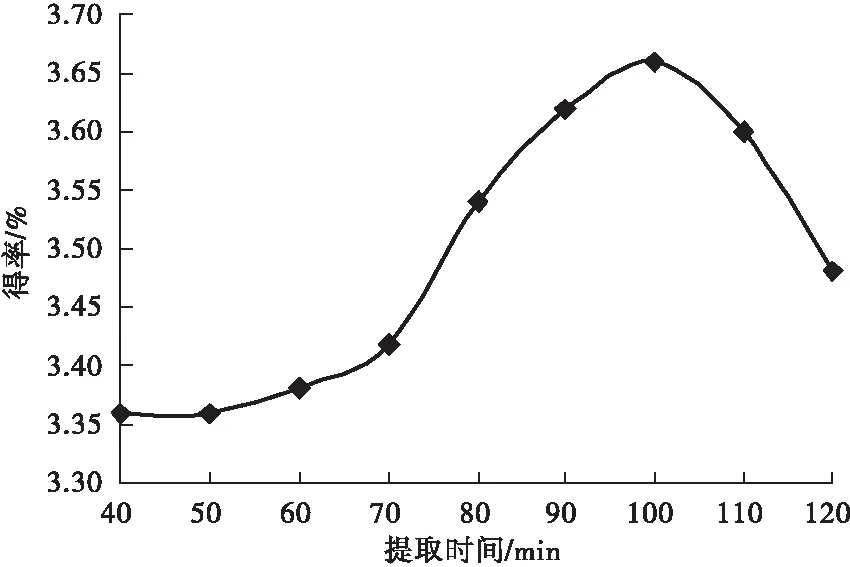
图4 提取时间对燕麦β-葡聚糖得率的影响

图5 反应温度对燕麦β-葡聚糖得率的影响
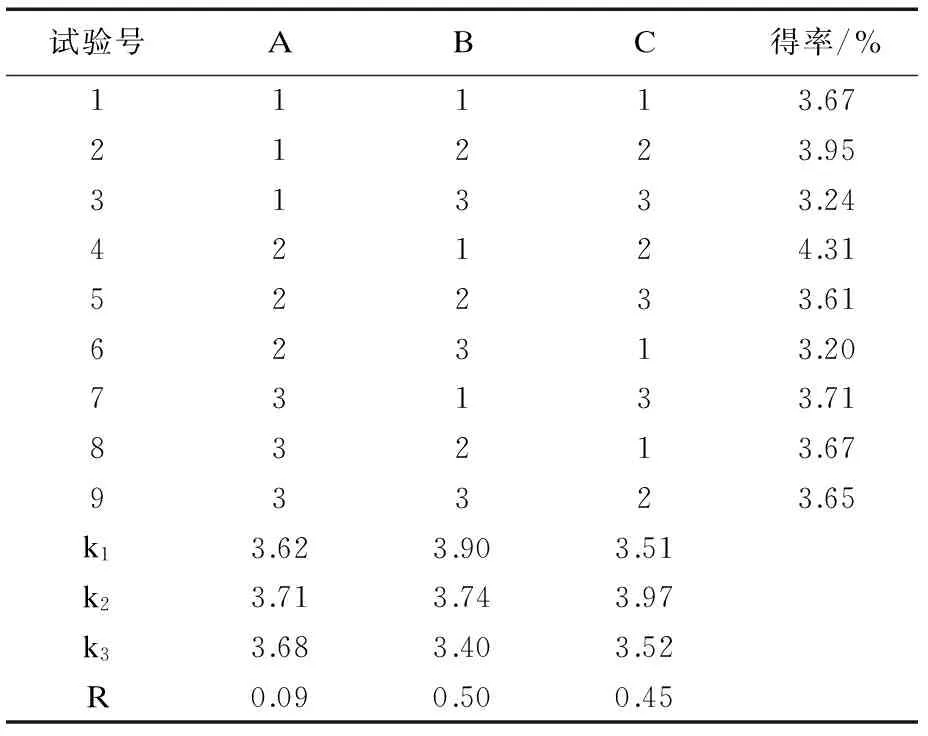
试验号ABC得率/%11113.6721223.9531333.2442124.3152233.6162313.2073133.7183213.6793323.65k13.623.903.51k23.713.743.97k33.683.403.52R0.090.500.45
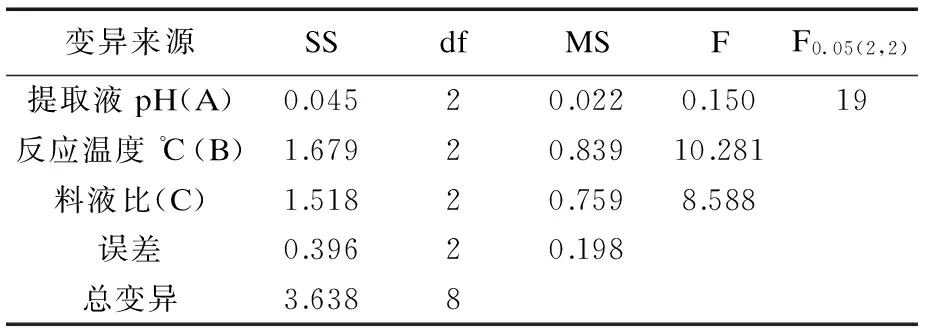
表3 正交实验方差分析
由表2,表3可知,各提取因素对燕麦麸皮β-葡聚糖得率影响均不显著,影响的顺序为提取液pH>料液比>反应温度.提取燕麦麸皮β-葡聚糖的最佳方案为A2B1C2,即提取液pH 10,反应温度14 ℃,料液比1∶20,在此条件下β-葡聚糖的得率为4.31%.
3 结论
本实验中各因素对燕麦麸皮β-葡聚糖的提取率都有一定影响但是影响均不显著,影响顺序依次为提取液pH>料液比>反应温度>提取时间.燕麦麸皮β-葡聚糖提取的最佳条件为:提取时间100 min,提取液pH 10,料液比(V)1∶20,反应温度10 ℃,在此条件下燕麦麸皮β-葡聚糖得率4.31%.
[1] 刘影,董利.燕麦营养成分与保健作用[J].中国粮食与营养,2009,(3):55-57.
[2] 董吉林,申瑞玲.裸燕麦麸皮的营养组成分析及β-葡聚糖的提取[J].山西农业大学学报,2005,(1):70-73.
[3] 黄桂英,常春.燕麦在我国保健食品工业中的开发现状[J].粮油食品,20-21.
[4] 陈春梅.膳食纤维对人体健康的影响[J].中国粮食与营养,2006,(11):48-50.
[5] 宁鸿珍,贾春媚,唐咏梅,等.燕麦β-葡聚糖对高脂血症大鼠抗脂质过氧化作用的研究[J].现代预防医学,2008,(7):1237-1238.
[6] 申瑞玲,董吉林,李文全.燕麦 β-葡聚糖对高脂血症大鼠胆固醇代谢的影响[J].中国食品学报,2009,(3):14-19.
[7] 闫雅岚.燕麦β-葡聚糖研究进展[J].食品粮油科技,2009,(5):5-7.
[8] 王尚玉.燕麦中β-葡聚糖的研究进展[J].食品粮油科技,2004,(6):47-48.
[9] 汪海波,谢笔钧,刘大川.燕麦中β-葡聚糖及抗氧化成分研究进展[J].粮食与油脂,2004,(8):16-19.
[10] 汪海波,谢笔钧,刘大川.燕麦中β-葡聚糖及抗氧化成分研究进展[J].粮食与油脂,2004,(8):16-19.
[11] 严明强,张红兵.β-葡聚糖在化妆品中的应用[J].香料香精化妆品,2007,(6):31-34.
[12] 吴绍函,沈群,刘宏,等.燕麦 β-葡聚糖对肠道的保健作用研究进展[J].食品工业科技,2012,(17):388-392.
[13] Tamer H.Gamel,El-Sayed M.Abdel-Aal,Nancy P.Ames,et al.Enzymatic extraction of beta-glucan from oat bran cereals and oat crackers and optimization of viscosity measurement[J].Journal of Cereal Science,Journal of Cereal Science,2014,(59):33-40.
[14] 李小鹏,苏宁,童军茂,等.不同方法提取的燕麦β-葡聚糖分子量及其透皮吸收研究[J].食品科技,2012,(12):252-256.
[15] Suchecka D,Harasym J P,Wilczak J,et al.Antioxidative and anti-inflammatory effects of high beta-glucan concentration purified aqueous extract from oat in experimental model of LPS-induced chronic enteritist[J].journal of functional foods,2015,(14):244-254.
[16] 张如,戴巧玲,吴小燕,等.分光光度法测定燕麦β-葡聚糖的含量[J].中国粮油学报,2016,6(31):140-145.
[17] 林伟静,吴广枫,周素梅,等.燕麦全粉中β-葡聚糖提取工艺优化[J].食品与机械,2010,(1):121-125.
(责任编辑李超)
RearchofExtractionandOptimizationofOatBranβ-glucan
CAI Tian-ge1,HOU Qian-qian1,TANG Feng-de2*
(1.CollegeofLifeScience,LiaoningUniversity,Shenyang110036,China;2.BusinessSchool,LiaoningUniversity,Shenyang110036,China)
The main component of soluble dietary fiber in oats is β-glucan,and many of its functions are dependent on β-glucan.In this experiment,oat bran was taken as the material,the β-glucan was extracted by Congo red extraction and the yield of β-glucan from oat bran was deter mined by spectrophotometry.The single factor test and orthogonal test were used to deter mine the combination of the highest extraction yield of oat bran β-glucan.The results showed that the extraction rate of oat bran β-glucan was influenced by the factors of the experiment,and the order was pH>ratio of material to solvent>reaction temperature>extraction time.The optimum extraction conditions were as follows:extraction time 100 min,ratio of material to liquid 1:20,extraction pH 10,reaction temperature 10 ℃.Under the optimal extraction condition,β-glucan The extraction rate was 4.31%.
β-glucan;congo red extraction; orthogonal experiment
R 284.2
A
1000-5846(2017)04-0351-06
2017-02-20
国家燕麦荞麦产业技术体系资助项目(CARS-08)
蔡天革(1966-),女,教授,从事植物生理生态和天然产物研究.
*
唐凤德(1967-),男,教授,从事生态学和生态旅游研究,E-mail:tangfd@126.com.
