水沙环境变化对季节性多沙河流沉积物菌群特征的影响
2017-11-23周孝德
刘 睿,周孝德
水沙环境变化对季节性多沙河流沉积物菌群特征的影响
刘 睿,周孝德*
(西安理工大学西北旱区生态水利工程国家重点实验室,陕西西安 710048)
为辨析沉积物粒度特征、氮磷含量及上覆水水质3类环境因子,对季节性多泥沙河流沉积物细菌群落多样性和结构特征变化的影响,采用T-RFLP技术分析了不同水文时期渭河(陕西段)流域沉积物细菌群落结构变化特征,并通过冗余分析和蒙特卡罗检验识别了不同时期的关键环境驱动因子.结果表明,不同水文时期渭河水沙环境差异显著.丰水期沉积物TN含量升高了1~2个数量级,且空间差异明显减小(RSD=17%).沉积物中的氮磷比受上覆水氮磷比影响较大,两者之间在丰水期呈现出一定的正相关关系(0.687,P=0.6).渭河干流沉积物细菌群落Shannon多样性指数在2.02~3.18之间,不同时期的沿程变化特征各异.相对平水期和枯水期,丰水期渭河沉积物细菌多样性的空间差异最大(RSD=37.4%),不同点位优势群落结构组成的Bray-Curtis相似度最低(17.4%).PAT比对表明优势细菌大多归属于变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes).沉积物氮磷含量对细菌群落变化的影响,在平水期和枯水期较为直接.上覆水水质对不同水文时期沉积物菌群变化解释度的贡献占比超过60%,对丰水期沉积物微生物环境的影响尤其显著.
渭河;沉积物;细菌群落;T-RFLP
沉积物是河流水生态环境的重要组成部分.其间以细菌为主的微生物,是河流底部生物地球化学过程的重要参与者[1-3].在不同的水力条件和理化状态下,河流底部沉积物与上覆水进行着不同程度的化学物质[4-5]与生物信息[6]交换,从而持续影响和塑造着河床沉积物的微生物生态环境.
对于季节性多泥沙河流,不同水文时期的河道水力特征、泥沙行为与颗粒特性迥异,影响沉积物微生物群落的环境因子更为复杂.基于分子微生物技术,国内外学者对全球不同区域的地表水体沉积物中,细菌群落结构的垂向和水平分布及季节变化特征进行了大量研究[7-9],并分析了沉积物化学特性,如有机物[10]、氮[11]、磷[12-13]、重金属[14-15]、pH值[8]、土质类型[16]等对细菌群落的影响.但相关研究对水文及泥沙含量时空差异显著的季节性多沙河流关注较少,此类河流的沉积物化学性质、粒度特征及上覆水水质同沉积物细菌群落特征的相关关系,以及上述各类环境因子对细菌群落变化影响程度的相对大小尚未明晰.
本文以我国西北地区典型季节性多泥沙河流——渭河为例,采用末端限制性片段长度多态性技术(T-RFLP),分析了渭河干流及南北两典型支流的沉积物细菌群落结构及多样性的时空变化特征,结合限制性排序分析,探究了不同水文时期影响群落的关键环境因子的差异,比较了沉积物氮磷、沉积物粒度特征、上覆水水质三类环境因子对细菌群落变化的贡献量,旨在为同类河流水生态环境相关研究和管理保护提供参考和依据.
1 材料与方法
1.1 研究区域与采样方法
陕西渭河流域地处半干旱半湿润地区,冬季干燥寒冷,夏季炎热多雨,不同季节水沙变化悬殊,年径流量的56%~70%和输沙量的60%~ 90%集中在汛期7~10月[17-18].渭河南北支流的水沙特征迥异,其南岸秦岭北麓是黄河中下游重要的洪水来源区,北岸黄土高原则为黄河流域的主要产沙区[19].考虑到渭河陕西段沿程环境变化及两岸支流水沙特征差异,本研究选取的渭河(陕西段)流域,涵盖了渭河中游(宝鸡峡至咸阳铁桥)和下游(咸阳铁桥至潼关入黄口)干流,以及黑河(南)与泾河(北)两条重要支流.渭河干流采样点W1~W3属中游河段,分别处于宝鸡、咸阳武功、咸阳兴平行政区;W4~W6属下游河段,其中W4、W5处于西安市、W6处于潼关行政区.W2与W4分别位于黑河与泾河汇入之前的干流河段,W3与W5分别位于黑河与泾河入汇之后的干流河段.具体采样点位置如图1所示.
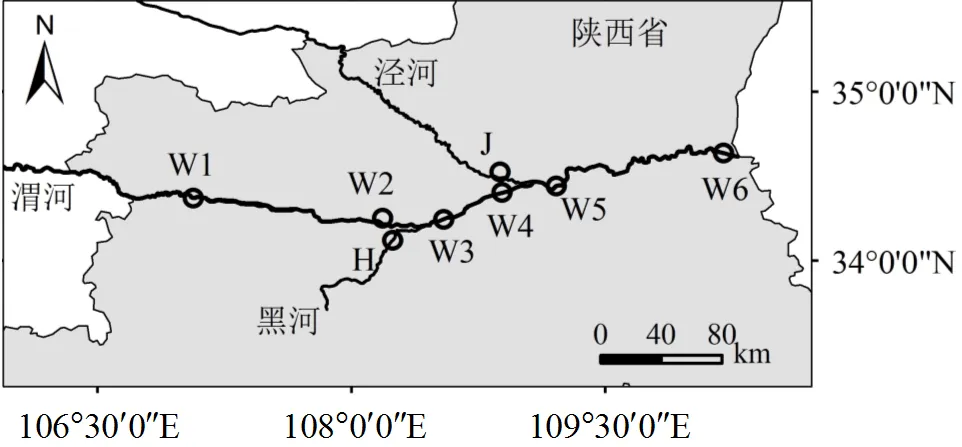
图1 采样点地理位置
河流表层沉积物样本(约0~10cm)使用彼得逊抓泥斗于河流断面中心10m范围内采集,每个断面采集3~5次,分装于500mL无菌广口聚乙烯瓶.采集沉积物之前,用有机玻璃采水器在沉积物采集点上方采集水样3L用于水质检测.沉积物和水样经冰上运输至实验室4℃保存,并尽快进行后续分析.
1.2 环境理化指标分析方法
充分冷冻干燥的沉积物样本,经混匀、研磨、过筛后,采用Foss8400全自动凯氏定氮仪测定总氮(TN)含量,采用瑞典FI515流动注射分析仪测定氨氮(NH4+-N)和硝态氮(NO3--N)含量,采用HClO4-H2SO4消煮、钼锑抗比色法测定全磷(TP)含量,并通过Mastersizer 2000激光粒度仪测定冻干沉积物的颗粒粒度分布.水质相关指标及分析方法与之前对渭河浮游菌群的研究相同[20].
1.3 T-RFLP实验方法
沉积物样本中的总DNA使用PowerSoil ® DNA Isolation Kit(Mo Bio)提取.选择5'端带FAM荧光标记的细菌通用引物27F(5'-GAGTTT- GATCMTGGCTCAG-3')/1492R(5'-GGTTACC- TTGTTACGACTT-3')进行PCR扩增.扩增体系和反应条件采用之前土壤和地表水相似研究中的方法[21-22].扩增产物经纯化(TIANquick Mini Purification Kit)后,采用限制性内切酶HhaⅠ(TaKaRa)酶切2h,70℃灭活15min送检.
1.4 数据分析方法
将T-RFLP峰谱图扫图结果中50~500bp的片段作为有效片段[22].使用PRIMER 5.0统计各样本中细菌群落的物种丰度(),均匀度()和Shannon多样性(),并计算样本群落间Bray- Curtis相似度,完成群落聚类分析.通过在线比对工具Phylogenetic Assignment Tool(PAT) (http: //mica.ibest.uidaho.edu/pat.php),识别不同片段代表的细菌类群[23].采用Canoco 4.5对细菌群落限制性片段(T-RF)相对丰度>0.05的部分进行去趋势分析(DCA)[24],结果表明各季节优势细菌群落数据均适合冗余分析(RDA).最后通过手动选择,在候选指标中依次选出不存在共线性的环境因子[25],并对各个入选指标和最终排序结果进行蒙特卡罗检验.
2. 结果与讨论
2.1 沉积物粒度特征、氮磷含量及上覆水水质
渭河各样点沉积物颗粒粒度特征指标如表1所示,其中粒度多样性(PSD)通过Shannon多样性指数公式计算得出[26].西安样点(W4)沉积物同其它样点相比,中位粒径明显偏大.这同宋进喜等[27]2011年在相近河段的采样分析结果相一致.除W4样点外,非汛期渭河流域沉积物中值粒径(D50)均值为33.1μm,沉积物构成以中粉砂和细粉砂为主[28].由于降水较少,枯水期采集到的沉积物粒度构成通常可以稳定较长时间(6~7个月)[29].对比丰枯两季各样点的粒度分布差异,可以看出丰水期雨洪对渭河陕西段沉积物的影响存在明显的分段特征.结合丰水期W1样点上覆水中极高的颗粒物浓度(TSS=16.33g/L)可以看出,上游雨洪携带着大量泥沙.这些上游来沙使宝鸡峡下游W1样点沉积物中的细颗粒和粒度多样性显著增加,体积平均粒径显著减小.进入中游(宝鸡峡-咸阳铁桥)宽浅河段后,河流中的泥沙逐步沉积(同期上覆水TSS经此河段降低83%),使相应样点(W2和W3)沉积物的体积平均粒径和中位粒径明显增大.进入渭河下游蜿蜒河段后,颗粒进一步淤积,相应样点(W5和W6)沉积物的比表面积减小,颗粒平均粒径变化程度降低.
丰水期渭河流域沉积物TN含量较平、枯两季提升了1~2个数量级,氮磷比(N/P)也显著增加(表2).同时,流域内各样点沉积物TN与N/P的空间相对标准偏差,在平、枯两季均高于88%,而在丰水期显著减小至17%和48%.结合对沉积物粒度特征沿程变化的分析可以看出,丰水期上游泥沙在渭河陕西段的沿程沉积过程,显著改变了沉积物的化学性质,使流域沉积物趋于均质化.渭河干流与泾河样点沉积物TP含量的最低值出现在枯水期,且此时的空间异质性(RSD=65%)较其它时期更高.上覆水的实测结果显示,枯水期各样点水体TP含量与平水期相近,而溶解态总磷(DTP)较平水期平均增加了一倍.冬季水生动植物残体矿化可能引发沉积物氧化还原条件改变[30],从而导致沉积物发生磷解吸,使含磷量降低.

表1 丰枯两季各样点沉积物颗粒粒度特征
Pearson相关性分析结果表明,丰水期沉积物粒度特征与TP含量存在显著相关关系.颗粒比表面积()与TP含量显著负相关(-0.844,= 0.008),中值粒径(D50)与TP含量显著正相关(0.867,=0.005).沉积物氮磷比与上覆水氮磷比之间,仅在丰水期存在中度正相关关系(相关系数为0.687),但显著性水平不高(=0.6).
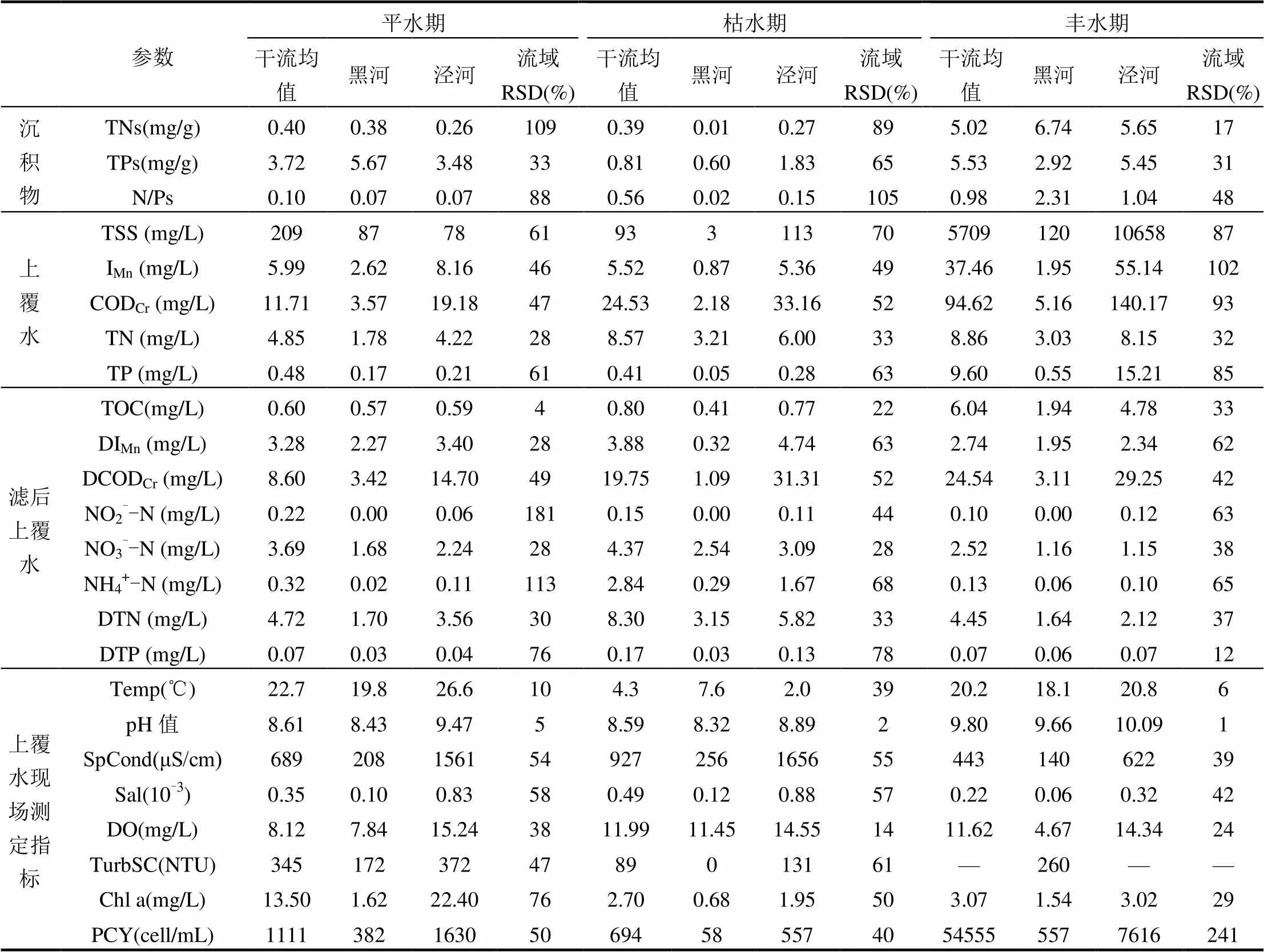
表2 沉积物氮磷及上覆水水质特征
注:Temp-温度,SpCond-电导率,Sal-盐度,TrubSC-浊度,PCY-藻细胞,RSD-相对标准偏差.
2.2 沉积物细菌群落多样性的时空分布
三季24个沉积物样点共检出限制性片段(T-RF)97条.渭河中下游流域沉积物细菌物种丰度的空间差异大于群落均匀度和多样性,相对标准偏差(RSD)呈现丰水期>枯水期>平水期的关系(表3).枯水期渭河干流物种丰度(21)和多样性(2.73)最高,丰水期最低.这与东平湖沉积物细菌多样性特征的季节变化规律一致[31].平水期支流与干流的物种数、均匀度和多样性最为接近;枯水期和丰水期的物种数和多样性均表现为黑河高于干流,泾河低于干流的关系.整体来看,黑河样点沉积物细菌多样性较高,稳定在2.8以上,而泾河样点沉积物细菌多样性季节波动剧烈,不同时期的多样性均值为1.75.作为渭河南、北两岸支流的代表,黑河流域土地以林地和农田为主,河流含沙量小、有机污染少、水质状况较好[32-33];而泾河流经黄土高原地区,含沙量大,并接受大量的城市污水和工业废水,水质较差[34-35].黑河与泾河沉积物微生物多样性的差异,与水文特征与流域污染状况相对应,体现了渭河南北两岸支流迥异的水生态环境.
不同时期渭河干流和的沿程变化趋势相似,物种数较高的点位,多样性也较高.平水期渭河干流沉积物细菌Shannon多样性指数变化范围在2.37~2.82之间(图2).中游河段(W1~W3)多样性稳定而略有增加,经西安临潼河段(W4、W5)多样性下降到最低值后,至下游潼关W6样点恢复至中游水平.枯水期渭河干流沉积物细菌多样性自上游至下游逐步减小(2.12~3.18),丰水期则沿程表现出较大的上下波动(2.02~2.89).渭河干流沉积物氮、磷含量在丰水期趋于空间均质化,但细菌群落多样性却表现出高于其它时期的空间差异(RSD=37.4%).这些均表明了水沙特征变化剧烈的季节性河流中,沉积物细菌群落变化驱动因子的复杂性.
图2 不同水文时期沉积物细菌群落Shannon多样性指数沿程变化趋势
Fig.2 Shannon index variation of sediment bacterial communities along Weihe River

表3 河流域沉积物细菌群落多样性统计
2.3 优势细菌群落构成及聚类分析
将各样点中相对丰度高于5%的所有T-RFs集合视为优势细菌群落,以不同颜色表示优势T-RF在样点中的相对丰度,并计算各样点Bray-Curtis相似度,对细菌群落进行聚类分析,得到的结果如图3所示.平水期、枯水期和丰水期流域内各样点检测出的优势T-RF种类分别为26、21和31种.丰水期沉积物中的优势细菌种类最丰富,细菌群落组成的空间相似度最低(17.4%);枯水期沉积物优势菌种最少,菌群结构的空间相似度最高(35.8%).
优势片段202bp和204bp出现在枯水期除泾河(J)外的所有样点中,相对丰度分别达到6.0%~28.1%和4.8%~14.0%,是枯水期渭河中下游沉积物普遍存在的优势细菌类群.经PAT比对,202bp和204bp T-RF通常来自β-变形菌纲中的菌群,前者多归属于纤毛菌属(sp.),后者可能涉及丛毛单胞菌属(sp.)、食酸菌属(sp.)、代尔夫特菌属(sp.)等.87bp和99bp出现在枯水期超过50%的样本中,其中99bp在下游样点(W5和W6)中的丰度达到26%以上,是枯水期渭河下游河段的关键优势菌种.经比对,87bp T-RF指示的菌群极可能为拟杆菌门黄杆菌属中的噬冷黄杆菌().99bp T-RF则可能来自ε-变形菌纲(-)中的弯曲菌属(sp.)、沃林氏菌属(sp.)、螺杆菌属(sp.),γ-变形菌纲(Proteobacteria)中的硫微螺菌属(sp.)、假单胞菌属(sp.)、曼氏杆菌属(sp.),以及拟杆菌门中的拟杆菌属(sp.)、列文虎克菌属(sp.)和黄杆菌属(sp.)等.
57、58、63、77、93bp是不同季节都有检出的优势片段.其中57bp和63bp经常出现在渭河中游(W1、W2)与黑河(H)样点,93bp则检出于不同季节的两支流和咸阳(W3)、西安(W4)样点.在比对结果中,58bp T-RF指示的菌群常见于土壤、沉积物及白蚁和蚯蚓消化道,从属于δ-变形菌纲(δ)和α-变形菌纲(α).77bp T-RF指示的菌群多鉴定为放线菌门下的节细菌属(sp.)和微颤菌属(sp.).93bp T-RF广泛分布在深海、湖泊、污水处理系统等不同类型的环境中,菌群主要涉及ε-变形菌纲中的螺杆菌属(sp.),δ-变形菌纲中的暗杆菌属(sp.)、地杆菌属(sp.),α-变形菌纲的鞘脂单胞菌属(sp.)和sp.菌属,以及拟杆菌门中的黄杆菌属、地杆菌属和噬纤维菌属(sp.)等.

图3 沉积物优势细菌群落T-RF构成及聚类关系(N-平水期,D-枯水期,W-丰水期)
51bp和52bp几乎仅在泾河样点中出现,且在泾河沉积物细菌群落中的相对丰度均超过70%,是该样点的绝对优势菌群.它们曾经被检出于厌氧膜生物反应器[36]和湿地香蒲根际环境[37]中,可能指示了对污染物降解具有积极意义的菌群.
统计不同样点和不同时期的群落相似度均值(表4),结果表明W1、W3和H样点在不同季节的Bray-Curtis相似度最高(均>35%),沉积物优势细菌群落结构最为稳定.泾河样点相似度均值最低(仅5.8%),沉积物优势细菌群落结构的季节差异最大.不同时期流域内各样点优势菌群相似度均值的大小关系为:枯水期>平水期>丰水期,表明丰水期水沙过程增大了沉积物优势群落结构在流域内的空间差异,对河流沉积物微生物生态过程具有重要影响.

表4 Bray-Curtis相似度均值(%)
2.4 不同水文时期关键环境因子的识别
在沉积物氮磷指标(TNs、TPs、N/Ps)的基础上,依次加入沉积物颗粒粒度特征指标(,[4,3],D[3,2],d10,d50,d90,PSD)和上覆水水质指标(TSS、IMn、CODCr、TN、TP、TOC、DIMn、DCODCr、NO2-N、NO3--N、NH4+-N、DTN、DTP、C/N、C/P、N/P、溶解性碳氮比DC/N、溶解性碳磷比DC/P、溶解性氮磷比DN/P、Temp、pH值、SpCond、Sal、DO、CHL、PCY)作为解释变量,参与CCA或RDA分析,得出各类指标对不同水文时期渭河流域沉积物优势细菌群落构成(优势T-RFs)及群落多样性指数(、、)变化的解释程度(表5).从结果中可以看出,仅通过沉积物氮磷指标,对枯水期优势菌群结构变化的解释度可以达到74.3%;但对平水期和丰水期优势菌群变化的解释度在50%以下,且分析结果未能通过蒙特卡罗检验(>0.05).由于枯水期渭河流量与流速较低,河流上覆水与沉积物的物质能量交互减弱,沉积物微生物群落变化主要受沉积物自身性质影响.而在平水期和丰水期,渭河水量和含沙量增大,河道内物质迁移转化行为多样而活跃,影响沉积物细菌群落变化的环境因素更加复杂.考虑沉积物颗粒特性的影响后,环境因子对沉积物优势细菌群落变化的解释度均超过50%;进一步加入上覆水指标后,解释度可以达到86%以上,同时,排序结果的显著性水平也明显提高.这一结果表明,对于季节性多泥沙河流,除过沉积物氮磷等化学特性之外,颗粒粒度与上覆水水质也在很大程度上影响着沉积物的细菌群落变化.
将标准化后的沉积物细菌群落多样性指标与优势T-RF相对丰度数据放入同一个排序空间,从全部环境指标中手动选择共同解释度最高,且不存在共线性关系的最优解释因子组合,结果如图4所示.平水期沉积物总磷(TPs)、氮磷比(N/P s)与上覆水COD、溶解态硝酸盐氮(NO3--N)、温度(Temp)和pH值对沉积物群落特征变化的共同解释度为96.2% (=0.018).pH值和N/P s对物种变化的单独解释度最高,分别为27%(=0.032)和22.5%(=0.030).且pH在平水期与沉积物细菌群落均匀度显著正相关(0.775,=0.024).氮磷作为构成生物体的重要生源物质,在不同类型地表水的沉积物中,往往是与细菌群落分布和多样性高低相关性最强的环境因子[11-13].而对夏季太湖不同植物类型湖区的研究发现[8],pH值是除有机物含量外,对沉积物细菌群落变化影响最显著的指标.酸碱度一方面可能反映离子和金属等其它环境因子的变化状态,另一方面也可以直接对细菌的新陈代谢过程产生影响[38-39].此外,从各样点在RDA排序图上的分布和距离可以看出,平水期渭河中游(W1、W2、W3)沉积物优势细菌群落结构和多样性状态较为相似,而同下游(W4、W5、W6)各样点存在明显差异.
枯水期沉积物总氮(TNs)、总磷(TPs)、体积平均粒径([4,3]),及上覆水溶解性硝酸盐氮(NO3--N)、溶解性碳氮比(DC/N)和叶绿素a(Chl a)构成的排序空间对沉积物优势细菌群落变化解释度为97.0%(=0.01).其中,DC/N和Chl a的单独解释度分别为42.2%(=0.062)和29.0%(=0.008).DC/N与沉积物细菌群落物种丰度(-0.755,=0.03)均匀度(-0.853,=0.007)和多样性指数(-0.827,=0.011)均呈显著负相关关系.上覆水NO3--N与99bp的相对丰度显著负相关(-0.960,=0.04),Chl a与58bp的相对丰度显著负相关(-0.998,=0.039).渭河流域枯水期实测水体Chl a平均浓度仅为平水期的五分之一.冬季藻类的消亡可以使氮素重新沉降,刺激表层沉积物中的细菌生长,增加氮循环相关细菌群落的多样性,但对具体菌种相对丰度的影响不一[40-41].沉积物体积平均粒径对细菌群落变化的解释程度,超过TNs和TPs排在环境因子中的第三位,表明枯水期沉积物粒度特征对渭河流域沉积物生态环境的重要性.在对海洋环境的研究中,也注意到了粒度特征带来的影响,认为沙质和泥质沉积物上的物理化学过程不尽相同[14,42],而颗粒的大小决定着细菌附着程度和携氧能力[16],从而导致了微生物群落的差异.排序空间中,渭河干流及黑河样点主要沿第二排序轴表现出梯度变化,且几乎按沿程顺序自下而上排布,表现出枯水期河流沉积物理化及微生物生态变化的空间连续性.
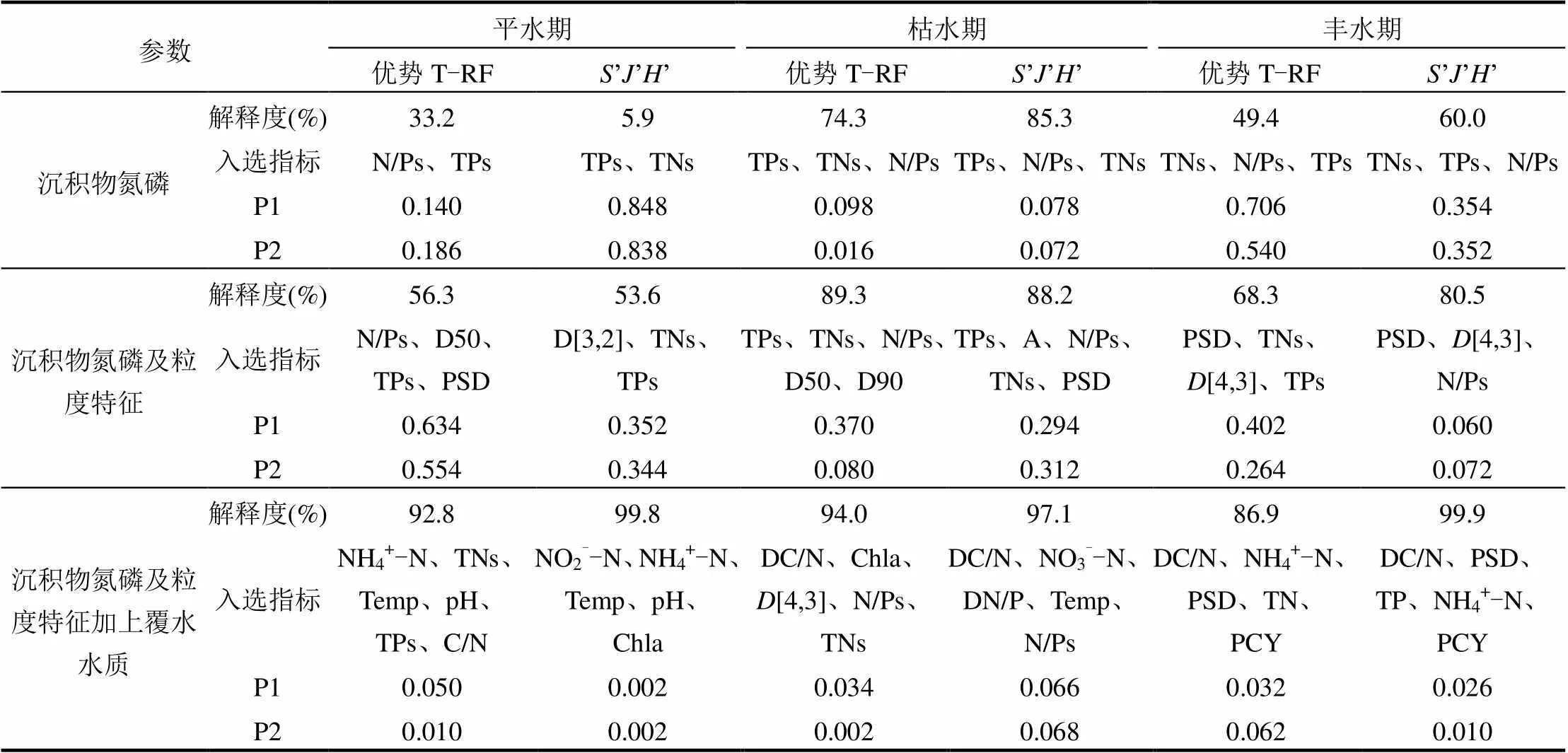
表5 不同环境变量对优势群落构成和群落多样性指数的解释度
注:P1为第一排序轴蒙特卡罗检验结果,P2为整个排序空间的检验结果.通过手动选择获得共同解释度最高,且不存在共线性关系的最优解释因子组合,入选指标依解释度由高到低排序.
丰水期入选的环境因子全部为上覆水水质指标,未过滤水样碳磷比(C/P)、COD、藻细胞数(PCY)、溶解性氨氮(NH4+-N)和溶解性碳氮比(DC/N)共同解释了94.6% (=0.064)的沉积物细菌群落变化.其中,DC/N和NH4+-N是单独解释度最高的指标,分别解释了38.0%(=0.132)和18.1%(=0.180)的沉积物物种变化,但未能达到统计学意义上的显著性.上覆水溶解性碳氮比与沉积物细菌群落均匀度和多样性指数显著负相关,相关系数分别为-0.881(=0.009)和-0.854 (=0.015).对渭河不同季节的实测研究发现[43],夏季沉积物和间隙水中的氮磷含量,同河流补给地下水的交换通量正相关,即河流上覆水中的氮磷在这一时期向沉积物发生了迁移.丰水期渭河河道内垂向的物质迁移过程(河流补给地下水和泥沙沉积),增强了水质对沉积物细菌群落的影响.与枯水期相似,丰水期除泾河样点外的其它各样点依然沿第二轴分布,但分布顺序与空间位置并不存在对应关系.渭河中游流域样点(W1、W2、W3、H)的环境及物种状况相对接近,而西安段样点(W4、W5、J)之间的环境和微生物状态差异显著.

图4 不同水文时期沉积物细菌群落空间变化与环境因子的RDA分析

图5 不同时期各类环境因子对解释沉积物细菌群落变化的贡献程度
不同水文时期的冗余分析结果表明,渭河沉积物细菌群落的关键环境驱动因子,存在季节性变化又具有一定的共性(图5).沉积物氮磷指标TPs、TNs或N/Ps,是平水期和枯水期沉积物菌群变化的关键解释因子,在整体解释变量中的贡献度分别为37%和14%.沉积物粒度特征对细菌群落的影响仅在枯水期有直接的体现.上覆水水质对沉积物细菌群落变化的解释贡献度,在不同季节均超过60%.其中,溶解态无机氮(NO3--N和NH4+-N)对沉积物细菌群落的影响,在3个时期中均有不同形式的体现.浮游植物相关的Chl a和PCY指标对优势菌群变化,在枯水期和丰水期表现出不可忽视的作用.而平水期和丰水期共有的解释变量为上覆水COD.丰水期RDA空间中的环境因子全部为上覆水水质指标,表明了这一时期渭河水体垂向交互作用的剧烈程度,以及上覆水环境对季节性多泥沙河流沉积物细菌群落变化的重要影响.总体来说,沉积物氮磷含量的影响比颗粒粒度特征更为显著,上覆水溶解性无机氮含量与溶解性碳氮比对渭河流域沉积物优势细菌群落结构变化具有重要意义.
上述结果表明,对于季节性多泥沙河流,尤其在水沙量大、河道垂向物质能量交互剧烈的水文时期,除过沉积物氮磷等化学特性之外,沉积物颗粒粒度与上覆水水质对沉积物的细菌群落变化的影响作用也不可忽视.
3 结论
3.1 平枯两季渭河流域沉积物以中粉砂和细粉砂为主,TP平均含量高于TN.丰水期渭河上游来水携沙在中下游河段发生逐步沉积,使渭河(陕西段)沉积物粒度特征与氮磷含量显著改变.沉积物TN含量在丰水期升高了1~2个数量级,且空间差异明显减小(RSD=17%).较其它时期,丰水期沉积物氮、磷含量与上覆水氮、磷浓度之间的相关性系数最高(0.687,=0.6).
3.2 渭河流域沉积物样本中,基于T-RFLP技术共检出16s rDNA限制性片段(T-RF)97条.干流沉积物细菌群落多样性在在2.37~2.82之间,不同时期的沿程变化特征各异.渭河丰水期水沙过程的改变,使沉积物氮磷性质趋于空间均质化,却增加了细菌群落特征的空间差异,Shannon多样性空间相对标准偏差达到37.4%,优势菌群Bray- Curtis相似度为17.4%.表明了季节性多沙河流沉积物细菌群落变化的复杂性,及汛期水沙变化对河流沉积物微生物生态环境的重大影响.流域优势菌群以变形菌门和拟杆菌门为主.不同时期不同河段的沉积物优势菌群在纲水平上表现出较大的差异.
3.3 在沉积物自身氮磷指标的基础上考虑沉积物颗粒特性和上覆水水质的影响后,对渭河流域沉积物细菌群落结构和多样性变化的解释度均有增加,且排序结果的显著性水平也明显提高.超过94%的沉积物细菌群落结构及多样性变化,与沉积物及上覆水理化指标相关,但不同水文时期菌群变化的关键驱动因子不同.沉积物氮磷及粒度特征对细菌群落变化的影响,在平水期和枯水期表现得更为直接;而上覆水水质对不同时期沉积物菌群变化的解释度贡献量均超过60%,对丰水期沉积物细菌群落的影响尤其显著.
[1] Brune A, Frenzel P, Cypionka H. Life at the oxic-anoxic interface: microbial activities and adaptations [J]. Fems Microbiology Reviews, 2000,24:691–700.
[2] Droppo I G, Krishnappan B G, Lawrence J R. Microbial interactions with naturally occurring hydrophobic sediments: Influence on sediment and associated contaminant mobility [J]. Water Research, 2016,(92):121-130.
[3] 鲍林林,王晓燕,陈永娟,等.北运河沉积物中主要脱氮功能微生物的群落特征 [J]. 中国环境科学, 2016,36(5):1520-1529.
[4] Liu T Z, Wang H, Zhang Z, et al. Application of synthetic iron- oxide coated zeolite for the pollution control of river sediments [J]. Chemosphere, 2017,180:160-168.
[5] 汪 淼,王圣瑞,焦立新,等.滇池沉积物内源氮释放风险及控制分区 [J]. 中国环境科学, 2016,36(3):798-807.
[6] Russo S A, Hunn J, Characklis GW. Considering Bacteria- Sediment Associations in Microbial Fate and Transport Modeling [J]. Journal of Environmental Engineering, 2011,137(8):697-706.
[7] Xu P, Laura G. Leff. Longitudinal changes in the benthic bacterial community of the Mahoning River (Ohio, U.S.A.)[J]. Hydrobiologia, 2004,522:329–335.
[8] Shao K Q, Gao G, Wang Y P, et al. Vertical diversity of sediment bacterial communities in two different trophic states of the eutrophic Lake Taihu, China [J]. Journal of Environmental Sciences, 2013,25(6):1186–1194.
[9] 郑艳玲,侯立军,陆 敏,等.崇明东滩夏冬季表层沉积物细菌多样性研究 [J]. 中国环境科学, 2012,32(2):300-310.
[10] 王 凯,邹 立,高冬梅,等.黄河口潮滩春季细菌群落的分布特征及其影响因素研究 [J]. 中国海洋大学学报, 2016,46(1): 108-115.
[11] 王永霞.云南高原程海湖沉积物中的细菌多样性研究[D]. 昆明:云南大学, 2014.
[12] 宋洪宁.东平湖沉积物细菌多样性分析[D]. 泰安:山东农业大学, 2010.
[13] 鲁克帅.南四湖沉积物细菌多样性研究[D]. 曲阜:曲阜师范大学, 2013.
[14] Wang L P, Liu L S, Zheng B H, et al. Analysis of the bacterial community in the two typical intertidal sediments of Bohai Bay, China by pyrosequencing [J]. Marine Pollution Bulletin, 2013,72:181–187.
[15] 刘爱菊,王洪海,潘嘉芬,等.孝妇河表层沉积物中重金属赋存形态与微生物群落组成 [J]. 中国环境科学, 2010,30(8):1103- 1109.
[16] Verma P, Raghavan R V, Jeon C O, et al. Complex bacterial communities in the deep-sea sediments of the Bay of Bengal and volcanic Barren Island in the Andaman Sea [J]. Marine Genomics, 2017,31:33–41.
[17] 孙 悦,李栋梁,朱拥军.渭河径流变化及其对气候变化与人类活动的响应研究进展 [J]. 干旱气象, 2013,31(2):396-405.
[18] 查小春,延军平.全球变化下秦岭南北河流径流泥沙比较分析 [J]. 地理科学, 2002,22(4):403-407.
[19] 刘晓琼,刘彦随,李同昇.基于小波多尺度变换的渭河水沙演变规律研究 [J]. 地理科学, 2015,35(2):211-217.
[20] 刘 睿,吴 巍,周孝德,等.渭河浮游细菌群落结构特征及其关键驱动因子 [J]. 环境科学学报, 2017,37(3):934-944.
[21] Huang Y, Zou L, Zhang S Y, et al. Comparison of bacterioplankton communities in threeheavily polluted streams in China [J]. Biomedical and Environmental Sciences, 2011,24(2): 140-145.
[22] Xie S G, Sun W M, Luo C L, et al. Stable Isotope Probing Identifies Novel m-Xylene Degraders in Soil Microcosms from Contaminated and Uncontaminated Sites [J]. Water Air and Soil Pollution, 2010,212(1-4):113-122.
[23] Kent A D, Smith D J, Benson B J, et al. Web-Based Phylogenetic Assignment Tool for Analysis of Terminal Restriction Fragment Length Polymorphism Profiles of Microbial Communities [J]. Applied and Environmental Microbiology, 2003,69(11):6768-6776.
[24] 王 萃,鲍林林,王晓燕.密云水库底泥和库滨区土壤中氨氧化细菌的多样性和丰度 [J]. 环境科学学报, 2013,33(12):3334- 3340.
[25] O'Brien R M. .Caution regarding rules of thumb for variance inflation factors [J]. Quality & Quantity, 2007,41(5):673-690.
[26] Leduc D, Rowden A A, Probert P K, et al. Further evidence for the effect of particle-size diversity on deep-sea benthic biodiversity [J]. Deep Sea Research Part I: Oceanographic Research Papers, 2012,63:164-169.
[27] 宋进喜,于 芳,王 珍.渭河陕西段河床沉积物的粒度参数分析 [J]. 南水北调与水利科技, 2013,11(4):75-78.
[28] 李 勇,李海燕,赵应权.沉积物粒度特征及其对环境的指示意义——以濠河为例 [J]. 吉林大学学报(地球科学版), 2015, 45(3):918-925.
[29] 杨小刚,宋进喜,陈 佳,等.渭河陕西段潜流带沉积物重金属变化初步分析 [J]. 环境科学学报, 2014,34(8):2051-2061.
[30] 张台凡,宋进喜,杨小刚,等.渭河陕西段沉积物中总磷、总氮时空分布特征及其影响因素研究 [J]. 环境科学学报, 2015,35(5): 1393-1399.
[31] 宋洪宁,杜秉海,张明岩,等.环境因素对东平湖沉积物细菌群落结构的影响[J]. 微生物学报, 2010,50(8):1065-1071.
[32] 刘铁龙.陕西省渭河主要支流水量与调控能力状况分析 [J]. 陕西水利, 2015,(4):15-19.
[33] 牛珊珊.2005—2010年渭河主要支流水质变化趋势 [J]. 人民黄河, 2014,36(10):89-91.
[34] 李家科,李怀恩,董 雯,等.渭河关中段典型支流非点源污染监测与负荷估算 [J]. 环境科学学报, 2011,31(7):1470-1478.
[35] 于 芳,宋进喜,殷旭旺,等.泾河陕西段水体污染特征分析 [J]. 北京师范大学学报(自然科学版), 2013,49(4):421-424.
[36] 隋立新.不同温度下微生物群落结构与厌氧膜生物反应器膜污染之间关系的研究 [D]. 哈尔滨:哈尔滨工业大学, 2014.
[37] 赵 霏.再生水湿地香蒲根际细菌多样性研究—以北京市永定河城市景观补水段为例 [D]. 北京:首都师范大学, 2014.
[38] Koski-Vahala J, Hartikainen H, Tallberg P. Phosphorus mobilization from various sediment pools in response to increased pH and silicate concentration [J]. Journal of Environmental Quality, 2001,30(2):546–552.
[39] Yannarell A C, Triplett E W. Geographic and environmental sources of variation in lake bacterial community composition [J]. Applied and Environmental Microbiology, 2005,71(1):227–239.
[40] 左新宇,梁运祥.微囊藻与硝化细菌在不同种群密度条件下的相互作用 [J]. 环境科学与技术, 2013,36(12):65-70.
[41] 黄 睿,沈 烽,罗 娟,等.蓝藻水华消亡对湖泊表层沉积物中氨氧化细菌丰度和群落结构的影响 [J]. 生态与农村环境学报, 2015,31(3):334-339.
[42] de Beer D, Wenzhöfer F, Ferdelman T, et al. Transport and mineralization rates in North Sea sandy intertidal sediments, Sylt-Romo Basin, Wadden Sea [J]. Limnology & Oceanography, 2005,50:113–127.
[43] 王 珍.渭河(陕西段)潜流带水交换对TN、TP迁移转化的影响研究 [D]. 西安:西北大学, 2014.
致谢:感谢北京大学环境学院谢曙光老师对本研究中分子微生物分析方法的指导.
Influences of sediment characteristics and overlying water quality on sediment bacterial communities in a seasonal sandy river.
LIU Rui, ZHOU Xiao-de*
(State Key Laboratory of Ecological Water Conservancy in the Northwest Arid Area, Xi’an University of Technology, Xi’an 710048, China)., 2017,37(11):4342~4352
The seasonal change of the diversity and structure of sediment bacterial communities in sandy Weihe River and the influences of sediment particle characteristic, sediment nutrient content and the quality of overlaying water were investigated using terminal-restriction fragment length polymorphism (T-RFLP) analysis. The results of redundancy analysis (RDA) revealed significant seasonal variations of sediment characteristics and water quality. Total nitrogen content in sediment increased one order of magnitude with a decrease of spatial heterogeneity (RSD=17%) in wet season, while N: P in sediment was moderately correlated with N:P in overlying water. Based on T-RFLP, the Shannon index of sediment bacterial communities in mainstream ranged between 2.02 and 3.18. Spatial change pattern of bacterial diversity was also considerably different between hydrological seasons. Sediment bacterial communities in wet season had the strongest heterogeneity (RSD=37.4%) and the lowest Bray-Curtis similarity (17.4%). Most of the dominant fragments belong to species within the phyla of Proteobacteria and Bacteroidetes. Properties of sediment strongly influenced bacterial communities in normal and dry season, while the quality of overlying water had a close relationship with sediment bacteria community in wet season. All these results indicated the complexity of sediment bacterial community variation in seasonally sandy river, and significant impacts of sediment characteristics and overlying water quality.
Weihe River;sediment;bacterial community;T-RFLP
X172
A
1000-6923(2017)11-4342-11
刘 睿(1985-),女,河南泌阳人,西安理工大学博士研究生,研究方向为环境微生物.发表论文5篇.
2017-04-16
教育部高等学校博士学科点专项科研基金(20136118120022);陕西省科技统筹创新工程计划项目(2013SZS02- P01)
*责任作者, 教授, zhouxd@xaut.edu.cn
