掺铜介孔碳活化过硫酸氢盐高效降解双酚A
2017-11-23李一兵王彦斌
刘 曼,李一兵,王彦斌,赵 旭*
掺铜介孔碳活化过硫酸氢盐高效降解双酚A
刘 曼1,2,李一兵1*,王彦斌2,赵 旭2*
(1.河北工业大学土木与交通学院,天津300401;2.中国科学院生态环境研究中心环境水质学国家重点实验室,北京100085)
采用蒸发诱导自组装的方法制备了掺铜有序介孔碳复合催化剂(Cu-OMC),开展了Cu-OMC活化过硫酸氢钾(PMS)氧化降解双酚A研究.研究结果显示,Cu-OMC可高效活化PMS进而有效降解双酚A,在催化剂投加量0.1g/L、PMS浓度0.5mmol/L的反应条件下,60min内对20mg/L的双酚A去除率可达91%.在pH=3~11范围内,双酚A均可有效降解,阴离子(Cl−、SO42−、HCO3−和PO43−)的存在对双酚A降解影响较小.利用自由基猝灭实验和电子顺磁共振(EPR)对反应过程中产生的活性氧自由基(ROS)进行了分析,结果表明除了硫酸根自由基(SO4•−)和羟基自由基(•OH),单线态氧(1O2)在双酚A的降解过程中起着重要作用.
过硫酸氢盐;硫酸根自由基;有序介孔碳;双酚A
双酚A(BPA),又称酚甲烷,工业上用于合成聚碳酸酯、环氧树脂等高分子材料,也作为增塑剂添加在塑料制品中[1].BPA是一种典型的内分泌干扰物,具有雌激素特性,环境中的BPA能够通过生物累积效应最终进入人体,导致荷尔蒙失衡,影响生殖功能,甚至诱导癌症的发生[2-3].传统的水处理技术对BPA去除能力有限.
近年来,基于硫酸根自由基(SO4•−)的高级氧化技术,因氧化能力强、选择性高、适用pH值范围广等优点日益受到关注[4].过硫酸盐能够在光、热、电及过渡金属离子的作用下产生SO4•− [5].过一硫酸盐主要来源于过一硫酸氢钾复合盐(2KHSO5×KHSO4×K2SO4,商业名称Oxone),其活性成分为HSO5−.其中,过渡金属离子活化过硫酸盐,无需外部能量的投入,更为经济和高效而得到广泛研究[6].
铜基催化剂,如CuO、CuFe2O4等在活化PMS方面表现出很好的催化活性.例如,Ji等[7]报道了CuO活化PMS降解苯酚,但是它在酸性条件下不稳定,限制了其在水处理方面的应用.Zhang等[8]报道了CuFe2O4在中性条件下对碘普胺表现出最高的降解效果,铜离子溶出相对较少.Feng等[9]以CuFeO2为催化剂活化PMS降解磺胺嘧啶,表现出较Fe2O3、Cu2O和CuFe2O4更高的催化活性.最近研究发现,碳材料对PMS也表现出很好的催化活性,包括活性炭[10]、石墨烯[11]、纳米金刚石[12]和碳纳米管[13]等.有序介孔碳(OMC)具有高的比表面积、均一的孔道结构,其表面丰富的含氧官能团作为催化活性位点,对PMS具有一定的活化性能[14],但催化活性仍有待提高.
本文在利用软模板法制备OMC过程中,将铜原位掺到OMC的骨架中,制备出铜掺杂的有序介孔碳复合催化剂(Cu−OMC).在此基础上研究了PMS投加量、催化剂用量、反应温度、初始pH和不同阴离子对于Cu−OMC/PMS体系降解BPA的影响及降解机理也进行了分析.
1 实验部分
1.1 药品及仪器
氢氧化钠、苯酚、甲醛(37wt%)、硝酸铜、乙醇、甲醇、双酚A均购自国药化学试剂公司,三嵌段共聚物F127(Mw=12600, PEO106PPO70PEO106),5,5-二甲基-1-吡咯啉-N-氧化物(DMPO,³97%),2,2,6,6-四甲基哌啶(TEMP,³95%)均购自Sigma−Aldrich化学试剂公司,过硫酸氢钾购自阿拉丁化学试剂公司,所有药物均为分析纯.实验用水由Milli−Q超纯水机制得(18.2MΩ/cm),管式炉(OTF−1200X,合肥科晶材料技术有限公司).
1.2 催化剂制备
以20wt%酚醛树脂乙醇(Resol)溶液作为碳源,其制备方法参考文献[15].具体方法为,将苯酚(8g、85mmol)60℃融化后加入到20wt% NaOH水溶液中(0.36g NaOH、1.7g H2O),逐滴加入甲醛溶液(37wt%、14.5g),搅拌10min后75℃反应90min.冷却后用2mol/L HCl调pH值至中性,减压蒸馏除去水分,然后溶于一定量的乙醇中,静置过夜后除去盐分,制得20wt% Resol溶液.
Cu−OMC−800的制备:将1g F127溶于20g乙醇中,35℃搅拌至澄清后加入24.2mg Cu(NO3)2×3H2O,继续搅拌至溶解,加入5g 20wt% Resol溶液后搅拌10min,倒入表面皿中室温下静置4h至乙醇挥发完全,烘箱中100℃加热24h.将产物于管式炉中以2℃/min的升温速率升至800℃,在N2气氛下煅烧4h,所得产物研磨成粉末.
OMC、CuFe2O4和CuO作为对照催化剂与Cu−OMC−800进行活性和稳定性对比.OMC的制备除不加Cu(NO3)2×3H2O外,其余过程与上述相同.CuFe2O4、CuO分别参照Ji等[7]和Zhang等[16]的方法制备.
1.3 催化剂表征
通过透射电子显微镜(TEM,H−7500,日本日立公司)对Cu−OMC催化剂的微观形貌进行表征.采用X射线衍射仪(XRD,X’ Pert PRO MPD,荷兰帕纳科分析仪器有限公司)和全自动比表面积及微孔物理吸附仪(BET,ASAP2020HD88,美国麦克仪器公司)对Cu−OMC催化剂的孔隙结构进行分析.X射线光电子能谱(XPS,PHI Quantera SXM,日本ULVAC-PHI公司)对催化剂组成进行分析.通过电感耦合等离子光谱仪(ICP,9800,日本岛津公司)对催化剂的性能进行评价.电子自旋共振波谱仪(EPR,A300−10/12,德国布鲁克有限公司)用来检测自由基的生成.
1.4 BPA降解实验
BPA的降解实验在100mL烧杯中进行.首先将0.1g/L的Cu−OMC催化剂加入到100mL的BPA溶液(20mg/L)中,搅拌30min后达到吸附平衡,加入0.5mmol/L的PMS,持续反应60min.反应过程中,每隔10min取样0.5mL,立即加入到0.5mL甲醇中,混匀后过0.22μm的有机微孔滤膜.BPA的浓度采用装有C18柱(4.6nm×250mm× 5μm)的高效液相色谱仪(HPLC,Shimadzu LC−20AT)进行分析.流动相为体积比70:30的甲醇和水的混合溶液,流速1mL/min,进样体积为20μL.总有机碳(TOC)采用总有机碳测定仪(TOC,岛津,日本)分析.
2 结果与讨论
2.1 催化剂表征
由图1(a)可见,材料呈现出高度有序性的周期性排布,表明介孔结构的存在.图1(b)中,表现为典型的具有H2型滞后回环的Ⅳ型等温线[17],滞后回环出现在相对压力0.4~0.8,对应于狭长孔.孔径分布曲线在3.7nm有一个非常明显的尖峰,表明Cu−OMC−800的孔径分布高度均一.Cu− OMC−800的BET比表面积高达798m2/g,孔体积为0.57cm3/g,平均孔径3.7nm.从图1(c)可以看到,在2≈ 0.8°处有一个明显的衍射峰,表明Cu− OMC−800的孔道在介观尺度内呈现周期性的有序排列.从图1(d)中可以看出,所有的样品均在1359,1589cm−1处出现典型的吸收峰,分别对应于碳原子晶格缺陷的D峰和碳原子sp2杂化面内伸缩振动的G峰[18].因此,D峰和G峰的强度比(D/G)可表征碳材料的缺陷度.可以看到,D/G随着煅烧温度的升高而不断增大,表明煅烧温度增加了碳材料的缺陷度和无序化,且减小了sp2杂化域.

图1 催化剂表征分析
(a)Cu−OMC−800的TEM图;(b)Cu−OMC−800的N2吸附−脱附等温线和孔径分布曲线;(c)小角XRD谱图; (d)不同煅烧温度下制得的Cu−OMC的Raman光谱
采用XPS对Cu−OMC−800表面元素相对含量和价态进行分析(图2).从XPS的总谱上可知,Cu− OMC−800表面主要含有Cu、C和O元素.C1s谱图可拟合为3个峰,分别对应于C—C键(284.8eV)、C—O键(285.6eV)和C=O键(288.6eV)[19].O 1s谱可拟合为4个峰,表明C—O(531.4eV)、C=O(532.6eV)、O—H(533.6eV)[20]以及H2Oads(535.9eV)的存在.该结果表明,Cu−OMC−800表面存在大量的含氧官能团,这些官能团可以作为活化PMS的活性位点[21].由Cu 2p谱图分析可知,在932.7,934.6eV处分别对应于Cu0和CuO[22].

图2 Cu−OMC-800的XPS谱图
2.2 催化降解BPA性能对比分析
由图3(a)可见,OMC−800对BPA的吸附可达10%左右,当Cu掺杂入介孔碳,催化剂的吸附性能可提高至20%,可见Cu的掺入有利于OMC吸附性能的提高.图3(b)中,当有PMS加入时,体系中出现了对BPA的催化氧化过程.实验过程中,首先加入催化剂与BPA反应30min后达到吸附平衡,此时再加入PMS.单独的PMS几乎不能降解BPA,CuO和OMC虽然能活化PMS降解BPA,但效率仅维持在20%以内,CuFe2O4对PMS有一定的活化作用,在60min内可降解47%的BPA,而Cu−OMC−800则展现出优异的性能,当PMS加入后,仅0.1g/L的催化剂对BPA的去除效率可达71%.上述结果表明,Cu与OMC在活化PMS降解BPA的过程中起到了协同作用.
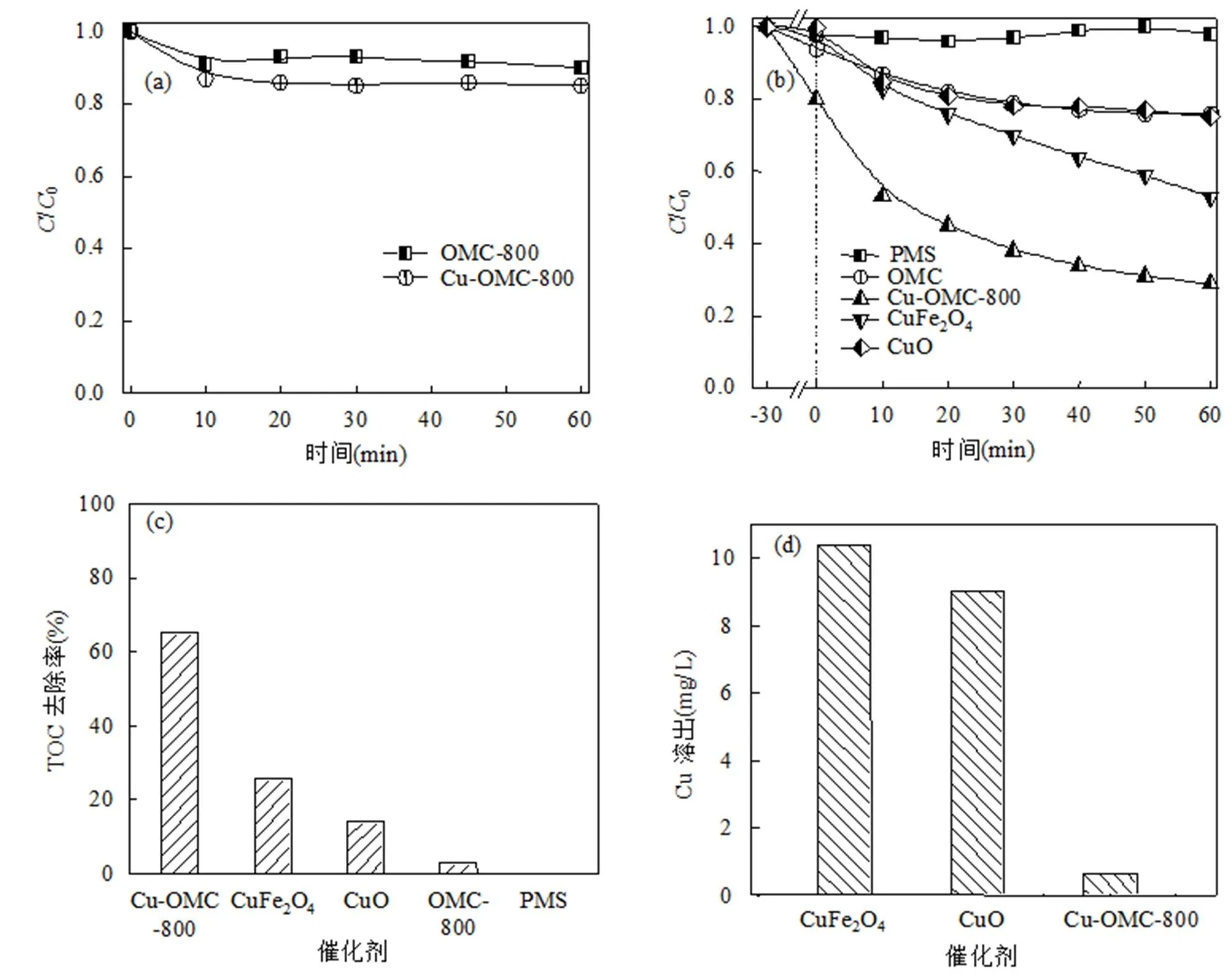
图3 催化剂性能分析
(a)BPA的吸附去除;(b)不同体系下BPA的去除效果;(c)不同体系TOC的去除率;(d)不同催化剂反应60min后铜的溶出量
由3(c)可以看出,单独的PMS对TOC的去除并不起作用,而OMC−800、CuO、CuFe2O4的TOC去除效率分别达3%、14.04%、25.67%,其中, Cu−OMC−800的去除效率最高,达65.13%.进一步可以看到,在相同条件下,不同的含Cu催化剂体系中,Cu−OMC−800催化剂中Cu的溶出量达到最小值[图3(d)].展现了异相催化反应中催化剂良好的稳定性,减少了二次水体污染的潜在危险.
2.3 影响因素分析
由图4(a)发现,PMS的浓度对BPA降解率的影响较小.例如,当PMS浓度为0.2mmol/L时,BPA的去除率为73%;当PMS继续增加到0.5,1.0,2.0mmol/L时,BPA的去除率分别为78%、80%和82%.由此可见,PMS浓度的增加对BPA去除率的提高作用不明显,因此后面的实验均采用PMS 0.5mmol/L.由图4(b)发现,随着催化剂投加量的增加,BPA的降解效率得到显著提升.在催化剂投加量为0.1g/L时,60min内BPA的去除率为78%;当投加量增加到0.2,0.3g/L时,BPA的去除率提高到91%和99%.这是因为催化剂量越多,催化活性位点数目越多,从而可以快速活化PMS.如图4(c)所示,初始pH值在3~9范围内,对Cu−OMC−800催化降解BPA的影响不显著;当pH增至11时,BPA的降解率从74%增加到96%.这可能是因为,在pH值较低时,H+的存在能够猝灭SO4•−和•OH[23](方程1~2),从而使反应体系氧化能力减弱.

(2)
(a)PMS浓度对BPA降解的影响;(b)催化剂投加量对BPA降解率的影响;(c)初始pH对BPA降解的影响和初始pH对Cu-OMC-800铜溶出的影响;(d)不同阴离子对BPA降解效率的影响
由此可见,碱性条件有助于Cu−OMC−800对PMS的活化.另外,碱性条件可以显著抑制铜的溶出,当初始pH为11时,铜的溶出仅为0.01mg/L,远低于pH为3时的0.992mg/L[图4(c)].该结果显示,碱性条件下Cu−OMC−800对PMS的活化作用为异相表面催化反应,而非均相催化反应.在实际水体中经常存在多种阴离子,如Cl−、SO42−、HCO3−和PO43−等,因此分析了不同阴离子存在情况下BPA的降解效果,如图4(d)所示,5mol/L阴离子的存在对BPA的降解并没有明显的影响.
2.4 催化机理分析
Cu-OMC催化剂通过提高铜的分散度,增加活性位点数目,同时碳材料良好导电性能,有助于电子的转移过程,从而提高其催化活性.另外,利用OMC与铜的相互作用,抑制反应过程中铜的溶出,达到提高其稳定性的目的.
活化PMS过程中可能产生多种自由基,一般来说SO4•−和×OH是降解有机物的主要氧化物种.利用自由基猝灭反应对可能产生的自由基进行分析.乙醇可以同时猝灭SO4•−和×OH,叔丁醇与SO4•−和×OH的反应速率分别为(4~9.1)×105和(3.8~7.6)×108mol/(L·s)[24],因此叔丁醇更易与×OH反应.从图5可知,叔丁醇和乙醇的加入使BPA的去除率由78%分别降为70%和44%,表明反应体系中存在SO4•−和×OH,但是SO4•−的作用较为显著.上述结果显示乙醇没有能够完全抑制BPA的降解,说明反应体系中除存在SO4•−和×OH自由基外,还存在非自由基的氧化物种.当加入单线态氧(1O2)的淬灭剂L−组氨酸后[13],BPA的降解得到完全抑制.由此可以推断,反应体系中的非自由基氧化物种是1O2.

图5 不同猝灭剂对BPA降解的影响
[乙醇] = [叔丁醇] = 0.5mol/L,[L−组氨酸] = 12mmol/L
以DMPO作为SO4•−和×OH的捕获剂进行EPR测试,从图6(a)中可以看到,典型的峰强比为1:2:2:1的4重峰,其超精细耦合常数为N=H= 14.9G,这是DMPO−OH加合物的特征峰[25].并且观察到微弱的DMPO−SO4加合物的六重峰,其超精细耦合常数为N=13.82G,Hβ=10.11G,Hγ= 1.370G[25].在3min的时候强度最高,然后随着反应时间的延长,峰强逐渐减弱.TEMP为1O2的捕获剂,反应生成的TEMPO具有顺磁性,可以被EPR检测到.图6(b)为不同反应时间测得的TEMPO的三重峰,强度比为1:1:1[26],证明了反应过程中确实存在1O2.

(a)(c)DMPO和(b)TEMP为自旋捕捉剂的
BPA的降解实验表明,初始pH11时,降解速率明显增加,因此,在该条件下以DMPO为自由基捕获剂进行了EPR测试.从图6(c)可以看出,在1min观察到明显的七重峰(超精细耦合常数N=7.35G,Hβ= 3.65G,Hγ= 3.65G),这是DMPOX 的特征峰,它可能是DMPO被过度氧化所产生,表明碱性条件下强烈的氧化能力.
基于上述实验结果和文献报道,提出如下反应机理.首先,OMC作为催化剂载体,其表面含有丰富的含氧官能团及离域π电子[4],它们可以作为活化PMS的活性位点,催化PMS产生SO4•−(方程3)、×OH(方程4)或SO5•−(方程5).

XPS分析(图2d)表明,Cu-OMC-800中的Cu主要以+2价的形式存在,Cu2+与PMS以电子传递的形式发生反应,产生SO5•−和SO4•−并实现Cu2+/+的相互转化[27](方程6~7).SO4•−与H2O反应产生•OH[28](方程8).同时,PMS在Cu-OMC-800的催化作用下产生大量的1O2(方程9).最终,BPA在多种氧化物种的共同作用下氧化分解.
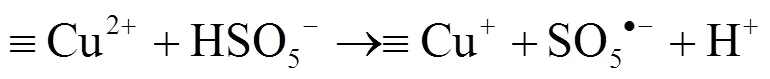

3 结论
3.1 采用蒸发诱导自组装的方法制备了掺铜有序介孔碳复合催化剂(Cu−OMC),其比表面积高达798m2/g,平均孔道尺寸3.7nm,对于活化过硫酸氢钾(PMS)表现出较高的催化活性.
3.2 催化剂投加量0.1g/L、PMS浓度0.5mmol/L的条件下,60min内对20mg/L的双酚A去除率可以达到91%.PMS浓度和水中阴离子(Cl−、SO42−、HCO3−和PO43−)对BPA降解的影响不明显.并且,Cu-OMC催化剂表现出较高的稳定性.
3.3 在活化PMS的过程中,Cu和OMC表现出明显的协同作用,SO4•−、×OH和1O2是主要的活性氧物种,在它们的共同作用下,将BPA高效氧化去除.
[1] 张晏晏,高乃云,高玉琼,等.高级氧化技术去除水中双酚A研究进展 [J]. 水处理技术, 2012,38(08):1-4+14.
[2] Im J, Loffler F E. Fate of bisphenol A in terrestrial and aquatic environments [J]. Environmental Science & Technology, 2016, 50(16):8403-8416.
[3] 陆正和,阎斌伦,杨家新.双酚A对萼花臂尾轮虫生殖的影响[J]. 中国环境科学, 2013,33(10):1850-1855.
[4] 刘佳露,卢 伟,张凤君,等.活化过硫酸盐氧化地下水中苯酚的动力学研究[J]. 中国环境科学, 2015,35(9):2677-2681.
[5] Oh W D, Dong Z L, Lim T T. Generation of sulfate radical through heterogeneous catalysis for organic contaminants removal: Current development, challenges and prospects [J]. Applied Catalysis B-Environmental, 2016,194:169-201.
[6] 金晓英,李任超,陈祖亮.纳米零价铁活化过硫酸钠降解2,4-二氯苯酚 [J]. 环境化学, 2014,(5):812-818.
[7] Ji F, Li C L, Deng L. Performance of CuO/Oxone system: Heterogeneous catalytic oxidation of phenol at ambient conditions [J]. Chemical Engineering Journal, 2011,178:239-243.
[8] Zhang T, Zhu H B, Croue J P. Production of sulfate radical from peroxymonosulfate induced by a magnetically separable CuFe2O4spinel in water: Efficiency, stability, and mechanism [J]. Environmental Science & Technology, 2013,47(6):2784-2791.
[9] Feng Y, Wu D L, Deng Y, et al. Sulfate radical-mediated degradation of sulfadiazine by CuFeO2rhombohedral crystal-catalyzed peroxymonosulfate: Synergistic effects and mechanisms [J]. Environmental Science & Technology, 2016, 50(6):3119-3127.
[10] Saputra E, Muhammol/Lad S, Sun H Q, et al. Activated carbons as green and effective catalysts for generation of reactive radicals in degradation of aqueous phenol [J]. Rsc. Advances, 2013, 3(44):21905-21910.
[11] Sun H Q, Liu S Z, Zhou G L, et al. Reduced graphene oxide for catalytic oxidation of aqueous organic pollutants [J]. Acs. Applied Materials & Interfaces, 2012,4(10):5466-5471.
[12] Lee H, Kim H I, Weon S, et al. Activation of persulfates by graphitized nanodiamonds for removal of organic compounds [J]. Environmental Science & Technology, 2016,50(18):10134-10142.
[13] Sun H Q, Kwan C, Suvorova A, et al. Catalytic oxidation of organic pollutants on pristine and surface nitrogen-modified carbon nanotubes with sulfate radicals [J]. Applied Catalysis B-Environmental, 2014,154:134-141.
[14] Duan X, Sun H, Kang J, et al. Insights into heterogeneous catalysis of persulfate activation on dimensional-structured nanocarbons [J]. ACS Catalysis, 2015,5(8):4629-4636.
[15] Meng Y, Gu D, Zhang F Q, et al. A family of highly ordered mesoporous polymer resin and carbon structures from organic- organic self-assembly [J]. Chemistry of Materials, 2006,18(18): 4447-4464.
[16] Zhang T, Chen Y, Wang Y R, et al. Efficient peroxydisulfate activation process not relying on sulfate radical generation for water pollutant degradation [J]. Environmental Science & Technology, 2014,48(10):5868-5875.
[17] Zhang Y T, Liu C, Xu B B, et al. Degradation of benzotriazole by a novel Fenton-like reaction with mesoporous Cu/MnO2: Combination of adsorption and catalysis oxidation [J]. Applied Catalysis B-Environmental, 2016,199:447-457.
[18] Chen J, Zhang L, Huang T, et al. Decolorization of azo dye by peroxymonosulfate activated by carbon nanotube: Radical versus non-radical mechanism [J]. Journal of Hazardous Materials, 2016,320:571-580.
[19] Yao Y J, Chen H, Qin J C, et al. Iron encapsulated in boron and nitrogen codoped carbon nanotubes as synergistic catalysts for Fenton-like reaction [J]. Water Research, 2016,101:281-291.
[20] Wei M Y, Gao L, Li J, et al. Activation of peroxymonosulfate by graphitic carbon nitride loaded on activated carbon for organic pollutants degradation [J]. Journal of Hazardous Materials, 2016, 316:60-68.
[21] Wang Y, Ao Z, Sun H, et al. Activation of peroxymonosulfate by carbonaceous oxygen groups: Experimental and density functional theory calculations [J]. Applied Catalysis B: Environmental, 2016,198:295-302.
[22] Wojcieszak D, Kaczmarek D, Antosiak A, et al. Influence of Cu-Ti thin film surface properties on antimicrobial activity and viability of living cells [J]. Materials Science & Engineering C-Materials for Biological Applications, 2015,56:48-56.
[23] Huang Y H, Huang Y F, Huang C I, et al. Efficient decolorization of azo dye Reactive Black B involving aromatic fragment degradation in buffered Co2+/PMS oxidative processes with a ppb level dosage of Co2+-catalyst [J]. Journal of Hazard Mater, 2009, 170(2/3):1110-1118.
[24] Lee H, Lee H J, Seo J, et al. Activation of oxygen and hydrogen peroxide by copper(II) coupled with hydroxylamine for oxidation of organic contaminants [J]. Environmental Science & Technology, 2016,50(15):8231-8238.
[25] Liu G, You S, Tan Y, et al. In situ photochemical activation of sulfate for enhanced degradation of organic pollutants in water [J]. Environmental Science & Technology, 2017,51(4):2339-2346.
[26] Qi C D, Liu X T, Ma J, et al. Activation of peroxymonosulfate by base: Implications for the degradation of organic pollutants [J]. Chemosphere, 2016,151:280-288.
[27] Ghanbari F, Moradi M. Application of peroxymonosulfate and its activation methods for degradation of environmental organic pollutants: Review [J]. Chemical Engineering Journal, 2017,310:41-62.
[28] Xu Y, Ai J, Zhang H. The mechanism of degradation of bisphenol A using the magnetically separable CuFe2O4/peroxymonosulfate heterogeneous oxidation process [J]. Journal of Hazardous Materials, 2016,309:87-96.
Activation of peroxymonosulfate by copper doped ordered mesoporous carbon for efficient destruction of bisphenol A.
LIU Man1,2, LI Yi-bing1*, WANG Yan-bin2, ZHAO Xu2*
(1.School of Civil Engineering and Transportation, Hebei University of Technology, Tianjin 300401, China;2.State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China)., 2017,37(11):4151~4158
Copper doped ordered mesoporous carbon (Cu-OMC) was prepared by evaporation induced self-assembly and presented high catalytic activity for the activation of peroxymonosulfate (PMS). At the condition of catalyst dosage 0.1g/L, PMS concentration 0.5mmol/L, the removal of 20mg/L bisphenol A (BPA) could be achieved 91% in 60min.The reaction can be performed under a wide pH range around 3-11 and little influenced by anions including Cl−, SO42−, HCO3−and PO43−. The reactive oxygen species (ROS) generated during the reaction process were analyzed by radical quenching tests and electron spin response (EPR). It was found that apart from sulfate radical (SO4•−) and hydroxyl radicals (×OH), singlet oxygen (1O2) also contributed to the degradation of BPA.
peroxymonosulfate;sulfate radical;ordered mesoporous carbon;bisphenol
X131.2
A
1000-6923(2017)11-4151-08
刘 曼(1992-),河北承德人,河北工业大学硕士研究生,中国科学院生态环境研究中心客座学生,主要研究方向氧化还原水处理.
2017-04-23
国家自然科学基金资助项目(21377148, 51222802)
* 责任作者, 赵旭, 研究员, zhaoxu@rcees.ac.cn; 李一兵, 教授, lybhebut@sina.com
