基于正交试验的沉积物-水界面营养盐交换通量研究——以海州湾海洋牧场为例
2017-11-23张俊波
张 硕,方 鑫,黄 宏,张 虎,张俊波,5,6
基于正交试验的沉积物-水界面营养盐交换通量研究——以海州湾海洋牧场为例
张 硕1,2,方 鑫1,黄 宏3,张 虎4,张俊波1,5,6*
(1.上海海洋大学海洋科学学院,上海201306;2.上海海洋大学大洋渔业资源可持续开发省部共建教育部重点实验室,上海201306;3.上海海洋大学海洋生态与环境学院,上海201306;4.江苏省海洋水产研究所,江苏南通226007;5.上海海洋大学国家远洋渔业工程技术研究中心,上海201306;6.上海海洋大学水产科学国家级实验教学示范中心,上海201306)
为了研究沉积物-水界面营养盐交换特性,采用正交试验设计,对海州湾海洋牧场2016年5月3个站位沉积物-水界面营养盐交换通量进行了研究,分析了沉积物类型、温度、DO和pH值对沉积物-水界面营养盐交换通量的影响.结果表明:影响营养盐交换通量的因素间存在主次关系,影响NH4+-N交换的因素依次:DO>温度>沉积物类型;影响NO3-+NO2--N交换的因素依次为:沉积物类型>DO>温度;影响PO43--P交换的因素依次为:DO>沉积物类型>温度;影响SiO32--Si交换的因素依次为:温度>pH值.因素之间的交互作用对各项营养盐交换通量有着重要的影响,在建立沉积物-水界面营养盐交换模型时,更应着重考虑交互作用的影响效果.本研究实验得出的沉积物类型、温度、溶解氧和pH值这4种因素对海州湾营养盐交换影响的结果与海州湾往年调查研究结果大致相符.
沉积物-水界面;营养盐;交换通量;正交试验;交互作用
沉积物和水体之间的相互作用(营养物质的循环、迁移和存储)对近岸浅海生态环境有重要的影响[1].沉积物-水界面是近岸浅海区域中非常重要的界面之一,沉积物-水界面营养盐的交换对维持海洋初级生产力和水体营养盐含量平衡有着显著的影响[2].控制沉积物-水界面间营养盐迁移的因素主要包括扩散、吸附-解吸、沉淀(矿化)、溶解和有机质分解等,沉积物中有机物通过微生物的作用转化成间隙水中的营养盐,再通过吸附-解吸、自生矿物沉淀、微生物的吸收利用及扩散等作用从沉积物中发生转移[3].在这些过程中,温度、溶解氧、pH值、盐度、生物扰动和沉积物自身理化性质等因素也会促进或抑制沉积物-水界面间营养的交换[4].沉积物的粒度是影响TP(总磷)、TN(总氮)含量的重要因素,沉积物颗粒越细,TP、TN含量越高,沉积物粒度还制约着沉积物中TP、TN的垂直分布,其含量随深度增加而逐渐降低[5].有研究表明,无机磷占TP的50%~90%,无机磷通过厌氧释放转化为PO43-[6-7],有机氮占TN的70%~90%,大部分有机氮会在微生物的作用下发生矿化作用,其主要产物是NH4+-N[8-9],后经硝化作用氧化为NO3--N或NO2--N,或通过扩散作用渗入间隙水中,从而改变N、P营养盐在沉积物-水界面的浓度梯度,发生交换作用[10-13].温度对硝化和反硝化作用有显著的影响,并认为硝化反应的微生物适宜温度为20~30℃.温度在5~30℃之间时,温度每上升10℃,细菌的增长速率增大1倍[14],在温度适宜的情况下,硝化作用发生后改变其原有的浓度梯度,加快了其交换速率,同时pH值升高也会加快NO3-的交换速率.SiO32-的交换速率虽然与温度呈正相关的关系,但同时还会受到沉积物粒度、盐度等因素的影响[15].温度的升高和较低的含氧量会加快PO43-从有机质中的释放,沉积物的类型也会影响PO43-的释放过程[16],在厌氧条件下,PO43-的释放速率则是好氧条件下的2~8倍[17].此外,温度和DO之间呈显著负相关[18],pH值与海水温度存在显著的相关性[19],从另一个侧面影响着营养盐的交换.
海州湾位于苏鲁交界处,该海域自2002年开始实施人工鱼礁项目,经过10多年的建设,人工鱼礁对海州湾渔场渔业资源的恢复起到了重要作用.从近些年的水质生态调查报告结果看[20-21],海州湾的生态环境得到显著的改善,海洋牧场的功能逐渐得到体现.而海洋牧场对环境的调控能力取决于该海域营养物质的交换与补充.因此,开展对海洋沉积物和海水中营养盐交换的特性研究显得尤为重要.海州湾是一个半开敞型海湾[22],湾内有多条入海河流,会导致海水的pH值产生波动,且海州湾气候四季分明,有研究表明海州湾C、N元素的赋存受到沉积物粒度的制约[23].目前,多数学者仅就单个因素对营养盐交换的影响规律进行了研究,董慧[4]和Zhen[24]通过单因素的控制实验发现,NH4+-N、NO3--N和PO43--P在贫氧环境下的交换通量要高于富氧条件下,随着温度的升高,NH4+-N、NO3--N和PO43--P的交换通量增大.但影响沉积物-水界面营养盐交换的因素之间并不是相互独立的,它们会共同作用于交换过程.故本研究采用统计学中的正交试验法设计实验室培养实验,从多因素(沉积物粒径、温度、溶解氧、pH值)角度,开展沉积物-水界面营养盐交换特性研究,从而为该海域建立营养盐交换模型提供基本参数,也为海域水环境修复提供理论依据.
1 材料与方法
1.1 研究站点与样品采集
为了解海州湾海洋牧场沉积物物理性质,本研究于2015年5月,由近及远在海州湾鱼礁区选取6个站位(RA1、RA2、RA3、RA4、RA5、RA6),对照区选择2个站位(CA1、CA2)进行现场采样调查,具体站位如图1所示,在每个站位使用抓斗式采泥器采集4组表层沉积物.根据2015年采样得到的沉积物类型结果,又于2016年5月,从8个站位中选取3个站位(CA1、RA1、RA4)进行现场调查采样,在每个站位使用柱状采泥器(内置可替换的PVC管)采集站位处的27根无扰动的表层沉积物(共计81根),每根PVC管直径为5cm,长度为35cm,且在采样时保证每根PVC管内的沉积物长度大于20cm,如若未达到20cm则重新采样,把PVC管的两头用橡胶塞子密封,放入加冰的便携式冷藏柜中冷藏并带回实验室.同时采集3桶(75L)沉积物上方的底层海水,放入冷藏柜中带回实验室.
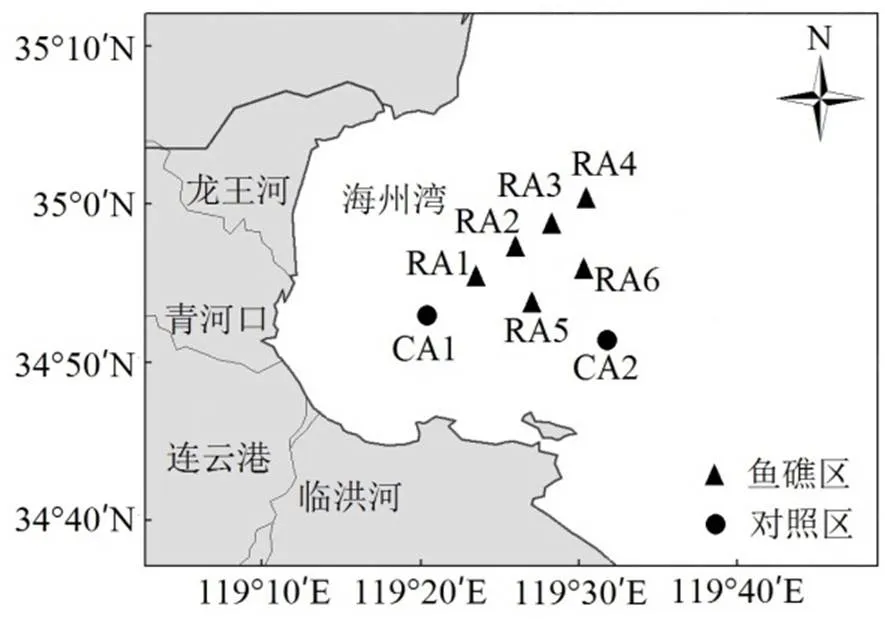
图1 海州湾海洋牧场采样站位
1.2 正交试验设计
根据2015年5月调查采样得到的结果, CA1、RA1、RA2站位的沉积物类型分别为粉砂质黏土(TY)、黏土质粉砂(YT)、粉砂质砂(TS),平均粒径依次增大,水深分别为12.6m、14.1m、14.5m. 908近海专项调查数据显示:海州湾海域全年表层水温变化在31.00~5.70℃之间,平均温度为17.58℃,底层水温在30.00~5.62℃之间,平均温度为16.78℃;表层溶解氧含量介于3.59~ 11.03mg/L,平均含量为7.33mg/L,底层溶解氧含量介于3.29~8.67mg/L,平均含量为7.03mg/L;表层pH值介于7.45~8.96,平均值为8.02,底层pH值介于7.81~8.34,平均值为8.09(908近海专项调查数据).从近些年海州湾的相关研究来看,海州湾海域全年平均海表温16.76℃,平均温度变化范围为5.51~28.52℃[23].海州湾平均溶解氧浓度为6.67mg/L,其具体变化范围为3.77~11.8mg/ L[25-26],且受多条入海河流影响导致海水的pH值会上下波动,其pH平均值为8.11.除了径流、降雨、大气交换等因素的影响,还会受到生物生长的影响,6月和10月是海州湾赤潮的多发期,部分海域的pH值会达到8.87[27].结合908近海专项调查数据与相关研究数据,采用正交设计研究沉积物类型、温度、DO和pH值对沉积物-水界面营养盐交换通量的影响,试验共设定上述4个因素(A、B、C、D),每个因素设定3个水平,在实验中不仅考虑单个因素的影响,而且考虑因素之间的相互作用,选取L27(313)正交设计表,具体试验设计见表1,每组实验设置3个平行.
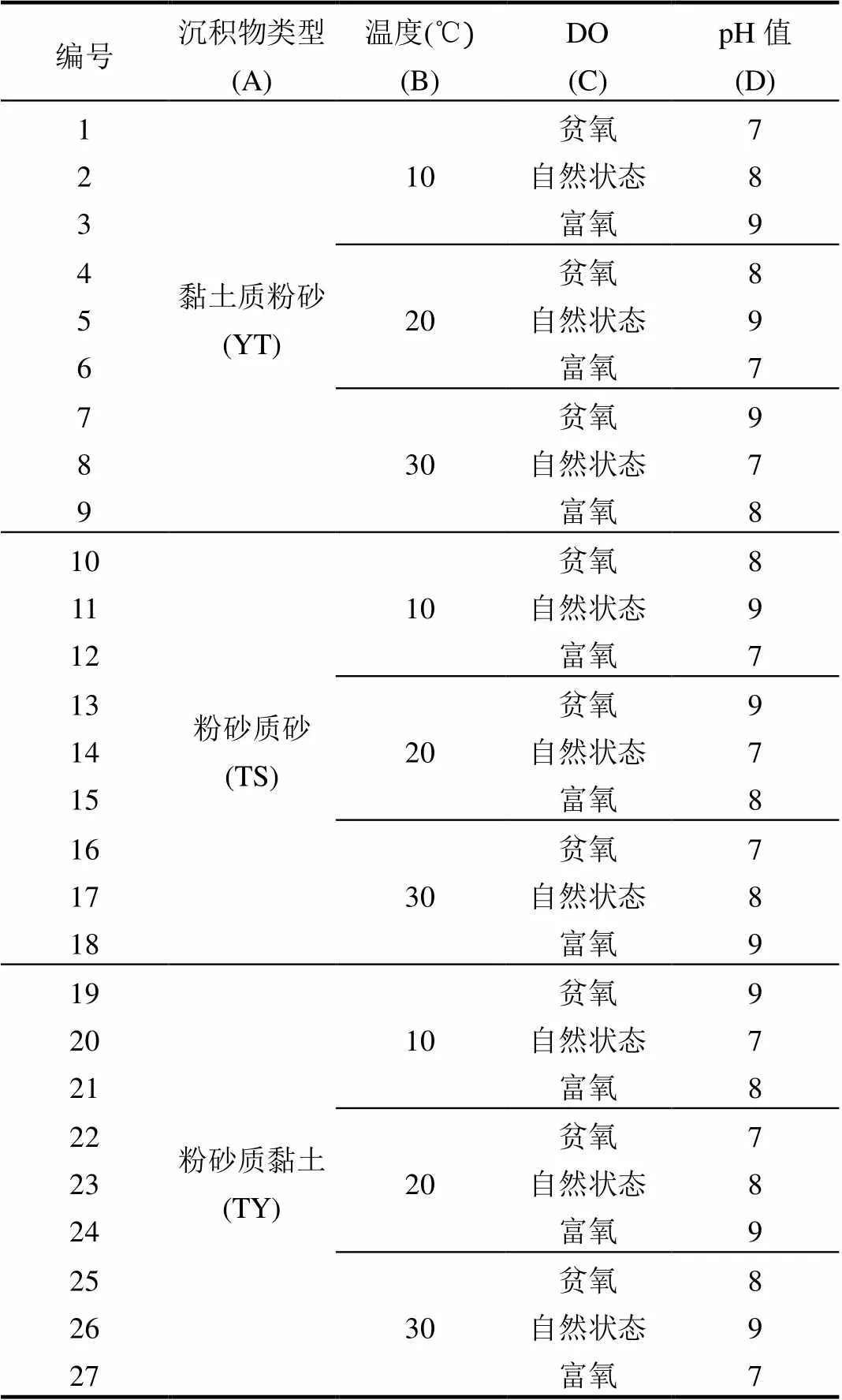
表1 正交试验设计方案
注:“贫氧”条件是向海水中充氮气,DO值为(3±0.5)mg/L;“自然状态”表示自然状态下的DO浓度(6.5±0.5)mg/L;“富氧”条件是向海水中充空气,DO值为(10±0.5)mg/L.
1.3 实验方法
将采集的PVC管中的沉积物样品解冻,并将其中的沉积物样品小心推入直径为5cm,高度为50cm的有机玻璃培养管中,培养管中沉积物的高度约为18cm,将采集的上覆水倒入2L的烧杯中(上覆水的体积约为600mL),用50%的HCL和20%的NaOH调整至所需的pH值,并充分搅匀,在沉积物上方加入约25cm的调整过pH值的上覆水,加水过程中注意避免搅动表层的沉积物.按表1调整每根培养管中的pH值,在需要充氮气和充氧气的培养管中放入连接着气泵的起泡石,调节起泡石的高度,避免搅动表层沉积物,并把这些培养管分别放入10,20,30℃的避光培养箱.分别在培养0,2,4,8,12,24,36,48h后采集上覆水50mL,并加入等体积对应站位的海水.采集的上覆水采用0.45µm醋酸纤维膜过滤,并加入三氯甲烷冷藏保存[28],以备分析.
1.4 测定及计算方法
沉积物粒径采用马尔文Mastersizer 2000激光粒度仪测定,参照谢帕德三角图进行分类[29].培养后采集的水样采用Clever Chem380全自动间断分析仪(Dechem-Tech)测定,各项营养盐的具体方法为:NH4+的测定采用苯酚-次氯酸盐比色法;NO3-的测定采用镉柱还原法;NO2-的测定采用重氮-偶氮法;PO43-的测定为钼蓝分光光度法;SiO32-的测定为硅钼蓝法;沉积物-水界面营养盐交换通量通过公式(1)计算计算得出[30].
式中:为沉积物-水界面营养盐的交换通量, mmol/(m2·d);()为上覆水营养盐质量的变化值, mmol;为培养柱的截面积,m2; Δ为培养时间的变化量,d.
1.5 数据统计与分析
由RGui 3.3.1软件对营养盐的结果进行多因素方差分析,主效应图由Origin 9.1绘制,交互作用图由Minitab 16.1.0绘制.
2 结果与讨论
2.1 不同因素对沉积物-水界面营养盐交换通量的影响
营养盐的交换通量方差分析结果如表2所示,在影响营养盐交换通量的各因素之间存在着交互作用的影响,且这些因素对各营养盐交换通量的影响程度有所不同,影响程度的显著性差异较大.其中DO对NH4+-N交换通量有极显著的影响(<0.01),沉积物类型、温度及沉积物类型和DO的交互作用对NH4+-N交换通量有显著的影响(<0.05).通过比较表2中显著性值的大小可以得出各个因素或交互作用对NH4+-N交换通量影响的主次关系:DO(C)>(A´C)>温度(B)>沉积物类型(A)>pH值(D)>(C´D)>(A´D)>(B´D)> (B´C)>(A´B).通过比较因素独立作用的显著性及其主效应图(图2),得出NH4+-N交换通量随着沉积物类型的平均粒径增大而增大,随着DO的升高而减小,当温度为20℃时,其交换通量最大.DO是影响NH4+-N交换通量最显著的因素,在有氧条件下NH4+可通过硝化作用氧化为NO2-,并能被继续氧化为NO3-,在缺氧条件下, NO3-通过反硝化作用,NO2-和NH4+通过厌氧氨氧化逐步还原生成 N2,或NO3-通过异化硝酸盐还原作用还原为NH4+[31].当水体中的DO浓度较大时,沉积物表层(氧渗透层)处于氧化环境,硝化作用更容易发生,沉积物间隙水中的NH4+-N经过硝化细菌作用转化为NO3-,导致表层沉积物间隙水中的NH4+-N浓度降低.此外,沉积物中NO3-在缺氧环境下会发生异化硝酸盐还原作用,提高沉积物中NH4+-N的浓度[31-33].实验中,当水体中的DO浓度降低时,沉积物表层的氧渗透层发生异化硝酸盐还原作用,改变了原有的浓度梯度,浓度梯度的改变直接影响物质的交换强度[34],从而增大了NH4+-N的交换通量;温度对NH4+-N交换通量存在显著的影响,温度在5~30℃之间时,温度每上升10℃,细菌的增长速率增大1倍[14].温度对参与硝化和反硝化作用的微生物活性有显著的影响,并认为硝化反应的微生物适宜温度为20~30℃,反硝化的适宜温度为25℃左右[35-37].实验发现在20℃时,NH4+-N平均交换通量达到最大值,这可能是由于20℃时微生物的活性较强,沉积物间隙水中大量NH4+-N发生硝化作用,导致水体中的NH4+-N浓度大于沉积物间隙水中的浓度,从而发生交换作用.但是随着温度的升高,硝化作用减弱,从而减低了NH4+-N交换通量;沉积物组成粒径较大的黏土质粉砂(YT)和粉砂质砂(TS)NH4+-N平均交换通量比粒径较小的粉砂质黏土(TY)的交换通量大,沉积物的粒度大小不仅可以改变沉积物中氧气的分布,而且沉积物的粒径越大,微生物能更容易接触到颗粒的表面,因而能培养更多的微生物,使得更多的微生物参与到硝化反应中,从而加快了NH4+-N的硝化过程[38-40].
如表2所示,沉积物类型及沉积物类型和DO的交互作用对NO3-+NO2--N交换通量有极显著的影响(<0.01),温度、DO、沉积物类型和温度的交互作用及沉积物类型和pH的交互作用对NO3-+NO2--N交换通量有显著的影响(< 0.05).通过比较表2中显著性值的大小可以得出各个因素或交互作用对NO3-+NO2--N交换通量影响的主次关系:沉积物类型(A)>(A´C)>DO (C)>温度(B)>(A´B)>(A´D)>pH值(D)>(B´D)> (B´C)>(C´D).通过比较因素独立作用的显著性及其主效应图(图2),得出当沉积物类型为黏土质粉砂(YT)时,NO3-+NO2--N交换通量最大,NO3-+ NO2--N的交换通量随着DO的升高而减小,当温度为10℃,其交换通量最大.沉积物类型是影响NO3-+NO2--N交换通量最显著的因素,沉积物组成粒径较大的黏土质粉砂(YT)和粉砂质砂(TS) 中NO3-+NO2—N的平均交换通量高于粒径较小的粉砂质黏土(TY)的交换通量大,与NH4+-N不同的是黏土质粉砂(YT)的交换通量比粉砂质砂(TS)和粉砂质黏土(TY)高,由于沉积物类型为黏土质粉砂(YT)和粉砂质砂(TS)时,NH4+-N表现出较高的交换通量,大量NH4+-N在细菌的作用下发生硝化作用转化成为NO3--N和NO2--N[41].当沉积物表层(氧渗透层)的NO3--N浓度大于沉积物间隙水中NO3--N的浓度时,NO3--N会向沉积物间隙水扩散,在扩散过程中有一部分NO3-- N会发生反硝化作用,导致交换通量的减小.DO对NO3-+NO2--N的交换通量也有显著的影响, DO的浓度直接关系到水体的氧化还原环境.当水体为氧化环境时,氧渗透层的NH4+-N更容易发生硝化作用,NO3-+NO2--N的交换通量应该比还原条件下更大.但在本实验中,NO3-+NO2--N的交换通量随溶解氧的升高而降低.原因可能是在还原条件下,沉积物对NO3--N有较强的吸附性,从而抑制NO3-+NO2--N的交换,导致其交换通量减小[42-44].但当温度超过25℃时,硝化反应速率降低[45],致使NO3-+NO2--N的交换通量增大,从而出现转折.
如表2所示,DO对PO43--P交换通量有极显著的影响(<0.01),沉积物类型、温度、温度和DO的交互作用对PO43--P交换通量有显著的影响(<0.05).通过比较表2中显著性值的大小可以得出各个因素或交互作用对PO43--P交换通量影响的主次关系:DO(C)>沉积物类型(A)>(B´C)>温度(B)>(A´B)>(B´D)>(A´D)>(C´D)>(A´C)>pH值(D).通过比较因素独立作用的显著性及其主效应图(图2),得出PO43--P交换通量随着沉积物类型的平均粒径增大而增大,随着DO的升高而减小,随着温度的升高而增大.DO是影响PO43--P交换通量最显著的因素, P不会直接参与氧化还原过程,Fe(Ⅲ)与PO43--P虽然形成难溶的铁结合态P,当沉积物表层(氧渗透层)含氧量较高时,Fe(Ⅲ)会限制PO43--P向水体的迁移[46],而当沉积物表层(氧渗透层)含氧量较低时,Fe(Ⅲ)被还原成Fe(Ⅱ),PO43--P从结合态P中释放出来[32,47-48],从而导致了PO43--P的交换通量随DO的降低而增大;沉积物的组成对PO43--P的交换通量也产生了显著的影响,水体中的水生动物的排泄、浮游动植物的尸体以及外源磷沉降都会导致沉积物中有机磷含量的增高,微生物能分解有机质,促进沉积物中营养盐向水层的释放[31],较大的粒径可以培养更多的微生物对有机质进行分解;温度对PO43--P的影响表现在两个方面,沉积物-水界面上的吸附反应通常是一个放热过程,当温度升高时,磷酸盐会发生解吸作用[49],温度的升高还会提高微生物的活性,从而使PO43--P的交换通量增大.
沉积物类型和温度的交互作用对SiO32--Si交换通量有极显著的影响(<0.01),温度、pH值及沉积物类型和DO的交互作用对SiO32--Si交换通量有显著的影响(<0.05).通过比较表2中显著性值的大小可以得出各个因素或交互作用对SiO32--Si交换通量影响的主次关系:(A´B)> (A´C)>温度(B)>pH值(D)>沉积物类型(A)>(A´D)>(B´C)>DO(C)>(C´D)>(B´D).通过比较因素独立作用的显著性及其主效应图(图2),得出SiO32--Si交换通量随着温度的升高而增大,随着pH的升高而增大.温度对SiO32--Si的交换通量有显著的影响,温度会显著影响生物硅的溶解度和溶解动力学过程[50-52].有研究表明,生物硅的溶解度和温度呈线性相关,其关系为eq=23.8+ 936,式中:eq是生物硅的溶解度,是反应温度,温度变化范围为4.5~28℃[53].生物硅的大量溶解,导致溶解态硅浓度上升,从而增大了SiO32--Si的交换通量;虽然pH值在海洋环境中相对稳定,但在河口地区,pH值的变化相对明显[54].生物硅的溶解动力在自然水体中都随pH值的增大而升高,而较高的pH值可以使硅醇键更容易断裂[55].研究发现当pH值从6.1上升至8.1时,二氧化硅的溶解速度上升了2倍[56],溶解速度的增大是导致硅酸盐交换通量变大的主要因素.

表2 正交设计方差分析
注:*表示有显著性差异(<0.05);**表示有极显著性差异(<0.01).´表示2个因素的交互作用.

图2 营养盐交换通量主效应Fig.2 Main effect plot of nutrients exchange flux
2.2 各因素交互作用对沉积物-水界面营养盐交换通量的影响
由表2和图3可知,只有(A´C)的交互作用对NH4+-N的交换通量产生了显著的影响,沉积物类型和DO在各自不同水平上都会有不同的效果.在单因素条件下,NH4+-N的交换通量随沉积物组成平均粒径的增大而减小,随DO的增大而减小,但 (A´C)存在对NH4+-N交换通量的交互作用,在平均粒径较小的沉积物类型和低DO水平共同作用下,NH4+-N的交换通量较大,在沉积物为黏土质粉砂(YT)和DO为自然水平的共同作用下,NH4+-N的交换通量较小.因此,在研究NH4+-N的交换通量时,需要对沉积物类型和DO的交互作用进行考虑.

图3 NH4+-N的交互作用

图4 NO3-+NO2--N的交互作用
由表2和图4可知,(A´B)、(A´C)、(A´D)的交互作用都对NO3-+NO2--N的交换通量产生了显著的影响,在单因素条件下,沉积物平均粒径较大时,NO3-+NO2--N的交换通量较大,20°C时NO3-+NO2--N的交换通量最大,随DO的升高而降低,且pH值对NO3-+NO2--N的交换通量并无显著的影响,但(A´B)、(A´C)、(A´D)存在对NO3-+NO2--N交换通量的交互作用,在平均粒径较大的沉积物类型和低温度水平共同作用下,NO3-+NO2--N的交换通量较大.在平均粒径较小的沉积物类型和低DO水平共同作用下, NO3-+NO2--N的交换通量较大.在沉积物为粉砂质砂(TS)和pH值为9的共同作用下,NO3-+ NO2--N的交换通量最大.因此,在研究NO3-+ NO2--N的交换通量时,需要对沉积物类型、DO、温度和pH值的交互作用进行考虑.

图5 PO43--P的交互作用
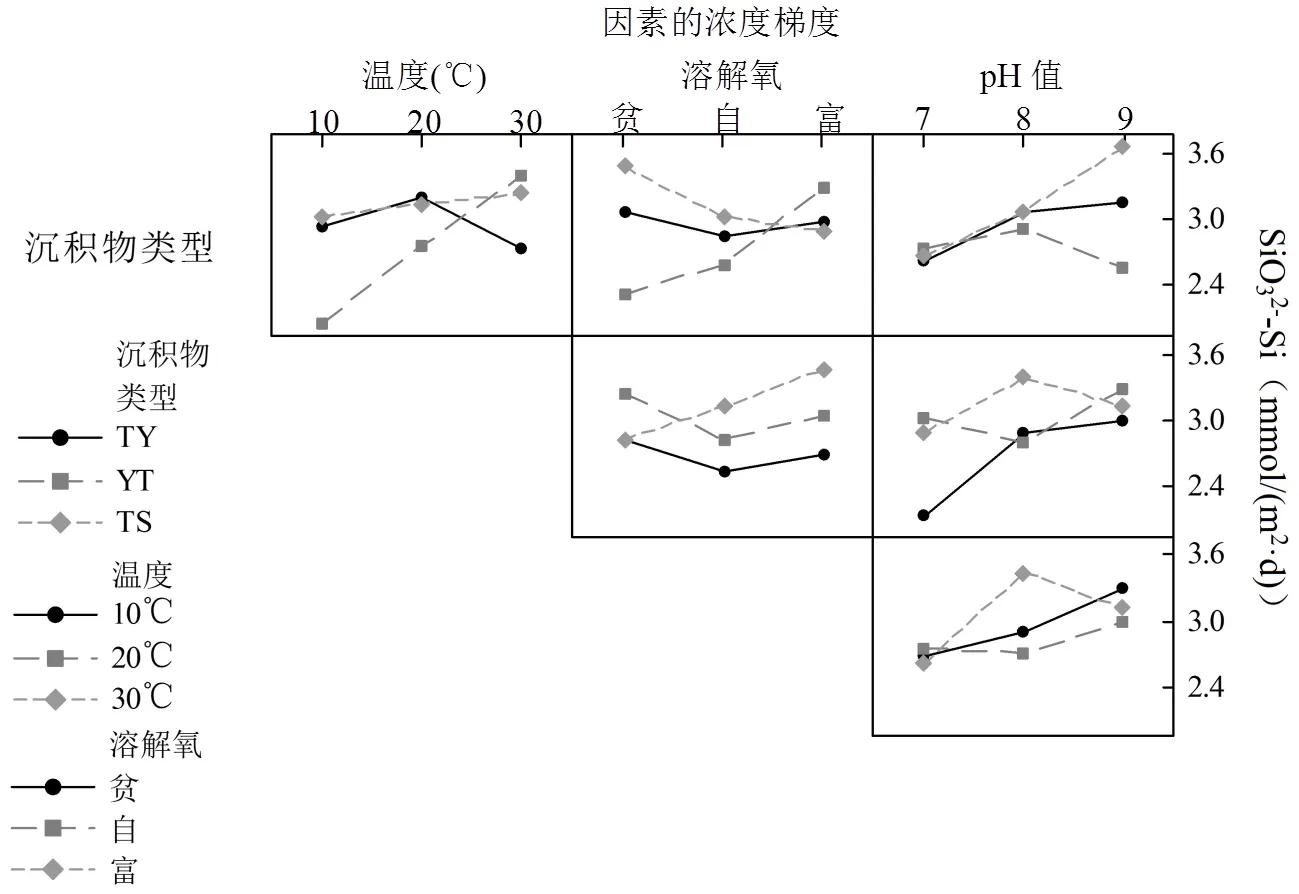
图6 SiO32--Si的交互作用
由表2和图5可知,只有(B´C)的交互作用对PO43--P的交换通量产生了显著的影响,在单因素条件下,PO43--P的交换通量随温度的上升而增大,随DO的增大而减小,但(B´C)存在对PO43--P交换通量的交互作用,在低温和低DO水平的共同作用下,PO43--P的交换通量较小.因此,在研究PO43--P的交换通量时,需要对温度和DO的交互作用进行考虑.
由表2和图6可知,(A´B)和(A´C)的交互作用对SiO32--Si的交换通量产生了显著的影响,在单因素条件下,沉积物类型和DO浓度并未对SiO32--Si的交换通量产生显著的影响,而SiO32-- Si的交换通量随温度的升高而增大,但 (A´B)和(A´C)存在对SiO32--Si交换通量的交互作用,在黏土质粉砂(YT)的沉积物类型和高温的共同作用下,SiO32--Si的交换通量最大,在黏土质粉砂(YT)的沉积物类型和低溶解氧水平的共同作用下,SiO32--Si的交换通量最小.因此,在研究SiO32--Si的交换通量时,需要对沉积物类型和温度的交互作用及沉积物类型和DO的交互作用进行考虑.
2.3 正交试验结果与往年海州湾实测数据比较
根据往年海州湾实地采样,通过实验室培养得到其交换通量的数据(其中2014年部分交换通量数据引自高春梅等[57]的研究),并结合海州湾理化参数进行分析,如表3所示.各项营养盐沉积物-水界面的交换通量随沉积物类型、温度、DO等的变化趋势与本文的研究结果大致相同, DO含量较小的夏季,NH4+-N的交换通量比春季和秋季大.秋季的水温条件应该更适合NH4+-N的交换,但还是比夏季的交换通量小,其原因可能是夏季雨量充沛,处于泄洪时期,河流携带大量营养盐进入水体.粒径较小的黏土质粉砂NH4+-N平均交换通量也比粒径较大的粉砂质砂大;沉积物为黏土质粉砂时,NO3-+NO2--N的交换通量最大. DO含量较小的夏季, NO3-+NO2--N的交换通量比春季和秋季大; DO含量较小的夏季, PO43--P的交换通量比春季和秋季大,且随着沉积物粒径的增大而增大.秋季的温度应更适合PO43--P的交换,但还是比春季的交换通量小,其原因可能是秋季浮游植物丰度较大[58-60],并认为硅藻沉积与沉积物中P 的埋藏有密切联系[61],导致其通量减小;SiO32--Si的交换通量随着夏季温度升高而增大.

表3 海州湾往年营养盐交换通量及理化参数
注:表中数值为正值,表示营养盐由沉积物向上覆水迁移;负值表示营养盐由上覆水向沉积物迁移.
3 结论
3.1 影响NH4+-N交换的因素依次为:DO>温度>沉积物类型;影响NO3-+NO2--N交换的因素依次为:沉积物类型>DO>温度;影响PO43--P交换的因素依次为: DO>沉积物类型>温度;影响SiO32--Si交换的因素依次为:温度>pH值.
3.2 在分析各因素对营养盐交换通量的影响和建立沉积物-水界面模型时,应着重考虑其交互作用的影响效果.
3.3 基于正交实验所得的沉积物类型、温度、DO和pH值这4种因素对沉积物-水界面营养盐交换通量的影响结果与往年海州湾现场调查结果相比较,结果显示本研究结果与往年海州湾现场调查的营养盐交换通量变化趋势具有一致性.
[1] Reay W G. Sediment-water column oxygen and nutrient fluxes in nearshore environments of the lower Delmarva Peninsula, USA [J]. Marine Ecology Progress, 1995,118(1-3):215-227.
[2] Callender E, Hammond D E. Nutrient exchange across the sediment-water interface in the Potomac River estuary [J]. Estuarine Coastal & Shelf Science, 1982,15(4):395-413.
[3] 宋金明.中国近海沉积物-海水界面化学过程与生源物质循环研究[J]. 海洋科学, 2000,24(2):56.
[4] 董 慧.河口区沉积物--水界面营养盐交换通量研究——以李村河为例[D]. 青岛:中国海洋大学, 2012.
[5] 李玲玲.黄河口湿地沉积物中营养盐分布及交换通量的研究[D]. 青岛:中国海洋大学, 2010.
[6] 宋国栋,刘素美,张国玲.黄东海表层沉积物中磷的分布特征[J]. 环境科学, 2014,35(1):157-162.
[7] 李玲玲.黄河口湿地沉积物中营养盐分布及交换通量的研究[D]. 青岛:中国海洋大学, 2010.
[8] Hopkinson C S. Nutrient regeneration in shallow-water sediments of the estuarine plume region of the nearshore Georgia Bight, USA [J]. Deep Sea Research Part B Oceanographic Literature Review, 1987,94(1):127-142.
[9] Mortimer R J G, Krom M D, Watson P G, et al. Sediment-Water Exchange of Nutrients in the Intertidal Zone of the Humber Estuary, UK [J]. Marine Pollution Bulletin, 1999,37(3-7):261- 279.
[10] Nedwell D B, Trimmer M. Nitrogen fluxes through the upper estuary of the Great Ouse, England: the role of the bottom sediments [J]. Marine Ecology Progress, 1998,163(1):109-124.
[11] Rysgaard S, Risgaard-Petersen N, Peter S N, et al. Oxygen regulation of nitrification and denitrification in sediments [J]. Limnology and Oceanography, 1994,39(7):1643-1652.
[12] Conley D J, Stockenberg A, Carman R, et al. Sediment-water Nutrient Fluxes in the Gulf of Finland, Baltic Sea [J]. Estuarine Coastal & Shelf Science, 1997,45(5):591-598.
[13] Rysgaard S. Seasonal variation in nitrification and denitrification in estuarine sediment colonized by benthic microalgae and bioturbating infauna [J]. Marine Ecology Progress Series, 1995, 126(4):154-5.
[14] Antoniou P, Hamilton J, Koopman B, et al. Effect of temperature and pH on the effective maximum specific growth rate of nitrifying bacteria [J]. Water Research, 1990,24(1):97-101.
[15] 石 峰.营养盐在东海沉积物-海水界面交换速率和交换通量的研究[D]. 青岛:中国海洋大学, 2003.
[16] Holdren G C, Armstrong D E. Factors affecting phosphorus release from intact lake sediment cores [J]. Environmental Science & Technology, 1979,14(1):79-87.
[17] 范成新,相崎守弘.好氧和厌氧条件对霞浦湖沉积物-水界面氮磷交换的影响[J]. 湖泊科学, 1997,9(4):337-342.
[18] 黄 爽.东海赤潮高发区颗粒有机物的来源、分布、分解及其环境效应[D]. 青岛:中国海洋大学, 2012.
[19] Gieskes J M. Effect of Temperature on the pH of Seawater [J]. Limnology and Oceanography, 1970,14(2):679-685.
[20] 章守宇,张焕君,焦俊鹏,等.海州湾人工鱼礁海域生态环境的变化[J]. 水产学报, 2006,30(4):475-480.
[21] 朱 珠,张 硕.2012年海州湾海洋牧场示范区水质状况分析与评价[C]. 杭州:中国水产学会学术年会, 2015.
[22] 张存勇.连云港近岸海域海洋工程对生态环境的影响及其研究[D]. 青岛:中国海洋大学, 2006.
[23] 谢 冕.海州湾南部近岸海域氮、磷营养盐变化规律及营养盐限制状况[D]. 青岛:国家海洋局第一海洋研究所, 2013.
[24] Zhen S. Phosphorus speciation and effects of environmental factors on release of phosphorus from sediments obtained from Taihu Lake, Tien Lake, and East Lake [J]. Toxicological & Environmental Chemistry, 2015,97(3/4):335-348.
[25] 张 旭.连云港海州湾近岸海域溶解氧含量及饱和度特征分析[J]. 中国水运:理论版, 2007,5(10):69-70.
[26] 方南娟,梅肖乐.海州湾近岸海域水质现状与趋势分析[J]. 水产养殖, 2013,34(1):28-31.
[27] 周德山.海州湾海域赤潮形成的环境因子研究[D]. 苏州:苏州大学, 2008.
[28] 徐善良,沈 勤,严小军,等.水样中氮磷营养盐的短期保存技术研究[C]. 福州:中国科学技术协会年会, 2010:52-59.
[29] 赵东波.常用沉积物粒度分类命名方法探讨[J]. 海洋地质前沿, 2009,25(8):41-44.
[30] Michaud E, Sundby B, Desrosiers G, et al. The functional group approach to bioturbation: II. The effects of the Macomabalthica, community on fluxes of nutrients and dissolved organic carbon across the sediment-water interface [J]. Journal of Experimental Marine Biology & Ecology, 2006,337(2):178-189.
[31] Francis C A, Beman J M, Kuypers M M. New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation [J]. Isme Journal, 2007,1(1): 19-27.
[32] Strous M, Kuenen J G, Jetten M S M. Key Physiology of Anaerobic Ammonium Oxidation [J]. Applied & Environmental Microbiology, 1999,65(7):3248-3250.
[33] Thamdrup B, Dalsgaard T. Thamdrup B, et al. Production of N2through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments [J]. Applied & Environmental Microbiology, 2002,68(3):1312-1318.
[34] Syers J K, Harris R F, Armstrong D E. Phosphate chemistry in lake sediments [J]. Journal of Environmental Quality, 1973,2(1): 1-14.
[35] Banerjee A, Elefsiniotis P, Tuhtar D. The effect of addition of potato-processing wastewater on the acidogenesis of primary sludge under varied hydraulic retention time and temperature [J]. Journal of Biotechnology, 1999,72(3):203-212.
[36] 马 娟,彭永臻,王 丽,等.温度对反硝化过程的影响以及pH值变化规律[J]. 中国环境科学, 2008,28(11):1004-1008.
[37] 尚会来,彭永臻,张静蓉,等.温度对短程硝化反硝化的影响[J]. 环境科学学报, 2009,29(3):516-520.
[38] Vlaeminck S E, Terada A, Smets B F, et al. Aggregate Size and Architecture Determine Microbial Activity Balance for One-Stage Partial Nitritation and Anammox [J]. Applied & Environmental Microbiology, 2009,76(3):900-909.
[39] Volcke E I, Picioreanu C, De B B, et al. Effect of granule size on autotrophic nitrogen removal in a granular sludge reactor [J]. Environmental Technology, 2010,31(11):1271-1280.
[40] 张 艳,白相东,袁四化,等.颗粒粒径对三氮硝化-反硝化影响特征研究[J]. 科学技术与工程, 2015,15(18):243-246.
[41] Herbert R A. Nitrogen cycling in coastal marine ecosystems [J]. FEMS Microbiology Reviews, 1999,23(5):563-590.
[42] 戚晓红,刘素美,张 经.东、黄海沉积物-水界面营养盐交换速率的研究[J]. 海洋科学, 2006,30(3):9-15.
[43] Cerco C F. Measured and modelled effects of temperature, dissolved oxygen and nutrient concentration on sediment-water nutrient exchange [J]. Hydrobiologia, 1989,174(3):185-194.
[44] 张 辉.黄东海沉积物中营养盐分布及交换通量研究[D]. 青岛:中国海洋大学, 2009.
[45] Fux C, Boehler M, Huber P, et al. Biological treatment of ammonium-rich wastewater by partial nitritation and subsequent anaerobic ammonium oxidation (anammox) in a pilot plant. [J]. Journal of Biotechnology, 2002,99(3):295-306.
[46] Jensen H S, Mortensen P B, Rasmussen E, et al. Phosphorus cycling in a coastal marine sediment, Aarhus Bay, Denmark [J]. Limnology and Oceanography, 1995,40(5):908-917.
[47] Andersen F Ø, Ring P. Comparison of phosphorus release from littoral and profundal sediments in a shallow, eutrophic lake [J]. Hydrobiologia, 1999,408-409:175-183.
[48] Anschutz P, Chaillou G, Lecroart P. Phosphorus diagenesis in sediment of the ThauLagoon [J]. Estuarine Coastal & Shelf Science, 2007,72(3):447-456.
[49] 赵志梅.渤海湾沉积物磷形态及营养盐在沉积物-水界面交换的研究[D]. 咸阳:西北农林科技大学, 2005.
[50] Lawson D S, Hurd D C, Pankratz H S. Silica dissolution rates of decomposing phytoplankton assemblages at various temperatures [J]. American Journal of Science, 1978,278(10):1373-1393.
[51] Kamatani A. Dissolution rates of silica from diatoms decomposing at various temperatures [J]. Marine Biology, 1982, 68(1):91-96.
[52] Cappellen P V, Qiu L. Biogenic silica dissolution in sediments of the Southern Ocean. I. Solubility [J]. Deep Sea Research Part II Topical Studies in Oceanography, 1997,44(5):1109-1128.
[53] Loucaides, Socratis, Cappellen P V, et al. Dissolution of biogenic silica from land to ocean: Role of salinity and pH [J]. Limnology & Oceanography, 2008,53(4):1614-1621.
[54] Jourabchi P, Meile C, Pasion L R, et al. Quantitative interpretation of pore water O2and pH distributions in deep-sea sediments [J]. Geochimica et Cosmochimica Acta, 2008,72(72):1350-1364.
[55] Dove P M, Elston S F. Dissolution kinetics of quartz in sodium chloride solutions: Analysis of existing data and a rate model for 25℃[J]. Geochimica et Cosmochimica Acta, 1992,56(12):4147- 4156.
[56] Loucaides S. Dissolution of biogenic silica: Roles of pH, salinity, pressure, electrical charging and reverse weathering [J]. Journal of Histochemistry & Cytochemistry Official Journal of the Histochemistry Society, 2009,22(12):1092-1104.
[57] 高春梅,郑伊汝,张 硕.海州湾海洋牧场沉积物-水界面营养盐交换通量的研究[J]. 大连海洋大学学报, 2016,31(1):95-102.
[58] 杨晓改.海州湾及其邻近海域浮游生物群落结构及其与环境因子的关系[D]. 青岛:中国海洋大学, 2015.
[59] 孔 明,张 路,尹洪斌,等.蓝藻暴发对巢湖表层沉积物氮磷及形态分布的影响[J]. 中国环境科学, 2014,34(5):1285-1292.
[60] 张玉凤,田 金,杨 爽,等.大连湾海域营养盐时空分布、结构特征及其生态响应[J]. 中国环境科学, 2015,35(1):236-243.
[61] Diaz J, Ingall E, Benitez-Nelson C, et al. Marine polyphosphate: a key player in geologic phosphorus sequestration [J]. Science, 2008,320(5876):652-655.
Exchange fluxes of nutrients at the sediment-water interface based on orthogonal experimental design--Taking the marine ranching area of Haizhou Bay as an example.
ZHANG Shuo1,2, FANG Xin1, HUANG Hong3, ZHANG Hu4, ZHANG Jun-bo1,5,6*
(1.College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;2.Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;3.College of Marine Ecology and Environment, Shanghai Ocean University, Shanghai 201306, China;4.Maine Fisheries Research Institution of Jiangsu, Nantong 226007, China;5.National Engineering Research Center for Oceanic Fisheries, Shanghai Ocean University, Shanghai 201306, China;6.National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China)., 2017,37(11):4266~4276
The exchange fluxes of nutrients between sediment and water interface were studied in Haizhou Bay, where 3 stations were sampled inMay 2016 to further investigate the characteristics of nutrients fluxes exchange based on orthogonal experiment method. The effects of sediment type, temperature, DO and pH on the exchange fluxes of nutrients between sediment and water interface were analyzed. The primary and secondary relations of various factors above affecting nutrient fluxes could be observed. With respect to NH4+-N, its influencing factors were shown as follows, DO>temperature>sediment type; for NO3-+NO2--N, sediment type>DO>temperature; for PO43--P, DO>sediment type>temperature; for SiO32--Si, temperature>pH. The interaction among these factors was found as an important effect on the fluxes of nutrients, which should be taken into account in the establishment of the sediment-water interface nutrients exchange model. Results in this study on the effect of sediment types, temperatures, dissolved oxygen, and pH on the nutrient exchange fluxes in Haizhou Bay were basically consistent with the investigation data of Haizhou Bay in former years.
sediment-water interface;nutrinets;exchange flux;orthogonal experiment;interaction
X131.2
A
1000-6923(2017)11-4266-11
张 硕(1976-),男,天津人,副教授,博士,主要从事海洋生态修复方面研究.发表论文40余篇.
2017-04-07
海州湾海洋牧场示范项目(D-8006-12-0018,D8006-15-8014);公益性行业(农业)科研专项(201003068,201303047);国家高技术研究发展计划项目(2006A A100303)
* 责任作者, 副教授, jb_zhang@shou.edu.cn
