微囊藻毒素-LR和铜绿微囊藻裂解液对水稻光合作用的影响
2017-11-23姜锦林邓正栋
时 玥,姜锦林,邓正栋
微囊藻毒素-LR和铜绿微囊藻裂解液对水稻光合作用的影响
时 玥1,2,姜锦林2*,邓正栋1
(1.解放军理工大学国防工程学院,江苏南京 210009;2.环境保护部南京环境科学研究所,国家环境保护农药环境评价与污染控制重点实验室,江苏南京 210042)
蓝藻水华在生长和衰亡过程中会产生包括微囊藻毒素在内的多种有毒代谢产物,这些毒素可能会随灌溉用水进入农田而对作物带来不利影响.本研究选用微囊藻毒素-LR(MC-LR)纯品和铜绿微囊藻裂解液分别对营养生长期水稻进行21d暴露处理,考察不同浓度(0.1,1.0,10.0,100.0,500.0μg/L)MC-LR和不同稀释倍数(0.002,0.02和0.2倍)铜绿微囊藻裂解液对水稻叶绿素荧光强度、净光合速率、蒸腾速率、气孔导度及叶片超微结构的影响.研究结果表明,MC-LR对水稻光合作用特征参数具有显著的抑制作用,其中蒸腾速率和气孔导度对MC-LR暴露最为敏感,比较来看,考察浓度范围内铜绿微囊藻裂解液对植物光合作用特性指标影响显示出不同的特点,甚至表现出一定刺激和促进作用,0.02倍裂解液暴露显著促进植株蒸腾作用和气孔导度.此外,高浓度的单一MC-LR和高浓度铜绿微囊藻裂解液都能对水稻叶片超微结构能造成一定程度的损伤.铜绿微囊藻裂解液和MC-LR作用特点不一致,推测是裂解液中其他组分造成微囊藻毒素有效性的改变和毒性的降低.
微囊藻毒素-LR;铜绿微囊藻;水稻;光合作用
在富营养化和超富营养化状态的水体中,蓝藻通常会异常增殖,产生水华蓝藻.水华蓝藻中如微囊藻、鱼腥藻、浮丝藻、念珠藻和节球藻等可产生微囊藻毒素(MCs)、鱼腥藻毒素和节球藻毒素等多种藻毒素[1],严重威胁水生生态系统,引发生态灾害事件并危及水源地水质安全.MCs是众多藻毒素中分布最广、毒性最大的,具有7种氨基酸组成的环状七肽物质,目前为止,已被发现的MCs异构体有近90种[2],以MC-LR、MC-RR和MC-YR这3种类型最为常见[3].蓝藻水华发生时,水体中藻毒素含量在0.1~10μg/L之间[4],当有外来因素导致蓝藻细胞内毒素大量释放时,水体中藻毒素含量短时内可高达1800μg/L[5],对生态及人类健康造成严重威胁.
MCs最经典的致毒机制是抑制蛋白磷酸酶1和2A活性,影响细胞内蛋白磷酸化和去磷酸化的平衡[6],近年研究表明氧化胁迫也是MCs致毒机理的一个重要方面[7-9].蓝藻代谢释放的MCs具有生物富集效应[10-11],会对水生动植物造成危害,并存在随食物链传递的风险[12].MCs还会随着灌溉、蓝藻堆放处理等方式进入到土壤圈中[13-14],在MCs在完全降解之前仍然要在土壤中滞留一段时间,这将对暴露在该环境下的作物带来不利影响.研究表明,塔克库斯特湖周围农田灌溉水中MCs的含量最高可达100μg/L[15];而在滇池湖水灌溉的农田土壤中检测到MCs的平均含量为1.6μg/kg[3].在MCs在完全降解之前仍然要在土壤中滞留一段时间,这将对暴露在该环境下的作物带来不利影响.经调查研究[16-17],种植在MCs污染水源附近的农作物如番茄、辣椒和水稻等样本中均有MCs的检出情况,且在MCs的长期暴露下,水稻、油菜、小白菜等作物的生长都会受到不同程度的抑制[18-20].
前期研究[21]表明,0.1~10.0 μg/L的MC-LR和微囊藻裂解液分别暴露对水稻的生长影响和生态生理学效应显示出不一致的特点,单一MC-LR能抑制水稻株高、根长及叶片中淀粉酶活性,而高浓度裂解液在水稻的生长发育方面更多地表现为对植株的刺激和促进作用,仅对水稻根长抑制显著.在生理生化方面,MC-LR纯品对水稻叶片还原性谷胱甘肽(GSH)具有诱导作用,而裂解液对GSH、丙二醛(MDA)和碱性磷酸酶(AKP)都表现出显著抑制.为进一步比较研究MCs纯品和微囊藻裂解液对特定营养生长期阶段的水稻(介于幼苗期和分蘖期之间)产生的不同生物效应,本研究选用单一MC-LR和铜绿微囊藻裂解液分别对水稻进行21d暴露处理,考察不同稀释倍数(0.1,1.0,10.0,100.0,500.0μg/L) MC-LR和不同浓度(0.002,0.02和0.2倍)裂解液对水稻叶绿素荧光强度、净光合速率、蒸腾速率、气孔导度及叶片超微结构的影响,拟通过本研究,比较MC-LR与纯毒素对水稻光合作用特性的异同点.
1 材料与方法
1.1 实验材料与试剂
铜绿微囊藻藻种PACHB-905、MC-LR标准样品(10.0μg/L)和ELISA试剂盒购自中科院武汉水生所;纯微囊藻毒素MC-LR(纯度³95%),购自台湾藻研究有限公司;相关生理生化指标检测试剂盒购自南京建成生物工程研究所.
1.2 铜绿微囊藻的培养及其裂解液制备
铜绿微囊藻PACHB—905采用BG11培养基,在光照培养箱中(25±1)oC,照度2000lx,120r/ min下培养.取对数生长期的铜绿微囊藻,12000r/min下离心10min,弃上清,收集藻细胞于冻干机中冻干,准确称取约5g冻干藻粉,加入一定量去离子水,反复冻融3次后,超声振荡器处理10min, 10000r/min离心20min后取上清液,定容至250mL,即得到蓝藻裂解液,经HLB小柱(Waters)萃取、净化、浓缩定容后,HPLC(Waters e2695/2998液相色谱仪,Zorbax Eclipse SB-C18柱,PDA检测器)测定蓝藻冻干粉中MC-LR浓度为43.47μg/g[21],干藻裂解液于-20℃保存.
1.3 水稻培养及暴露处理
选取颗粒饱满的日本晴(L.)水稻种子用1% NaClO消毒20min,充分漂洗后于28℃下浸种24h,并于恒温培养箱25℃黑暗湿润环境中催芽,待水稻发芽后挑选长势良好的幼苗转移入国际水稻研究所常规营养液(含40mg/L Na+,10mg/L P5+,40mg/L K+,40mg/L Ca2+,40mg/L Mg2+,0.5mg/L Mn2+,0.05mg/L Mo6+,0.2mg/L B3+, 0.01mg/L Zn2+,0.01mg/L Cu2+,2mg/L Fe3+)中继续培养.培养条件:光/暗为14h/10h,光照强度2000lx, 相对湿度75%/70%,温度25℃.每2d换一次营养液,培养1周后对水稻进行染毒实验.
实验浓度设置为空白对照组(加100mL水培液);0.1,1.0,10.0,100.0,500.0μg/L MC-LR处理组;0.002倍裂解液处理组(100mL水培液+0.2mL裂解液);0.02倍裂解液处理组(98mL水培液+2mL裂解液);0.2倍裂解液处理组(80mL水培液+20mL裂解液),每组设3个平行,染毒周期为21d,每2d换一次营养液,定期收集10mL残留液过0.45μm滤膜,根据ELISA试剂盒MC-LR的定量线性范围(0.1~10.0μg/L)设置不同稀释倍数,测定水培液中藻毒素含量.
1.4 植株光合系统相关指标测定
用便携式光合测定仪测定水稻叶片净光合速率、蒸腾速率、气孔导度和叶绿素荧光.测定水稻叶片叶绿素荧光时,激发光强为最大光强的50%(1500μmol/(m2·s)),暗适应时间不少于30min,记录时间5s,测定均在室温下进行.用可变荧光()与最大荧光(m)的比值/m表示光合效能活性的大小.
1.5 叶片透射电镜观察
双刀片法获得水稻鲜叶样品,样品经4%戊二醛(0.2mol/L磷酸缓冲液配制,pH 7.2)固定,0.1mol/L磷酸缓冲液清洗,1%锇酸(0.2mol/L磷酸缓冲液配制,pH 7.2)固定,0.1mol/L磷酸缓冲液清洗,丙酮系列脱水(30、50、70、90)%各1次,纯丙酮2次;丙酮与Epon812包埋剂(1:1,1:2)渗透各1次,纯Epon812包埋剂渗透过夜,(30℃ 24h、40℃ 24h、60℃ 48h)烘箱内聚合,修块,LKB-Ⅴ型超薄切片机半薄切片定位,超薄切片,醋酸铀、柠檬酸铅双染色,HITACHI H-600(日立)透射电子显微镜观察、拍片.
1.6 数据处理
研究结果由SPSS 19.0软件计算,对于效应值的显著性分析,在满足正态分布(Shapiro-Wilk test)和方差齐性(Levene’s test)的前提条件下,采用方差分析(ANOVA)和多重比较(S-N-K test)分析处理之间的差异显著性,否则采用非参数检验(Kruskal- Wallis test)来检验处理之间差异的显著性,<0.05具有显著差异,<0.01具有极为显著的差异,实验结果表示为平均数±标准偏差,用Origin 8.5作图.
2 结果与分析
2.1 暴露体系微囊藻毒素的ELISA分析
暴露体系中微囊藻毒素的ELISA分析结果如表1所示,由表1可知,0.1μg/LMC-LR处理组的测定浓度比理论浓度略高,这可能是该浓度接近试剂盒测定下限造成测定有所干扰,或为低浓度溶液配制偏差,加上暴露体系在培养环境中培养液蒸发和换液等相关步骤等综合因素导致,其余MC-LR处理组在21d暴露期间的实际暴露浓度均与理论浓度较为符合.铜绿微囊藻裂解液测定结果为总微囊藻毒素浓度,结果除包括MC-LR外,可能还含有MC-RR等其他共存的藻毒素.

表1 培养液中微囊藻毒素实际浓度测定
2.2 MC-LR与铜绿微囊藻裂解液对水稻植株光合系统相关指标的影响
2.2.1 MC-LR与铜绿微囊藻裂解液分别暴露对水稻净光合速率的影响 由图1所示,在较低浓度范围(0.1~10.0μg/L),MC-LR暴露21d对水稻叶片净光合速率无显著影响,而高浓度MC- LR(100.0,500.0μg/L)处理则对植株净光合速率有极显著的抑制作用.比较来看,考察浓度范围内铜绿微囊藻裂解液暴露对水稻净光合速率无显著影响.
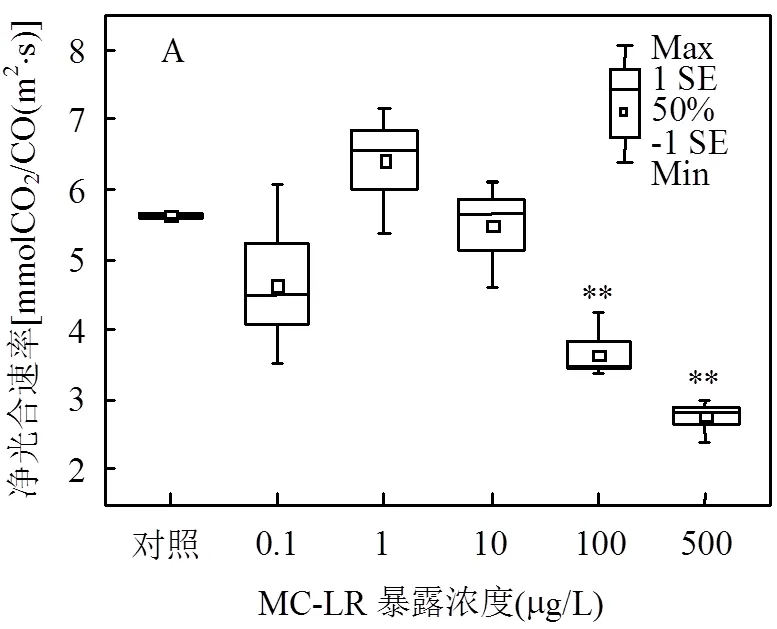
*<0.05,**<0.01;Max和Min分别代表试验数据最大值和最小值;1SE和-1SE代表标准误差;50%代表试验数据的中位数; □代表算术均值(下同)
2.2.2 MC-LR与铜绿微囊藻裂解液分别暴露对水稻蒸腾速率的影响 由图2所示,和空白对照相比,MC-LR纯品暴露21d对水稻蒸腾速率整体起到极显著的抑制作用, 0.02倍绿微囊藻裂解液与MC-LR纯品作用特点不同,暴露21d对水稻的蒸腾作用有极显著促进作用.
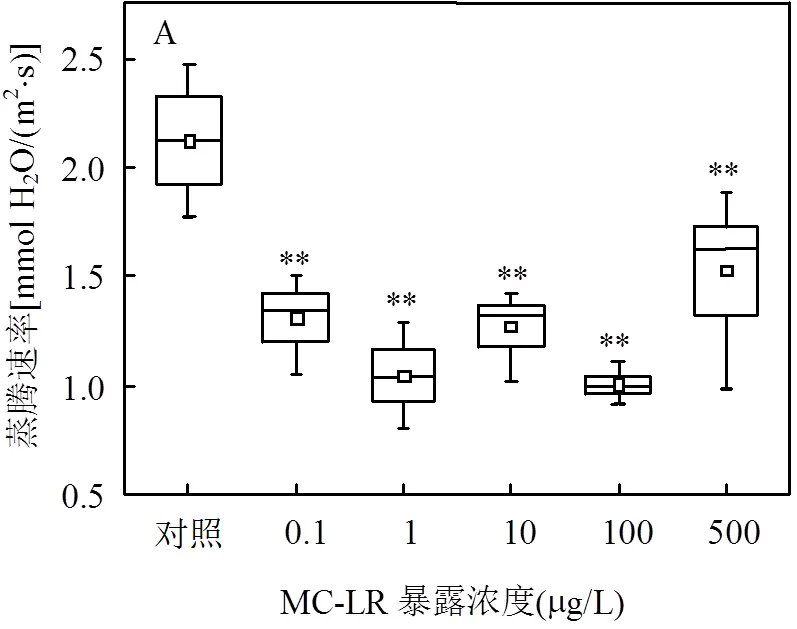
2.2.3 MC-LR与铜绿微囊藻裂解液分别暴露对水稻气孔导度的影响 由图3所示,与蒸腾速率变化类似,和空白对照相比,MC-LR纯品暴露21d对水稻气孔导度整体起到极显著的抑制作用, 而0.02倍绿微囊藻裂解液暴露21d对水稻的气孔导度有极显著促进作用.
2.2.4 MC-LR与铜绿微囊藻裂解液分别暴露对水稻叶绿素荧光影响 由图4所示,高浓度组的MC-LR(500.0μg/L)暴露21d造成水稻叶绿素荧光极显著下降,而考察稀释浓度范围内铜绿微囊藻裂解液对水稻叶绿素荧光均无显著影响.

图3 MC-LR(A)与铜绿微囊藻裂解液(B)分别暴露对水稻气孔导度的影响

图4 MC-LR(A)与铜绿微囊藻裂解液(B)分别暴露对水稻叶绿素荧光影响对比
2.3 MC-LR和铜绿微囊藻裂解液对水稻叶片超微结构的影响
由图5可知,对照组水稻叶片细胞中的超微结构主要特征为叶绿体紧贴细胞壁分布,中央大液泡,细胞核近一侧分布,线粒体正常;其中叶绿体中含少量淀粉粒和嗜锇颗粒,类囊体片层排列有序并且规则.

图5 对照组水稻叶片超微结构的影响
(A)显示叶片细胞中的叶绿体及细胞核,Bar=2µm;(B)显示叶片细胞叶绿体中的类囊体片层,Bar=500nm对照;(C)显示叶片细胞中的线粒体,Bar= 1µm
由图6可知,100.0μg/L MC-LR暴露后,水稻叶片超微结构出现损伤,主要表现为叶绿体部分贴细胞壁分布,部分细胞出现质壁分离现象,中央大液泡中仍然有高电子密度大圆颗粒状嗜锇物质分布,同时中央大液泡中出现较多的环状片层,细胞核近一侧分布,线粒体被膜降解;其中:叶绿体肿胀,同样含有少量淀粉粒,嗜锇颗粒有增大趋势,类囊体片层扩张.

图6 100.0μg/L MC-LR暴露对水稻叶片超微结构影响
(A)显示叶片细胞中的叶绿体及液泡中的高电子密度圆颗粒状嗜锇物质,Bar=2µm;(B)显示叶片细胞叶绿体中的类囊体片层,Bar=500nm;(C)显示叶片细胞中的线粒体及环状片层 Bar=1µm;(D)显示叶片细胞中的线粒体,Bar=1µm
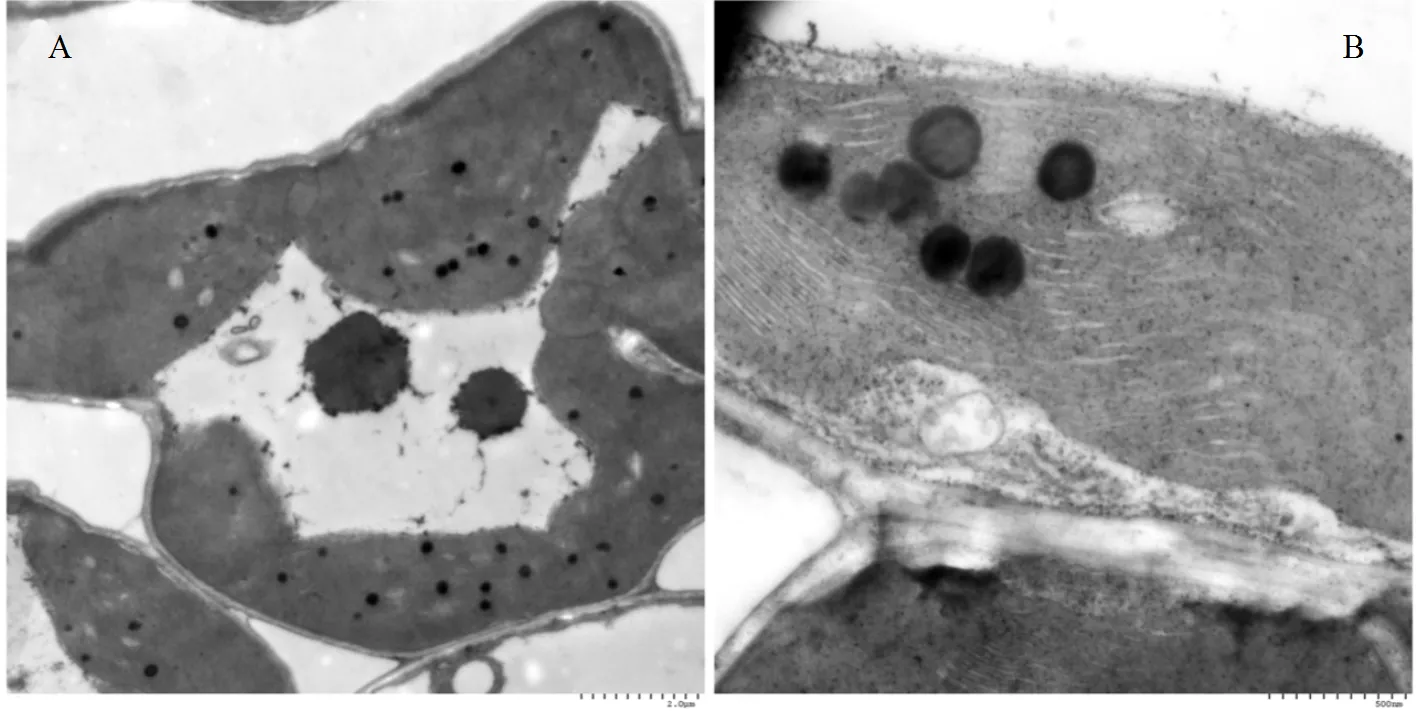
(A)显示叶片细胞中的叶绿体及液泡中的高电子密度圆颗粒状嗜锇物质,Bar=2µm;(B)显示叶片细胞叶绿体中的类囊体片层,Bar=500nm;(C)显示叶片细胞中的线粒体Bar=1µm;(D)显示叶片细胞中的细胞核,Bar=2µm
由图7可知,0.2倍铜绿微囊藻裂解液稀释液暴露后,水稻叶片细胞中的超微结构也受到一定影响,但受损程度不如100.0μg/L MC-LR暴露组严重,主要表现为叶绿体依然近贴细胞壁分布,但部分叶绿体有肿胀现象,中央大液泡中高电子密度大圆颗粒状嗜锇物质分布仍然较多,细胞核近一侧分布,线粒体大部分正常,少部分细胞出现轻微质壁分离现象;其中:叶绿体同样含有少量淀粉粒,嗜锇颗粒有增多趋势,类囊体片层有轻微扩张.
3 讨论
3.1 MC-LR与铜绿微囊藻裂解液对水稻光合特性的影响
自然界中生产藻毒素的蓝藻群体可生产一种或多种藻毒素,不同藻毒素的毒性结构和致毒机理也不尽相同[22],因此,藻毒素裂解液与MC-LR纯品产生的生物毒性会有所不同.前期研究表明,水稻在MC-LR纯品和铜绿微囊藻裂解液暴露对水稻的生长和生理生化指标展现出不同的毒性效应特点[21],本研究同样表明, MC-LR纯品和铜绿微囊藻裂解液对水稻光合作用系统也显示出不同的效应特点.净光合速率、蒸腾速率和气孔导度是植物光合特性相关的重要参数.净光合速率指植物光合作用积累的有机物,其值等于总光合速率减去呼吸速率.本研究中高浓度MC-LR(100.0和500.0μg/L)处理对水稻净光合速率有极显著的抑制作用,表明高浓度MC-LR可以抑制植物光合作用,进而对水稻生长发育和物质积累造成严重不利影响,与前期研究结果相符合[21].植物蒸腾作用主要是气孔蒸腾,其主要受光、温度和CO2等因素的调节.本研究考察浓度范围内,MC-LR纯品暴露均对水稻的蒸腾速率造成显著抑制,这与MC-LR暴露后造成水稻叶片气孔导度的改变相关.气孔运动具有渗透调节机制,保卫细胞水势提高则气孔张开,水势降低则气孔关闭.由本研究水稻叶肉细胞超微结构图可知,MC-LR暴露可造成水稻叶肉细胞产生一定程度的质壁分离现象,即细胞液泡失水使原生质层与细胞壁分离,因而推测MC-LR可以造成水稻叶片保卫细胞水势降低,进而造成蒸腾作用下降.气孔运动与保卫细胞中淀粉和蔗糖转化而形成的渗透势改变也有关,前期研究表明一定浓度的MC-LR暴露造成水稻淀粉酶活力显著下降[21],淀粉水解转化为蔗糖时保卫细胞的渗透势降低,水进入细胞使细胞膨压增加,气孔张开,蒸腾速率提高,反之则下降,因而MC-LR胁迫下水稻叶片淀粉酶活力的降低可能与蒸腾速率下降也有关系.此外,MC-LR还能破坏生物细胞骨架系统,因此纯品MC-LR暴露下蒸腾速率的敏感变化可能与保卫细胞牵引气孔运动的微纤丝受损有关[23].而铜绿微囊藻裂解液暴露后水稻的蒸腾速率出现相反变化的趋势,0.02倍铜绿微囊藻裂解液暴露21d对水稻的蒸腾作用有极显著促进作用.这种MCs暴露后出现效应不一致的情况与前期研究中发现的植株生长和生理生化指标不一致的结果在一定程度上是类似的[21].这是由于植株暴露在含复杂基质成分的裂解液中,除遭受MCs的毒性影响之外,同时还暴露于其他复杂藻细胞裂解成分(也包括部分营养物质),复合因素影响对植株生长和生理生化指标表现出一定的未知刺激作用.
3.2 MC-LR与铜绿微囊藻裂解液对水稻叶绿素荧光的影响
光合作用是植物生长的基础,叶绿素荧光和光合作用过程中各个步骤都紧密相关,采用叶绿素荧光技术能精确测定和研究光合作用的动态变化,能灵敏探测各种外界胁迫因子对光合作用造成的影响.本研究中只有高浓度MC-LR暴露对水稻叶绿素荧光造成显著性抑制,但考察浓度范围内铜绿微囊藻裂解液对其无显著影响.目前植物衰老或者污染物胁迫下植物光合作用效率、抗氧化系统、光合反应关键酶、叶绿体超微结构、类囊体膜脂肪酸成分变化和光合膜功能性大分子蛋白质复合物的变化特征等都已有研究[24-25],但这些光合效能指标与微囊藻毒素作用过程的相互关系还有待进一步探索.MCs毒性作用机制最为经典的解释是抑制丝氨酸-苏氨酸蛋白磷酸酶1和2A的活性[6,9],近几年的研究表明氧化胁迫也是MCs另一个重要的毒性作用机理[7,9].活性氧(ROS)作为重要的信号分子参与到一系列植物生命过程中,如根毛发育和延长、叶片展开、顶端优势、花药发育和花粉成熟等[26],调查生物或非生物因素胁迫下ROS 的产生和变化对研究相关毒性机制是至关重要的[8],Jiang等[9]发现,低浓度MC-LR对沉水植物苦草的致毒机制似乎与氧化应激关系更为密切,且1.0~10.0μg/L MC-LR作用14d可导致叶片可溶性蛋白含量下降,叶绿素含量下降,还观察到高浓度MC-LR (10.0和25.0μg/L)胁迫导致植株色素表达模式上发生变化,随着暴露浓度升高,叶片Chla含量增高且Chlb含量下降.类似的结果也在其他研究中得到佐证:将金鱼藻暴露于0~5μg/L的MC-LR溶液中,24h后明显可以看到一个剂量依赖性的色素表达变化:从Chl a向Chl b转变[27].而叶绿素含量的变化明显将影响到水生植物的光合作用,这实际上也是蓝藻对水生高等植物他感作用的一个体现.
3.3 MC-LR与铜绿微囊藻裂解液对水稻叶片超微结构的影响
到目前为止,对MCs作用下植物的超显微结果的损伤研究甚少,Jiang等[9]发现与MC-LR作用剂量正相关的叶肉细胞超显微结构的变化,较高浓度MC-LR可造成细胞器如叶绿体和线粒体的严重损伤.本研究发现MC-LR暴露可造成水稻叶片叶绿体肿胀、类囊体片层扩张现象.此外,还发现MC-LR暴露可造成水稻少部分叶肉细胞出现质壁分离现象,即细胞液泡失水使原生质层与细胞壁分离,说明MC-LR可以造成水稻叶片保卫细胞水势降低,进而造成蒸腾作用下降.比较来看,纯品MC-LR和铜绿微囊藻裂解液的超微结构影响特点较为相似,在考察浓度范围内,微囊藻毒素对水稻叶片超微结构的影响不甚严重.综合前期研究[21]与本研究光合系统各指标研究结果,铜绿微囊藻裂解液中存在的其他组分可能对水稻生物效应影响较大,该方面还需进一步研究.这主要是由于铜绿微囊藻裂解液基质的复杂,植株暴露在裂解液中,除遭受MCs的毒性影响之外,同时还暴露于其他复杂藻细胞裂解成分(也包括部分营养物质),可对植株生长和各个生理生化指标表现出与纯毒素不一样的生物效应结果;此外,由于裂解液中存在大量溶解性和少量不溶性有机质,这些物质可能会增加MCs的吸附或改变其可溶态形态,因此暴露体系内MC-LR的生物有效性可能与对应的纯品存在显著差异,常导致其有效性和毒性的降低.
4 结论
4.1 高浓度MC-LR(100.0和500.0μg/L)纯品对水稻净光合速率有极显著的抑制作用,水稻蒸腾速率和气孔导度对MC-LR暴露十分敏感, 0.1~500.0μg/L的MC-LR均能显著抑制植株蒸腾速率和气孔导度,但最高浓度组MC-LR (500.0μg/L)造成水稻叶绿素荧光极显著下降.
4.2 考察浓度范围内铜绿微囊藻裂解液对植物光合作用特性指标影响显示出不同的特点,甚至表现出一定刺激和促进作用,0.02倍裂解液暴露显著促进植株蒸腾作用和气孔导度,考察浓度范围内裂解液对植物净光合速率和叶绿素荧光影响不显著.
4.3 高浓度MC-LR纯品和高浓度铜绿微囊藻裂解液对水稻叶片超微结构能造成一定影响,造成水稻叶片叶绿体肿胀、类囊体片层扩张和质壁分离等现象
4.4 MC-LR暴露能抑制水稻光合作用,但铜绿微囊藻裂解液和MC-LR作用特点不一致,推测其中存在的其他组分可能对其生物效应影响很大,该方面还需进一步研究.
[1] Wiegand C, Pflugmacher S. Ecotoxicological effects of selected cyanobacterial secondary metabolites a short review [J]. Toxicology and Applied Pharmacology, 2005,203(3):201-218.
[2] Spoof L, Neffling M R, Meriluoto J. Fast separation of microcystins and nodularins on narrow-bore reversed-phase columns coupled to a conventional HPLC system [J]. Toxicon, 2010,55(5):954-964.
[3] 詹晓静,向 垒,李彦文,等.农田土壤中微囊藻毒素污染特征及风险评价 [J]. 中国环境科学, 2015,35(7):2129-2136.
[4] Lahti K, Rapala J, Frdig M, et al. Persistence of cyanobacterial hepatotoxin, microcystin-LR in particulate material and dissolved in lake water [J]. Water Research, 1997,3l(5):l005-10l2.
[5] Jones G J, Orr P T. Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay [J]. Water Research, 1994,28(4): 871-876.
[6] Craig M, Luu H A., McCready T L, et al. Molecular mechanisms underlying the interaction of motuporin and microcystins with type-1and type-2A protein phosphatases [J]. Biochemistry and cell biology, 1996,74(4):569-578.
[7] 朱 枫,钱 晨,卢 彦.微囊藻毒素诱导细胞氧化胁迫的研究进展 [J]. 生态毒理学报 [J]. 2010,5(6):769-775.
[8] Amado L L, Monserrat J M. Oxidative stress generation by microcystins in aquatic animals: why and how. Environ Int, 2010,6:226-235.
[9] Jiang J L, Gu X Y, Song R, et al. Microcystin-LR induced oxidative stress and ultrastructural alterations in mesophyll cells of submerged macrophyte Vallisneria natans (Lour.) Hara. Journal of Hazardous Materials, 2011,190(1-3):188-196.
[10] Ozawa K, Yokoyama A, Ishikawa K, et al. Accumulation and depuration of microcystin produced by the cyanobacterium Microcystis in freshwater snail [J]. Limnology, 2003,4:131-138.
[11] 吴幸强,龚 艳,王 智,等.微囊藻毒素在滇池鱼体内的积累水平及分布特征 [J]. 水生生物学报, 2010,34(2):388-393.
[12] Chen J, Zhang D W, Xie P, et al. Simultaneous determination of microcystin contaminations in various vertebrate (fish, turtle, duck and water bird) from a large eutrophic Chinese lake, Lake Taihu, with toxic Microcystis blooms [J]. Science of the Total Environment, 2009,407(10):3317-3322.
[13] Crush J R, Briggs L R, Sprosen J M, et al. Effect of irrigation with lake water containing microcystins on microcystin content and growth of ryegrass, clover, rape, and lettuce [J]. Environmental Toxicology, 2008,23(2):246-252.
[14] Chen W, Song L R, Gan N Q, et al. Sorption, degradation and mobility of microcystins in Chinese agriculture soils: risk assessment for groundwater protection [J]. Environmental Pollution, 2006,144(3):752-758.
[15] Corbel S, Mougin C, Bouaïcha N. Cyanobacterial toxins: modes of actions, fate in aquatic and soil ecosystems, phytotoxicity and bioaccumulation in agricultural crops [J]. Chemosphere, 2014, 96(2):1–15.
[16] Romero C S, Contardo V, Block T, et al. Accumulation of microcystin congeners in different aquatic plants and crops – A case study from lake Amatitlán, Guatemala [J]. Ecotoxicology and Environmental Safety 2014,102(1):121-128.
[17] Chen J, Han F X, Wang F, et al. Accumulation and phytotoxicity of microcystin-LR in rice(Oryza sativa) [J]. Ecotoxicology and Environmental Safety, 2012,76(2):193-199.
[18] 张敏敏,姜锦林,周军英,等.环境相关浓度MC-LR作用对营养生长期水稻生长和抗氧化酶活性的影响 [J]. 农业环境科学学报, 2014,33(12):2296-2302.
[19] Chen J, Song L, Dai J, et al. Effects of microcystins on the growth and the activity of superoxide dismutase and peroxidase of rape (Brassica napus L.) and rice (Oryza sativa L.) [J]. Toxicon, 2004, 43(4):393-400.
[20] 耿志明,顾迎迎,王 澎.微囊藻毒素对小白菜、番茄生长发育影响及其在它们体内积累的研究 [J]. 江西农业学报, 2011,23(9): 21-24.
[21] 张 慧,姜锦林,张宇峰,等.微囊藻毒素-LR和铜绿微囊藻裂解液对营养生长期水稻生理生化效应研究 [J]. 中国环境科学, 2017,37(8):3134-3141.
[22] 姜锦林,宋 睿,任静华,等.蓝藻水华衍生的微囊藻毒素污染及其对水生生物的生态毒理学研究 [J]. 化学进展, 2011,23(1): 246-253.
[23] Jiang J L, Wang X R, Shan Z J, et al. Proteomic analysis of hepatic tissue of Cyprinus carpio L. exposed to cyanobacterial blooms in Lake [J]. Plos One, 2014,9(2):1-13.
[24] Peng L W, Ma J F, Chi W, et al. Low PSII accumulation1 is involved in efficient assembly of photosystem II in Arabidopsis thaliana [J]. Plant Cell, 2006,18(4):955-969.
[25] Chen X, Zhang W, Xie Y J, et al. Comparative proteomics of thylakoid membrane from a chlorophyll b-less rice mutant and its wild type [J]. Plant Science, 2007,173(4):397-407.
[26] Hu L F, Liang W Q, Yin C S, et al. Rice MADS3 regulates ROS homeostasis during late anther development [J]. Plant Cell, 2011, 23(2):515-533.
[27] Pflugmacher S. Possible allelopathic effects of cyanotoxins, with reference to microcystin-LR, in aquatic ecosystems [J]. Environmental Toxicology, 2002,17(4):407-413.
Effects of pure MC-LR andcrude extracts on photosynthesis ofL.
SHI Yue1,2, JIANG Jin-lin2*, DENG Zheng-dong1
(1.National Defense College of Engineering, PLA University of Science and Technology, Nanjing 210009, China;2.Key laboratory of Pesticide Environmental Assessment and Pollution Control, Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China)., 2017,37(11):4284~4293
Microcystins (MCs) and other toxic metabolites, released from cyanobacterial blooms, can be transferred to farmland via irrigation and therefore may have adverse effects on terrestrial crops. In the present study, the net photosynthetic rate, transpiration rate, stomatal conductivity and chlorophyll fluorescence, as well as the ultrastructural features of leaves of rice (L.) at vegetative stage were investigated under the exposure to a series of concentrations of MC-LR (0.1, 1.0, 10.0, 100.0 and 500.0μg/L) andcrude extracts (0.002 lysate, 0.02 lysate and 0.2 lysate) for 21days. Results showed that exposure to pure MC-LR can produce significant inhibitory effects on the photosynthetic characteristic parameters of rice, and the transpiration rate and stomatal conductivity are the most sensitive indicators in rice to MC-LR exposure. In contrast, different effect characteristics of photosynthesis parameters, even the stimulating and promoting effects, were found in rice under the exposure tocrude extracts (e.g. significant induction of the transpiration rate and stomatal conductivity of rice under the exposure to 0.02lysate). In addition, a series of ultrastructural alterations were also found in rice leaves exposed to high levels of the pure MC-LR andcrude extract. These results suggested that the toxicity mechanism ofcrude extracts to rice is different from pure MC-LR and the decrease of biological toxicity might be due to the changes of MCs bio-availability caused by the interactions with other components co-existed in crude extract solution.
MC-LR;;rice;photosynthesis
X503.231
A
1000-6923(2017)11-4284-10
时 玥(1984-),女,江苏南京人,讲师,硕士,研究方向为污染生态学和水污染控制.发表论文10篇.
2017-05-03
国家自然科学基金青年基金(21407056)
* 责任作者, 副研究员, jjl@nies.org
