改良脾动脉栓塞治疗肝硬化性脾功能亢进及脾动脉盗血综合征的临床效果
2017-11-22许小亚叶进冬段留新李长政刘全达
卢 昊, 许小亚, 叶进冬, 郭 栋, 段留新,3, 李长政, 刘全达,2
(1 火箭军总医院 全军肝胆胃肠病中心, 北京 100088; 2 苏州大学, 江苏 苏州 215006;3 中国人民解放军总医院 介入科, 北京 100853)
改良脾动脉栓塞治疗肝硬化性脾功能亢进及脾动脉盗血综合征的临床效果
卢 昊1,2, 许小亚1, 叶进冬1, 郭 栋1, 段留新1,3, 李长政1, 刘全达1,2
(1 火箭军总医院 全军肝胆胃肠病中心, 北京 100088; 2 苏州大学, 江苏 苏州 215006;3 中国人民解放军总医院 介入科, 北京 100853)
目的肝硬化合并脾功能亢进患者的粗大脾动脉竞争性“窃取”腹腔干血流,引起肝动脉灌注不足(即肝硬化性脾动脉盗血综合征)。探讨脾动脉主干联合分支动脉栓塞的改良脾动脉栓塞术纠正肝硬化性脾动脉盗血综合征及脾功能亢进的有效性。方法选取2007年1月-2015年12月在火箭军总医院和解放军总医院住院的脾功能亢进合并脾动脉盗血综合征的肝硬化患者220例,分成3组,即给予药物或联合内镜干预的内科治疗组(120例)、内科治疗基础上实施传统的部分脾栓塞组(PSE组,40例)和联合脾动脉主干及分支动脉栓塞的改良脾动脉栓塞组(MSAE组,60例),中位随访5年以上,并对3组间的相关指标进行比较分析。计量资料3组间比较利用单因素方差分析,进一步两两比较采用LSD-t检验;2组间比较采用t检验;计数资料组间比较采用χ2检验;利用Kaplan-Meier生存分析法分析生存率和消化道出血率;log-rank法检验统计学差异。结果MSAE组患者血小板、白细胞计数术后5年内整体水平显著高于内科治疗组(P值均<0.05)。术后6个月MSAE组Child-Pugh评分显著低于内科治疗组(P<0.001)和PSE组(P=0.014);术后1年MSAE组Child-Pugh评分仍显著低于内科治疗组(P=0.009);术后6个月MSAE组MELD评分显著低于内科治疗组(P=0.004)和PSE组(P=0.048);术后1年MSAE组MELD评分仍显著低于内科治疗组(P=0.012)。MSAE组消化道出血/再出血及内镜治疗次数显著低于PSE组和内科治疗组(χ2=9.41,P=0.009;χ2=10.91,P=0.004);术后5年MSAE组术后消化道出血/再出血发生率仍显著低于内科治疗组(χ2=14.70,P=0.002)。MASE组术后并发症(发热、腹痛)程度及持续时间均有所改善,脾脓肿等严重并发症发生率更低。MSAE组中位生存时间45(8~91)个月,PSE组中位生存时间41(6~86)个月,内科治疗组中位生存时间34.5(7~84)个月。随访5年MSAE组死亡7例(11.7%),内科治疗组死亡40例(30%),PSE组死亡7例(17.5%)。MSAE组患者累积生存率显著高于内科治疗组(χ2=9.733,P=0.001)。结论联合脾动脉主干及分支动脉栓塞的改良型脾动脉栓塞术安全性较高,能有效纠正肝硬化性脾功能亢进和脾动脉盗血,且能改善肝功能,一定程度降低消化道出血风险,值得进一步深入研究。
肝硬化; 脾动脉盗血; 改良型脾动脉栓塞; 脾功能亢进
失代偿期肝硬化多导致门静脉高压症,临床表现为脾大、脾功能亢进(脾亢)、食管胃底静脉曲张/破裂出血和腹水等。内镜下硬化或套扎是食管胃底静脉曲张/出血的一线治疗选项;肝硬化性脾亢,传统上常选择部分脾栓塞术(partial splenic embolization, PSE)或脾切除术。
随着对肝硬化血流动力学变化认识的不断深入,发现脾动脉盗血综合征(splenic artery steal syndrome, SASS)不仅存在于肝移植术后患者[1-2],也广泛存在于失代偿期肝硬化患者[3-4]。SASS的本质是脾动脉与肝动脉竞争血流,致使肝动脉灌注不良并引起肝细胞缺氧。纠正SASS后,可明显改善肝功能[1-3]。本中心自2007年起开始采用脾动脉主干联合分支动脉栓塞的改良脾动脉栓塞术(modified splenic artery embolization, MSAE),联合内镜下硬化/套扎等综合措施治疗失代偿期肝硬化患者。本研究对存在脾亢、SASS的失代偿期肝硬化患者进行分析,分别接受传统内科治疗、内科治疗基础上联合PSE或MSAE,并长期随访观察了3组患者的临床疗效,现总结如下。
1 资料与方法
1.1 病例选择 SASS诊断标准[1-6]:(1)存在明显脾脏肿大;(2)脾动脉显著增粗(>4 mm或>1.5倍肝动脉直径);(3)肝动脉通畅,直径纤细,血流缓慢,动脉期肝实质充盈延迟;(4)脾动脉增粗,血流快速,造影剂早期充盈脾实质;(5)造影后脾静脉和门静脉早期显影,甚至在动脉期显影。入组标准:(1)肝硬化合并脾亢患者;(2)胃镜证实存在不同程度的食管胃底静脉曲张;(3)腹部增强CT和三维CT符合肝硬化性SASS的影像学特征(图1)。排除标准:存在离肝血流;门静脉血栓形成;合并有肝癌、原发性免疫性血小板减少症等全身性疾病;终末期肝疾病;肝移植者。
1.2 临床资料 本研究选取了2007年1月-2015年12月于火箭军总医院和解放军总医院住院的肝硬化患者,符合入组标准者共220例,均接受了内科保守治疗,包括保肝、利尿、补充白蛋白、改善凝血等药物治疗;慢性乙型肝炎患者均接受口服核苷类药物6个月以上;丙型肝炎及自身免疫性肝炎患者均处于非活动期;酒精性肝硬化患者接受常规保肝药物治疗,并戒酒6个月以上;对于存在重度食管胃底静脉曲张出血或高危患者,住院期间给予联合内镜下套扎/硬化治疗。

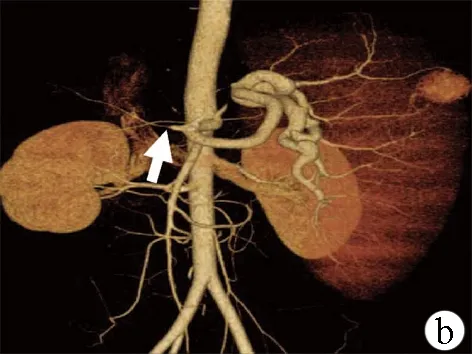
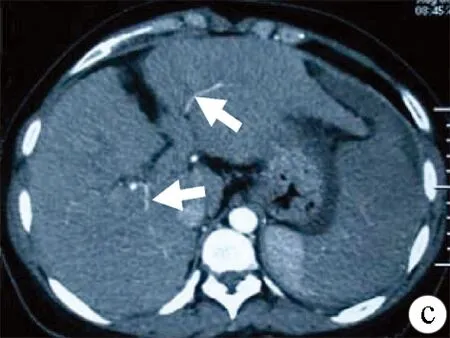
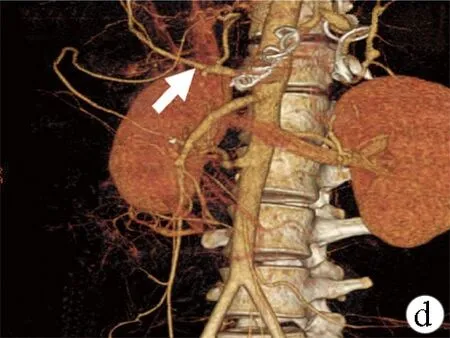
图1肝硬化性SASS腹部CT动脉期表现及三维CT血管重建
a:肝硬化失代偿期脾脏实质充盈迅速,肝脏实质充盈延迟,门静脉提前显影(箭头);b:三维CT血管重建示肝动脉纤细(箭头);c:改良脾动脉栓塞后腹部CT示肝脏明显充盈改善,可见肝动脉分支(箭头),门静脉提前显影消失;脾脏可见缺血区域;d:三维CT血管重建提示肝动脉直径较术前明显增粗(箭头)
1.3 分组与治疗方法 将所有纳入患者按照治疗方法的不同分为内科治疗组120例、PSE组40例,MSAE组60例,所有患者有创治疗前均签署治疗知情同意书。各组治疗方法如下:
内科治疗组:给予保肝、降酶、抗HBV等药物治疗,输血浆改善凝血、补充蛋白等支持治疗;调整饮食,口服β受体阻滞剂预防食管胃底静脉曲张出血,并联合内镜下食管静脉套扎/硬化治疗。
PSE组:在内科治疗基础上,采用改良Seldinger技术穿刺右侧股动脉,插入4F动脉鞘,然后插入4F动脉导管行腹腔干动脉造影,评估肝脾动脉血流情况;行脾动脉造影,评估脾动脉末梢分支分布情况及宜栓塞的动脉末梢分支范围,用微导管超选择至二级至三级动脉内,经导管释放栓塞微球(300~500 μm),并经导管注入造影剂确认脾脏栓塞范围,重复操作,确认脾脏栓塞范围控制在30%~60%,如果效果不理想则行再次脾栓塞。
MSAE组:操作方法同上,插入4F动脉导管至腹腔干,造影评估肝、脾动脉血流灌注情况;将导管深入至近脾门部脾动脉主干造影评估脾脏动脉走形,可见动脉分支2~3支;微导管超选择至脾脏中下极宜栓塞的二级动脉内,在DSA透视下逐枚释放微钢圈(MWCE-18S-3/2, MWCE-18S-4/2),并造影评估血流情况,重复操作,根据分支管径及血流情况,释放微钢圈2~3枚甚至多枚,直至目标分支动脉血流完全阻断,达到完全栓塞效果;重复分支动脉造影,根据动脉分支血流分布情况,选择1~2支动脉分支进行上述栓塞,根据造影显影控制脾脏实质缺血范围为1/3~2/3;将导管退至脾动脉主干,在透视下释放普通钢圈(MWCE-35-14-10, MWCE-18S-8/4)数枚,逐枚、逐次重复造影,直至脾动脉主干血流明显减少(图2),避免主干完全栓塞,为脾亢复发的再次栓塞预留通道。如脾脏巨大,栓塞效果不持久,考虑分期栓塞,先行改良脾动脉部分栓塞,预留二次栓塞通道,脾亢复发时可再次行MSAE。
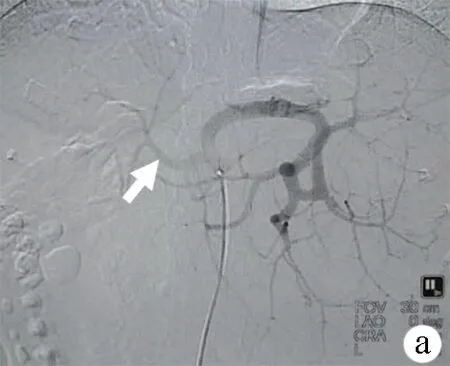
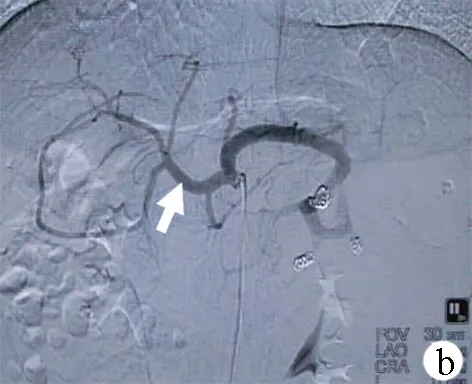
图2 MSAE前后腹腔干造影结果a:肝硬化失代偿期患者腹腔干造影示脾动脉粗大迂曲,脾动脉血流速度快;肝动脉纤细(箭头)、血流缓慢、肝动脉远端末梢显影稀疏;b:改良脾动脉栓塞后,腹腔干造影可见肝动脉管径增粗(箭头),血流加快,肝动脉末梢显影明显增多
1.4 随访及评价 术后第3天、1~2周、1、3、6个月及第1、2、3、4、5年复查血常规、生化、凝血及腹部影像学检查,评估血细胞计数、胆红素、白蛋白、凝血酶原时间及腹部情况,并评估肝功能Child-Pugh评分、MELD评分;统计3组患者消化道出血/再出血、内镜重复治疗次数及生存时间。

2 结果
2.1 一般临床资料比较 3组患者年龄、性别、术前血细胞计数、肝功能指标、肝功能评分评级及消化道出血史均无明显差异(P>0.05)(表1)。

表1 患者临床资料特征
2.2 血细胞计数 MSAE组患者血细胞计数短期内提升明显,血小板计数、白细胞计数在术后2周达到高峰,之后开始缓慢下降,术后5年内整体水平仍显著高于保守治疗(P值均<0.05),MSAE组与PSE组的治疗效果相当(P>0.05)(图3,4)。
2.3 肝功能指标 MASE组和PSE组在脾栓塞后出现ALT、AST一过性升高,3~5 d内均恢复正常;术后血胆红素和凝血酶原时间等肝功能指标均有不同程度改善,术后1~6个月改善最明显。术后6个月MSAE组Child-Pugh评分显著低于内科治疗组(P<0.001)和PSE组(P=0.014);术后1年MSAE组Child-Pugh仍显著低于内科治疗组(P=0.009);术后6个月MSAE组MELD评分显著低于内科治疗组(P=0.004)和PSE组(P=0.048);术后1年MSAE组MELD评分仍显著低于内科治疗组(P=0.012);术后2~5年3组无显著差异(图5,6)。
2.4 消化道出血/再出血率 综合治疗后第2年随访情况见表2,MSAE组消化道出血/再出血及内镜治疗次数显著低于PSE和内科治疗组(χ2=9.41,P=0.009;χ2=10.91,P=0.004);术后5年内MSAE组术后消化道出血、再出血发生率仍显著低于内科组(χ2=14.70,P=0.002);略低于传统PSE组,但差异无统计学意义(χ2=2.88,P=0.479)(图7)。
2.5 生存率 MSAE组中位生存时间45(8~91)个月;PSE组中位生存时间41(6~86)个月;内科组中位生存时间34.5(7~84)个月。随访5年内MSAE组死亡7例(11.7%),内科治疗组死亡40例(30%),PSE组死亡7例(17.5%)。MSAE组患者累积生存率显著高于内科治疗组(χ2=9.733,P=0.001),略优于PSE组,但差异无统计学意义(χ2=0.134,P=0.426)(图8)。
2.6 脾栓塞术后并发症 如表3所示,PSE术后都有发热,且持续时间较长;出现显著腹痛症状37例,给予口服非甾体类消炎药物如布洛芬等有效9例,阿片类镇痛药有效28例;术后2周腹部CT证实脾脓肿1例,给予穿刺外引流后好转;自发性细菌性腹膜炎4例,升级抗生素治疗后好转;门静脉系统血栓2例,给予抗凝治疗后改善。MASE组出现术后发热51例,明显腹痛49例,口服非甾体类消炎药布洛芬等控制症状36例,给予阿片类止痛药治疗者13例;门静脉系统部分性血栓形成2例,抗凝治疗后血栓消失。

表2 随访2年患者的生存状况
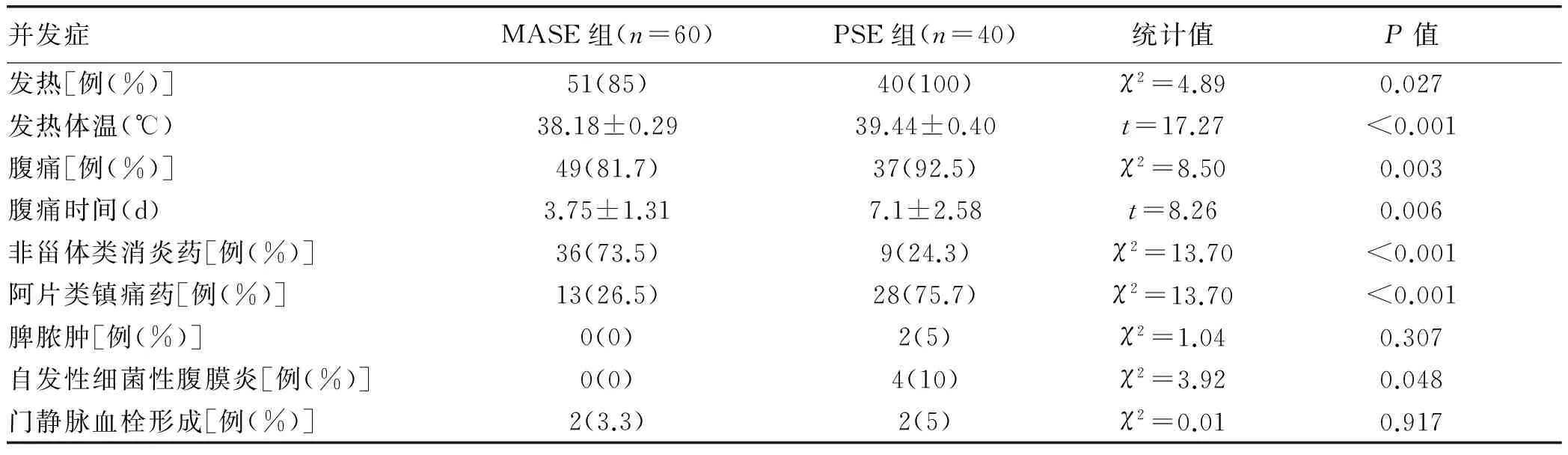
表3 脾栓塞术后并发症
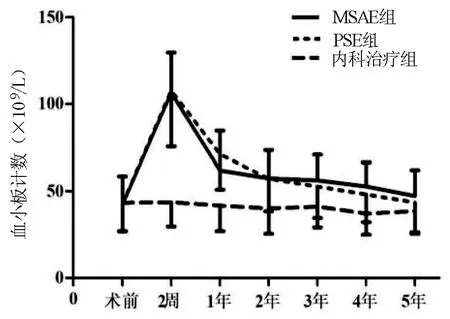
图3 治疗后血小板计数
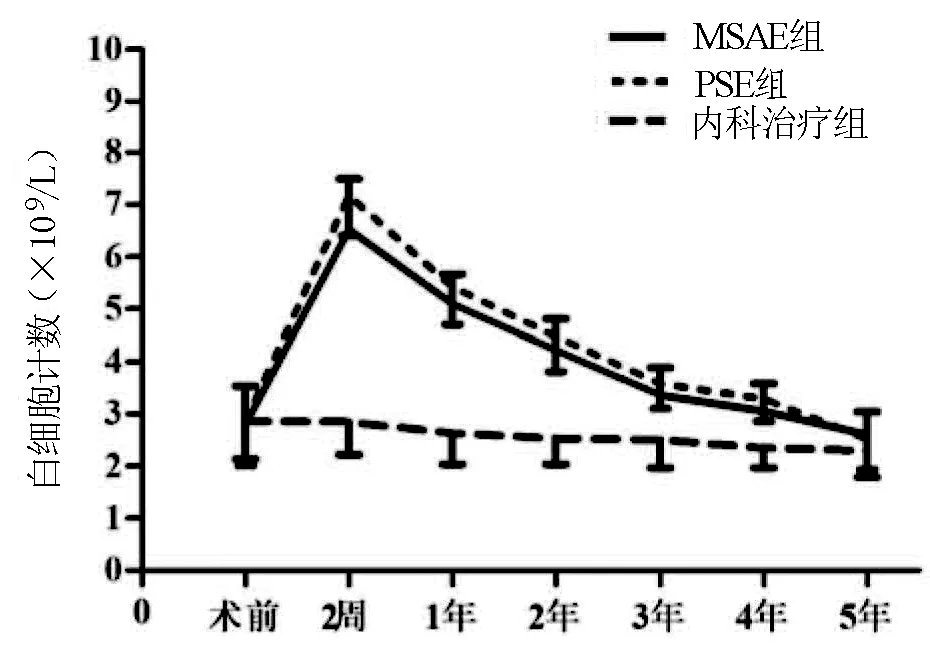
图4 治疗后白细胞计数
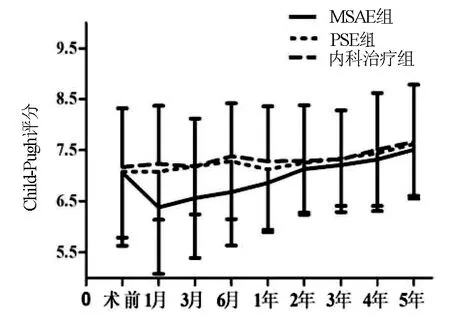
图5 治疗后Child-Pugh评分

图6 治疗后MELD评分
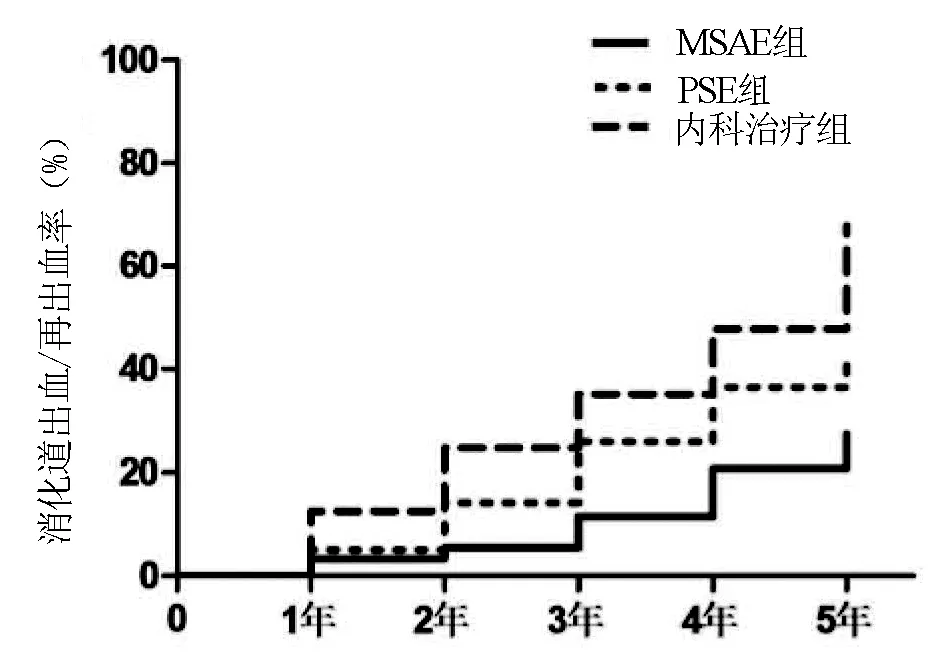
图7 治疗后消化道出血、再出血率
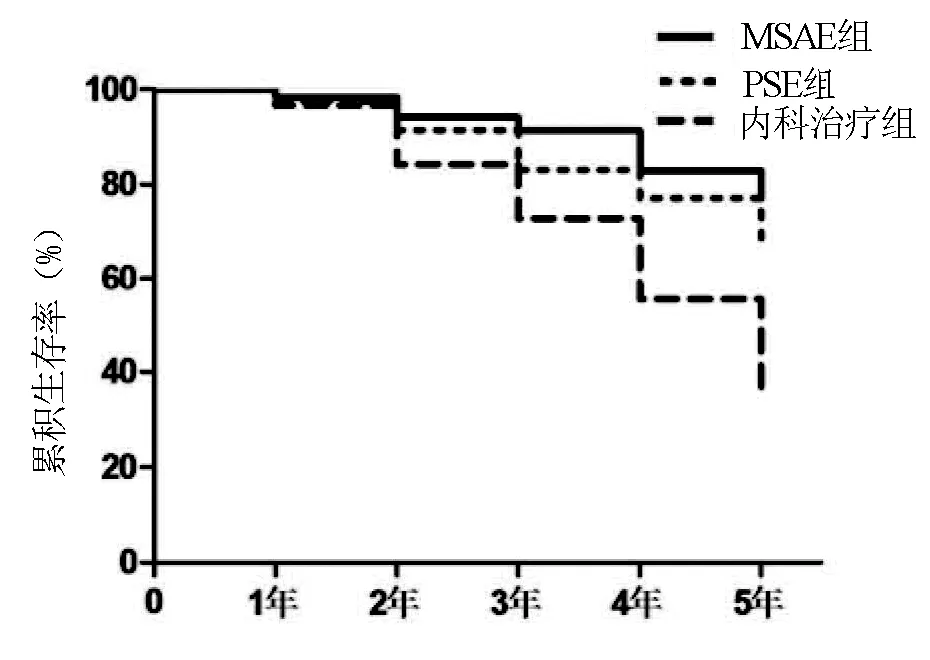
图8 治疗后生存率
3 讨论
肝硬化失代偿期多出现门静脉高压,主要表现为脾亢、脾大、食管胃底静脉曲张及破裂出血、中重度血小板减低症及腹水等症状,其中食管静脉曲张破裂出血是导致失代偿期肝硬化患者死亡的最重要因素[7]。传统观点认为,当发生肝硬化时,门静脉血流减少,继发肝动脉血流增加[8]。
近年文献报道肝硬化失代偿期患者存在肝动脉低灌注状态[3,9-10]。Liu等[9]通过采用三维CT血管重建、Doppler超声、腹腔干动脉造影等技术证实,肝硬化患者肝动脉纤细,血流明显减少,阻断脾动脉主干后,肝动脉显著增粗;Zeng等[10]在肝硬化患者同样并没有观察到肝动脉血流增加现象,但发现脾动脉/肝动脉直径比值是增加的。实际上,SASS现象不仅存在于肝移植术后患者,也较广泛存在于失代偿期肝硬化患者[1-5]。因此,国内学者指出“SASS”可以作为失代偿期肝硬化治疗的新靶点[3]。
预防或控制食管胃底静脉曲张破裂出血是失代偿期肝硬化门静脉高压常规治疗的重中之重[11-12],但药物联合内镜干预的传统内科治疗不能显著改善门静脉高压,再出血风险仍较高,亦不能改善血细胞减少症。传统PSE术可缓解脾亢,提高血小板计数,但不能纠正SASS,对改善肝功能和降低门静脉压力的作用有限;且传统PSE术后出现腹痛、发烧、腹水等并发症较多[6],严重时会发生脾脓肿及肝衰竭。
有鉴于此,本组实施脾栓塞时不仅栓塞脾动脉的分支动脉,而且针对SASS栓塞了脾动脉主干(即MSAE),减少脾动脉血流;同时选用钢圈和微钢圈作为栓塞材料[13]。本研究证实,通过上述技术的改良,MSAE不仅获得不劣于PSE的血细胞改善,且远比PSE安全、耐受性好;且通过纠正脾动脉盗血,改善了肝功能和肝功能评分分级。其原因可能和增加肝脏动脉血流,缓解肝细胞缺氧,进一步促进肝细胞再生有一定关系[9,14],但目前缺乏直接证据。长期随访证实纠正SASS后,患者的肝功能指标及肝功能评分分级获得明显改善,食管胃底曲张静脉破裂出血/再出血的风险及内镜重复治疗次数显著下降。可能是由于纠正了SASS后,一定程度上减少了脾静脉回流至门静脉的血流量有关[9,14]。
传统PSE术,使用栓塞颗粒或微球,导致栓塞脾脏实质发生彻底坏死,患者术后发热、腹痛的发生率高,发热与腹痛程度较重,症状持续时间较长,严重者术后出现脾脓肿、自发性细菌性腹膜炎等严重并发症。MASE选用对人体副作用小的钢圈,栓塞同样范围的脾脏实质出现的并发症的程度较轻,严重并发症的发生率低。
因此,联合脾动脉主干及分支动脉栓塞的MASE安全性较高,能有效纠正肝硬化性脾亢和脾动脉盗血,临床证实能够改善肝功能,一定程度降低消化道出血率,值得进一步深入研究。
[1] PINTO S, REDDY SN, HORROW MM, et al. Splenic artery syndrome after orthotopic liver transplantation: a review[J]. Int J Surg, 2014, 12(11): 1228-1234.
[2] LIU QD, ZHOU NX, WANG MQ, et al. Splenic artery steal syndrome after liver transplantation[J]. Chin J Surg, 2005, 43(15): 989-990. (in Chinese)
刘全达, 周宁新, 王茂强, 等. 肝移植术后脾动脉盗血综合征[J]. 中华外科杂志, 2005, 43(15): 989-990.
[3] LIU QD,SONG Y,ZHOU NX.Splenic arterial steal syndrome:a neglected therapeutic target for livel diseases[J]. J Clin Hepatol, 2011, 27(3): 241-244.(in Chinese)
刘全达, 宋扬, 周宁新. 脾动脉盗血综合征: 一个被忽视的肝病治疗靶点[J]. 临床肝胆病杂志, 2011, 27(3): 241-244.
[4] LIU QD,ZHOU NX,SONG Y,et al.The application of occlusive techniques of the splenic artery combined with radiofrequency ablation for hypersplenism due to portal hypertension[J]. J Clin Hepatol, 2011, 27(2): 136-139. (in Chinese)
刘全达, 周宁新, 宋扬, 等. 脾动脉阻断技术在射频消融治疗门脉高压性脾功能亢进症中的应用[J]. 临床肝胆病杂志, 2011, 27(2): 136-139.
[5] DOKMAK S, AUSSILHOU B, BELGHITI J. Liver transplantation and splenic artery steal syndrome: the diagnosis should be established preoperatively[J]. Liver Transpl, 2013,19(6): 667-668.
[6] HADDUCK TA, MCWILLIAMS JP. Partial splenic artery embolization in cirrhotic patients[J]. World J Radiol, 2014, 6(5): 160-168.
[7] GARCIA-TSAO G, BOSCH J. Varices and variceal hemorrhage in cirrhosis: a new view of an old problem[J]. Clin Gastroenterol Hepatol, 2015,13(12): 2109-2117.
[8] LAUTT WW. Mechanism and role of intrinsic regulation of hepatic arterial blood flow: hepatic arterial buffer response[J]. Am J Physiol, 1985, 249(5): 549-556.
[9] LIU Q, MA K, SONG Y, et al. Two-year follow-up of radiofrequency ablation for patients with cirrhotic hypersplenism: Does increased hepatic arterial flow induce liver regeneration ?[J]. Surgery, 2008, 143(4): 509-518.
[10] ZENG DB, DAI CZ, LU SC, et al. Abnormal splenic artery diameter/hepatic artery diameter ratio in cirrhosis-induced portal hypertension[J]. World J Gastroenterol, 2013,19(8): 1292-1298.
[11] KIRNAKE V, ARORA A, GUPTA V, et al. Hemodynamic response to carvedilol is maintained for long periods and leads to better clinical outcome in cirrhosis: a prospective study[J]. J Clin Exp Hepatol, 2016, 6(3): 175-185.
[12] SUN Y, REN TS, ZHAO QC. Analysis of drug use in 537 patients with decompensated liver cirrhosis[J]. Trauma Crit Med, 2016, 4(4): 229-235. (in Chinese)
孙滢, 任天舒, 赵庆春. 肝硬化失代偿期537例患者用药分析[J]. 创伤与急危重病医学, 2016, 4(4): 229-235.
[13] GU JJ, HE XH, LI WT, et al. Safety and efficacy of splenic artery coil embolization for hypersplenism in liver cirrhosis[J]. Acta Radiologica, 2012, 53(8): 862-867.
[14] PRESSER N, QUINTINI C, TOM C, et al. Safety and efficacy of splenic artery embolization for portal hyperperfusion in liver transplant recipients: A 5-year experience[J]. Liver Transpl, 2015, 21(4): 435-441.
引证本文:LU H, XU XY, YE JD, et al. Clinical effect of modified splenic artery embolization in treatment of hypersplenism and splenic artery steal syndrome due to liver cirrhosis[J]. J Clin Hepatol, 2017, 33(11): 2141-2146. (in Chinese)
卢昊, 许小亚, 叶进冬, 等. 改良脾动脉栓塞治疗肝硬化性脾功能亢进及脾动脉盗血综合征的临床效果[J]. 临床肝胆病杂志, 2017, 33(11): 2141-2146.
(本文编辑:刘晓红)
Clinicaleffectofmodifiedsplenicarteryembolizationintreatmentofhypersplenismandsplenicarterystealsyndromeduetolivercirrhosis
LUHao,XUXiaoya,YEJindong,etal.
(InstituteofHepatobiliaryGastrointestinalDiseases,GeneralHospitalofthePLARocketForce,Beijing100088,China)
ObjectiveTo investigate the clinical effect of modified splenic artery embolization of the splenic artery and branch arteries in the treatment of splenic artery steal syndrome (SASS) and hypersplenism due to liver cirrhosis, since in patients with liver cirrhosis complicated by hypersplenism, the enlarged splenic artery competitively “steals” the blood flow in the celiac trunk and causes hypoperfusion in the hepatic artery (i.e., SASS due to liver cirrhosis).MethodsA total of 220 cirrhotic patients with hypersplenism and SASS who were hospitalized in General Hospital of the PLA Rocket Force and Chinese PLA General Hospital from January 2007 to December 2015 were enrolled and divided into medical treatment group with 120 patients (drugs combined with endoscopic intervention), partial splenic embolization (PSE) with 40 patients (PSE combined with medical treatment), and modified splenic artery embolization (MSAE) group with 60 patients (embolization of the splenic artery and branch arteries combined with medical treatment). Related indices were analyzed and compared between the three groups. A one-way analysis of variance was used for comparison of continuous data between three groups, and the least significant difference t-test was used for further comparison between two groups; the chi-square test was used for comparison of categorical data between groups; the Kaplan-Meier survival analysis was used to calculate survival rates and gastrointestinal bleeding rate; the log-rank test was used to evaluate statistical difference.ResultsWithin 5 years after surgery, the MSAE group had significantly higher platelet and leukocyte counts than the medical treatment group (P<0.05). At 6 months after surgery, the MSAE group had a significantly lower Child-Pugh score than the medical treatment group (P<0.001) and the PSE group (P=0.014); at 1 year after surgery, the MSAE group still had a significantly lower Child-Pugh score than the medical treatment group (P=0.009). At 6 months after surgery, the MSAE group had a significantly lower Model for End-Stage Liver Disease (MELD) score than the medical treatment group (P=0.004) and the PSE group (P=0.048); at 1 year after surgery, the MSAE group still had a significantly lower MELD score than the medical treatment group (P=0.012). The MSAE group had significantly lower numbers of gastrointestinal bleeding/rebleeding events and endoscopic therapies than the PSE group (χ2=9.41,P=0.009) and the medical treatment group (χ2=10.91,P=0.004); at 5 years after surgery, the MSAE group still had a significantly lower incidence rate of gastrointestinal bleeding/rebleeding than the medical treatment group (χ2=14.70,P=0.002). The MSAE group had certain improvements in the degree and duration of postoperative complications (pyrexia and abdominal pain) and had a lower incidence rate of serious complications (splenic abscess), as compared with the other two groups. The median survival time was 45 (8-91) months in the MSAE group, 41 (6-86) months in the PSE group, and 34.5 (7-84) months in the medical treatment group. During the 5-year follow-up, 7 patients (11.7%) in the MSAE group, 40 (30%) in the medical treatment group, and 7(17.5%) in the PSE group died. The MSAE group had a significantly higher cumulative survival rate than the medical treatment group (χ2=9.733,P=0.001).ConclusionModified splenic artery embolization of the splenic artery and branch arteries has good safety and can effectively correct hypersplenism and SASS due to liver cirrhosis, improve liver function, and reduce the risk of gastrointestinal bleeding. Therefore, it deserves further investigation.
liver cirrhosis; splenic artery steal syndrome; modified splenic artery embolization; hypersplenism
R657.31
A
1001-5256(2017)11-2141-06
10.3969/j.issn.1001-5256.2017.11.018
2017-05-13;
2017-07-13。
北京市首都临床特色应用研究(Z141107002514110)
卢昊(1989-),男,主要从事肝胆胰疾病的临床和基础研究。
刘全达,电子信箱: liuquanda@sina.com。
