水溶液中的离子平衡学习策略
2017-11-22辽宁省盘锦市高级中学高二15
■辽宁省盘锦市高级中学高二(15)班 闫 涵
水溶液中的离子平衡学习策略
■辽宁省盘锦市高级中学高二(15)班 闫 涵
编者注:在化学学习的过程中,你一定会遇到许多问题,也需要解决这些问题,而在解决问题的过程中,如果能深入一些,细致一些,就会有新的发现。希望同学们在学习过程中善于发现和总结,并汇成文字寄给我们。电子信箱:282200380@qq.com。
一、掌握弱电解质电离平衡的规律
1.弱电解质电离平衡时的特点:一是动态平衡;二是分子化和离子化速度相等;三是溶液中弱电解质的电离程度和各种粒子的浓度保持一定;四是当外界条件变化时,电离平衡要发生改变。
2.影响弱电解质电离平衡因素:一是溶液稀释;二是温度变化。
3.要掌握电离平衡常数的影响因素:K值大小是表示弱电解质电离的难易程度,它只与温度有关。
例1温度在25℃下,已知某醋酸的K值是1.81×10-5,次氯酸的K值是2.87×10-8,硫酸的K1是4.29×10-7,K2是5.72×10-11。求:
(1)写出硫酸的K1表达式:___。
(2)相同条件、相同浓度的醋酸钠、次氯酸钠、碳酸钠溶液,碱性最强的是____。
二、掌握水的电离和溶液pH计算
要掌握水的离子积Kw只与温度有关,以及影响水电离的几种因素,要掌握溶液pH的规定和计算方法,并能灵活运用。
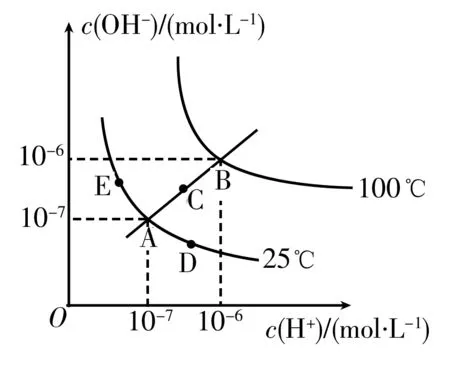
图1
例2根据图1中水的电离平衡曲线回答问题:
(1)在图中的 A、B、C、D、E这几点的Kw之间是什么关系?
(2)如果让Kw从A点变化到D点,可选择的措施是____。
a.升高温度 b.加入少量HCl c.加入少量NH4Cl
(3)在E点对应温度下,把pH=9的NaOH溶液与pH=4的H2SO4溶液混合,如果混合后溶液pH=7,则两溶液的体积比为____。
三、掌握盐类水解的规律和影响因素
1.掌握盐类水解规律。如果盐中含有弱酸(碱)根离子,盐才能水解,否则盐不发生水解;弱酸(碱)根离子越弱,则其水解程度就越大;盐溶液的酸碱性显示的是相对较强的离子对应的酸(碱)性;当阳离子、阴离子都水解时,溶液的酸(碱)性由水解程度大的离子决定。
2.影响盐类水解的外界因素。①温度:盐的水解是吸热反应,因此升高温度水解程度增大。②浓度:盐浓度越小,水解程度越大;盐浓度越大,水解程度越小。③外加酸碱能促进或抑制盐的水解,例如水解呈酸性的盐溶液中加入碱,就会中和溶液中的H+,使平衡向水解方向移动而促使水解,若加酸则抑制水解。
3.溶液粒子浓度大小比较规律。多元弱酸溶液按多步电离进行分析,多元弱酸正盐溶液按弱酸根分步水解进行分析,在不同溶液中对同一离子浓度进行比较,要根据溶液中其他离子对其影响程度来考虑,混合溶液中各粒子浓度的比较要根据三个守恒定律综合考虑。
四、掌握难溶解电解质的溶解平衡
难溶解电解质在溶液中存在沉淀溶解平衡,要掌握沉淀溶解平衡在以下方面的应用:一是沉淀的溶解和生成,二是沉淀的转化应用。
例3Mg(OH)2是难溶电解质,其Ksp=1.2×10-11。在c(Mg2+)=0.12mol·L-1的溶液中,要生成 Mg(OH)2沉淀,溶液pH至少应控制在什么范围?
五、掌握中和滴定实验的方法
一是如何做好滴定前的实验准备工作;二是如何选择指示剂;三是掌握中和滴定实验的关键问题;四是掌握具体的滴定过程和注意事项;五是掌握实验数据计算、处理方法和误差判断原则。
例4用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH 三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积是V1、V2、V3。求三个体积的关系。
(责任编辑 谢启刚)
