追根溯源解析电化学
2017-11-22北京市十一学校周逸清博士
■北京市十一学校 周逸清(博士)
追根溯源解析电化学
■北京市十一学校 周逸清(博士)
电化学是将化学现象和电现象关联起来的重要化学分支科学。电化学是对于微粒行为分析的进一步延续,重点分析溶液中离子得失电子以及移动方向的行为。该部分高考命题方向主要包括:电极反应的书写、离子的浓度改变、电子得失守恒相关的计算等。这一部分高考题命题素材较为新颖,多为最新的科研成果,但是又贴近生活,与人们的生活息息相关。由于电化学考查的知识点较为集中,现在高考命题中很少单独成一道大题的,一般都出现在大题的后半部分,作为考查知识的延伸、拓展,而且一般有较高区分度。我们精心设计了电化学中电解以及原电池的题,帮助大家对于电化学中的知识点有更好的理解。
例1若用氢氧化钠溶液做电解质,可制取有广泛用途的Na2FeO4,同时获得氢气。工作原理如图1所示。装置通电后,铁电极附近生成紫红色的,镍电极有气泡产生。若溶液碱性过强,铁电极区会产生红褐色固体。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
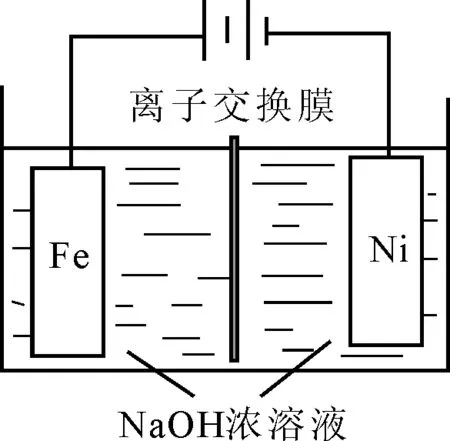
图1
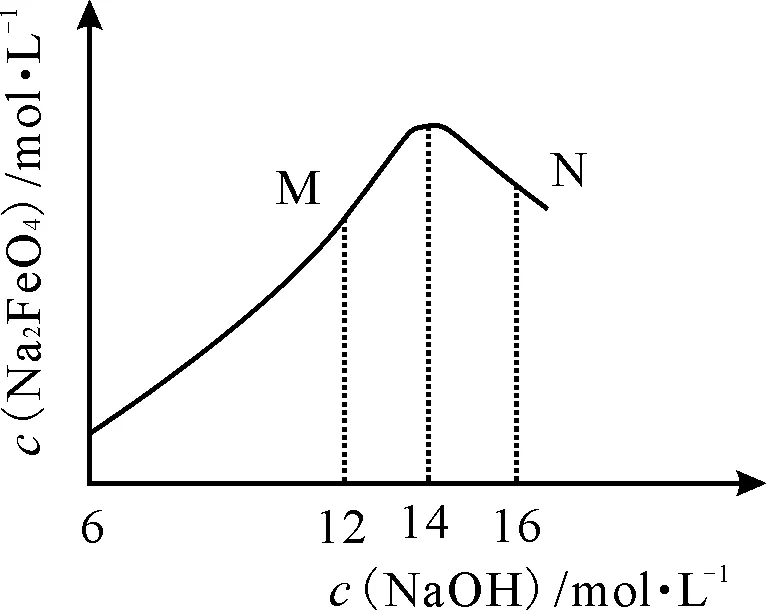
图2
(1)电解一段时间后,c(OH-)升高的区域在____(填“阴极室”或“阳极室”)。铁电极的电极反应式为____。
(2)电解过程中,须将阴极产生的气体及时排出,其原因是____。
(3)用同一装置、在相同的电流密度下电解相同的时间,c(Na2FeO4)随初始c(NaOH)的变化如上图2所示,分析N点c(Na2FeO4)和M点c(Na2FeO4)低于最高值的可能原因:___。
解析:(1)根据题意,在镍电极产生气泡,是因为氢离子放电生成氢气,进一步促进了水的电离平衡正向移动,H2OH++OH-,故而c(OH-)升高的区域在阴极室。对于铁电极的电极反应式的书写,由题干可知Fe转化为,首先配得失电子,Fe的化合价升高6,失去6个电子,Fe-6e-══;其次,配平电荷守恒,左边带有六个正电荷,右边带有两个负电荷,可以通过左边补OH-或者右边补H+来配平电荷,根据溶液的碱性环境在左边补齐8个OH-,最后配原子守恒,一般是配水,右边配4个H2O,电极反应就书写完成,Fe+8OH--6e-══
(2)首先分析出阴极气体是氢气,进而分析氢气的性质主要体现还原性,根据题意Na2FeO4只在碱性条件下稳定,易被H2还原,电解过程中,须将氢气及时排出,防止Na2FeO4与H2反应导致产率降低。
(3)根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)较低,Na2FeO4的稳定性较差,且反应慢,故而c(Na2FeO4)较低;在N点,c(OH-)较高,根据题意“溶液碱性过强,铁电极区会产生红褐色固体”,此时出现了副产物Fe(OH)3,故而产率降低,c(Na2FeO4)也会降低。
答案:(1)阴极室Fe+8OH--6e-══
(2)防止Na2FeO4与H2反应导致产率降低
(3)在M点,c(OH-)较低,Na2FeO4的稳定性较差,且反应慢,故而c(Na2FeO4)较低;在N点,c(OH-)过高,出现了副产物Fe(OH)3,故而产率降低,c(Na2FeO4)也会降低
例2(1)铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
①某原电池装置如图3所示,图3右侧烧杯中的电极反应式为____,左侧烧杯中的c(Cl-)________(填“增大”“减小”或“不变”)。
②已知图4甲、乙两池的总反应式均为Fe+H2SO4══FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
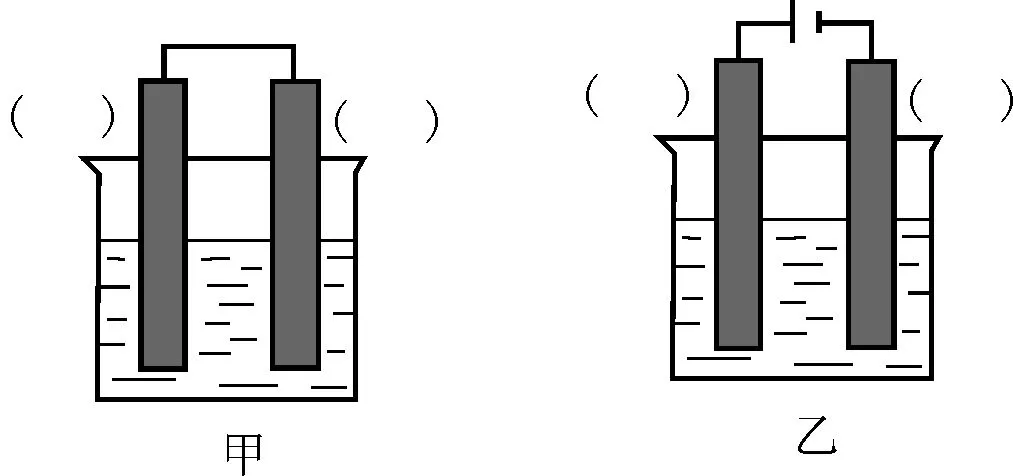
图4
(2)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O══3Zn(OH)2+2Fe(OH)3+4 KOH。
①写出正极反应式:___。
②用高铁(Ⅵ)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成(标准状况)。
解析:(1)①该装置为原电池装置,左侧铁为负极,右侧有正极,右侧H+得电子转化为H2,故而电极反应式为2H++2e-══H2↑。左侧的电极反应中生成Fe2+,故而溶液中阳离子变多,阴离子需要进入左侧溶液平衡电荷,故而c(Cl-)增大。
②Fe和H2SO4之间的反应,如果设计电解池实验,金属铁作阳极,阳极反应为Fe-2e-══Fe2+,电解质为硫酸,阴极是氢离子放电,电极反应为2H++2e-══H2↑,即阳极为铁,阴极为C;如果设计原电池实验,金属铁作负极,负极反应为Fe-2e-══Fe2+,电解质为硫酸,正极是氢离子放电,电极反应为2H++2e-══H2↑,即负极为铁,正极为C。
②利用电子转移守恒来计算,每生成0.2molK2FeO4转移电子0.6 mol,故而H2应生成0.3mol,体积为6.72L。
答案:(1)①2H++2e-══H2↑ 增大
②甲:左边为Fe,右边为C;乙:左边为Fe,右边为C。
②6.72
跟踪练习:将NO2转化为N2O4,可用于电解制备绿色硝化试剂N2O5。图5是其原理示意图。

图5
①阳极电解液中的N2O4由NO2降温转化得到,降温的原因是____。
②阳极区生成N2O5的电极反应式是____。
③阴极区得到一种可循环利用的物质,其化学式是____。
答案0,降温平衡右移,有利于NO2转化为N2O4
②N2O4-2e-+2HNO3══2N2O5+2H+
③N2O4(或NO2)
点评:电化学的核心知识点其实就是电极反应的书写,有些题不直接问你电极反应,只有当你把电极反应书写出来后才能作答。因此,在后续的学习中,要多对溶液中的微粒的氧化还原性进行分析,才能更快捷地书写出电极反应式。此外,对于陌生元素也不必畏惧,只需要根据你学过的书写电极反应的步骤即可完成。化学的学习要通过逻辑和分析完成,这样才能事半功倍。
(责任编辑 谢启刚)
周逸清,毕业于清华大学,博士,海淀区兼职教研员,海淀区新教师培训优秀学员,多次承担市级、区级公开课,辅导多名学生考入北京大学、清华大学,在国际、国内期刊发表高水平文章二十余篇。
